亚洲蜈蚣藻(Grateloupiaasiatica Kawaguchi et Wang)的个体生态学研究
王宏伟, 刘雨薇, 王 晨, 赵树雨, 田伊林
(辽宁师范大学 生命科学学院, 辽宁 大连 116081)
亚洲蜈蚣藻(GrateloupiaasiaticaKawaguchi et Wang)的个体生态学研究
王宏伟, 刘雨薇, 王 晨, 赵树雨, 田伊林
(辽宁师范大学 生命科学学院, 辽宁 大连 116081)
对分布在大连市黄海海域的亚洲蜈蚣藻(GrateloupiaasiaticaKawaguchi et Wang)的生物量、成熟个体比例、生殖盛期及rbcL基因序列进行了详细研究.结果表明:不同季节亚洲蜈蚣藻的个体形态、大小、生物量均有差异.幼体从3月份出现,平均生物量为0.396 g/m2,10月份藻体最大,平均生物量达到4.944 g/m2.亚洲蜈蚣藻的主要繁殖季节为每年的8—11月(夏季到秋季),生殖器官首先出现在夏季较大的个体上,到秋季在较小的个体上也有出现.同一海域的雌雄配子体和四分孢子体的数量几乎为1∶1.rbcL基因序列分析表明:4个海域的8个亚洲蜈蚣藻样本无碱基差异.
亚洲蜈蚣藻;个体生态学;生物量;rbcL
亚洲蜈蚣藻(GrateloupiaasiaticaKawaguchi et Wang)隶属于红藻门(Rhodophyta)、杉藻目(Gigartinales)、海膜科(Halymeniaceae)、蜈蚣藻属(GrateloupiaC. Agardh)[1],广泛分布于中国、日本、韩国及亚洲太平洋地区,多生长在中、低潮带的石沼中.亚洲蜈蚣藻具有很高的营养价值,在大连等一些地区的居民将其制作成凉菜食用[2].
一直以来,很多藻类分类学家把亚洲蜈蚣藻(G.asiaticaKawaguchi et Wang)和蜈蚣藻属的属模蜈蚣藻(G.filicina(Lamouroux) C. Agardh) 误认为是同一个种.直到2001年,Kawaguchi 等通过rbcL基因序列分析以及生殖结构的详细观察,发现分布于亚洲及西太平洋的物种并非为蜈蚣藻(G.filicina(Lamouroux) C. Agardh),而是一新种,并命名为亚洲蜈蚣藻(G.asiaticaKawaguchi et Wang)[1].2014年,王宏伟等对亚洲蜈蚣藻的孢子发育及生活史进行了研究,结果显示:温度25 ℃、光照强度80 μmol/(m2·s)为亚洲蜈蚣藻孢子发育的最适条件[3].
目前,亚洲蜈蚣藻虽然已有分子系统分析、生殖结构、生活史以及对孢子和盘状体发育的研究[3-7],但关于其个体生态学研究一直未见报道.本文分析了大连地区黄海海域亚洲蜈蚣藻的生物量、大小、成熟个体比例、成熟个体的生物量/总生物量的变化、四分孢子体和雌雄配子体的比例,并结合了rbcL分子生态学方面的研究.研究结果为亚洲蜈蚣藻的物种保护、维持物种稳定、生殖繁育以及在生态修复中的地位和作用提供理论依据.
1 材料与方法
1.1 采集点布设

图1 采集点的设置
采集点的布设是依据生态环境保护较好、海藻种类及生物量相对丰富的黄海海域作为采集点,共设置了4个采集点(如图1所示),分别位于辽宁省大连市旅顺口区黄金山(121°16.948′E,38°47.724′N),大连市黑石礁(121°33.399′E,38°52.139′N),大连市付家庄(121°37.388′E,38°51.753′N)和大连市金石滩(122°2.560′E,39°4.155′N).
1.2 标本的采集与处理
2014年9月至2015年8月每个月大干潮日(农历初一或十五),同时对布设的4个海域进行亚洲蜈蚣藻标本采集,并且测量海水的温度以及根据天气预报确定光照时长.标本采集分为定性采集和定量采集.
定性采集:选择在中、低潮带的石沼中生长较好、藻体完整和带有生殖器官的藻体(图2a).将采回的藻体在解剖镜下用毛刷轻轻刷洗,确保除掉藻体表面的泥沙、附生性杂藻、原生动物等杂物,再用灭菌海水反复冲刷.定性采集的样品用作形态研究和基因提取.
定量采集:选择亚洲蜈蚣藻生长旺盛的区域布设样方(50 cm×50 cm),亚洲蜈蚣藻样方的布设如(图2b).藻体表面清洗方法同定量采集.处理好后记录每个样方内亚洲蜈蚣藻雌、雄配子体和四分孢子体的数量及分布情况以及R/T指数[8](成熟个体的生物量/总生物量的变化).定量采集的样品用吸水纸吸干藻体表面的水后,放置在65 ℃的烘干箱中干燥24 h,保证藻体彻底干燥后称重.

图2 亚洲蜈蚣藻的野外生境及样方的布设(50 cm×50 cm)
1.3 rbcL基因序列分析
分别从4个采样点选取1个幼苗阶段和1个成熟阶段的亚洲蜈蚣藻样本,以及从GenBank中获得的大连石槽、大连石庙、山东青岛、韩国、墨西哥和日本各1个亚洲蜈蚣藻的rbcL序列和蜈蚣藻属其他6个与亚洲蜈蚣藻形态相近的种:蜈蚣藻(G.filicina(J.V.Lamouroux) C.Agardh)[1]、多枝蜈蚣藻(G.ramosaWang et Luan)[9]、细弱蜈蚣藻(G.tenuisWang et Luan)[10]、阳江蜈蚣藻(G.yangjiangensisLi et Ding)[11]、黄海蜈蚣藻(G.huanghaiensisWang et Zhao)[12]、链状蜈蚣藻(G.catenataYendo)[13],以及叶状体类型的博鳌蜈蚣藻(G.boaoensisWang et Luan)[14]的rbcL序列用于构建ML系统发育树.
2 结 果
2.1 亚洲蜈蚣藻个体形态及大小的季节变化
对4个采样点的亚洲蜈蚣藻的外部形态比较后,发现在同一季节中,个体形态及大小没有显著的差异.如图3所示为不同季节采集的亚洲蜈蚣藻个体,其中,春季采集到最多的为亚洲蜈蚣藻的幼苗(图3a,图3b,图3c).夏季为亚洲蜈蚣藻的快速生长阶段,此时期藻体有分枝出现(图3d,图3e,图3f).秋季为亚洲蜈蚣藻的繁殖盛期,此时期藻体高度最大能达到20 cm(图3g,图3h).当亚洲蜈蚣藻的孢子放散后,藻体渐渐腐烂,所以冬季采集到的多为腐烂的个体.

图3 不同季节的亚洲蜈蚣藻个体大小春季:a,b,c,夏季:d,e,f,秋季:g,h
2.2 亚洲蜈蚣藻成熟个体比例及成熟个体生物量的季节变化
8月份,亚洲蜈蚣藻藻体开始出现囊果、精子囊和四分孢子囊等生殖器官,而9—11月份期间采集的所有个体都具有生殖器官,11月份之后,具有生殖器官的个体数量开始减少,而在4—7月份采集的个体均没有生殖器官(表1).8月份,成熟个体的比例为59%,而9—11月份都为100%,12月到第2年3月份成熟个体的比例逐月下降(表1).其中,最小平均生物量出现在3月份,最大平均生物量出现在10月份.
基于R/T公式计算得到的波动指数见表1.8月份成熟个体总生物量占总个体总生物量的68%.10月份,百分比达到99%(表1),之后百分比又开始下降,下降的原因是成熟的个体释放完孢子后就逐渐分解,所以成熟个体的生物量也随之减少.笔者采集到的最小的具有生殖器官的个体长度为15 mm,干重为4.8 mg.
通过统计每个地点不同月份不同世代的数据发现,最小平均生物量出现在3月份,最大平均生物量出现在10月份(表1).其中,3月份黄金山的样方内(50 cm×50 cm)平均生物量是0.344 g/m2、黑石礁是0.436 g/m2、付家庄是0.492 g/m2、金石滩是0.44 g/m2.10月份黄金山平均生物量是4.784 g/m2、黑石礁是4.182 g/m2、付家庄是4.092 g/m2、金石滩是5.156 g/m2.

表1 亚洲蜈蚣藻个体生态学统计表
2.3 亚洲蜈蚣藻四分孢子体和配子体的分布

图4 亚洲蜈蚣藻的雌雄配子体和四分孢子体在4个地点样方(50 cm×50 cm)内的分布情况
图4为2014年10月份4个地点的亚洲蜈蚣藻四分孢子体和配子体的分布情况,四分孢子体和雌雄配子体的比例接近1∶1.其中,黄金山亚洲蜈蚣藻的四分孢子体占比例为46%、雌雄配子体各占27%,黑石礁的亚洲蜈蚣藻四分孢子体占比为50%、雌雄配子体各占25%,付家庄的亚洲蜈蚣藻四分孢子体占比为44%、雌配子体占23%、雄配子体占35%,以及金石滩的亚洲蜈蚣藻四分孢子体占比为55%、雌配子体占27%、雄配子体占18%.
2.4 rbcL序列分析
4个采集点亚洲蜈蚣藻的幼苗和成体之间 的rbcL基因没有碱基差异,并且4个采集点的8个个体间也无碱基差异,与大连石槽、石庙和青岛以及日本的标本间同样没有碱基差异,但与韩国和墨西哥的亚洲蜈蚣藻有2 bp的碱基差异(0.17%);与模式标本产地地中海的蜈蚣藻属模式种蜈蚣藻(G.filicina(J.V.Lamouroux) C.Agardh)的碱基差异为83 bp(7.67%);与形态上相似的多枝蜈蚣藻(G.ramosaWang et Luan)的碱基差异为87 bp(8.16%),与链状蜈蚣藻(G.catenataYendo)的碱基差异为91 bp(8.60%),与细弱蜈蚣藻(G.tenuisWang et Luan)的碱基差异为85 bp(7.97%),与阳江蜈蚣藻(G.yangjiangensisLi et Ding)的碱基差异为85 bp(7.97%),与黄海蜈蚣藻(G.huanghaiensisWang et Zhao)的碱基差异为84 bp(7.87%),与叶状体类型的博鳌蜈蚣藻(G.boaoensisWang et Luan)的碱基差异为87 bp(8.16% )(图 5).
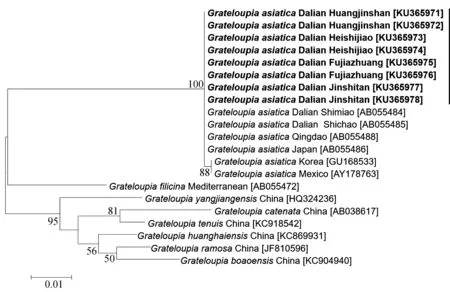
图5 基于rbcL基因构建的ML系统树
3 讨 论
通过对亚洲蜈蚣藻的个体生态学研究,发现亚洲蜈蚣藻属于多年生海藻,在冬季和初春,藻体上部分逐渐分解,但固着器一直存在.3月份,随着海水温度的升高,一部分个体由固着器开始生长,另一部分个体由孢子发育而来,所以在10月份同时采到了四分孢子体和雌雄配子体.同样的情况在日本角叉菜(ChondrusnipponicusYendo)上也有发现.1993年,Michio Masuda 和 Yasuharu Hashimoto对日本角叉菜的个体生态学进行了研究,发现日本角叉菜的配子体和四分孢子体比例也接近1∶1[15].这说明海藻的配子体和四分孢子体可在同一时期生长繁殖.
3—6月,海水的温度从5.9 ℃到15.3 ℃不断升高,光照时长从11.53 h到15.26 h逐渐变长,这段时间内藻体不断生长,由此可见,温度和光照都可影响亚洲蜈蚣藻的生长.8月份,海水温度达到最高23.2 ℃,光照时长为13.69 h,但此时个体还在继续生长.10月份时,亚洲蜈蚣藻的生物量最大,10月之后的生物量开始减少,可能是因为孢子放散后,藻体营养体部分就开始逐渐分解或藻体在低海水温度以及短日照条件下不适合生长造成的.
近年来,我国诸多海域富营养化严重,海湾赤潮和海水污染频繁发生,海湾生态系统严重失衡.而一些研究学者发现,海带、裙带菜、紫菜、龙须菜等大型海藻在生长过程中能大量吸收C、N、P等营养物质,大型海藻是吸收、利用营养物质,防治富营养化的有效措施之一,对于生态系统的修复具有重要的作用[16].本研究中的亚洲蜈蚣藻同属于大型多年生海藻并且常年存在,因此亚洲蜈蚣藻对生态系统的修复和保护也应具有一定的作用.通过对亚洲蜈蚣藻的个体生态学研究,掌握了其个体生长发育的变化以及生殖的规律,希望通过研究亚洲蜈蚣藻生活习性和生长周期的特点为其物种的保护和繁育等提供理论依据.
在rbcL序列分析中得出4个采样点的幼苗和成体没有碱基差异,证明了其遗传的稳定性.同时与大连石槽、石庙以及山东青岛的样本没有碱基差异,说明国内的亚洲蜈蚣藻没有遗传差异;其次,与日本的样本同样没有碱基差异,说明日本同中国的亚洲蜈蚣藻样本没有因地理或环境的因素发生遗传差异.本研究的8个样本与韩国和墨西哥的亚洲蜈蚣藻有2 bp的碱基差异,可能是地理或环境等因素导致的差异.从系统发育树中可以看出,亚洲蜈蚣藻与属模蜈蚣藻分别在单独的2个进化枝上,进一步证明了亚洲蜈蚣藻确实为蜈蚣藻属中一个独立的物种而非蜈蚣藻(G.filicina).
[1] KAWAGUCHI S,WANG H W,HORIGUCHI T,et al.A comparative study of the red algaGrateloupiafilicina(Halymeniaceae) from the Northwestern Pacific and Mediterranean with the description ofGrateloupiaasiaticasp.nov.[J].Journal of Phycology,2001,37(3):433-442.
[2] 王宏伟,戚贵成.辽宁沿海蜈蚣藻属的初步研究[J].辽宁师范大学学报(自然科学版),2009,32(2):231-234.
[3] 王宏伟,李雅卓,曹翠翠,等.亚洲蜈蚣藻(GrateloupiaasiaticaKawaguchi et Wang )孢子发育及生活史的研究[J].辽宁师范大学学报(自然科学版),2014,37(2):246-251.
[4] ADHARINI R I,KIM H G.Developmental pattern of crust into upright thalli ofGrateloupiaasiatica(Halymeniaceae,Rhodophyta)[J].Journal of Applied Phycology,2014,26(4):1911-1918.
[5] 村上迪代,猪野俊平.ムカデノリの四分孢子发生について[J].藻类,1967,15(2):61-67.
[6] 李伟新,符鹏飞,丁镇芬,等.蜈蚣藻及其生殖器官的研究[J].热带海洋,1984,3(4):35-42.
[7] 房历生,肖培华.蜈蚣藻(GrateloupiafilicinaC.Ag)幼苗生物学的初步研究[J].海洋通报,1985,4(4):40-44.
[8] HASEGAWA Y,FUKUHARA E.Ecological studies onIridophycuscornucopiae(P. et R.) Setch. et Gardn. 3. On the seasonal change of the number of gametophytes and sporophytes[J].Bull Hokkaido Reg Fish Res Lab,1952,3:20-30.
[9] CAO C C,LIU M,GUO S R,et al.Grateloupiaramosa,Wang & Luan sp. nov. (Halymeniaceae,Rhodophyta),a new species from China based on morphological evidence and comparativerbcL sequences[J].Chinese Journal of Oceanology & Limnology,2015(2):283-294.
[10] YU L,WANG H W,LUAN R X.GrateloupiatenuisWang et Luan sp. nov. (Halymeniaceae,Rhodophyta):a new species from South China sea based on morphological observation andrbcL gene sequences analysis[J].Biomed Research International,2013(3):560163.
[11] WANG H W,GUO S R,ZHANG X M,et al.Re-identifyingGrateloupiayangjiangensis(Rhodophyta,Halymeniaceae) based on morphological observations,life history andrbcL sequence analyses[J].Acta Oceanologica Sinica,2014,33(4):77-84.
[12] WANG H W,GUAN Y,ZHAO F Q,et al.Grateloupiahuanghaiensissp. nov. (Halymeniaceae,Rhodophyta),a peculiar new species from China[J].Marine Biology Research,2014,11(4):396-404.
[13] WANG H W,GUO S R,ZHANG X M,et al.Reinstatement ofGrateloupiacatenata(Rhodophyta,Halymeniaceae) on the basis of morphology andrbcL sequences[J].Phycologia,2000,39(3):228-237.
[14] LIU M,WANG H W,LUAN R X.Morphological observation andrbcL sequence analysis of a new species from china,GrateloupiaboaoensisWang et Luan sp. Nov. (Halymeniaceae,Rhodophyta)[J].Acta Hydrobiologica Sinica,2014,38(5):938-944
[15] MASUDA M,HASHIOTO Y.Autecological studies onChondrusnipponicusYendo(Gigartinales,Rhodophyta)[J].Japanese Journal of Phycology Sapporo,1993,41(2):99-111.
[16] 林贞贤,汝少国,杨宇峰.大型海藻对富营养化海湾生物修复的研究进展[J].海洋湖沼通报,2007(4):128-134.
Autecological studies onGrateloupiaasiaticaKawaguchi et Wang (Halymeniaceae,Rhodophyta)
WANGHongwei,LIUYuwei,WANGChen,ZHAOShuyu,TIANYilin
(College of Life Science, Liaoning Normal University, Dalian 116081, China)
We investigated individual biomass,mature individual proportion,reproductive stage andrbcL gene onGrateloupiaasiaticaKawaguchi et Wang distributed in Dalian detailedly. The results indicated that the individual morphology,size and biomass ofG.asiaticain different seasons were all different. This species begin to grow in March when the algae is minimum. And the average individual biomass is 0.396 g/m2at this time. And the maximum biomass is 4.944 g/m2in October. The main reproduction season is from August to November(from summer to autumn). Reproductive structures are first formed on larger blades and progressively on smaller blades. The number of tetrasporophytes and gametophytes is virtually equal in the same place in different months. And there is no bases difference of eightG.asiaticasample in the four sites based on therbcL gene.
Grateloupiaasiatica;autecology;biomass;rbcL
2016-08-08 基金项目:国家自然科学基金资助项目(30870161;31270251;31570209) 作者简介:王宏伟(1963-),男,辽宁北镇人,辽宁师范大学教授,博士.
1000-1735(2017)01-0083-06
10.11679/lsxblk2017010083
Q948.8
A

