hERG钾通道通过降低氧化应激改善肝细胞糖代谢
卢 晶 沈 涵 程 呈 宋丽妮 张怡尘 谢荣荣 袁明霞 杨金奎*
(1.首都医科大学附属北京同仁医院内分泌科,北京 100730; 2.糖尿病防治研究北京市重点实验室,北京 100730)
·内分泌与代谢病专题 ·
hERG钾通道通过降低氧化应激改善肝细胞糖代谢
卢 晶1,2沈 涵1,2程 呈1,2宋丽妮1,2张怡尘1,2谢荣荣1,2袁明霞1,2杨金奎1,2*
(1.首都医科大学附属北京同仁医院内分泌科,北京 100730; 2.糖尿病防治研究北京市重点实验室,北京 100730)
目的 研究hERG钾通道(human ether-α-go-go related gene channels) 在肝细胞中与糖代谢的关系。方法 用hERG钾通道过表达载体转染人类肝癌细胞系(liver hepatocellular carcinoma, HepG2)细胞,通过荧光定量PCR (real-time PCR, RT-PCR) 和蛋白印迹 (Western blotting) 法检测糖代谢、糖异生、氧化应激及还原型烟酰胺腺嘌呤二核苷酸磷酸 (nicotinamide adenine dinucleotide 2′-phosphate, NADPH ) 相关亚基的表达。结果hERG钾通道蛋白可在肝脏细胞中表达,将hERG钾通道过表达于HepG2细胞后,糖异生相关基因葡萄糖-6-磷酸激酶 (glucose-6-phosphatase, G6Pase) 表达显著降低,而磷酸烯醇式丙酮酸羧激酶 (phosphoenolpyruvate carboxykinase, PEPCK) 表达有降低。胰岛素表达相关基因葡萄糖转运蛋白2(glucose transporter type 2, GLUT2)、胰岛素受体底物2 (insulin receptor substrate, IRS-2) 和腺苷酸活化蛋白激酶α亚基2 [(adenosine 5’-monophosphate(AMP)-activated protein kinase), AMPKα2] 的表达水平均显著增高。NADPH4种亚基p22、p47、p67和p91表达均显著降低。结论hERG钾通道可以通过降低氧化应激改善肝细胞内糖代谢。
人ether-α-go-go相关基因;胰岛素抵抗;氧化应激;糖代谢
流行病学研究表明,糖尿病在我国发病人数接近1亿,严重影响我国人民健康状况。2型糖尿病主要表现为胰岛素分泌缺陷或胰岛素分泌障碍[1-2]。肝脏是机体能量代谢的主要器官之一,也是胰岛素作用的主要靶器官,参与维持体内空腹血糖浓度。肝脏胰岛素抵抗主要是指胰岛素抑制肝脏葡萄糖输出能力,造成糖异生增加,糖原分解减少,从而导致2型糖尿病。
人ether-a-go-go相关基因 (human ether-a-go-go related gene,hERG) 编码的离子通道称为hERG钾通道,属于电压依赖性钾通道(voltage-dependent potassium channel, Kv) 家族成员[3]。hERG钾通道主要参与心肌动作电位的复极化,hERG钾通道突变后可导致外向复极钾电流降低,QT间隙延长,引起多型性室性心动过速,严重者可导致猝死,即长QT综合征 (long-QT syndrome, LQTs)[4]。 本课题组[5]前期已成功构建hERG钾通道基因敲除小鼠,并发现hERG钾通道基因在维持胰岛β细胞的形态及功能方面具有重要作用,敲除小鼠表现为血糖水平增高和胰岛素分泌降低。氧化应激是造成胰岛素抵抗的重要原因之一,hERG钾通道可能通过抑制氧化应激来改善机体内糖代谢。
本研究拟在细胞水平研究hERG钾通道在人肝脏细胞HepG2中的表达情况,并深入研究其与氧化应激和糖代谢的关系。
1 材料与方法
1.1 细胞培养
人肝癌细胞系HepG2购自中国协和医科大学细胞资源中心 (Cell Resource Center, IBMS, CAMS/PUMC),用DMEM (Dulbecco’s Modified Eagle’s Medium) (Gibco公司,美国)进行培养,加入10%(体积分数)胎牛血清(Gibco公司,美国)、100 U/mL青霉素和0.1 g/L链霉素(Gibco公司,美国),放于37 ℃,5%(体积分数) CO2孵箱内培养,每2 d用0.25%(质量分数)胰酶(Gibco公司,美国)消化后传代,待细胞生长至90%时进行质粒转染。
1.2 质粒构建和转染
将hERG钾通道基因构建到pcDNA3.1-GFP-His(-)B (PCDB) (Sino-Geno Max, 中国) 载体上。质粒DNA采用TransIntro EL Transfection Reagent(TransGen Biotech 公司,中国)脂质体转染法,根据转染试剂盒操作说明转染HepG2 细胞。以pcDNA3.1-增强型绿色荧光蛋白(green fluorescence protein,GFP) 载体转染的HepG2 细胞作为实验对照组(control)。细胞转染48 h后观察GFP荧光强度并收集细胞用于后续实验。
1.3 RNA的提取和荧光实时定量PCR
采用天根细胞组织总RNA提取试剂盒(批号:DP419)提取RNA,采用天根FastQuant cDNA第一链合成预混试剂(批号:KR108)合成cDNA。Beta-actin基因作为内参。采用Light Cycler 96仪器 (Roche公司,美国),SYBR Green master mix检测RNA的表达情况。PCR反应体系为20μL,2×Enzyme mix (Transgen Biotech, 批号:AS111) 10 μL;正向引物 0.4 μL;反向引物 0.4 μL; cDNA 1.5μL, DEPC H2O 7.7 μL。扩增条件为94 ℃ 5 min,94 ℃ 30 s,60 ℃ 30 s,72 ℃ 20 s,35个循环;72 ℃ 5 min,自然冷却至室温,所用引物见表1。

表1 引物序列
1.4 Western blotting分析
采用BCA蛋白分析试剂盒 (碧云天生物技术有限公司,中国)测定蛋白浓度。hERG抗体购自Sigma公司(美国),批号SAB14082;PEPCK购自Santa-Cruz公司(美国),批号SC-28477;G6Pase购自Santa-Cruz公司(美国),批号SC-25486;Beta-actin作为内参,抗体购自CST(Cell Signal Technology)公司,批号8457。取80 μg总蛋白进行10%(质量分数)的SDS-PAGE电泳,湿转(200 mA,120 min)至硝酸纤维膜上。用TBST[TBS+0.1%(体积分数) Tween-20]配制的5%(质量分数)脱脂奶粉室温封闭1.5 h,用封闭液将一抗稀释后与膜在4 ℃摇床孵育过夜,次日用TBST洗膜3次,每次5 min,再与辣根过氧化物酶(horseradish peroxidase, HRP)标记的二抗(1∶2 000)室温孵育1 h。TBST洗涤,滴加增强化学发光(enhanced chemiluminescence, ECL)发光液后用Chemi-Doc Touch凝胶成像系统显影成像,并用Image J软件对图像进行灰度分析。
1.5 统计学方法
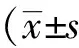
2 结果
2.1hERG载体转染HepG2细胞
将hERG过表达质粒和pcDNA3.1-GFP质粒分别转染HepG2细胞,48 h后观察GFP表达情况。结果显示,两种质粒的GFP荧光均有明显表达,两种质粒均成功转染HepG2细胞(图1)。
2.2hERG钾通道在肝脏细胞中表达
采用Western blotting法检测hERG蛋白在人肝脏细胞HepG2中的表达。结果显示,hERG蛋白在HepG2中有表达,而将hERG钾通道蛋白过表达HepG2后,hERG蛋白表达增加明显 (P<0.01,图2)。
2.3hERG钾通道对糖异生相关基因的影响
将hERG钾通道过表达于HepG2细胞后,检测糖异生相关基因PEPCK和G6Pase蛋白的表达。Western blotting结果显示,hERG钾通道过表达HepG2细胞后,G6Pase蛋白水平显著降低 (P<0.05)。PEPCK表达水平降低(图3)。
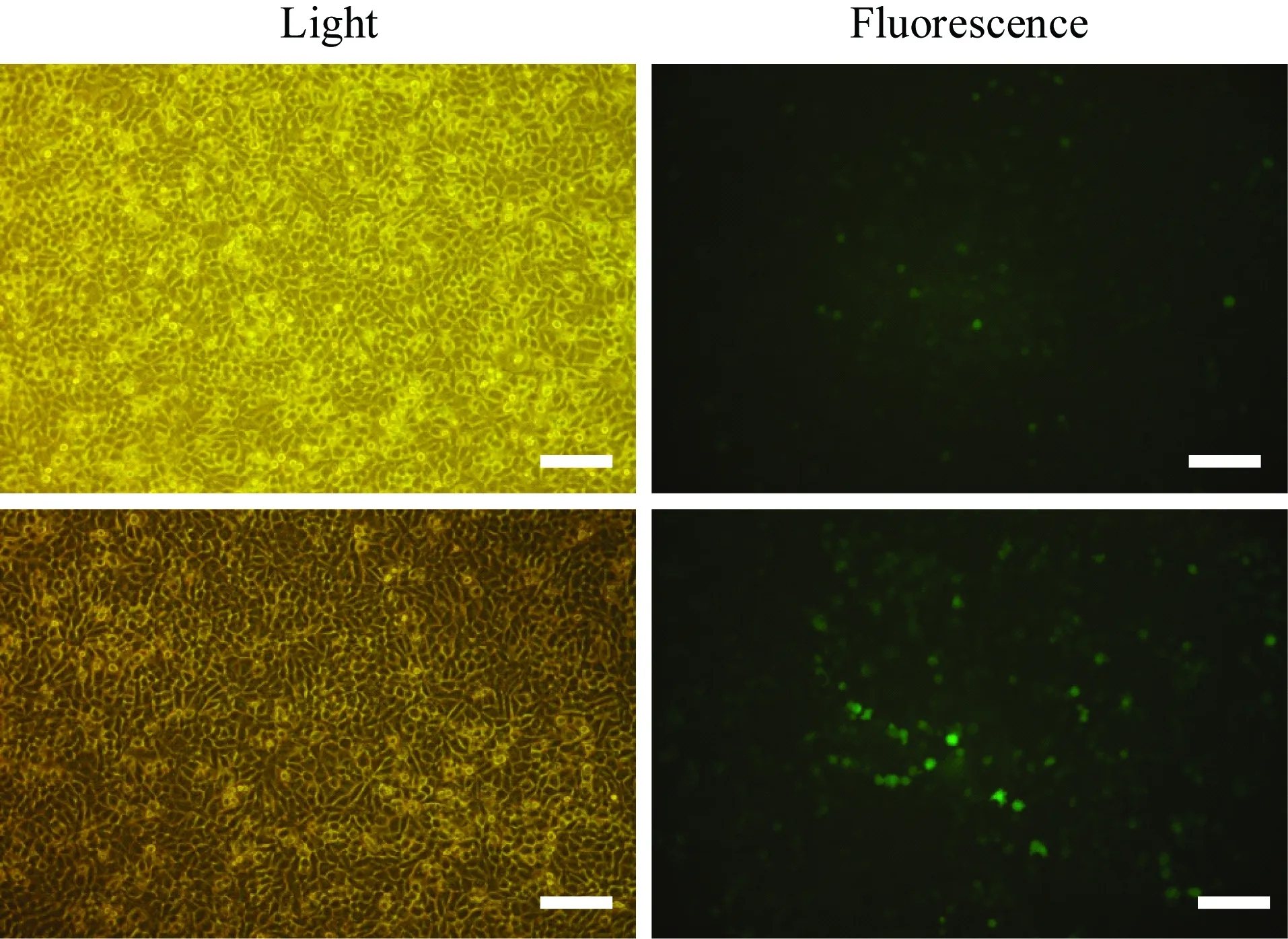
图1 质粒转染HepG2
A:hERGover-expression plasmid; B: pcDNA3. 1-GFP vector;hERG: human ether-a-go-go related gene; Bar: 100 μm.
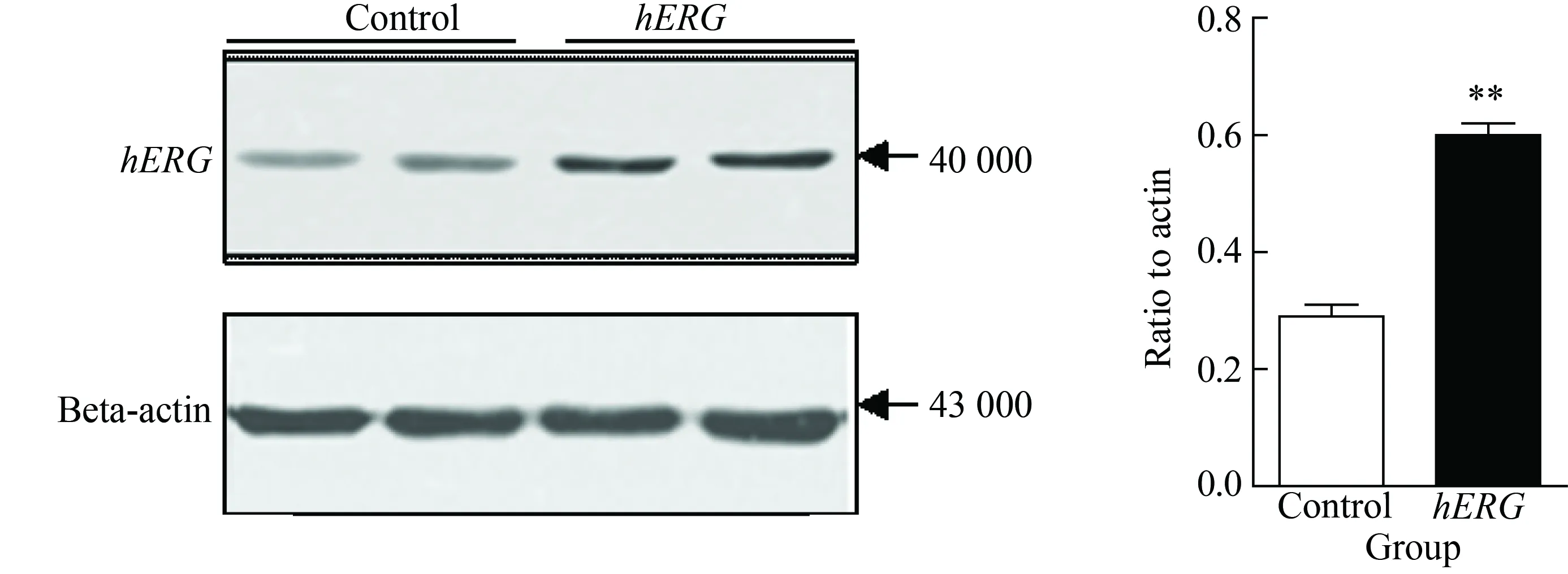
图2 hERG钾通道蛋白在HepG2细胞中的表达

图3 hERG钾通道对HepG2细胞糖异生相关基因表达的影响
*P<0.05vscontrol group,n=3;hERG: human ether-a-go-go related gene;G6Pase: glucose-6-phosphatase;PEPCK: phosphoenolpyruvate carboxykinase.
2.4hERG钾通道对糖代谢相关基因表达的影响
将hERG钾通道过表达于HepG2细胞后,采用RT-PCR方法检测糖代谢相关基因GLUT2、IRS-2和AMPKα2的表达水平,结果显示,hERG钾通道过表达HepG2细胞后,与对照组相比,3种基因的mRNA水平显著升高 (P<0.05)(图4)。
图4 hERG钾通道对HepG2细胞糖代谢相关基因表达的影响
*P<0.05,***P=0.000vscontrol group,n=3;hERG: human ether-a-go-go related gene;GLUT2:glucose transporter type 2;IRS-2: insulin receptor substrate-2;AMPKα2: adenosine 5’-monophosphate(AMP)-activated protein kinase α2.
2.4hERG过表达降低NADPH相关亚基的表达水平
为检测hERG过表达后对NADPH亚基的影响,采用RT-PCR检测NADPH亚基p22、p47、p67和p91的mRNA表达,结果显示,hERG过表达后p22、p47、p67和p91的mRNA表达均明显降低(P<0.05,图5)。
3 讨论
hERG钾通道属于电压依赖性钾通道家族,但是其电流特点与其他传统的钾通道不同,较为复杂[6]。hERG钾通道在多种组织,如心、脑、垂体、胰腺等均有表达,并发挥不同作用[7]。本课题组[8]前期研究显示,在C57BL/6小鼠上将hERG基因敲除后,小鼠会出现血糖增高、胰岛素抵抗等糖代谢紊乱症状现象。肝脏是体内糖代谢的重要器官之一。胰岛素抵抗是2型糖尿病发病的机制之一。氧化应激是造成胰岛素抵抗的重要原因。目前尚未有研究hERG钾通道与氧化应激及糖代谢的关系的报道。本研究在细胞水平证实,hERG钾通道在肝脏细胞中表达,并通过降低氧化应激,减少糖异生,改善糖代谢。
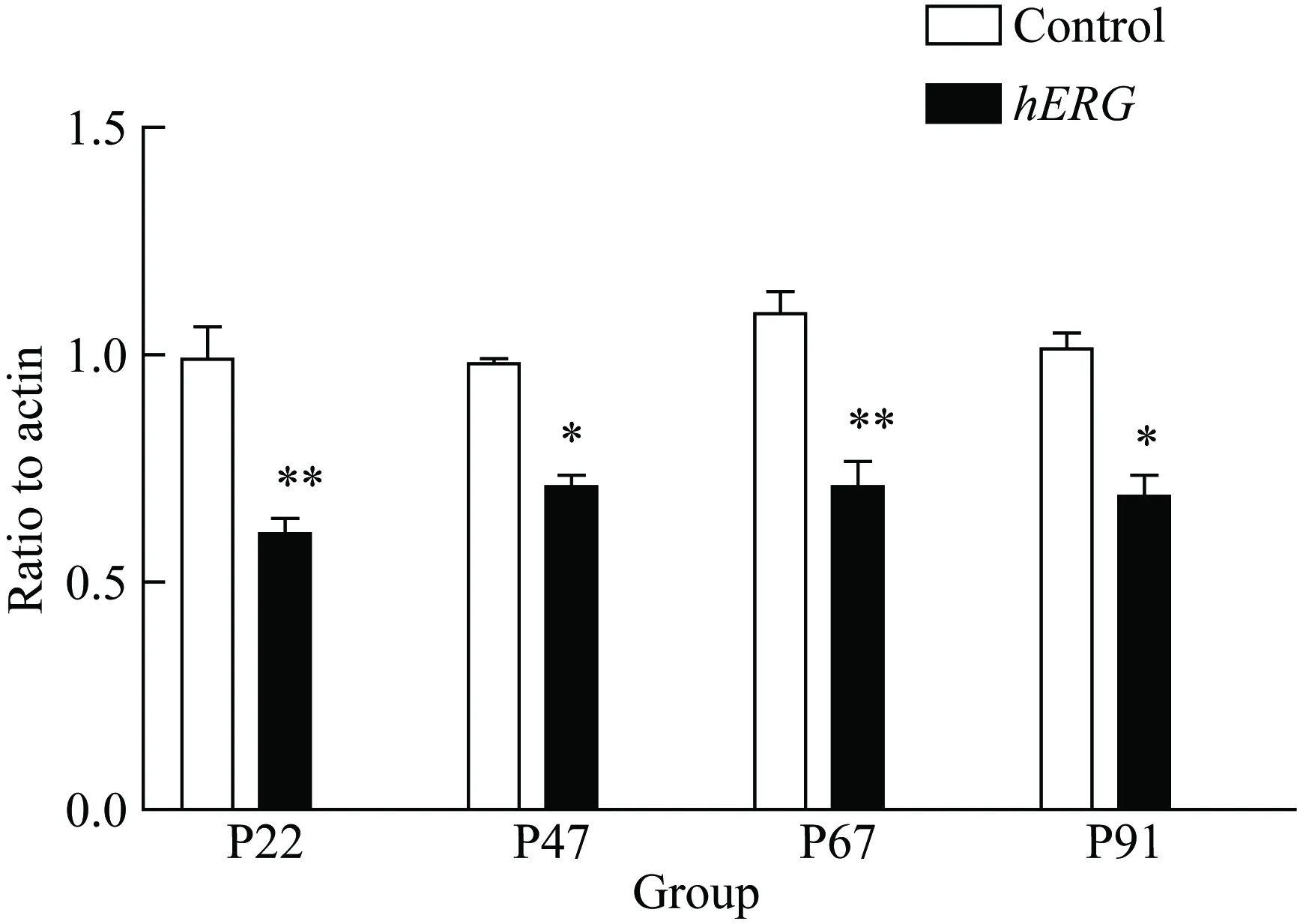
图5 hERG降低HepG2细胞中NADPH亚基的表达
*P<0.05,**P<0.01vscontrol group,n=3;hERG: human ether-a-go-go related gene; NADPH: nicotinamide adenine dinucleotide 2′-phosphate.
AMPK是一个能量传感器,参与调节包括胰岛B细胞、肝脏、骨骼肌和脂肪在内的多种外周组织的糖脂代谢过程[9]。AMPK是一个异源三聚体蛋白,由α、β和γ 3个亚单位组成,其中α亚基起催化作用。AMPK的亚基α2的活性与胰岛素抵抗相关[10-11]。本研究结果显示,hERG可诱导AMPKα2的表达。糖代谢相关基因GLUT2和IRS-2表达也增高,PEPCK和G6Pase是糖异生的主要限速酶,hERG过表达后,糖异生基因PEPCK和G6Pase表达下降,提示hERG钾通道在细胞水平可以降低糖异生,促进糖分解。
NADPH氧化酶属于NOX家族成员,主要由催化亚基p91,跨膜亚基p22,胞质亚基p47、p67等组成的酶复合体。NADPH氧化酶主要的生理学功能是产生ROS,参与机体氧化应激,已有研究[12-13]表明其与胰岛素抵抗密切相关。因此本研究推测,hERG钾通道可能通过抑制氧化应激作用,减少胰岛素抵抗从而改善糖代谢。本研究结果证实了这一推测,hERG过表达后,NADPH 4种亚基均有明显降低,显示hERG钾通道通过降低氧化应激水平,调节糖代谢。
本研究下一步拟在两方面进行深入研究。一方面,在动物水平,利用课题组前期构建的hERG敲除小鼠,研究hERG钾通道敲除后,主要是肝脏内,氧化应激是否增加从而导致糖耐量异常;另一方面,目前已知的多种hERG钾通道抑制剂,如E4031[14]、多菲利特[15]、西沙比利[3,16]、维拉帕米[17]等,这几种药物均在不同程度上影响hERG钾通道的门控特性,使其改变,造成电流幅度下降甚至完全消失。本课题组将在细胞水平和动物水平分别运用这几种药物,研究药物抑制后hERG钾通道对氧化应激及糖代谢的影响。
[1] Ye J M, Dzamko N, Cleasby M E, et al. Direct demonstration of lipid sequestration as a mechanism by which rosiglitazone prevents fatty-acid-induced insulin resistance in the rat: comparison with metformin [J]. Diabetologia, 2004, 47(7):1306-1313.
[2] Fryer L G, Carling D. AMP-activated protein kinase and the metabolic syndrome [J]. Biochem Soc Trans, 2005, 33(2):362-366.
[3] Bentzen B H, Olsen S P, Roon L C B, et al. Bk channel activators and their therapeutic perspectives[J]. Front Physil, 2014, 5:389.
[4] Curran M E, Splawski I, Timothy K W, et al. A molecular basis for cardiac arrhythmia: HERG mutations cause long QT syndrome [J]. Cell, 1995, 80 (5): 795-803.
[5] Qiu H Y, Yuan S S, Yang F Y, et al. HERG protein plays a role in Moxifloxacin-induced hypoglycemia [J]. J Diabetes Res, 2016,16 (6): 298-304.
[6] 元沙沙,黄海霞,杨金奎. 胃肠动力药西沙比利对表达于HEK293细胞的人ether-a-go-go相关基因2通道的影响[J].首都医科大学学报,2014,35 (6): 760-764.
[7] Warmke W, Ganetzky B. A family of potassium channel genes related to eag in Drosophila and mammals [J]. Proc Natl Acad Sci USA, 1994, 91(8): 3438-3442.
[8] Taniguchi C M, Ueki K, Kahn R. Complementary roles of IRS-1 and IRS-2 in the hepatic regulation of metabolism [J]. J Clin Invest, 2005, 115 (3): 718-727.
[9] Hardie D G, Hawley S A, Scott J W. AMP-activated protein kinase-development of the energy sensor concept.[J] J Physiol, 2006, 574 (1): 7-15.
[10]Long Y C, Zierath J R. AMP-activated protein kinase signaling in metabolic regulation [J]. J Clin Invest, 2006, 116 (7): 1776-1783.
[11]王芸姣,韩文祺,李若菲,等.AMPK参与调节大鼠脂肪肝相关性肝癌前病变的形成[J]. 首都医科大学学报, 2016,37(2) :208-213.
[12]刘颐轩,宋桉,王芸,等.氧化应激在肥胖及胰岛素抵抗中的作用研究进展[J]. 段力园,宋光耀.解放军医药杂志, 2014,26(1) :99-101.
[13]Wei Y, Sowers J R, Nistala R, et al. Angiotensin II-induced NADPH oxidase activation impaired insulin signaling in skeletal muscle cells [J]. J Biol Chem, 2006, 281(46): 35137-35146.
[14]Zhou Z, Gong Q, Ye B, et al. Properties of channels stably expressed in HEK 293 cells studies at physiological temperature [J]. Biophys J, 1998, 74(1): 230-241.
[15]Snyders D J, Chaudhary A. High affinity open channel block by dofetilide of HERG expressed in a human cell line [J]. Mol Pharrnacol, 1996, 49(6): 949-955.
[16]Mohammad S, Zhou Z, Gong Q, et al. Blockage of HERG human cardiac K+channel by the gastrointestinal prokinetic agent cisapride [J]. Am J Physiol, 1997, 273 (5 Pt 2): H2534-H2538.
[17]Calloe K, Elmedyb P, Olesen S P, et al. Hypoosmotic cell swelling as a novel mechanism for modulation of cloned HCN2 channels[J]. Biophys J, 2005,89(3): 2159-2169.
编辑 慕 萌
Human ether-α-go-go related gene channels improves glucose metabolism via anti-oxidative stress in HepG2 cells
Lu Jing1,2, Sheng Han1,2, Cheng Cheng1,2, Song Lini1,2, Zhang Yichen1,2, Xie Rongrong1,2, Yuan Mingxia1,2, Yang Jinkui1,2*
(1.DepartmentofEndocrinology,BeijingTongrenHospital,CapitalMedicalUniversity,Beijing100730,China; 2.BeijingKeyLaboratoryofDiabetesResearchandCare,Beijing100730,China)
Objective To evaluate the effect of the new pathway of human ether-α-go-go related gene (hERG) channels on glucose metabolism in hepatic cells. Methods Liver hepatocellular carcinoma (HepG2) cells were transfected withhERGchannels over-expression plasmid DNA. pcDNA3. 1-GFP plasmid was used as a negative control. The expression ofhERG, phosphoenolpyruvate carboxykinase(PEPCK) and glucose-6-phosphatase (G6Pase) were detected by Western blotting. The mRNA level of glucose transporter type 2 (GLUT2), insulin receptor substrate (IRS-2), adenosine 5′-monophosphate(AMP)-activated protein kinase (AMPKα2), p22, p47, p67 and p91 were observed by real-time PCR(RT-PCR). Results The experiments showed that hERG gene can be expressed in HepG2 cells. Over-expression ofhERGgene in HepG2 cells could down-regulate the expression of PEPCK, G6Pase. while GLUT2, IRS-2, AMPKα2 genes were up-regulated. Over-expression of hERG gene also inhibited the relative mRNA level of p22, p47, p67and p91. ConclusionhERGchannels could be involved in improving glucose metabolism via anti-oxidative effects.
human ether-α-go-go related gene channels; insulin resistance; oxidative stress; glucose metabolism
国家自然科学基金(81370946, 81400824, 81300726),北京市自然科学基金(7131005),首都医科大学附属北京同仁医院科研基金 (TRYY-KYJJ-2016-013)。This study was supported by National Natural Science Foundation of China (81370946, 81400824, 81300726), Natural Science Foundation of Beijing (7131005) , Foundation of Beijing Tongren Hospital, Capital Medical University (TRYY-KYJJ-2016-013).
时间:2017-04-13 20∶07
http://kns.cnki.net/kcms/detail/11.3662.R.20170413.2007.058.html
10.3969/j.issn.1006-7795.2017.02.003]
R587.1
2017-01-20)
*Corresponding author, E-mail:jinkui.yang@gmail.com

