CD55/CD59及嗜水气单胞菌毒素变异体在阵发性睡眠性血红蛋白尿症患者中的表达*
杨柯,欧剑锋,白海,王存邦,潘耀柱,吴涛
(兰州军区兰州总医院血液科/血液病研究所,兰州 730050)
CD55/CD59及嗜水气单胞菌毒素变异体在阵发性睡眠性血红蛋白尿症患者中的表达*
杨柯,欧剑锋,白海,王存邦,潘耀柱,吴涛
(兰州军区兰州总医院血液科/血液病研究所,兰州 730050)
目的 探讨CD55/CD59及嗜水气单胞菌毒素变异体(FLAER)在阵发性睡眠性血红蛋白尿症(PNH)患者中的表达水平。方法 用流式细胞仪检测30例健康人对照及13例PNH患者外周血红细胞和粒细胞表面抗原CD55/59缺失率,以及粒细胞和单核细胞FLAER缺失率。结果 PNH患者红细胞CD55/59抗原缺失率(40.21±7.45,56.14±9.27)、粒细胞CD55/59抗原缺失率(55.52±13.40,72.63±16.26)、单核及粒细胞FLAER缺失率(83.60±11.92,87.37±10.53)均高于健康人对照组(P均<0.05);PNH患者粒细胞CD55/59抗原缺失率明显高于红细胞,且在同种细胞中CD59缺失率亦高于CD55(P<0.05);PNH患者粒细胞FLAER缺失率明显高于粒细胞CD55/59抗原缺失率(P<0.05)。结论 CD55/59和FLAER在PNH患者中的缺失率较高,且在粒细胞中FLAER缺失率更高。
CD55/59;嗜水气单胞菌毒素变异体;阵发性睡眠性血红蛋白尿
阵发性睡眠性血红蛋白尿(paroxysmal nocturnal hemoglobinuria,PNH)患者细胞膜表面缺失糖化磷脂酰肌醇(GPI)锚连蛋白,易引发血管内溶血和血红蛋白尿[1]。GPI蛋白─CD55和CD59几乎存在于所有的血细胞膜上,其发生缺失可作为PNH克隆存在的标志物,但CD55/59与锚链抗原特异性结合时抗原表达不稳定,易受再生障碍性贫血(AA)、骨髓增生异常综合征(MDS)、自身免疫性疾病(ALPS)、溶血和细胞发育不全等因素的影响,诊断敏感性及特异性均不高[2]。嗜水气单胞菌溶素前体变异体(FLAER)能特异性与细胞膜上GPI蛋白结合,不会产生因GPI蛋白种类和数量造成的误差,且不受输血和溶血影响,而具有更高的检出率、敏感性和特异性[3]。但红细胞表面某些糖蛋白的存在使FLAER不能很好与GPI锚蛋白结合,目前FLAER只用于粒细胞和单核细胞检测[4]。本研究用流式细胞仪检测PNH患者FLAER及CD55/59水平。报道如下。
1 材料与方法
1.1 研究对象 收集于2009年1月至2017年3月本院血液科临床诊断为全血细胞减少患者226例,参照《血液病诊断及疗效标准》[5],PNH纳入标准:(1)临床表现符合PNH;(2)Ham试验、糖水试验,蛇毒因子溶血试验、尿潜血(或含铁血黄素)等项试验2项以上阳性;(3)流式细胞术检测外周血中CD55或CD59阴性中性粒细胞或红细胞>10%。同时具备(1)+(2)或(1)+(3)条件即可纳入病例组。排除标准:排除再生障碍性贫血、缺铁性贫血、溶血性贫血和骨髓增生异常综合征等疾病。最终确诊为PNH患者13例,男9例,女4例,年龄34~76岁,中位年龄49岁,患者均无治疗及输血史。选择同期于本院体检健康者30例作为对照组,男18例,女12例,年龄22~69岁,中位年龄41岁。
1.2 仪器与试剂 FACS Canto Ⅱ流式细胞仪(美国BD公司);CD59-FITC、CD55-PE、CD33-PE、CD14-PE、CD45-Percp及相应同型对照IgG2a、溶血素FACS Lysing solution 10×(美国BD公司);嗜水气单胞菌溶素前体变异体(FLAER-ALexa-488,美国Cedarlane公司)。
1.3 标本采集 采集各研究对象空腹静脉血2 mL,EDTA-K2抗凝,室温静置,1 h内上机检测。
1.4 流式细胞检测 按照仪器操作规程及参考文献[6]进行,并作适当改进。
1.4.1 红细胞CD55/59检测 取2个空白试管,设为样品管和对照管。样品管中分别加入CD55-PE和CD59-FITC各20 L,对照管中分别加入IgG2a-PE和IgG2a-FITC各20 μL。取10 μL全血经PBS洗涤后稀释于1.5 mL PBS中,取100 μL分别加入2管中,充分混匀,室温避光温育30 min,1 000 r/min离心5 min,弃上清液, PBS洗涤2次,0.5 mL PBS重悬后上机检测。用FACS diva软件在FSC/SSC散点图上选定红细胞群,最少获取细胞数100 000,分别计算红细胞CD55-和CD59-比例,同一标本重复检测3次。
1.4.2 粒细胞CD55/59检测 样品管和对照管抗体处理步骤同1.4.1。取100 μL全血分别加入2管中,充分混匀,室温下避光温育30 min。各加入溶血素1 mL,充分混匀,室温下避光反应15 min,1 000 r/min离心5 min,弃上清液,PBS洗涤2次,0.5 mL PBS重悬后上机检测。FSC/SSC散点图上选定粒细胞群,计算同1.4.1,同一标本重复检测3次。
1.4.3 粒细胞和单核细胞FLAER检测 设立对照管和样品管1和2,对照管中分别加入IgG2a-PE、IgG2a-FITC、CD45-Percp各20 μL,样品管1中加入CD14-PE、FLAER和CD45-Percp各20 μL,样品管2中加入CD33-PE、FLAER和CD45-Percp各20 μL,CD45/CD33散点图上选定粒细胞群,CD45/CD14散点图上选定单核细胞群,最少获取细胞数100 000,分别计算粒细胞、单核细胞FLAER-细胞比例,同一标本重复检测3次。
2 结果
2.1 红细胞和粒细胞CD55/59抗原缺失率检测结果 与健康人对照组比较,PNH患者红细胞和粒细胞CD55/59抗原缺失率均明显增加(P<0.05)。见表1。PNH组中,粒细胞CD55/59抗原缺失的细胞比例明显高于红细胞(t分别为3.514,3.425,P均<0.05)。同种细胞上,CD59抗原缺失细胞比例亦明显高于CD55(t分别为4.324,2.997,P均<0.05)。健康人对照及PNH患者粒细胞、红细胞CD55/59流式检测结果见图1。
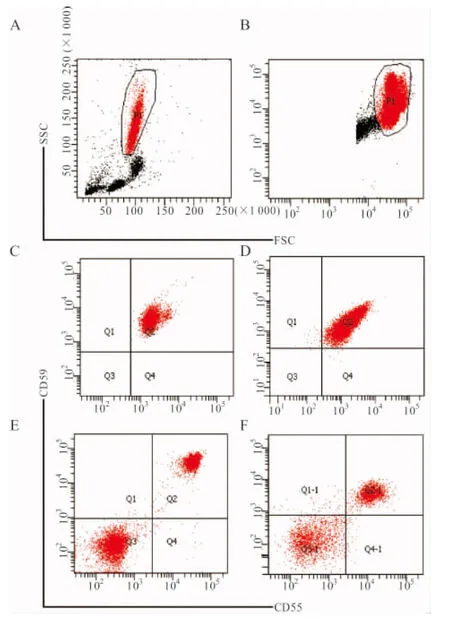
注:A~B,分别对粒细胞和红细胞设门;C,健康人对照组粒细胞;D,健康人对照组红细胞;E,PNH患者粒细胞;F,PNH患者红细胞。
图1 流式细胞术检测粒细胞、红细胞CD55/59抗原
2.2 粒细胞和单核细胞FLAER缺失率对比分析 PNH患者粒细胞和单核细胞FLAER缺失率明显高于健康人对照组,见表1。而在PNH组中,粒细胞FLAER与单核细胞相比无显著性差异(t=0.989,P=0.332)。粒、单细胞FLAER缺失率的流式检测结果见图2。
表1 各组CD55/59抗原及FLAER缺失率对比结果
2.3 粒细胞中CD55/CD59和FLAER缺失率检测结果对比 结果表明,CD55/59抗原缺失率在粒细胞中明显低于FLAER缺失率(t分别为7.125,5.299,P均<0.05)。
3 讨论
冯玉虎等[7]研究表明,PNH患者CD55和CD59在红细胞及粒细胞上的表达水平并不一致,CD55缺失率约为5%~10%,而CD59缺失率均>10%,本研究结果显示,PNH患者同种细胞中,CD59抗原缺失细胞比例也明显高于CD55,说明CD59比CD55具有更高的检出率。杨容助等[8]认为,外周血粒细胞更新速度较快,不易受到输血、溶血等因素影响,表达水平较为恒定,故其敏感性强于红细胞,对PNH诊断价值更高。本研究结果发现PNH组粒细胞CD55/59抗原缺失的细胞比例明显高于红细胞,分析原因可能是由于PNH最先累及的是粒细胞,其次才是红细胞,而PNH患者红细胞寿命普遍较短,发生严重溶血后,降低了GPI异常克隆的红细胞数量导致不易被检测到。因此,对PNH患者来说,中性粒细胞的CD55/59检测比红细胞更有意义。
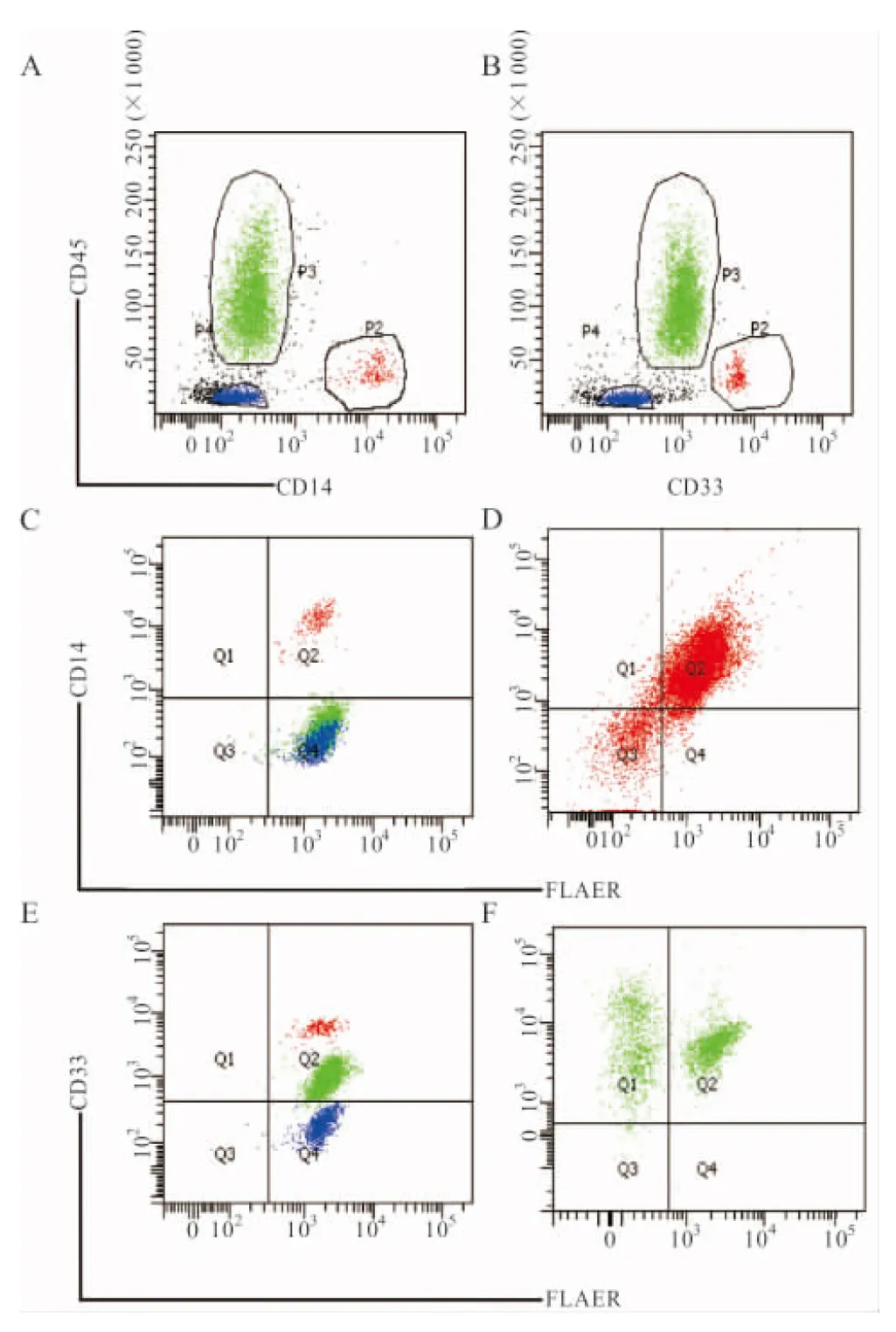
注:A~B,对单核细胞和粒细胞分别设门(绿色为中性粒细胞,红色为单核细胞,蓝色为淋巴细胞);C,健康人对照组单核细胞(红色细胞群);D,PNH患者单核细胞;E,健康人对照粒细胞(绿色细胞群);F,PNH患者粒细胞。
图2 流式细胞术检测单核细胞、粒细胞FLAER缺失率
FLAER特异表达于所有含GPI锚连蛋白的白细胞表面,理论上健康人白细胞系列抗原(CD45、CD14、CD15)和FLAER呈100%共阳性表达,利用CD45/CD15/CD24/FLAER进行单核细胞和粒细胞的PNH分析,可检测到<0.1%的微量异常克隆,检出率可达100%[9]。Sutherland等[10]对536例疑似PNH患者进行FLAER与CD55/59对比检测,发现用FLAER检出63例(检出率11.8%),并且克隆数较大,不受溶血和输血的影响;CD55/59检出33例(检出率6.2%),检测出的克隆数较小,容易受溶血和输血的影响。本实验中,对照组粒细胞FLAER比CD55/59具有更低的PNH克隆数,而PNH组粒细胞FLAER比CD55/59具有更高的PNH克隆数,表明与粒细胞CD55/CD59检测相比,用FLAER直接检测GPI蛋白,具有更高的PNH异常克隆细胞检出率,在PNH诊断中具有更大的优势,与国内其他文献[3]报道的结果基本一致。但PNH为罕见病,本研究9年间仅收集到13例的PNH患者,更多的证据尚待以后积累。此外,本实验中FLAER检测主要应用于存在明显异常克隆的PNH患者,而缺乏对AA、MDS、ALPS、溶血性贫血等存在微量PNH克隆性疾病的对比实验结果,尚不明确FLAER在这些患者中的检出率、敏感性和特异性,也无法全面评价CD55/59和FLAER在所有全血细胞减少患者中的临床诊断意义,今后仍需进一步研究证实。
[1]吴琼,王小中.CD55和CD59检测在阵发性睡眠性血红蛋白尿症诊断中的意义[J].实验与检验医学,2016,34(2):146-149.
[2]Brodsky RA.Advances in the diagnosis and therapy of paroxysmal nocturnal hemoglobinuria[J]. Blood Rev,2008,22(2):65-74.
[3]刘淑媛,万腊根,闻芳,等.FLAER检测及其在阵发性睡眠性血红蛋白尿症诊断中的意义[J].实验与检验医学,2015, 33(1): 4-7.
[4]Battiwalla M,Hepgur M,Pan D,etal.Multiparameter flow cytometry for the diagnosis and monitoring of small GPI-deficient cellular populations[J].Cytometry B Clin Cytom,2010,78(5): 348-356.
[5]张之南,郝玉书.血液病学[M].北京:科学出版社,2012.
[6]刘艳荣.实用流式细胞术-血液病篇[M].北京:北京大学医学出版社,2010:289-290.
[7]冯玉虎,夏瑞祥,王卫国,等.贫血患者外周血CD55、CD59检测及对阵发性睡眠性血红蛋白尿症的诊断意义[J].实用医学杂志,2015,31(8):1262-1265.
[8]杨荣助,宋建新.62例阵发性睡眠性血红蛋白尿患者临床分析[J].中外医学研究,2013,11(15):138-139.
[9] Correia RP, Bento LC, Bortolucci AC,etal. Technical advances in flow cytometry-based diagnosis and monitoring of paroxysmal nocturnal hemoglobinuria[J]. Einstein(Sao Paulo), 2016,14(3):366-373.
[10]Sutherland DR,Kuek N,Azcona-Olivera J,etal.Use of a FLAER-based WBC assay in the primary screening of PNH clones[J].Am J Clin Pathol,2009, 132(4):564-572.
(本文编辑:许晓蒙)
10.13602/j.cnki.jcls.2017.03.06
国家自然科学基金(81372132)。
杨柯,1989年生,男,硕士,主要从事血液病流式检测诊断工作。
白海,主任医师,博士,E-mail:baihai98@hotmail.com。
R556.6+4, R446.62
A
2016-11-23)

