小麦品系天00127抗白粉病基因遗传分析与SSR标记定位
周喜旺,曹世勤,刘鸿燕,黄 瑾,张耀辉,岳维云,宋建荣,王化俊
(1.甘肃省天水市农业科学研究所,甘肃天水 741001; 2.甘肃农业大学农学院,甘肃兰州 730070;3.甘肃省农业科学院植物保护研究所, 甘肃兰州 730070)
小麦品系天00127抗白粉病基因遗传分析与SSR标记定位
周喜旺1,2,曹世勤3,刘鸿燕1,黄 瑾3,张耀辉1,岳维云1,宋建荣1,王化俊2
(1.甘肃省天水市农业科学研究所,甘肃天水 741001; 2.甘肃农业大学农学院,甘肃兰州 730070;3.甘肃省农业科学院植物保护研究所, 甘肃兰州 730070)
白粉病是严重危害小麦安全生产的重要病害之一。天00127是对小麦白粉病具有良好抗性的新品系。为明确其白粉病抗性及遗传规律,选用白粉菌系Linxia-3对天00127与感病品种铭贤169的杂交F1、F2代分离群体和F3代家系进行温室苗期抗白粉性遗传分析,并对其抗白粉病基因进行SSR分子标记分析。结果表明,天00127对Linxia-3的抗性由1对隐性基因控制,暂命名为 PmT00127。筛选到3个与目的基因连锁的SSR标记Xgwm566、Xgwm376和Xwmc1,距离目的基因最近的两侧标记为Xgwm566和Xgwm376,其遗传距离分别为3.7和2.2 cM,初步表明抗病基因位于小麦3B染色体上。分子检测及系谱分析结果表明, PmT00127可能是一个来自农家品种白大头的抗白粉病新基因。
小麦;白粉病;抗病基因;SSR标记
由专性寄生菌布氏白粉菌(Blumeriagraminisf.sp.tritici)引起的小麦白粉病是一种真菌性气传病害。该病主要发生在小麦植株地上部的叶、茎秆和穗部。近年来,小麦白粉病在甘肃省发生面积达53.3万hm2以上[1],已成为甘肃省小麦生产上的主要病害之一。研究发现,利用和种植抗病品种是防治小麦白粉病最经济有效且有利于保护环境的措施。由于小麦白粉病菌的高度变异性,在抗源单一化的情况下,一旦产生新的毒性菌株或种群发生变化,会导致抗病基因丧失抗性,引起小麦白粉病的大规模流行,给小麦生产带来严重损失。甘肃陇南麦区生产上大面积推广的抗病品种和育成的高代品系大多为92R系和贵农系的后代[2],抗源较单一,为避免重蹈1B/1R易位系小麦品种抗病性丧失而引起病害大流行的覆辙,发掘新的白粉病抗源并应用于抗病育种中这一工作迫在眉睫。目前,已经正式命名的小麦抗白粉病基因有50个位点( Pm1~ Pm55, Pm18= Pm1c, Pm22= Pm1e, Pm23= Pm4c, Pm31= Pm21, Pm8和 Pm17为等位基因)上的70多个主效抗白粉病基因[3-9],其中位点 Pm1、 Pm2、 Pm3、 Pm4、 Pm5 及 Pm24分别有5、3、17、4、5和2个等位基因,在这些命名的抗病基因中,一部分来自普通小麦,另一部分来自小麦的近缘种属[10]。研究发现,普通小麦品种特别是长期未被利用的农家小麦品种中蕴藏着丰富的、尚未发掘的抗白粉病基因资源,它们将可能成为抗病育种中最便于利用的抗病基因库。
分子标记技术已经广泛应用于小麦抗白粉病基因鉴定和定位中,基于PCR技术的SSR标记由于其位点丰富、操作简单、重复性好、多为共显性、实验成本低等诸多优点[11],在小麦抗病基因定位和分子标记辅助选择方面得到广泛的应用。近年来,国内外学者利用SSR分子标记技术已将许多抗白粉病基因定位到小麦不同的染色体上,如抗白粉病基因 Pm47[12]、 Pm50[13]、 Pm53[14]及 Ml91260[15]等。
天00127是甘肃省天水市农业科学研究所利用农家品种白大头与小麦品系C184-3-4-1和85-173-4杂交(白大头/C184-3-4-1//85-173-4),采用系谱法经多年选育而成的普通小麦新品系。该品系经2007-2011年连续4年在甘肃省农业科学院植物保护研究所兰州低温温室接种及陇南田间抗病性鉴定和监测,其全生育期对白粉菌供试菌系E05、E09、E20及混合菌均表现免疫,在陇南各地田间对自然诱发的白粉菌混合菌也表现免疫,抗白粉病性优异。但迄今为止,关于天00127抗白粉病的遗传规律尚未见研究报道。为此,本研究通过常规杂交分析法和SSR分子标记技术对天00127中抗白粉病基因进行遗传分析和分子标记研究,以期为更好地利用这一品系提供理论依据和技术基础。
1 材料与方法
1.1 供试材料
利用抗白粉病品系天00127和感病品种铭贤169配制杂交组合,得到F1、F2代分离群体和F3代家系,用于天00127苗期白粉病抗性鉴定和遗传分析。以上材料由甘肃省农业科学院植物保护研究所病害组提供。天00127的3个亲本白大头、C184-3-4-1和85-173-4由天水市农业科学研究所甘谷试验站提供。
1.2 抗病性鉴定
白粉病鉴定采用温室苗期鉴定的方法。用于抗性鉴定的白粉菌小种为Linxia-3,其对品系天00127中的抗白粉病基因无毒性,由甘肃省农业科学院植物保护研究所病害组提供。用白粉菌小种Linxia-3对抗病亲本天00127、感病亲本铭贤169及其F1、F2代分离群体和F3代家系进行苗期接种鉴定,同时对天00127的三个亲本进行苗期接种鉴定。对每个F3代家系鉴定20株幼苗的抗病性,用于推导F2单株的基因型。具体方法为:将供试材料播种于直径9 cm的塑料盆内,每盆播20粒种子,待小麦幼苗长至一叶一心期,放置于隔离空间下,用扫抹法接种后置于温度为10~20 ℃的环境下培养,接种后10~14 d,待感病对照铭贤169充分发病后,按苗期反应型6级分级标准进行抗病性调查[16],即0、0;、1、2、3、4,其中,0~2级为抗病,3~4级为感病。用卡方测验进行适合度检测,以明确天00127对白粉菌系Linxia-3的抗病基因数、互作方式及抗病特点。
1.3 基因组DNA的提取和抗感池的构建
根据F3家系苗期抗性鉴定结果,对每个F3家系采用混合法[17]取样。用CTAB法[18-19]提取抗病亲本、感病亲本及F3家系的基因组DNA,用1%琼脂糖凝胶和紫外分光光度计检测样品的浓度和纯度。从F3代家系中随机选取10个纯合高抗家系和10个纯合高感家系的DNA,等量混合分别组建抗病基因池(BR)和感病基因池(BS)。
1.4 SSR分析
选取Röder等[20]、Pestsova等[21]、Song等[22]、Somers[23]等报道的引物及http//wheat.pw.usda.gov上公布的CFD、CFA等引物,由北京赛百盛公司合成。以抗病亲本、抗病基因池(BR)、感病亲本、感病基因池(BS)及F3代家系的DNA为模板进行PCR扩增,筛选与抗病基因连锁的SSR标记。同时,利用目标基因两侧标记对天00127亲本进行PCR扩增。扩增反应总体系为10 μL,包括5 μL 2×MasterMix(天根生化科技有限公司)、2 μL ddH2O、上下游引物各1 μL、模板DNA(50 ng·μL-1) 1 μL。扩增程序:94 ℃预变性4 min;94 ℃变性50 s,55~64 ℃退火50 s,72 ℃延伸50 s,共35个循环;72 ℃延伸10 min。扩增产物经8%的非变性聚丙烯酰胺凝胶电泳、硝酸银染色后置于胶片观察灯上照相。
1.5 遗传距离估算和连锁分析
用JoinMap 4.0软件计算SSR分子标记与抗白粉病基因之间的遗传距离,用MapDraw V2.1软件绘制该基因的遗传连锁图谱。
2 结果与分析
2.1 天00127抗白粉病基因的遗传分析
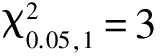
表1 小麦品系天00127中抗白粉病基因 PmT00127的遗传分析
Table 1 Genetic analysis of powdery mildew resistance gene PmT00127 in wheat line Tian 00127
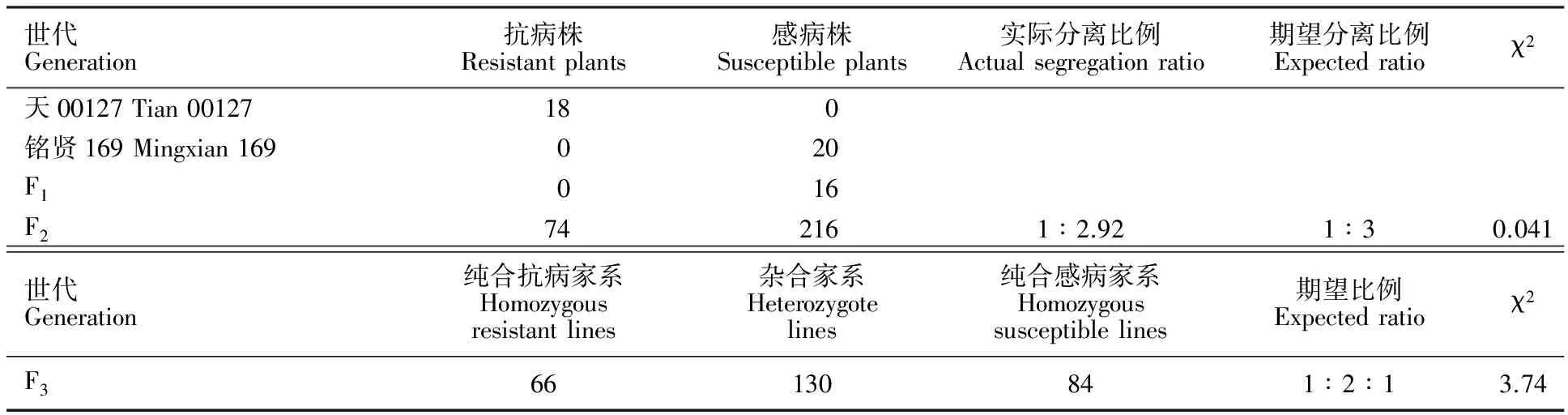
世代Generation抗病株Resistantplants感病株Susceptibleplants实际分离比例Actualsegregationratio期望分离比例Expectedratioχ2天00127Tian00127180铭贤169Mingxian169020F1016F2742161∶2.921∶30.041世代Generation纯合抗病家系Homozygousresistantlines杂合家系Heterozygotelines纯合感病家系Homozygoussusceptiblelines期望比例Expectedratioχ2F366130841∶2∶13.74
2.2 天00127抗白粉病基因的SSR标记分析
随机选取分布在小麦基因组上的482对微卫星引物对抗病亲本天00127、感病亲本铭贤169、抗病池和感病池DNA进行PCR扩增,其中,位于3B上的标记Xgwm566在抗、感亲本间和抗、感池间均扩增出一致的多态性条带(图1)。为确定所获标记与抗白粉病基因之间的连锁性,在F3家系中随机选取抗、感家系各10个进行小群体验证,结果表明,标记Xgwm566与抗白粉病基因 PmT00127连锁(图1、表2)。依据Somers等[22]发表的小麦遗传图谱可知,这一标记位于小麦3B染色体上,因此,进一步选取位于3B染色体上的其他SSR标记在抗、感亲本和抗、感池间进行筛选,发现标记Xgwm376和Xwmc1与抗病基因存在连锁性。同样,这2对标记在F3家系中的检测结果表明二者也与抗病基因 PmT00127连锁,且与标记Xgwm566一致均为共显性标记(表2)。
2.3 连锁图谱的绘制
利用JoinMap 4.0软件对3对SSR标记位点与抗白粉基因 PmT00127连锁分析,结果表明标记Xgwm566位于抗病基因 PmT00127的一侧,标记Xgwm376和Xwmc1位于抗病基因的另一侧,在染色体上的排列顺序为Xgwm566- PmT00127-Xgwm376-Xwmc1,与抗白粉病基因 PmT00127的遗传距离分别为3.7、2.2和12.0 cM,因此,抗病基因 PmT00127被初步定位于3B染色体上。据此绘制抗白粉基因 PmT00127的遗传连锁图(图2)。
表2 标记在天00127/铭贤169组合F3家系的分离
Table 2 Segregation ratios of SSR markers linked to powdery mildew resistance gene PmT00127 in F3lines of Tian 00127/Mingxian 169
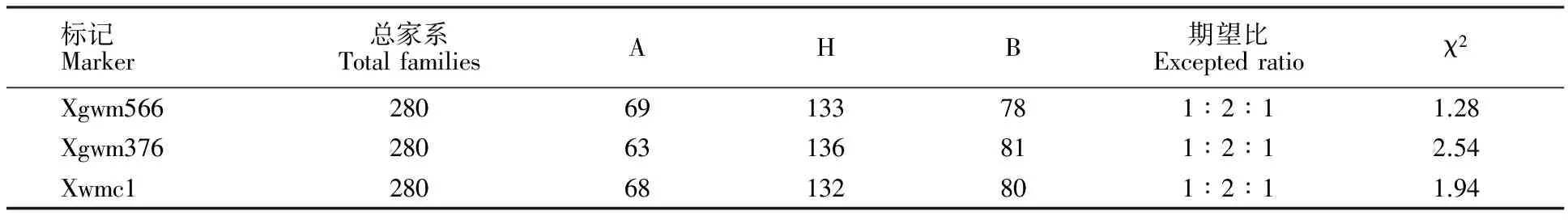
标记Marker总家系TotalfamiliesAHB期望比Exceptedratioχ2Xgwm56628069133781∶2∶11.28Xgwm37628063136811∶2∶12.54Xwmc128068132801∶2∶11.94
A:与抗病亲本天00127带型相同;B:与感病亲本铭贤169带型相同;H:杂合带型。
A:Homozygous to the allele from the resistant parent Tian 00127; B:Homozygous to the allele from the susceptible parent Mingxian 169; H:Heterozygous.

M:50 bp DNA ladder; 1:天00127;2:铭贤169;3:抗病池;4:感病池;5~10:抗病家系;11~16:感病家系;17~22:杂合家系。
M:50 bp DNA ladder; 1:Tian 00127; 2:Mingxian 169; 3:Resistant pool; 4:Susceptible pool; 5-10:Homozygous resistant lines; 11-16:Homozygous susceptible lines; 17-22:Heterozygous lines.
图1 多态性SSR标记Xgwm566在天00127/铭贤169 F3家系上的PCR扩增结果
Fig.1 Polymorphic DNA fragments detected by SSR marker Xgwm566 in Tian 00127/Mingxian 169 F3lines
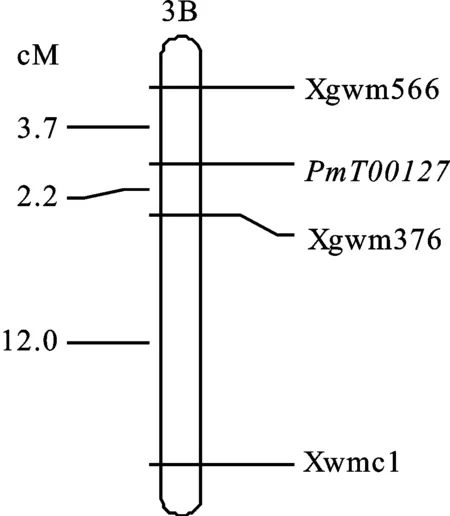
图2 抗白粉基因 PmT00127的遗传连锁图谱
2.4 天00127亲本的抗性鉴定及分子标记检测
接种白粉菌小种Linxia-3后,天00127和白大头表现为抗病,C184-3-4-1和85-173-4表现为感病。分别用抗病基因 PmT00127两侧最近的标记Xgwm566和Xgwm376对天00127的原始亲本白大头、C184-3-4-1及85-173-4进行分子检测,结果(图3)表明,白大头扩增出与抗病亲本天00127一致的抗病条带,C184-3-4-1和85-173-4扩增出与感病品种铭贤169一致的感病条带。
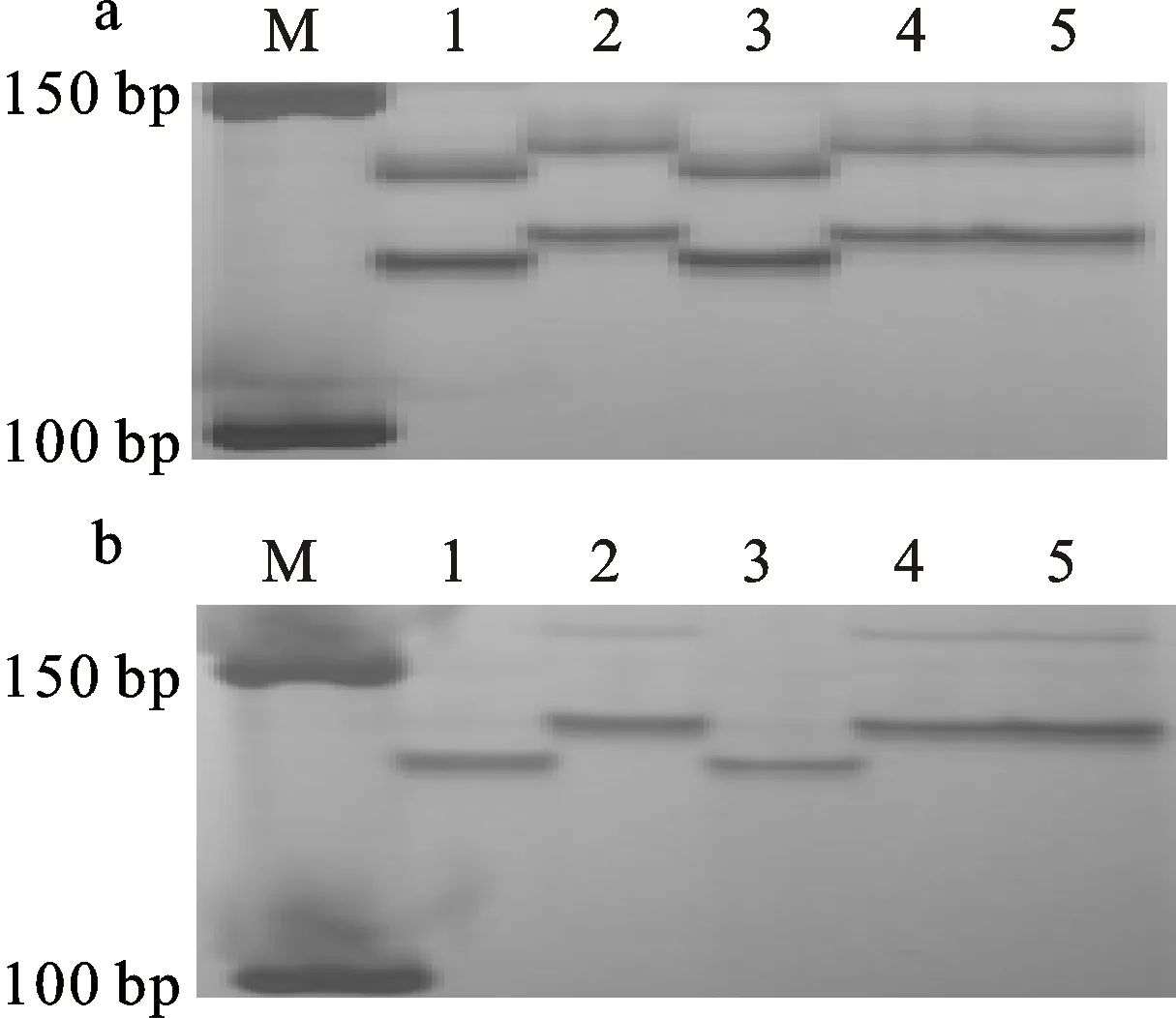
M:50 bp DNA ladder; 1:天00127; 2:铭贤169; 3:白大头; 4:C184-3-4-1; 5:85-173-4。
M:50 bp DNA ladder; 1:Tian 00127; 2:Mingxian 169; 3:Baidatou; 4:C184-3-4-1; 5:85-173-4.
图3 标记Xgwm566(a)和Xgwm376(b)对天00127各亲本的扩增结果
Fig.3 PCR products amplified with SSR markers Xgwm566(a) and Xgwm376(b) in the parents of Tian 00127
3 讨 论
本研究结果表明,天00127对白粉菌小种Linxia-3具有良好的抗病性,其抗病性是由1对隐性基因控制,将其所含抗病基因暂命名为 PmT00127,并定位于3B染色体的标记Xgwm566和Xgwm376之间。该品系系谱为(白大头/C184-3-4-1//85-173-4)。温室接菌鉴定表明,C184-3-4-1和85-173-4对白粉菌小种Linxia-3均失去抗性,白大头对Linxia-3表现高抗。C184-3-4-1和85-173-4为天水市农业科学研究所育成的品系,C184-3-4-1是用天选36号选出的品系,85-173-4是兰天系品系,两材料在甘肃陇南田间对自然诱发的白粉菌混合菌一直表现感病(李金昌,私人通讯),结合标记Xgwm566和Xgwm376检测结果,推测 PmT00127可能来源于农家品种白大头。利用SSR分子标记技术在3B上筛选到3对与目标基因紧密连锁的分子标记Xgwm566、Xgwm376和Xwmc1,构建了分子标记连锁图谱,为该基因的分子标记辅助选择和精细定位奠定了基础。
目前,定位于3B染色体上的抗白粉病基因有 Pm13、 Pm41、 MlIW3、 MlIW10、 PmHNK和 PmJ。 Pm13来源于高大山羊草[24],被定位在T3BL.3BS-3S1上,与RFLP标记Xcdo-460-3BS连锁。张军刚等[25]将中大01携带的 Pm13基因定位于3BS上,找到5个与 Pm13基因连锁的SSR标记。 Pm41来自野生二粒小麦[26],该基因定位于3BL,与SSR标记Xbarc84和Xwmc326紧密连锁,遗传距离分别是3.7和2.0 cM;李根桥等[27]从野生二粒小麦IW3和W10中鉴定出的 MlIW3和 MlIW10是 Pm41位点上的等位基因或同一基因。李春鑫等[28]将周98165中的抗白粉病基因PmHNK定位于3BL7-0.63-1.00区域。此外,由于 Pm13、 Pm41、PmHNK、MlIW3、MlIW10均为显性基因,与 PmT00127基因明显不同。肖明纲[29]将农家品种箭头红中的隐性抗病基因PmJ定位于3BS上,与标记Xgwm533和cfp1347的遗传距离分别为0.7和2.2 cM,本研究定位的 PmT00127基因,与标记Xgwm566和Xwmc1的遗传距离分别为3.7和14.2 cM。参照这些标记在染色体上的位置分析[23,29],PmJ位于标记Xgwm533和cfp1347区间, PmT00127位于标记Xgwm566和Xwmc1区间,标记Xgwm533和cfp1347位于3BS中部,而标记Xgwm566和Xwmc1位于着丝粒附近。另外,从系谱分析,PmJ基因来源于农家品种红箭头,而天00127所携带的 PmT00127基因可能来源于农家品种白大头。综上分析,天00127所含的3B上的隐性抗白粉基因 PmT00127与已知Pm不同,可能为新的抗白粉病基因。
中国普通小麦农家品种中蕴含着丰富的抗源,往往由于其产量和农艺性状差等原因而被育种家们忽视。在已报道的抗白粉病基因中,有 Pm2c[9]、 Pm47[12]、 Pm5e[30]、 Pm24a[31]、 Pm24b[32]、 mlxbd[33]、 pmX[34]、 MlHLT[35]等8个基因分别来源于农家品种鸟麦、红洋辣子、复壮30、齿牙糙、白葫芦、小白冬、小红皮和葫芦头,分别被定位于5DS、7BS、7BL、1DS、1DS、7BL、2AL和1DS染色体上。其中, Pm5e、 Pm47、 mlxbd和 pmX为隐性基因。白大头是甘肃陇南农家生产品种,近年来在甘肃陇南对接种及自然诱发的白粉菌均表现免疫到高抗水平,抗病性表现优异。本研究从白大头的衍生系天00127中找到1个隐性抗白粉病基因,并将其定位于3B染色体上。马东方等[17]研究结果表明,白大头苗期对当前条锈菌优势小种CYR32和CYR33感病,但成株期对自然诱发和接种的条锈菌表现高抗,并将白大头中的抗条锈病基因定位于6DS染色体上。由此可见,农家品种白大头蕴含丰富的抗病资源,在当前抗病品种严重缺乏的情况下,应对其进行充分的研究和利用,加快挖掘抗病基因资源,以丰富抗病基因多样化类型,拓宽白粉病抗性基因遗传基础,给甘肃小麦白粉病和条锈病的持续控制打下良好基础。
致 谢 :西北农林科技大学植物保护学院李 强副教授和巢凯翔博士在本论文完成过程中给予了很多帮助,在此深表感谢!
[1] 曹学仁,周益林,段霞瑜,等.甘肃省主要小麦生产品种及高代品系的抗白粉基因推导[J].植物保护,2011,37(2):41.
CAO X R,ZHOU Y L,DUAN X Y,etal.Postulation of wheat powdery mildew resistance genes in commercial wheat cultivars and advanced lines from Gansu Province [J].PlantProtection,2011,37(2):41.
[2] 曹世勤,骆惠生,武翠平,等.甘肃省主要小麦生产品种(系)及抗源材料抗白粉病基因推导分析[J].作物学报,2010,36(12):2107.
CAO S Q ,LUO H S,WU C P,etal.Postulation of powdery mildew resistance genes in 64 wheat varieties(lines) in Gansu Province,China [J].ActaAgronomicaSinica,2010,36(12):2107.
[3]HAO Y,LIU A,WANG Y,etal. Pm23:a new allele of Pm4 located on chromosome 2AL in wheat [J].TheoreticalandAppliedGenetics,2008,117:1205.
[4]SINGRÜN C,HSAM S L K,HARTL L,etal.Powdery mildew resistance gene Pm22 in cultivar Virest is a member of the complex Pm1 locus in common wheat(TriticumaestivumL.em Thell.) [J].TheoreticalandAppliedGenetics,2003,106:1420.
[5]MCINTOSH R A,DUBCOVSKY J,ROGERS W J,etal.Catalogue of gene symbols for wheat:2013-2014 supplement [J].AnnuWheatNewsl,2014,60:153.
[6]XIE W,BEN-DAVID R,ZENG B,etal.Suppressed recombination rate in 6VS/6AL translocation region carrying the Pm21 locus introgressed fromHaynaldiavillosainto hexaploid wheat [J].MolecularBreeding,2012,29:399.
[7]HAO Y,PARKS R,COWGER C,etal.Molecular characterization of a new powdery mildew resistance gene Pm54 in soft red winter wheat [J].TheoreticalandAppliedGenetics,2015,128:465.
[8]ZHANG R Q,SUN B X,CHEN J,etal. Pm55,a developmental-stage and tissue-specific powdery mildew resistance gene introgressed fromDasypyrumvillosuminto common wheat [J].TheoreticalandAppliedGenetics,2016,129:1975.
[9]XU H X,YI Y J,MA P T,etal.Molecular tagging of a new broad-spectrum powdery mildew resistance allele Pm2c in Chinese wheat landrace Niaomai [J].TheoreticalandAppliedGenetics,2015,128:2077.
[10] 赵富强,张海琴,孙宗华,等.鹅观草不同居群条锈病和白粉病抗性评价[J].草业学报,2016,25(4):149.
ZHAO F Q,ZHANG H Q,SUN Z H,etal.Resistance ofReogneriakamoi(Poaceae:Triticeae)populations to stripe rust and powdery mildew [J].ActaPrataculturaeSinica,2016,25(4):149.
[11]ZIETKIEWICZ E,RAFALSKI A,LABUDA D.Genome fingerprinting by simple sequence repeat(SSR)-anchored polymerase chain reaction amplification [J].Genomics,1994,20:176.
[12]XIAO M G,SONG F J,JIAO J F,etal.Identification of the gene Pm47 on chromosome 7BS conferring resistance to powdery mildew in the Chinese wheat landrace Hongyanglazi [J].TheoreticalandAppliedGenetics,2013,126:1397.
[13]MOHLER V,BAUER C,SCHWEIZER G,etal. Pm50:a new powdery mildew resistance gene in common wheat derived from cultivated emmer [J].JournalofAppliedGenetics,2013,54:259.
[14]PETERSEN S,LYERLY J H,WORTHINGTON M L,etal.Mapping of powdery mildew resistance gene Pm53 introgressed fromAegilopsspeltoidesinto soft red winter wheat [J].TheoreticalandAppliedGenetics,2015,128:303.
[15] 张向展,赵 卜,陈 林,等.小麦品系91260抗白粉基因的分子标记定位[J].麦类作物学报,2015,35(8):1067.
ZHANG X Z,ZHAO B,CHEN L,etal.Molecular mapping of powdery mildew resistance genes in wheat line 91260 [J].JournalofTriticeaeCorps,2015,35(8):1067.
[16] 盛宝钦.用反应型记载小麦苗期白粉病 [J].植物保护,1988(1):49.
SHENG B Q.Using the infection type record wheat powdery mildew at seedling stage [J].PlantProtection,1988(1):49.
[17]MA D F,LI Q,TANG M S,etal.Mapping of gene conferring adult-plant resistance to stripe rust in Chinese wheat landrace Baidatou [J].MolecularBreeding,2015,35:157.
[18]PATERSON A H,BRUBAKER C L,WENDEL J F.A rapid method for extraction of cotton(Gossypiumspp.) genomic DNA suitable for RFLP or PCR analysis [J].PlantMolecularBiologyReporter,1993,11:122.
[19]POREBSKI S,BAILEY L G,BAUM B R.Modification of a CTAB DNA extraction protocol for plants containing high polysaccharide and polyphenol components [J].PlantMolecularBiologyReporter,1997,15:8.
[20]RÖDER M S,KORZUN V,WENDEHAKE K,etal.A microsatellite map of wheat [J].Genetics,1998,149:2007.
[21]PESTSOVA E,GANAL M W,RÖDER M S.Isolation and mapping of microsatellite markers specific for the D genome of bread wheat [J].Genome,2000,43:689.
[22]SONG Q J,SHI J R,SINGH S,etal.Development and mapping of microsatellite(SSR) markers in wheat [J].TheoreticalandAppliedGenetics,2005,110:550.
[23]SOMERS D J,ISAAC P,EDWARDS K.A high-density microsatellite consensus map for bread wheat(TriticumaestivumL.) [J].TheoreticalandAppliedGenetics,2004,109:1105.
[24]CENCI A,D’OVIDIO R,TANZARELLA O A,etal.Identification of molecular markers linked to Pm13,anAegilopslongissimagene conferring resistance to powdery mildew in wheat [J].TheoreticalandAppliedGenetics,1999,98:448.
[25] 张军刚,董 娜,闫文利,等.小麦抗白粉病基因 Pm13的SSR标记筛选[J].河南农业科学,2014,43(10):62.
ZHANG J G,DONG N,YAN W L,etal.Screening for SSR markers linked to wheat powdery mildew resistance gene Pm13[J].JournalofHenanAgriculturalSciences,2014,43(10):62.
[26]LI G Q,FANG T L,ZHANG H T,etal.Molecular identification of a new powdery mildew resistance gene Pm41 on chromosome 3BL derived from wild emmer(Triticumturgidumvar.dicoccoides) [J].TheoreticalandAppliedGenetics,2009,119:531.
[27] 李根桥,房体麟,张宏淘,等.来自野生二粒小麦IW3和IW10的两个抗白粉病基因的鉴定及SSR标记定位[J].作物学报,2009,35(5):761.
LI G Q,FANG T L,ZHANG H T,etal.Identification and SSR mapping of two powdery mildew resistance genes in wild emmer(Triticumdicoccoides) accessions IW3 and IW10 [J].ActaAgronomicaSinica,2009,35(5):761.
[28] 李春鑫,许为钢,王根松,等.小麦白粉病新基因PmHNK的遗传分析和分子标记等位[J].中国农业科学,2009,42(8):2771.
LI C X,XU W G,WANG G S,etal.Molecular marker mapping and genetic analysis of anovel powdery mildew resistance genePmHNK[J].ScientiaAgriculturaSinica,2009,42(8):2771.
[29] 肖明纲.中国小麦地方品种抗白粉病新基因的发现[D].北京:中国农业科学院,2013:34-37.
XIAO M G.Identification of the genes conferring resistance to powdery mildew in the Chinese wheat landraces [D].Beijing:Chinese Academy of Agricultural Sciences,2013:34-37.
[30]HUANG X Q,WANG L X,XU M X,etal.Microsatellite mapping of the powdery mildew resistance gene Pm5e in common wheat(TriticumaestivumL.) [J].TheoreticalandAppliedGenetics,2003,106:858.
[31]HUANG X Q,HSAM S L K,ZELLER F J,etal.Molecular mapping of the wheat powdery mildew resistance gene Pm24 and marker validation for molecular breeding [J].TheoreticalandAppliedGenetics,2000,101:407.
[32]XUE F,WANG C Y,LI C,etal.Molecular mapping of a powdery mildew resistance gene in common wheat landrace Baihulu and its allelism with Pm24 [J].TheoreticalandAppliedGenetics,2012,125:1425.
[33] 薛 飞,翟雯雯,段霞瑜,等.小麦地方品种小白冬麦抗白粉病基因分子标记[J].作物学报,2009,35(10):1806.
XIE F,ZHAI W W,DUAN X Y,etal.Microsatellite mapping of powdery mildew resistance gene in wheat landrace Xiaobaidong [J].ActaAgronomicaSinica,2009,35(10):1806.
[34]FU B S,CHEN Y,LI N,etal. pmX:a recessive powdery mildew resistance gene at the Pm4 locus identified in wheat landrace Xiaohongpi [J].TheoreticalandAppliedGenetics,2013,126:913.
[35]WANG Z Z,LI H W,ZHANG D Y,etal.Genetic and physical mapping of powdery mildew resistance gene MlHLT in Chinese wheat landrace Hulutou[J].TheoreticalandAppliedGenetics,2015,128:365.
Genetic Analysis and SSR Mapping of Powdery Mildew Gene in Wheat Line Tian 00127
ZHOU Xiwang1,2,CAO Shiqin3,LIU Hongyan1,HUANG Jin3,ZHANG Yaohui1,YUE Weiyun1,SONG Jianrong1,WANG Huajun2
(1.Institute of Agricultural Science of Tianshui,Tianshui,Gansu 741001,China; 2.College of Agronomy,Gansu Agricultural University, Lanzhou,Gansu 730070,China; 3.Institute of Plant Protection,Gansu Academy of Agricultural Sciences,Lanzhou,Gansu 730070,China)
Powdery mildew,caused byBlumeriagraminisf.sp.tritici,is a globally important disease of wheat(TriticumaestivumL.).The most feasible mean to control the disease and reduce yield loss is breeding resistant varieties.Tian 00127,a new wheat line has greater resistance to the isolates ofB.graminisf.sp.triticiat seedling and adult plant stages.To map the resistance gene of Tian 00127 on wheat chromosome,we used a highly virulent isolate Linxia-3 to screen the F1and F2segregating population and F3generations derived from the cross between Tian 00127 and Mingxian 169 at seedling stage.Genetic analysis indicated that Tian 00127 carried a recessive gene,designated as PmT00127,and PmT00127 was preliminary located on chromosome 3B using SSR markers.Linkage analysis indicated that the resistance gene was linked to three SSR markers,including Xgwm566,Xgwm376 and Xwmc1.The two closest linked flanking markers were Xgwm566 and Xgwm376,with genetic distances of 3.7 and 2.2 cM,respectively.According to origin and molecular detection, PmT00127 could be a new resistance gene from landrace Baidatou.
Wheat; Powdery mildew; Resistance gene; SSR marker
时间:2017-03-07
2016-12-07
2017-01-16
国家自然科学基金项目(31360433,31560504);甘肃省科技支撑计划-农业类项目(1504NKCE115)
E-mail:zhouxiwang1208@163.com
曹世勤(E-mail:caoshiqin6702@163.com);王化俊(E-mail:whuajun@yahoo.com)
S512.1;S332
A
1009-1041(2017)03-0325-07
网络出版地址:http://kns.cnki.net/kcms/detail/61.1359.S.20170307.1637.014.html

