利用基因芯片技术检测李痘病毒主要株系的研究
陈定虎+何春梅++苏斐+冯黎霞+熊仁广+郑传发+陈文聪+刘运+方腾奎

摘 要:针对我国检疫性植物病毒即李痘病毒主要6个株系设计了6个特异性探针,同时设计了扩增该6个株系的一对通用引物,并确定了靶基因的PCR扩增体系和芯片杂交体系。对6个探针核酸序列进行同源性比对,结果表明探针之间的同源性只有39-61%,而各探针与本株系的同源性达到95%以上,因此适合作为检测李痘病毒主要株系的探针。成功设计的李痘病毒各主要株系的通用引物能够一次性扩增6个株系中的任何一个株系,而不需要做多重PCR,标记的扩增片段即可同芯片进行杂交,不但可以检测出李痘病毒,而且还能够明确是该病毒的哪个株系,检测结果直观明了,易于判定。芯片特异性好,能够正确区分6个株系,而且与其他植物病毒没有交叉反应。芯片的灵敏度高,可达到5pg/μL DNA模板浓度。
关键词:基因芯片;李痘病毒;主要株系;检测
李痘病毒(Plum pox virus, PPV)是我国2007年颁布的进境植物检疫性有害生物,是核果类果树危险性最大的病毒之一,属于马铃薯Y病毒科(Potyviridae)中的马铃薯Y病毒属(Potyvirus),其自然寄主主要是李属的木本植物,侵染李、杏、桃、樱桃等核果类果树后,使叶片和果实均受到严重危害,未成熟果实大量脱落,造成果实品质下降,产量降低。病毒远距离扩散则主要靠感染病毒的植物繁殖材料的调运。根据病毒的来源和侵染植物的不同,该病毒的目前主要株系有6个,它们分别为PPV-D, PPV-M,PPV-C, PPV-EA, PPV-W,PPV-Rec,其中D株系和M株系是目前最主要的流行株系。
由于植物病毒的特殊性,即一般种子和苗木带毒率是非常低的,加上进出境量通常非常之多,如果抽样量过少,则漏检的机率就一定非常之大,把关作用就会大大消弱;为了最大限度的提高检测率,避免漏检,就必须加大抽样量,这样就会导致样品众多,不仅会加大检测的工作量,而且会极大的影响检测速度,推迟通关速度,进而影响进出境贸易的正常进行,因此急需具有高通量检测的仪器设备和方法,而基因芯片技术正好适合这一要求。
基因芯片(gene chip)的最早是80年代中期由Dulbecco首次提出且目前已经在许多方面得到了广泛的应用[1,2,3,4],其本质上仍然是核酸分子杂交方法,具体系指将大量(通常每平方厘米点阵密度高于400)探针分子固定于支持物上后与标记的样品分子进行杂交,通过检测每个探针分子的杂交信号强度进而获取样品分子的数量和序列信息。基因芯片技术由于同时将大量探针固定于支持物上,所以可以一次性对样品大量序列进行检测和分析,从而解决了传统核酸印迹杂交技术操作繁杂、自动化程度低、操作序列数量少、检测效率低等不足;而且,通过设计不同的探针阵列、使用特定的分析方法可使该技术具有多种不同的应用价值,如基因表达谱测定、实变检测、多态性分析、基因组文库作图及杂交测序等。
目前基因芯片技术已经在许多方面得到了广泛的应用,但是在李痘病毒主要不同株系检测鉴定方面还未见诸报道,本项目预期达到的最终目标是研制出一次同时能够高通量检测李痘病毒主要株系的基因芯片和检测方法。
1 研究材料
1.1 李痘病毒毒株来源
1.1.1 D(Dideron)株系: Tey (X16415)、PENN2(AF401296)、Fan (AY912056)、Rankovic (M21847)、Skiernevice(S73776)。
1.1.2 M(Marcus)株系: SK68(M92280)、PS (AJ243957)、06 (S57405)、S57404(1768bp)。
1.1.3 EA(El Amar)株系:X56258,AM157175。
1.1.4 C(Cheery)株系:Y09851、AY184478、X97398。
1.1.5 W(Winona) 株系:AY912055。
1.1.6 Rec (Recombinants between D and M) 株系:AY028309。
以上株系均購自美国GADIA公司,其标准序列来自NCBI,括号中为其核酸序列登陆号。
1.2 芯片杂交材料
1.2.1 醛基载玻片:购自北京博奥晶典生物技术有限公司。
1.2.2 探针:本实验探针是人工合成的,长度41bp,并在合成的寡聚核苷酸探针末端(5'端)带上氨基修饰,这种探针需要点制在醛基基片上。
1.2.3 点样液:购自北京博奥晶典生物技术有限公司;点样液的目的是使点出的点圆润均匀。
1.2.4 杂交液:购自北京博奥晶典生物技术有限公司。
1.2.5 洗液1:500ML: 量取440ml蒸馏水倒入1000ml试剂瓶中,加入50ml 20XSSC,混匀,再加入10ml 10%SDS,混匀,室温储藏。
1.2.6 洗液2:500ML: 量取495ml蒸馏水倒入1000ml试剂瓶中,加入5ml 20XSSC,混匀,室温储藏。
1.2.7 梯度PCR仪,Peltier Thermal Cycler 220:MJ Research,USA。
1.2.8 凝胶成像分析系统:Hema,德国。
1.2.9 核酸浓度测定仪,ND-1000 Spectrophotometer:NanoDrop Technologies Inc.,USA。
1.2.10 核酸干燥仪,DNA120 SpeedVac System:Thermo Speed
Vac,USA。
1.2.11 晶芯PersonalArrayer 16TM个人点样仪、CapitalBio Corporation 杂交仪、LuxScanTM10K扫描仪、芯片盒,载玻片盒等均由北京博奥晶典生物技术有限公司生产。
2 研究方法
2.1 李痘病毒主要株系探针设计
采用软件DNAStar 6.0的序列比较功能Meglign软件对六种株系内和株系间的序列进行比较,特别是针对外壳蛋白编码的基因序列进行比对,找出其共同部分和特异部分,并对特异序列在NCBI中进行核酸Blast搜索(http://www.ncbi.nlm.nih.gov/BLAST),以便设计出PCR扩增的通用引物,并用通用引物对六个株系分别进行PCR扩增,以检测通用引物的实用性和特异性。
2.2 六株系PCR扩增的特异性通用引物设计及检测
2.2.1 六株系PCR扩增的特异性通用引物设计
对以上六株系序列进行多序列比较,设计出了PCR扩增这六个株系的通用特异性引物:
上游引物:PPV-chip-P1:5'- CCCATTTTCAC(G/A)CCAGCA(A/G)C -3'
下游引物:PPV-chip-P2:5'- TCGCATGATCCAACAATGGC -3'
扩增片段长度:508bp.
2.2.2 通用引物检测
(1)感病植物总RNA提取
根据广州普博生物技术公司提供的方法,称取0.1g 感病植物组织,然后按照Trizol试剂盒方法提取其总RNA。
(2)反转录
在装有去离子水9.5?滋L的0.2mL PCR管中,加入上步提取的总RNA 2?滋L,Oligo(dT)15 0.5?滋L(0.5ug), dNTPs(10?滋mol/L)1uL,混合均匀,70℃水浴 5min后立即置于冰上2min,3000rpm離心30秒后加入5×cDNA第一链合成缓冲液4?滋L,0.1mol/L DTT 1?滋L,RNase 抑制剂 1?滋L(30U),M-MLV反转录酶1?滋L(20U),40℃水浴60min。
(3)PCR 扩增
通用引物PCR 扩增:在0.2mL PCR管中,加入10×PCR扩增缓冲液2.5?滋L, dNTPs(10mmol/L)1?滋L,通用引物PPV-chip-P1 1 ?滋mol/L,PPV-chip-P2 1 ?滋mol/L,反转录合成反应液2?滋L,加水至25?滋L,Taq 聚合酶 0.5?滋L(2.5U);94℃ 3分钟;94℃ 40s,55℃ 40s,72℃ 1min,循环35次;72℃ 10min;4℃保存。
杂交用PCR扩增:此时PCR扩增用的引物5'末端用荧光染料HEX进行标记,即:在0.2mL PCR管中,加入10×PCR扩增缓冲液2.5?滋L, dNTPs(10mmol/L)1?滋L,通用引物PPV-chip-P1(Cy3 标记) 1 ?滋mol/L,PPV-chip-P2(Cy3 标记) 1 ?滋mol/L,反转录合成反应液2?滋L,加水至25?滋L,Taq 聚合酶 0.5?滋L(2.5U);94℃ 3分钟;94℃ 40s,55℃ 40s,72℃ 1min,循环35次;72℃ 10min;4℃保存。这样扩增产物都会被标记上HEX荧光素,以便用于杂交反应。
(4)电泳分析
用1XTAE缓冲液配置1%的琼脂糖凝胶,然后对5?滋L PCR产物进行电泳分析。一般而言,引物的扩增长度设计在300~1000bp之间,适当的扩增长度,可以保证有较强的荧光信号,但是过长的靶基因,会加大它与探针杂交的空间位阻,同时也更容易产生非特异性杂交或与拥有部分相同序列的同种病毒其他株系的交叉杂交。本实验PCR片段长度是508bp,长度大小和通用性及特异性都能够满足实验要求。
2.3 基因芯片点样
取5ul纯化探针,加点样液(100% DMSO,其中含1:100000的Cy3-dCTP)5ul混匀,探针浓度为10?滋m;然后加到晶芯PersonalArrayer 16TM个人点样仪的384孔板上,每孔加40μL,将寡核苷酸探针点在醛基玻片上,并通过探针5'末端的氨基基团进行共价固定。
2.4 阵列设计
阵列排布示意图如图1所示,点与点的中心距离为740μm,点的直径为500μm,样品包括探针、阳性对照(定位基因)、阴性对照(DMSO)及空白对照(三蒸水),每个样品点20个重复点,每块玻片点两个重复阵列。
阴性对照是用50%的DMSO,阳性对照是标记有荧光染料HEX的λDNA,阴性对照和阳性对照的作用是确认芯片质量合格及反应条件正常与否,以保证反应结果的有效性。正常情况下阳性对照应该有荧光信号,而阴性对照则没有荧光信号。另外阳性对照还起到一个位置标志的作用,让实验者可以方便的找到各个株系探针的位置。
2.5 芯片预处理
预处理的目的就是通过紫外光的照射(紫外交联),使基因芯片上的核酸探针与基片牢固地结合在一起,以便与样品杂交。点样仪中干燥好芯片于65℃烘箱中固定1h,将芯片点有DNA的一面在60℃水浴锅上水合10s,芯片距水面距离2-3cm,在空气中室温自然干燥后,再进行一次水合。之后将点有探针的一面朝上,放在紫外交联仪中250mJ交联,后再将芯片放在42℃预热的0.5% SDS中洗涤10min(42℃条件下水浴摇床80rpm),再用42℃预热的蒸馏水清洗4min,最后用无水乙醇清洗2min。2000rpm离心5min去除芯片表面的液体后,密封,室温保存备用。
2.6 芯片的杂交
制备好芯片放置在北京博奥晶典生物技术有限公司生产的专用杂交盒中。
10uL杂交液的配制:100%甲酰胺 5uL,10% SDS 0.2uL,20 X SSC 1.5uL,PCR样品标记物3.3uL。(以不含标记样品的水做参照)。将标记样品与杂交液的混合物混匀后,3000rpm,离心30s,于95℃沸水中变性处理3min,冰浴骤冷1min,然后用移液器将杂交混合液分别加注到杂交芯片的盖片上的小孔中,使预杂交液覆盖于点样区,然后盖紧杂交盒的盖,放入42℃的水浴中,杂交2h,使样品与探针充分混合。
2.7 芯片的清洗
杂交结束后,在暗室内取出芯片,杂交面朝上放于清洗盒中,放在水平摇床上用42℃预热洗液1清洗4min,以便洗去没有与探针特异性结合的样品;然后迅速地用镊子将芯片转移到盛放有洗液2的清洗盒中,杂交面朝上,放在水平摇床上用42℃预热洗液1清洗4min。清洗结束后,1500rpm,1min离心干燥,除去玻璃表面上的液体,在4小时内进行扫描。
2.8 芯片的扫描分析
利用基因芯片激光共聚焦扫描仪LuxScanTM10K扫描仪扫读芯片信息,先打开扫描软件是LUXSCAN 3.0,然后开仓,将芯片插入机器内,关仓,使用绿色荧光通道,先使用4伪彩进行预扫一次,以便选择扫描区域,再进行精扫,扫描参数为扫描分辩率为10μm,激发光源波长532nm,接收的荧光信号中心波长570nm,检测灵敏度小于一个荧光分子/um2,激光功率值(Laser Power)100%,光电倍增管效率值(PMT Gain)600。
2.9 数据处理与结果判定
扫描后图像将通过判读软件(CapitalBio)自动进行分析,通过比较分析信号中位值和信号平均值的输出数据,以其中最能反应本试验芯片杂交图像信息的参数值进行结果分析。当芯片上呈现绿色信号且HEX质控信号呈现绿色信号时即可判定阳性反应,对于反应强烈的可以直接从扫描图片上荧光的反应判断检测结果。
2.10 芯片的特异性试验
将PPV不同的株系PCR标记扩增的PCR产物分别与制备好的芯片进行杂交,以检测芯片的特异性。
2.11 芯片的灵敏性试验
灵敏度实验是指基因芯片所能检測的最低DNA浓度,取决于目的基因制备时PCR扩增的灵敏度。本试验将D株系的标记PCR扩增后的DNA稀释成以下浓度:20pg/μL、10pg/μL、5pg/μL及2.5pg/μL,再与杂交液混匀后与检测芯片进行杂交,经荧光扫描仪扫读信号,验证检测芯片的灵敏度。
2.12 应用芯片对植物病毒的验证检测
用同样是果树上非常重要的病毒同时也是我国重要的进境检疫性病毒即李坏死环斑病毒做验证试验材料,采用与李痘病毒样品处理相同的方法,提取其总RNA,设计其PCR扩增引物并进行5'端标记:PNRSV1:5'-gatggtttgccgaatttgcaatc-3', 下游引物PNRSV2:5'-ctagatctcaagcaggtcct-3',然后做反转录RT,再用荧光标记的特异性引物做PCR扩增, 反应条件:94℃ 变性3min,然后94℃ 40s,60℃ 40s,72℃ 1min,35个循环,然后72℃延伸10min,最后再与李痘病毒的芯片进行杂交。
3 结果与分析
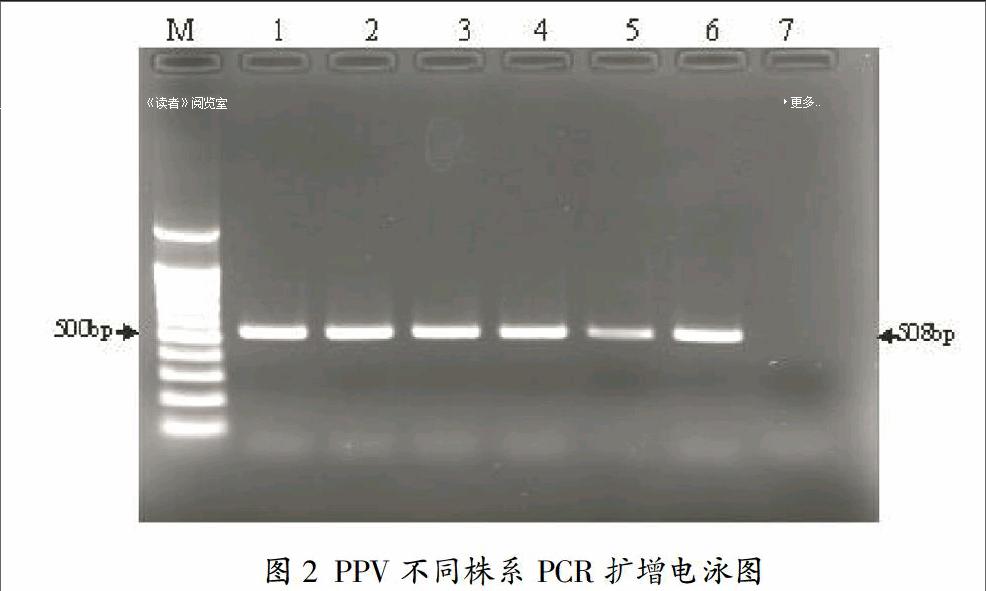
3.1 PPV六种株系PCR鉴定
经过对PPV六种株系的序列进行比对,找出了这六个株系的特性的保守片段,并设计了检测它们的通用引物,本实验PCR片段长度是508bp,长度大小和通用性及特异性都能够满足实验要求,电泳结果显示用通用PCR引物能扩增出个株系的特异性DNA片段,如图2,为制备标记靶基因奠定了基础。
3.2 探针的设计与合成
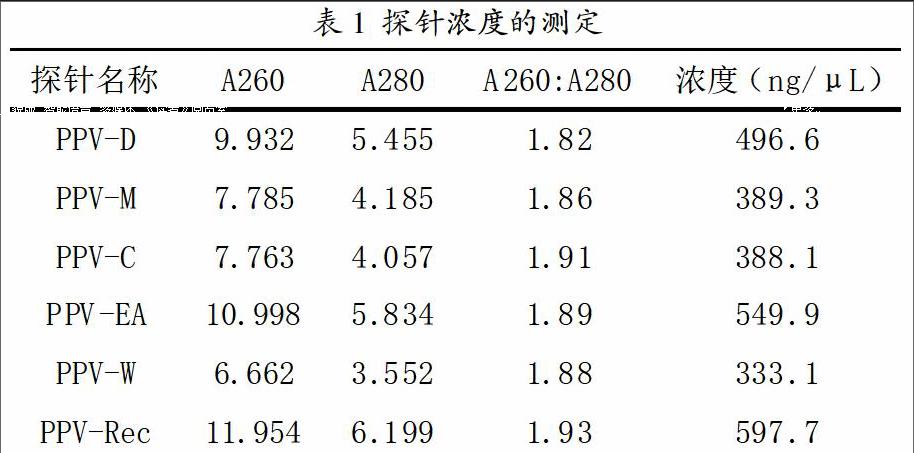
根据序列比对,最后设计各株系特异性探针长度都是41bp,序列分别如下:5'- 3';探针浓度的测定值如表1所示,其A260:A280比值都超过1.8,纯度符合实验要求。
PPV-D-X16415.1-CP:
C A A C A A A A C C A G T T T C A C A G G T G C C A G G A C C T C A A C T G C A A
PPV-M-AJ243957.1-CP:
C G G T A A G A C C A G T T C C T C C A A T T T C A G G G A C C A A A C C G C G G
PPV-EA-X56258-CP:
C C A C T A G G A C A G T G C C T C A C A C A A C A A C T A C T A C A C C T C C T
PPV-Rec-AY028309-CP:
C G A T A A G A C C A G T T T C T C C A A T T T C A G G G G C C A C A C C G C A G
PPV-W-AY912055-CP:
G C G T G A A G C C A A C T A C A T C A G C A A C A A T T A A C C C A A C G T C T
PPV-C-Y09851-CP:
A T G T G A G A C C G A T T G C A C C A G T A G T G A C A A G T C C A T T C T C G
通过对检测靶基因即PCR产物的同源性分析,能够评价一个基因是否适合用于检测某一种病毒,同时也为杂交反应提供理论依据,是一个重要的指标。探针的选择是构建检测芯片最核心的内容之一。作为检测探针,必须根据探针在属或种内保守性及特异性的两大原则来设计,本实验设计的各个探针与同株系PCR产物即靶标之间的同源性达到95%以上,而与非同株系的靶标之间的同源性只有39-61%,这样就确保了检测靶基因间不会产生交叉杂交现象,保证了实验的检测特异性。同源性分析结果表明,本实验所选用的6个DNA序列片段适合用作构建检测李痘病毒6个主要株系的基因芯片的探针。
3.3 芯片的特异性杂交试验
将PPV不同的株系PCR标记扩增的PCR产物分别与制备好的芯片进行杂交,结果显示每个株系的探针只与其相同株系的PCR扩增产物杂交,并显示出强烈的荧光信号,而与其他株系的PCR标记扩增产物没有任何反应,荧光暗淡。此杂交结果表明,检测芯片具有良好的特异性,且杂交信号强度好,扫描图像上杂交斑点明显,检测结果目视即可判定,有利于应用该芯片对植物样品中该病毒进行检测,如图3-8。
3.4 芯片的灵敏性试验
将D株系的标记PCR扩增后的DNA稀释成不同的浓度后杂交表明在模板DNA浓度在5~20pg/μL范围内,都有明显的杂交信号,杂交斑点明显;模板DNA浓度为2.5pg/μL时,无杂交信号,SNR为0.40,信号值小于100,肉眼看不到杂交斑点,表明检测芯片的检测灵敏度可达到5pg/μL。如图9所示。
3.5 芯片的特异性试验
首先用同样为木本植物的检疫性病毒即李坏死环斑病毒进行验证,用PNRSV的荧光标记的特异性引物做RT-PCR扩增,可以扩增出675bp的特异性片段,结果如下图10所示,然后将扩增的标记产物与PPV芯片杂交,结果显示PPV芯片除了阳性质控出现强烈荧光外,并不能与李坏死环斑病毒的扩增物杂交上,如图11.表明PPV芯片具有一定的特异性。
M:100bp分子量标准;
1. PNRSV及PPV二重PCR扩增产物
2. PPV PCR 扩增产物(243bp)
3. PVRSV PCR 扩增产物(675bp)
4 讨论
特异性探针的设计是基因芯片检测技术的核心内容,芯片中所用的探针为核酸分子探针,是指特定的已知序列的核酸片段,能与互补核酸序列发生杂交。因此可以利用探针检测样品中特定基因的特征片段或测定未知基因的序列。根据核酸分子探针的来源及其性质可以分为基因组DNA探针、CDNA探针、RNA探针及寡核苷酸探针等。可以根据检测对象和要求的不同选用不同类型的探针。但并不是任意一段核酸片段均可作为探针。探针选择正确与否,将会直接影响到杂交结果的分析。探针选择最基本的原则是应具有高度特异性,兼而考虑来源及制备的方便等因素。本实验是通过核酸序列比对从李痘病毒外壳蛋白编码基因的种的保守序列中寻找株系的核酸序列的特异性,并基于此设计出了6个株系的特异性探针,通过序列再比较并在NCBI中通過BLAST比对发现这6条探针具有高度的特异性,完全可以作为株系探针来检测和区分李痘病毒不同株系。
芯片基片的选择非常重要,各种各样的芯片表面修饰中,目前最常用的具有活性氨基或活性醛基基团修饰。氨基化芯片适用于点制PCR产物、cDNA和蛋白质等大分子,表面的氨基在中性的条件下带正电荷,与DNA骨架上带负电荷的磷酸基团通过静电相互作用相结合,这种结合方式与靶基因的序列组成和空间排列没有关系。在一般的实验条件下,氨基基片均能表现出较低的自发荧光和低的背景荧光,但是对于比较短DNA片段如40bp左右的寡核苷酸,由于片段比较短小,为了其有更好的杂交效率,一般要对其进行氨基修饰,并点在醛基基片更为合适,由于本实验设计的探针都只有41bp,故本实验选用醛基基片,并对探针的5'端进行氨基修饰,以便使氨基与醛基包被的基片结合,从而将探针固定在基片上。
芯片杂交的特异性取决于选取靶基因的同源性。本研究中所选取的靶基因均为同种病毒内保守序列,但探针相互之间的同源性在39-61%以下,确保在杂交过程中不出现交叉杂交的现象。
对于一种检测方法,必须要明确其最低的检测浓度即灵敏度,以避免由于DNA浓度的影响而造成假阴性的结果。在本试验中,选取李痘病毒的D株系的PCR产物进行进行灵敏性试验,结果表明基因芯片检测的灵敏度为5pg/μLDNA模板浓度。
基因芯片技术虽然目前已经在许多方面得到了广泛的应用,但是在李痘病毒6个主要不同株系检测鉴定方面还未见诸报道,因此本项目的研究对植物病毒的检测特别是对李痘病毒的检测具有一定的现实意义并为其他植物病毒的检测提供了一定的参考价值。
参考文献
[1]步恒富,祝庆余.基因芯片技术在致病微生物研究中的应用[J].国外医学:微生物学分册,2001,24(1):8-11.
[2]杨国淋,文心田,曹三杰,等.基因芯片技术在鸡病毒性疾病诊断中的应用[J].中国兽医杂志,2015,51(10):57-60.
[3]邱秀文,吴小芹,黄霖,等.基因芯片技术在生物研究中的应用进展[J].江苏农业科学,2014,42(5):60-62.
[4]生物芯片分析[M].张亮,等译.北京:科学出版社,2004:100,112,13
5,258.
作者简介:陈定虎(1985,5-),男,汉族,籍贯:湖北荆州,博士研究生,高工,研究方向:植物病毒检疫。

