基于场流分离技术分离表征血清中的脂蛋白
王静,张潇月,张竞文,窦海洋,,申世刚
(1.河北大学 化学与环境科学学院,河北省分析科学技术重点实验室,河北 保定 071002;2.河北大学 医学院,河北 保定 071002)
基于场流分离技术分离表征血清中的脂蛋白
王静1,张潇月2,张竞文2,窦海洋1,2,申世刚1
(1.河北大学 化学与环境科学学院,河北省分析科学技术重点实验室,河北 保定 071002;2.河北大学 医学院,河北 保定 071002)
采用非对称场流分离系统与多角度激光光散射检测器、荧光检测器联用技术分离表征冠心病患者血清中脂蛋白.研究了恒定交叉流流速和指数衰减交叉流流速对非对称场流分析血清的影响.利用非对称场流分离系统分离并收集了血清主要成分片段,通过动态激光光散射仪对收集的样品片段进行了表征.研究结果表明,血清中游离的蛋白质和脂蛋白能被非对称场流分离系统分开;指数衰减交叉流流速不仅缩短了分析时间,而且提高了脂蛋白亚类片段的分离度.结果证明,非对称场流分离与多角度激光光散射检测器、荧光检测器联用技术是一种潜在的血清中脂蛋白的分离表征方法.
非对称场流分离;血清;脂蛋白;冠心病
血清中的脂蛋白是由蛋白质与脂质形成的复合物,与动脉粥样硬化型心血管疾病之间有着密切的关系.目前,临床上常以血液中高密度脂蛋白(highdensitylipoprotein,HDL)和低密度脂蛋白(lowdensitylipoprotein,LDL)的胆固醇含量(HDL-C和LDL-C)作为冠心病的预测因子[1-3].然而,最近的研究发现他汀类药物升高HDL-C水平的同时却没有降低冠心病的发病风险[4].因此单纯从血液中HDL-C和LDL-C的角度评价冠心病发生风险存在明显的局限性.最近,Pérez-Méndez等[5]指出与HDL-C相比,血清中HDL/LDL值具有较强的冠心病风险预测能力.Schmidt课题组[6]发现小粒径、高密度的LDL预测能力不依赖于性别、年龄、吸烟等冠心病风险因素.血清中的脂蛋白粒径分布可能成为不受冠心病风险因素影响的新的预测因子.因此,血清中脂蛋白的分离及粒径表征对了解冠心病的发病机理及冠心病的诊断和治疗具有重要意义.然而,目前广泛应用于血清中脂蛋白分离的超高速离心法具有分析时间长、操作复杂等缺点.聚丙烯酰胺凝胶电泳(polyacrylamidegelelectrophoresis,PAGE)测得的血清中脂蛋白的粒径是平均粒径,准确性低,并且无法测得脂蛋白的粒径分布.因此,急需一种快速、准确、高效的血清中脂蛋白的分离表征方法.
非对称场流分离技术(asymmetricalflowfieldflowfractionation,AF4)是一种基于样品与外力场相互作用机理的分离表征技术[7].不同于HPLC、GPC基于样品与固定相相互作用的分离技术,AF4池道中没有固定相和填充材料,故AF4具有较广泛的检测范围(1nm~50μm,103~1018g/mol),适用于剪切力敏感的生物样品的分离.AF4池道的独特设计使分析载液具有广泛的选择性,进而可对样品进行原位分析;收集的AF4样品片段可用于其他分析手段的离线或在线分析.此外,根据AF4理论,AF4与一些检测器串联可以同时提供样品的粒径分布图.这是超高速离心法和PAGE法等其他分离技术所无法比拟的.
尽管AF4已广泛应用于生物样品的分离表征,但是应用于分离血清的报道较少,最近,Moon课题组[8]报道了应用中空纤维场流分离血清中的脂蛋白,但并未进行脂蛋白粒径分析.本文采用非对称场流分离与多角度激光光散射检测器、荧光检测器联用技术分离表征了冠心病患者血清中脂蛋白,通过非对称场流分离收集了脂蛋白亚类片段,并通过动态激光光散射对收集的片段进行了粒径表征.
1 实验部分
1.1 试剂
磷酸氢二钠、磷酸二氢钠、溴酚蓝、马脾铁蛋白、高密度脂蛋白标准样品、低密度脂蛋白标准样品购自美国Sigma-Aldrich公司;氯化钠、叠氮化钠购自上海麦克林生化科技有限公司;质量分数为37%盐酸(北京化工厂);所用试剂均为分析纯,所用水为超纯水.
1.2 血清制备
取8mL冠心病志愿者静脉血,置于10mL促凝管中,多次翻转后使用TGL-20B离心机(上海安亭分析仪器厂)离心(6 000r/min,20min).取上层清液(血清),并在相同条件下再次离心,以确保上层清液中没有血细胞.将制备好的血清样品储存在超低温冰箱(-80 ℃)待AF4分析.
1.3 血清AF4分析
采用美国Wyatt公司的Eclipse2非对称场流分离系统对血清样品进行分离.Eclipse2依次串联着美国Wyatt公司的DAWNEOS多角度激光光散射检测器(MALS),日本岛津公司的RL-10AXL荧光检测器.载液为10mmol/L的PBS缓冲溶液,pH=7.4.为了抑制细菌产生,载液中加入了3mmol/L叠氮化钠,同时加入了不同量的氯化钠调节载液的离子强度.载液使用前,通过0.1μm的可再生纤维素膜过滤.载液通过美国Agilent公司的1200HPLC泵注入到AF4池道中.AF4池道长度为26.5cm,包括350μm的聚酯垫片和5KDa可再生纤维素超过滤膜.通过已知扩散系数(D)的马脾铁蛋白标样测得的实际AF4池道高度(w)为283 μm.进样20 μL混合后的四名冠心病患者血清样品.池道横流流速设定为1.0 mL/min,交叉流流速(Vc)分别设定为恒定流速和指数衰减流速.Vc为2,3和 4 mL/min时,通过溴酚蓝测定的聚集时间分别为2.1,2.0,和1.8 min.指数衰减交叉流流速和衰减时间的关系如式1所示[9]:
Qc(t)=Qc(0)·e(-ln2/t1/2)t,
(1)
其中,Qc(t)是Vc随时间衰减函数;Qc(0)是开始时交叉流流速;t1/2是半衰期.
AF4分离主要包括样品进样、聚集松弛和分离3个过程.如图1所示,进样后粒子在外力场作用下往池道底部运动,同时粒子的布朗运动使其向池道中心扩散.当2种外力达到平衡时,由于粒径小的颗粒扩散系数大,形成的样品层的中心位置更接近于池道中心,此位置的横流流速较快,故粒径小的粒子先被洗脱出来[7].根据AF4理论(式2)[10-12],在没有样品与超过滤膜交联的条件下,水动力学直径(dH)和保留时间(tr)具有如下关系:

(2)
其中,k为波尔兹曼常数,T为绝对温度,V0为空隙体积,η为载液黏度,Vc为交叉流流速,w为实测池道厚度,t0为空隙时间.

图1 场流分离技术原理Fig.1 Principle of field flow fractionation
1.4 血清DLS表征
采用美国Wyatt公司的NanoStar动态激光光散射粒度仪(DLS)对血清和收集的AF4血清片段进行了粒度表征.20 μL样品直接加入到DLS样品池中,样品室温度设定为25 ℃,样品采集时间为5 s,每个样品采集点数为100,操作波长为658 nm.通过DYNAMICS V7软件进行数据分析.
2 结果与讨论
2.1 血清中脂蛋白的分离
AF4分离过程中,外力源于通过超过滤膜的交叉流流速,是影响样品AF4分离度的主要因素.图2是不同交叉流流速荧光检测器(FL,激发波长为288 nm,发射波长为335 nm)和90°角MALS检测器(LS90)的血清AF4洗脱谱图.载液包含3 mmol/L NaN3,50 mmol/L NaCl 和10 mmol/L PBS缓冲溶液,pH=7.4.由图2a可见,当Vc=2 mL/min时,空隙峰(t0)后面出现了2个洗脱峰.第1个相对强度较大的洗脱峰可能是一些游离的蛋白质,第2个相对强度较弱并伴随着拖尾的洗脱峰可能是脂蛋白.在60 min关闭交叉流后洗脱出来了一个小峰.这可能是由于少量较大的或是一些交联在超过滤膜表面上的成分被洗脱出来.随着Vc的逐渐增加,样品的保留时间逐渐向右移动.正如AF4理论所示(式2),在较高Vc条件下,样品被进一步推向池道底部,平衡时样品层中心位置的层流流速较慢,故增加了保留时间.当Vc=3 mL/min时,第1个洗脱峰和空隙峰完全分开,当60 min关闭交叉流后释放出来的峰强度和Vc=2 mL/min时释放出来的峰强度相比没有明显变化,说明样品与超过滤膜没有发生明显的交联.当Vc增加到4 mL/min时,第2个洗脱峰变成了“拖尾峰”,关闭交叉流后释放出来的峰强度增强,表明样品与超过滤膜发生了交联.
由图2b可以看出,当Vc=2 mL/min,AF4-LS90显示了3个洗脱峰;当Vc=4 mL/min,60 min时关闭交叉流后释放出来的峰的强度显著高于荧光检测器信号强度(图2a).这主要是由于LS90信号强度不仅和样品的浓度有关,而且与样品的粒径大小相关.LS90检测出来的第3个洗脱峰可能是粒径较大的低密度脂蛋白.根据AF4原理(式2),在Vc=3 mL/min条件下,将保留时间转换成了水动力学直径并列于图2b顶部x轴上.结果显示,3个洗脱峰水动力学直径分别为3~10 nm,10~20 nm,20~100 nm.
图3为不同半衰期指数衰减的交叉流流速的血清AF4-FL(a)和AF4-LS90(b)图谱.初始交叉流流速为3 mL/min.载液为3 mmol/L NaN3,50 mmol/L NaCl 和10 mmol/L PBS缓冲溶液,pH=7.4.由图3a可以看出,在指数衰减的交叉流流速作用下,血清中大部分成分在60 min内被洗脱;第1个洗脱峰完全和空隙峰分开.和恒定交叉流流速相比(图2b),指数衰减交叉流流速半衰期t1/2=7 min时(图3b)在保留时间为36 min时,出现了一个小的洗脱峰.这主要是由于MALS信号强度和粒子直径有关,对于粒径大的粒子即使浓度相对很小,也能有较好的响应值.随着半衰期的增加,新出现的洗脱峰逐渐趋向于长的保留时间并且强度相对减弱.结果证明,与恒定交叉流流速相比,指数衰减的交叉流流速不仅缩短了分析时间,而且改善了粒径大的粒子的分离度.故选择t1/2=7 min的指数衰减的交叉流流速作为本文研究的分析条件.

图2 不同交叉流流速的血清AF4-FL(a)和AF4-LS90图谱、水动力学直径分布图(b)Fig.2 AF4-FL fractograms(a)and AF4-LS90 fractograms hydrodynamic diameter distribution(b)of serum obtained at various cross-flow rates.
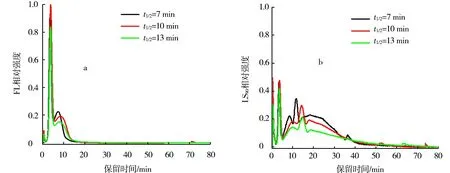
图3 不同半衰期指数衰减的交叉流流速的血清AF4-FL(a)和AF4-LS90(b)图谱Fig.3 AF4-FL fractograms(a)and AF4-LS90 fractograms (b) of serum obtained by exponentially decaying cross-flow rate with various half-life times
图4为不同NaCl浓度载液的血清AF4-FL和AF4-LS90图谱.从图4a可以看出,随着载液中NaCl浓度的增加,第1个洗脱峰的信号强度减小,第2个洗脱峰的信号强度增强.由于载液离子强度的增加,降低了样品表面双电子层的厚度,使样品更接近于超过滤膜表面,从而提高样品的分离度.从图4a可以看出,随着载液中NaCl浓度的增加,血清中粒径大的成分(保留时间大于35 min)LS90信号强度逐渐降低.这可能是由于粒径大的粒子更接近于超过滤膜表面,发生了不可逆吸附.
2.2 血清中脂蛋白洗脱峰的确定
为了确定血清中脂蛋白的洗脱峰,分析了HDL和LDL标准样品,如图5所示.载液为3 mmol/L NaN3,25 mmol/L NaCl 和10 mmol/L PBS缓冲溶液,pH=7.4,指数衰减交叉流初始流速为3 mL/min,t1/2=7 min.由图5a可以看出第2个洗脱峰主要成分是HDL,保留时间10 min以后洗脱出的主要成分是LDL.由图5b可以看出,LDL标准样品的洗脱峰包括3个成分,可能是低密度脂蛋白(LDL)、极低密度脂蛋白(VLDL)、超低密度脂蛋白(VVLDL).结果证明,AF4-MALS在指数衰减交叉流流速辅助下,可以分离出低密度脂蛋白的亚类.此外,由于AF4分离不破坏样品的物化性质,收集的AF4样品片段可以进一步进行离线或在线分析.

图4 不同氯化钠浓度载液的血清AF4-FL(a)和AF4-LS90(b)图谱Fig.4 AF4-FL fractograms(a)and AF4-LS90 fractograms (b) of serum obtained with carrier liquid of various concentrations of NaCl

图5 血清、HDL标准样品、LDL标准样品的AF4-FL(a)和AF4-LS90(b)图谱Fig.5 AF4-FL fractograms(a)and AF4-LS90 fractograms (b) of serum,HDL and LDL standard samples
2.3 血清中脂蛋白的DLS表征
血清和收集的AF4血清片段(图5b中片段F1、F2、F3和F4)的水动力学直径DLS表征结果见表1.从表1可以看出,长保留时间收集的片段对应的DLS测得的水动力学直径相对较大,符合AF4分离原理,即粒径较小的样品先被洗脱出来.DLS测得的整个血清样品的水动力学直径偏大.由于DLS光强度正比于粒子直径的6次方,即粒径扩大1倍,DLS光信号强度扩大106倍.因此DLS分析粒径分布宽的样品时,粒径小的样品的光强度往往被粒径大的光强度淹没,导致结果偏大.实验结果表明,经过AF4样品预分离,可以减少DLS结果的偏差.
3 结论
AF4-MALS-FL不仅可以进行血清中主要成分的分离,可以提供水动力学直径分布图.AF4-MALS-FL在指数衰减交叉流流速辅助下,不仅缩短了血清的分析时间,而且可以分离低密度脂蛋白的亚类.由于AF4是一种温和的分离技术,其对生物样品的不破坏性使收集的AF4样品片段可以进一步分析.实验结果表明,AF4-MALS-FL是一种潜在的血清中脂蛋白的分离表征方法.

表1 血清和收集AF4片段的水动力学直径
[1]KRISHNANS,HUANGJ,LEEH,etal.Combinedhigh-densitylipoproteinproteomicandglycomicprofilesinpatientsatriskforcoronaryarterydisease[J].JournalofProteomeResearch,2015,14(12):5109-5118.DOI:10.1021/acs.jproteome.5b00730.
[2]NAKAMURAT,OBATAJ-E,HIRANOM,etal.PredictivevalueofremnantlipoproteinforcardiovasculareventsinpatientswithcoronaryarterydiseaseafterachievementofLDL-cholesterolgoals[J].Atherosclerosis,2011,218(1):163-167.DOI:10.1016/j.atherosclerosis.2011.04.040.
[3]KINGWELLBA,CHAPMANMJ,KONTUSHA,etal.HDL-targetedtherapies:progress,failuresandfuture[J].NatureReviewsDrugDiscovery,2014,13(6):445-464.DOI:10.1038/nrd4279.
[4]CHECHIK,BLANCHARDP-G,MATHIEUP,etal.BrownfatlikegeneexpressionintheepicardialfatdepotcorrelateswithcirculatingHDL-cholesterolandtriglyceridesinpatientswithcoronaryarterydisease[J].InternationalJournalofCardiology,2013,167(5):2264-2270.DOI:10.1016/j.ijcard.2012.06.008.
[5]PREZ-MNDEZ,PACHECOHG,MARTNEZ-SNCHEZC,etal.HDL-cholesterolincoronaryarterydiseaserisk:Functionorstructure[J].ClinicaChimicaActa,2014,429(0):111-122.DOI:10.1016/j.cca.2013.12.001.
[6]TOFT-PETERSENA,TILSTEDH,AAROEJ,etal.SmalldenseLDLparticles-apredictorofcoronaryarterydiseaseevaluatedbyinvasiveandCT-basedtechniques:acase-controlstudy[J].LipidsinHealthandDisease,2011,10(1):21-27.DOI:10.1186/1476-511X-10-21.
[7]GIDDINGSJC.Field-flowfractionation:Analysisofmacromolecular,colloidal,andparticulatematerials[J].Science,1993,260(5113):1456-1465.DOI:10.1126/science.8502990.
[8]LEEJY,BYEONSK,MOONMH.Profilingofoxidizedphospholipidsinlipoproteinsfrompatientswithcoronaryarterydiseasebyhollowfiberflowfield-flowfractionationandnanoflowliquidchromatography-tandemmassspectrometry[J].AnalyticalChemistry,2015,87(2):1266-1273.DOI:10.1021/ac503973p.
[9]NILSSONL,LEEMANM,WAHLUNDK-G,etal.Mechanicaldegradationandchangesinconformationofhydrophobicallymodifiedstarch[J].Biomacromolecules,2006,7(9):2671-2679.DOI:10.1021/bm060367h.
[10]BAALOUSHAM,STOLPEB,LEADJR.Flowfield-flowfractionationfortheanalysisandcharacterizationofnaturalcolloidsandmanufacturednanoparticlesinenvironmentalsystems:Acriticalreview[J].JournalofChromatographyA,2011,1218(27):4078-4103.DOI:10.1016/j.chroma.2011.04.063.
[11]DOUH,KIMK-H,LEEB-C,etal.Preparationandcharacterizationofcyclo-1,3,5-trimethylene-2,4,6-trinitramine(RDX)powder:Comparisonofmicroscopy,dynamiclightscatteringandfield-flowfractionationforsizecharacterization[J].PowderTechnology,2013,235(0):814-822.DOI:10.1016/j.powtec.2012.11.042.
[12]DOUH,LEEY-J,JUNGEC,etal.Studyonsterictransitioninasymmetricalflowfield-flowfractionationandapplicationtocharacterizationofhigh-energymaterial[J].JournalofChromatographyA,2013,1304(0):211-219.DOI:10.1016/j.chroma.2013.06.051.
(责任编辑:梁俊红)
Separation and characterization of lipoproteins in serum using field flow fractionation
WANG Jing1,ZHANG Xiaoyue2,ZHANG Jingwen2,DOU Haiyang1,2,SHEN Shigang1
(1.Key Laboratory of Analytical Science and Technology of Hebei Province,College of Chemistry and Environmental Science,Hebei University,Baoding 071002,China;2.College of Medicine,Hebei University,Baoding 071002,China)
The lipoproteins in serum were separated and characterized using asymmetrical flow field-flow fractionation(AF4)coupled with multiangle light scattering(MALS),and fluorescence(FL)detectors.The effect of programmed cross-flow rates in linear decay and exponential decay on the AF4 analysis of serum was studied.The collected AF4 fractions of the serum were characterized by dynamic light scattering(DLS).It was found that the free proteins and lipoproteins in the serum were separated by AF4.The application of exponentially decaying cross-flow rate not only reduced the time of AF4 analysis of serum,but also improved the resolution for the sub-class of lipoproteins.The results demonstrate that AF4-MALS-FL is a useful tool for the analysis of lipoproteins in serum.
asymmetrical flow field-flow fractionation;serum;lipoprotein;coronary artery disease
10.3969/j.issn.1000-1565.2017.02.004
2016-12-05
河北省自然科学基金资助项目(B2016201002);河北省引进留学人员资助项目(CL201603);河北省高等学校科技研究基金资助项目(QN2016081);河北省2016医学学科研究重点课题资助项目(20160048);保定市科学研究与发展计划资助项目(15ZG049);河北省大学生创新创业训练计划资助项目(201610075071)
王静(1992—),女,河北临漳人,河北大学在读硕士研究生,主要从事场流分离研究.E-mail:13403204355@163.com
窦海洋(1983—),男,河北香河人,河北大学讲师,博士,主要从事场流分离研究.E-mail:douhaiyang-1984@163.com申世刚(1964—),男,河北阜城人,河北大学教授,博士,主要从事反应动力学研究.E-mail:shensg@hbu.edu.cn
O
A
1000-1565(2017)02-0128-06

