地衣芽孢杆菌BL-5芽孢生成条件优化
陈文莹,许云贺,谌小立,肖海蒂,王淋枫,黄涛,张莉力*
(1.遵义医学院公共卫生学院,贵州遵义563000;2.锦州医科大学食品科学与工程学院,辽宁锦州121001)
地衣芽孢杆菌BL-5芽孢生成条件优化
陈文莹1,2,许云贺2,谌小立1,肖海蒂2,王淋枫2,黄涛2,张莉力2*
(1.遵义医学院公共卫生学院,贵州遵义563000;2.锦州医科大学食品科学与工程学院,辽宁锦州121001)
地衣芽孢杆菌(Bacillus licheniformis)作为微生态制剂在食品或饲料工业中具有广泛的应用前景。通过温度对地衣芽孢杆菌BL-5致死率的影响研究得出无芽孢菌体的致死温度为75℃。以芽孢率和芽孢数为评价指标,得到地衣芽孢杆菌BL-5芽孢生成的最佳培养基配方为:蔗糖29.85 g/L、硫酸铵10.00 g/L、酵母膏3.00 g/L、磷酸氢二钾3.42 g/L、硫酸镁1.5 g/L、pH 8.0。最佳培养条件为:接种量5%、发酵时间48 h,发酵温度30℃、转速150 r/min。
地衣芽孢杆菌BL-5;芽孢率;芽孢数
地衣芽孢杆菌(Bacillus licheniformis)是芽孢杆菌属的非致病性细菌,呈革兰氏阳性[1]、过氧化氢酶阳性和氧化酶阳性,形成内生孢子[2]。在20世纪初,重组地衣芽孢杆菌生产的一些工业产品,在美国、欧洲和日本已被批准生产。自1972年以来,地衣芽孢杆菌已被安全地用于大型工业发酵产酶。随后,地衣芽孢杆菌菌株在国际食品法典的第三版被列为食源性蛋白酶的来源和糖酶制剂[3]。
由于地衣芽孢杆菌生产淀粉酶,脂肪酶和蛋白酶的能力很强[4],有利于营养素的降解和吸收,增加饲料的利用率,也被广泛应用于饲料行业[5-6]。RANJIT K N等[2]在罗氏沼虾幼体(4.0±0.02)g中研究了益生性地衣芽孢杆菌的膳食补充剂对肠道菌群生长和免疫响应的影响,结果表明,地衣芽孢杆菌的膳食补充可以调节罗氏沼虾的肠道菌群、增加生长和免疫应答。地衣芽孢杆菌在较高浓度(1.0× 109CFU/g饲料)下益生效果更好。此外,地衣芽孢杆菌能够增强动物的抗氧化能力、免疫力及抗病力。ZHANGCN等[7]的研究表明,膳食低聚果糖(fructooligosaccharide,FOS)和地衣芽孢杆菌能显著提升三角鲂(Megalobrama terminalis)的先天免疫和抗氧化能力,以及提高其抗病能力。这两个益生元和/或益生菌的最佳组合是0.3%FOS和1×107CFU/g地衣芽孢杆菌。CHEN X M等[8]通过对鲤鱼补充0、0.5%、1.0%和2.0%剂量的地衣芽孢杆菌XY-52进行免疫刺激产生次级活性代谢产物,此产物对免疫响应可以产生积极的影响,增强鲤鱼对嗜水气单胞菌(Aeromonas hydrophila)感染的抗病能力。周振峰[9]研究报道,地衣芽孢杆菌能有效地平衡和增强奶牛瘤胃有益微生物菌群的优势,能增强奶牛免疫力及抵抗疾病的能力,提高饲料的利用率。VINOJ G等[10]的结果表明,地衣芽孢杆菌DAHB1可开发用作预防性治疗剂以抑制或减少在水产养殖中虾的弧菌定植和死亡率。此外,地衣芽孢杆菌因能产生丰富的酶系,也长期用于生产食品工业用的酶制剂[11]。REHMAN H U等[12]分离的地衣芽孢杆菌KIBGE IB-21具有果胶酶活性。
芽孢数和芽孢率作为芽孢杆菌性能的重要指标,只有当芽孢数和芽孢率较高时才能达到较好的益生效果。除了碳源和氮源对芽孢生成有影响外,赵晓燕等[13-14]报道磷酸氢二钾和硫酸镁对产孢菌株产孢能力有重要影响。因此本研究在前期实验对碳源和氮源优化的基础上[15]对影响地衣芽孢杆菌BL-5的芽孢数及芽孢率的因素(培养条件及培养基配方中的无机盐)进行优化,为后期进一步优化实验提供数据支持,为地衣芽孢杆菌BL-5作为微生态制剂在食品或饲料工业中的应用奠定基础。
1 材料与方法
1.1 材料与试剂
地衣芽孢杆菌(Bacillus licheniformis)BL-5:锦州医科大学食品微生物实验室保存。
牛肉膏、蛋白胨、酵母膏和琼脂(均为生化试剂):北京奥博星生物技术有限责任公司;硫酸铵、NaCl、葡萄糖、蔗糖、MgSO4·7H2O和K2HPO4·3H2O(均为分析纯):天津市致远化学试剂有限公司。
种子培养基:牛肉膏5 g、大豆蛋白胨10 g、NaCl 5 g、水1 L,pH7.0。
促芽孢培养基:葡萄糖1.0 g、蛋白胨1.0 g、硫酸铵0.2 g、酵母膏0.7 g、MgSO4·7H2O 0.2 g、磷酸氢二钾1 g、琼脂20 g(固体培养基时),水1 L,pH7.2。
优化培养基:蔗糖29.85 g/L、硫酸铵10.00 g/L、酵母膏3.00 g/L、硫酸镁0.50 g/L、磷酸氢二钾1.80 g/L、pH 8.0。
1.2 仪器与设备
M4-AL204电子分析天平:兰州中西仪器有限公司;UV754PC紫外分光光度计:上海佑科仪表有限公司;SWCJ-2FD型双人单面净化工作台:苏州净化设备有限公司;DHP-9082型恒温培养箱:金坛市鑫鑫实验仪器厂;YXQ-LS型立式压力蒸汽灭菌器:上海博讯实业有限公司;DK-98-1型水浴锅:天津泰斯特仪器公司;DHP-9052型pH计:上海一恒科技有限公司;微量移液器:百得实验室仪器有限公司;HZQ-F200振荡培养箱:北京东联哈尔仪器制造有限公司;CX41生物显微镜:奥林巴斯(中国)有限公司。
1.3 方法
1.3.1 菌种活化方法
将冻存于-80℃超低温冰箱中的地衣芽孢杆菌BL-5以体积分数2%接种量接入5 mL种子培养基进行活化,37℃摇床培养24 h,继续传代培养3代至菌种活力上升后,接种于斜面培养基(营养琼脂)上,作为后续实验的菌种。
1.3.2 产芽孢菌的筛选
将活化后的保存于斜面上的菌株挑取少许划线于促芽孢培养基平皿上,30℃培养24 h后挑选独立且大菌落到装有25 mL无菌生理盐水中,振荡均匀后置100℃水浴锅中水浴10 min,再涂布于促芽孢培养基的平皿上培养,反复多次。最后选取平皿上的大菌落转接到促芽孢培养基的试管斜面上,30℃培养箱培养24 h后,转置于4℃冰箱冷藏室保存备用。
1.3.3 芽孢数及芽孢率的测定方法[16]
芽孢数(b):将前期实验得到的优化培养基在转速150 r/min条件下[6]摇床培养后的菌液,在致死温度条件下处理15 min后,迅速用流水冷却后采用稀释梯度平皿计数法统计活菌数;
总菌数(a):将培养后的菌液直接进行稀释梯度平皿计数法统计活菌数。
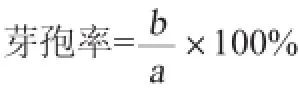
1.3.4 试验设计[17]
(1)温度对细菌致死率的影响
按5%的接种量,用优化培养基在30℃、转速150 r/min条件下摇床培养地衣芽孢杆菌BL-5,然后进行致死温度实验,各取20 mL培养48 h的菌液分别在70℃、75℃、80℃、85℃、90℃、95℃、100℃温度下水浴处理15 min后立即流水冷却,以未经处理的菌液为对照,测定细菌的致死率。

(2)各因素对芽孢数及芽胞率的影响
固定优化培养基中的蔗糖29.85 g/L、硫酸铵10.00 g/L、酵母膏3.00 g/L[15]、硫酸镁0.50 g/L、pH 8.0,考察不同的发酵温度(30℃、35℃、40℃)、接种量(3%、5%、8%、10%)、磷酸氢二钾质量浓度(1.14 g/L、2.28 g/L、3.42 g/L)、硫酸镁质量浓度(0.5 g/L、1.0 g/L、1.5 g/L)发酵时间(12 h、24 h、36 h、48 h、60 h、72 h)对芽孢数及芽孢率的影响。将每个时间段取的菌样分为两部分:一部分直接进行稀释,取三个稀释度(10-5、10-6、10-7)进行涂平板,以获得菌样总菌数;另一部分在致死温度下水浴15min处理营养细胞,以获得芽孢数。
2 结果与分析
2.1 温度对细菌的致死率的影响
因芽孢杆菌具有耐高温特点,将温度从70℃开始设定,梯度设为每次增加5℃,最终增加至100℃,考察不同温度条件下的致死率,结果见图1。
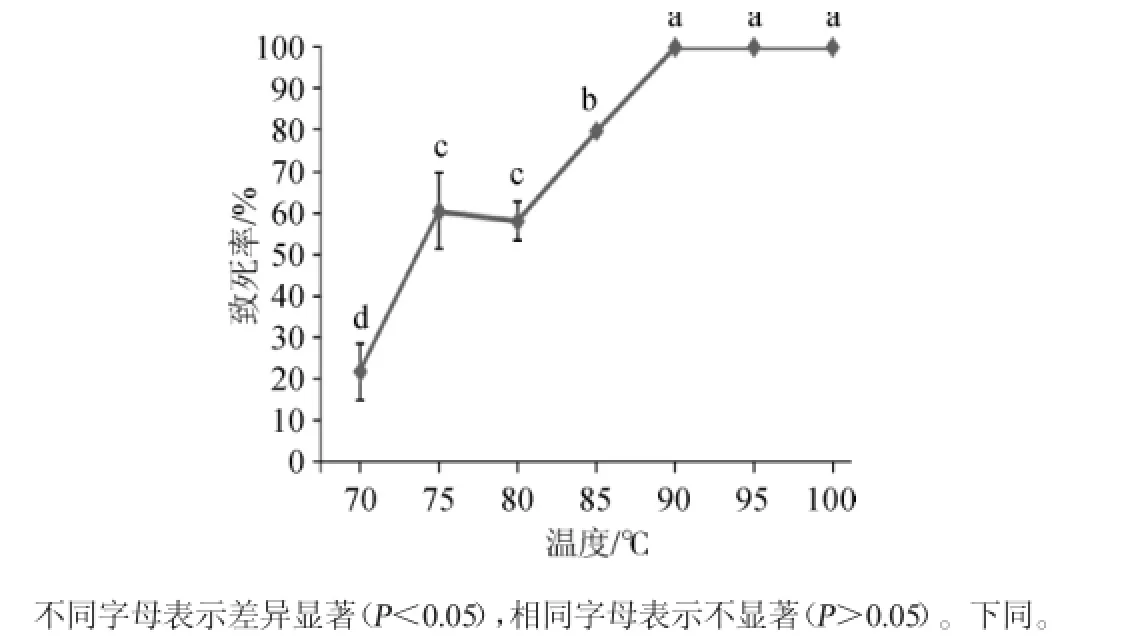
图1 不同温度对致死率的影响Fig.1 Effect of different temperature on lethality
由图1可知,当温度为70℃时,致死率约为20%。当升高至75~80℃时,致死率为60%左右;当温度为85℃时,致死率较80℃升高了近20%;当温度升至90~100℃时,各温度之间的致死率差异并不显著(P>0.05),致死率近乎100%。
从温度75℃和80℃的致死率变化情况可知,地衣芽孢杆菌BL-5在75~80℃这个温度阶段的致死率近似,并且75℃和80℃条件下的致死率并无显著差别(P>0.05),即在温度为75℃时,不含芽孢的营养细胞已被高温致死,超过80℃后致死率又迅速上升,说明主要死亡的为芽孢,因此75℃即为芽孢死亡开始的临界温度,故确定无芽孢菌体的致死温度为75℃,将此温度作为芽孢数和芽孢率实验温度选择的依据。
2.2 发酵时间对芽孢数及芽孢率的影响
考察不同发酵时间对芽孢率和芽孢数的影响,结果见图2。
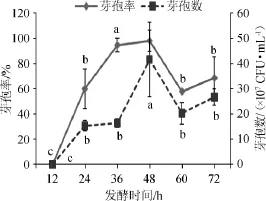
图2 不同发酵时间对芽孢率和芽孢数的影响Fig.2 Effect of different fermentation time on sporulation rate and spores number
由图2中可知,发酵时间为36 h和48 h时的芽孢率无显著差异(P>0.05);当发酵时间为48 h时,芽孢率和芽孢数最高,与36 h的芽孢数存在显著差异(P<0.05)。综合芽孢率和芽孢数,最终确定最佳发酵时间为48 h。
2.3 发酵温度对芽孢数及芽孢率的影响
考察不同发醇温度对芽孢率和芽孢数的影响,结果见图3。
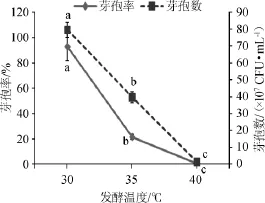
图3 不同发酵温度对芽孢率和芽孢数的影响Fig.3 Effect of different fermentation temperature on sporulation rate and spores number
由图3可知,3个温度水平条件下的芽孢率存在显著差异(P<0.05),其中发酵温度为30℃时,芽孢率最佳。随着发酵温度升高,芽孢率显著降低(P<0.05)。发酵温度对芽孢数的影响与对芽孢率的影响相似,都呈负相关关系,当发酵温度为30℃时芽孢数最佳,40℃时最差,且具有统计学意义(P<0.05)。综合芽孢率和芽孢数,最终确定发酵温度为30℃。2.4接种量对芽孢数及芽孢率的影响
考察不同接种量对芽孢率和芽孢数的影响,结果见图4。
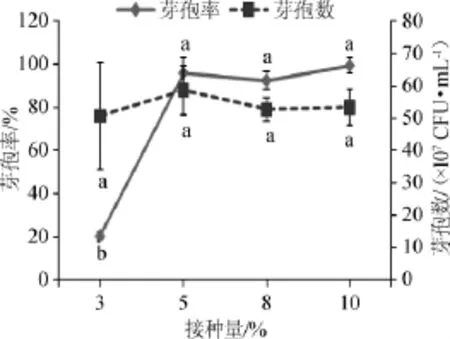
图4 不同接种量对芽孢率和芽孢数的影响Fig.4 Effect of different inoculum on sporulation rate and spores number
由图4可知,接种量为3%与5%、8%、10%的芽孢率有着显著差异(P<0.05),而接种量为5%、8%、10%时,则没有显著差异(P>0.05)。不同的接种量间芽孢数无显著差异(P>0.05)。综合芽孢率和芽孢数,当接种量为5%时,芽孢率和芽孢数均最高。故最佳接种量为5%。
2.5 磷酸氢二钾质量浓度对芽孢数及芽孢率的影响
考察不同磷酸氢二钾质量浓度对芽孢率和芽孢数的影响,结果见图5。
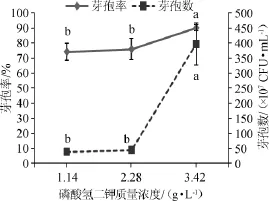
图5 不同磷酸氢二钾质量浓度对芽孢率和芽孢数的影响Fig.5 Effect of different dipotassium phosphate concentration on sporulation rate and spores number
由图5可知,在磷酸氢二钾的三个质量浓度中,3.42 g/L与1.14 g/L、2.28 g/L之间存在显著差异(P<0.05),当磷酸氢二钾质量浓度为3.42 g/L时芽孢率和芽孢数均最高,其芽孢数达3.97×109CFU/mL。李忠等[18]在对枯草芽孢杆菌生防菌产孢条件的优化实验中也使用了相似的磷酸氢二钾质量浓度(3 g/L)。因此,综合芽孢率和芽孢数,确定最佳磷酸氢二钾质量浓度为3.42 g/L。
2.6 硫酸镁质量浓度对芽孢数及芽孢率的影响
考察不同硫酸镁质量浓度对芽孢率和芽孢数的影响,结果见图6。
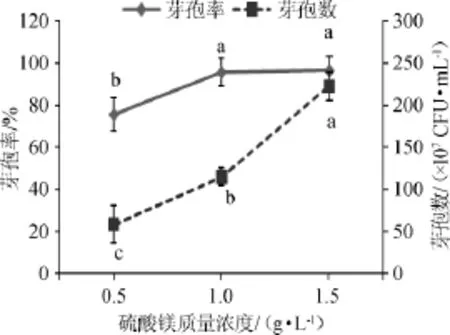
图6 不同硫酸镁质量浓度对芽孢率和芽孢数的影响Fig.6 Effect of different magnesium sulfate concentration on sporulation rate and spores number
由图6可知,当硫酸镁质量浓度为1.5 g/L时,芽孢率最佳;当硫酸镁质量浓度为1.0 g/L和1.5 g/L时,没有显著差异(P>0.05),但芽孢率显著高于0.5 g/L时(P<0.05)。从芽孢数来看,硫酸镁的3种质量浓度之间存在显著差异(P<0.05),当硫酸镁质量浓度为1.5 g/L时芽孢数最佳,达2.23×109CFU/mL。王金玲等[19]在对胶质芽孢杆菌产孢培养基的优化得到相似的硫酸镁质量浓度(1.2g/L)。因此,综合芽孢率和芽孢数,最终确定最佳硫酸镁质量浓度为1.5g/L。
3 结论
通过温度对地衣芽孢杆菌BL-5的影响研究得出无芽孢菌体的致死温度为75℃,以此作为芽孢数和芽孢率实验温度选择的依据。以芽孢率和芽孢数为评价指标,得到地衣芽孢杆菌BL-5芽孢生成的最佳培养基配方为蔗糖29.85 g/L、硫酸铵10.00 g/L、酵母膏3.00 g/L、磷酸氢二钾3.42 g/L、硫酸镁1.5 g/L、pH 8.0。最佳培养条件为接种量5%、发酵时间48 h,发酵温度30℃、转速150 r/min。
[1]应璐,周慧杰,蒋慧.骆驼刺源产乳酸的地衣芽孢杆菌分离鉴定和菌株特性研究[J].中国酿造,2014,33(10):14-17.
[2]RANJIT K N,RAMAN R P,JADHAO S B,et al.Effect of dietary supplementation ofBacillus licheniformison gut microbiota,growth and immune response in giant freshwater prawn,Macrobrachium rosenbergii (de Man,1879)[J].Aquac Int,2013,21(2):387-403.
[3]DE BOER A S,PRIEST F,DIDERICHSEN B.On the industrial use of Bacillus licheniformis:a review[J].Appl Microbiol Biotechnol,1994, 40(5):595-598.
[4]李情敏,何名芳,张凤英,等.枯草芽孢杆菌液态发酵的研究[J].中国酿造,2016,35(2):43-47.
[5]ROZSM,MANCZINGERL,VÁGVÖLGYIC,etal.Secretionofatrypsinlike thiol protease by a new keratinolytic strain ofBacillus licheniformis [J].FEMS Microbiol Lett,2001,205(2):221-224.
[6]于寒松,辛迎雪,张杰,等.发酵饲料用微生物的分离与鉴定[J].中国酿造,2015,34(3):58-61.
[7]ZHANG C N,LI X F,XU W N,et al.Combined effects of dietary fructooligosaccharide andBacillus licheniformison growth performance, body composition,intestinal enzymes activities and gut histology of triangular bream(Megalobrama terminalis)[J].Aquac Nutr,2015,21(5): 755-766.
[8]CHEN X M,LU H M,NIU X T,et al.Enhancement of secondary metabolites fromBacillus licheniformisXY-52 on immune response and expression of some immune-related genes in common carp,Cyprinus carpio[J].Fish Shellfish Immunol,2015,45(1):124-131.
[9]周振峰.地衣芽孢杆菌制剂对泌乳奶牛生产性能与健康状况的影响[D].杨凌:西北农林科技大学,2006.
[10]VINOJ G,VASEEHARAN B,THOMAS S,et al.Quorum-quenching activity of the AHL-lactonase fromBacillus licheniformisDAHB1 inhibitsVibrio biofilmformationin vitroand reduces shrimp intestinal colonisationandmortality[J].Marine Biotechnol,2014,16(6):707-715.
[11]ROY J K,MUKHERJEE A K.Applications of a high maltose forming, thermo-stable α-amylase from an extremely alkalophilicBacillus licheniformisstrain AS08E in food and laundry detergent industries[J]. Biochem Eng J,2013,77:220-230.
[12]REHMAN H U,AMAN A,ZOHRA R R,et al.Immobilization of pectin degrading enzyme fromBacillus licheniformisKIBGE IB-21 using agaragar as a support[J].Carbohyd Poly,2014,102:622-626.
[13]赵晓燕,吴晓青,赵忠娟,等.菌株TLB15发酵培养基的优化及其发酵液的杀虫活性[J].福建农业学报,2014,29(7):669-672.
[14]解顺昌,刘扬科,胡国春,等.地衣芽孢杆菌YTDY_01高产芽孢的培养基优化[J].生物技术世界,2015(10):1-3.
[15]陈文莹,张莉力,黄涛.地衣芽孢杆菌BL-5的发酵条件优化研究[J].饲料研究,2015(21):46-51.
[16]徐蓉,葛平,陈蓉,等.3种不同方法检测艰难梭菌芽孢率的比较[J].检验医学,2015,30(2):201-202.
[17]付小猛.枯草芽孢杆菌CCAM080032的益生特性及高密度固态发酵工艺的研究[D].武汉:华中农业大学,2011.
[18]李忠,乐峰松,殷红福,等.枯草芽孢杆菌生防菌产孢条件的优化[J].安徽农业科学,2013,41(5):1937-1938.
[19]王金玲,赵凤艳,吕长山,等.胶质芽孢杆菌液体发酵产孢培养基的优化[J].食品与生物技术学报,2013,32(4):417-424.
Optimization of sporulation conditions ofBacillus licheniformisBL-5
CHEN Wenying1,2,XU Yunhe2,SHEN Xiaoli1,XIAO Haidi2,WANG Linfeng2,HUANG Tao2,ZHANG Lili2*
(1.School of Public Health,Zunyi Medical University,Zunyi 563000,China;2.College of Food Science and Engineering, Jinzhou Medical University,Jinzhou 121001,China)
Bacillus licheniformis,as micro-ecological agent,has broad application prospects in food and feed industry.The effect of temperature on B.licheniformisBL-5 lethality was studied.The results showed that lethal temperature of spore-free bacteria was 75℃.According to the sporulation rate and spores number,the optimal medium formula for the sporulation rate ofB.licheniformisBL-5 was as follows:sucrose 29.85 g/L,ammonium sulphate 10.00 g/L,yeast extract 3.00 g/L,dipotassium phosphate 3.42 g/L,magnesium sulfate 1.5 g/L,pH 8.0.The optimal culture conditions were as follows:inoculum 5%,fermentation time 48 h,fermentation temperature 30℃,and rotation speed 150 r/min.
Bacillus licheniformisBL-5;sporulation rate;spores number
S816
0254-5071(2017)04-0063-04
10.11882/j.issn.0254-5071.2017.04.014
2016-11-11
辽宁省自然科学基金项目(2014022046);国家自然科学基金项目(31301499);遵义医学院博士学位授权支撑学科建设经费
陈文莹(1989-),女,硕士研究生,研究方向为微生物。
*通讯作者:张莉力(1977-),女,副教授,博士,研究方向为微生物。

