葡萄灰霉病生防菌株的筛选及其拮抗机理初探
罗琳,王其慧,赵海霞,张殿朋,刘娅*
(1.石河子大学食品学院,新疆石河子832000;2.新疆巴音郭勒蒙古自治州产品质量检验所,新疆库尔勒841100;3.北京市农林科学院植保所,北京100097)
葡萄灰霉病生防菌株的筛选及其拮抗机理初探
罗琳1,王其慧1,赵海霞2,张殿朋3,刘娅1*
(1.石河子大学食品学院,新疆石河子832000;2.新疆巴音郭勒蒙古自治州产品质量检验所,新疆库尔勒841100;3.北京市农林科学院植保所,北京100097)
以新疆哈密瓜、蟠桃及红枣中分离出的59株内生细菌为出发菌株,采用离体实验和活体实验,从中筛选出11株对葡萄灰霉菌具有较好抑制作用的菌株;经低温作用、农药耐受性及致病菌广谱性等复筛实验,从红枣中获得1株性能优良的目标菌株T2,该菌在0℃条件下对葡萄灰霉菌的抑菌率可达58.43%,农药耐受性达68.2%~98.4%,对致病菌具有广谱抗性,其中桃褐腐病菌和草莓灰霉菌的病原菌菌落直径均小于30 mm,葡萄炭疽菌病原菌菌落直径小于50 mm。经过形态、生理生化和16S rDNA同源性分析,确定菌株T2为解淀粉芽孢杆菌(Bacillus amyloliquefaciens),该菌主要依靠菌体本身和重寄生作用对葡萄灰霉菌发挥拮抗作用。
葡萄灰霉病;生物防治;内生菌;筛选;拮抗机理
葡萄灰霉病(graymold)是由灰葡萄孢(Botrytiscinerea)侵染引发的一类葡萄病害[1],果实采后因贮藏条件相对湿度较大、温度适宜,易大面积发病,导致每年葡萄采后的腐烂损失率高达30%[2]。二氧化硫、硫化物等化学保鲜剂和吡咯类[3]、甲氧基丙烯酸酯类[4]等化学杀菌剂[5]都是在生产上常用的防治采后灰霉病害的方法,但其使用中产生的病原菌抗药性、化学试剂残留、环境污染问题日益突出。因此,有必要寻找更安全、环保、有效的葡萄病害防治方法。
已有研究表明,许多细菌具有防治灰霉病的效果,如枯草芽孢杆菌(Bacillus subtilis)、短体芽孢杆菌(Bacillus pumilus)、多粘芽孢杆菌(Bacillus polymyxa)、假单孢菌(Pseudomonassp.)、地衣芽孢杆菌(Bacillus licheni formis)、荧光假单孢菌(Pseudomona fluorescens)、嗜麦芽黄单孢菌(Xanthomonas maltophilia)等,可使番茄、葡萄、辣椒、草莓、苹果等多种植物免受灰霉病的侵害,拮抗菌的抑制率高达80%以上[6-9]。现今内生拮抗菌已成为植物病害防治中重要的生防因子,有很大的发展潜力。研究表明,内生菌长期存活于宿主植物体内,与其协同进化,宿主植物为其提供所需的营养和能量,其又可借助信号传导作用或通过自身代谢产物对宿主植物产生影响[10-11]。目前人们已从水稻、辣椒、马铃薯葡萄等多种植物中分离筛选出对青枯病、白粉病、灰霉病等常见病害具有良好抑制作用的内生菌株[12-15]。
鉴于拮抗细菌具有种类多,繁殖速度快,作用方式广等优势,加之源自果蔬中的内生细菌具有很高的安全性,因此本研究以哈密瓜、蟠桃及红枣中分离的内生菌为出发菌株,从中筛选对葡萄灰霉病具有较好防效的生防细菌,对于拓宽葡萄灰霉病生防菌种来源,提高生防菌种安全性具有重要理论意义和实际研究价值。
1 材料与方法
1.1 材料与试剂
1.1.1 原材料
葡萄:购自新疆石河子143团,具体品种包括红提,维多利亚和巨峰,要求颗粒饱满、成熟度一致、无病虫害。
1.1.2 供试菌种
供试出发菌株:实验室自主分离的59株植物内生细菌,其中23株源自新疆哈密瓜,23株源自新疆蟠桃,13株源自新疆红枣。
供试植物病原菌:葡萄灰霉菌(grapeBotrytis cinerea),草莓灰霉菌(strawberryBotrytis cinerea),葡萄炭疽菌(Colletotrichum gloeosporioides),桃褐腐病菌(Monilinia laxa),均由北京市农林科学院提供。
1.1.3 化学试剂
琼脂、牛肉膏、蛋白胨(均为生化试剂):北京奥博星生物技术有限责任公司;次氯酸钠、氯化钠、葡萄糖、无水乙醇(均为分析纯):天津盛奥化学试剂有限公司。
1.1.4 培养基
营养琼脂(nutrient agar,NA)培养基:蛋白胨10 g,牛肉膏3 g,氯化钠5 g,琼脂15 g,pH 7.2,蒸馏水1 000 mL。
马铃薯葡萄糖琼脂(potatodextroseagar,PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂15 g,蒸馏水1 000 mL。
马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基:马铃薯200 g,葡萄糖20 g,蒸馏水1 000 mL。
1.2 仪器与设备
X-700型TOMY快速自动高压灭菌仪:南京非同科学仪器有限公司;LHR-100型低温培养箱:上海一恒科学仪器有限公司;QHR-98A型全温度振荡培养箱:太仓市华美生化仪器厂;LGJ-1型真空冷冻干燥机:北京亚泰隆仪器技术有限公司;G560E型通用漩涡混匀器:北京科技有限公司;OLRMPUS CX41型显微镜:北京悦驰恒业仪器科技有限公司。
1.3 方法
1.3.1 离体实验(in vitro)
采用平板对峙法[16],同时以单独接种灰霉菌菌饼的平板为对照,25℃培养7 d,测定菌落直径[17],用抑菌带宽表示病菌菌丝边缘到细菌菌落边缘的距离。每个处理重复3次。
1.3.2 活体实验(in vivo)
将葡萄果粒表面洗净晾干,放入体积分数2%的次氯酸钠溶液浸泡2 min,用无菌水冲洗2遍,常温下自然晾干,随机分组,每组40粒果实。使用灭菌打孔器在葡萄果实中间部位打一直径3 mm、深4 mm的孔,形成一个伤口。将离体实验中表现较好的拮抗细菌制成菌悬液(108CFU/mL),分别接入不同组葡萄的伤口中,每孔注入20μL,以接入20μL无菌水作为对照组,放置2 h自然晾干后再各接入20 μL病原菌孢子悬浮液(106CFU/mL),放置2 h自然晾干后置于25℃条件下贮藏。5 d后观察发病面积大小,使用游标卡尺测量病变直径,并按不同发病等级进行记录[18]。使用已经证实了的1到4级评定进行评估。1级为0%,表示没有可见的发病症状;2级表示发病面积占0~35%(不包括0%);3级表示发病面积约占35%~65%;4级表示发病面积约占65%~100%[19]。每组实验做3组平行实验,记录平均病情级数。并计算病情指数及相对防效。
病情指数及防治效果的计算公式如下:

1.3.3 低温生长实验
将供试葡萄灰霉菌菌饼(直径6 mm)接于PDA平板中央,用接种环在培养的拮抗菌平板上挑取一环菌,在PDA平板上距葡萄灰霉菌饼中心3 cm的两侧划线,置于0℃培养7 d,测量葡萄灰霉菌落直径,每个处理做3次重复。同时以放置在常温25℃条件下进行相同处理的平板为对照。
1.3.4 农药耐受性实验
选取常见残存于鲜食葡萄中的代森锰锌、甲霜灵、腐霉利、氯氰菊酯4种农药,以国家标准GB 2763—2014《食品中农药最大残留限量》对4种农药的最大残留量要求(用量依次为5mg/kg,1mg/kg,5mg/kg和0.2mg/kg)添加到初筛的拮抗菌菌液中,170r/min振荡培养48h,以无农药组作为对照,测定波长600 nm处的菌株OD600nm值,每种农药做3个重复。
1.3.5 广谱抗性实验
采用平板对峙法,测试初步筛选出的细菌对草莓灰霉菌、葡萄炭疽菌、桃褐腐病菌三种病原真菌菌丝生长的拮抗作用。同时以单独接种病原菌菌饼的平板为对照,置于25℃培养7 d,观察抑制效果,每个处理做3次重复[20]。
1.3.6 目标菌株T2的鉴定
形态观察:将T2菌株在NA培养基上划线,28℃培养24 h,观察菌落形态[21]。挑取菌株进行革兰氏染色,并用显微镜于高倍镜下观察菌体形态。
1.3.7 分子生物学鉴定
采用聚合酶链式反应(polymerase chain reaction,PCR)法对T2菌株的16S rDNA片段进行扩增。PCR反应体系为:模板10×PCRbuffer5μL、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)(2.5 mmol/L)4 μL、模板2 μL、TapDNA聚合酶1μL、引物各1μL,补充去离子水至50μL。反应条件为:95℃5 min;95℃30 s,48℃30 s,72℃1 min,40个循环;72℃10 min[22]。PCR产物用1%凝胶电泳进行分析后送往北京市理化分析测试中心进行序列的测定。获得菌株序列后,进行BLAST比对分析,寻找具有较高同源性的16S rDNA序列。并利用MEGA4.0软件进行系统发育分析,构建系统发育树[23]。
1.3.8 T2拮抗机理抗生作用的研究
将已培养24 h的T2菌株接种于PDB液体培养基中,于28℃培养3~4 d后,以转速5 000 r/min、时间20 min的条件下进行离心分离,收集上清液待用。将分离的菌体于28℃条件下干燥,收集菌体。采用滤纸片法[24]进行拮抗离体实验,将葡萄灰霉菌菌饼(直径6 mm)放于PDA平板中央,然后在平板上接入四个沾有T2菌液的圆滤纸片,接种点距离平板中心3cm,并以沾有无菌水调配菌体的滤纸片做对比,25℃培养7 d,观察现象[25]。每个处理做3次重复。
1.3.9 拮抗细菌对葡萄灰霉菌菌丝生长的影响
采用生长速率法[26]进行检测。取菌株T2的发酵液,用无菌水分别稀释至5倍、50倍和500倍。然后每个梯度各取1 mL于平皿内,倒入9 mL融化好的无菌PDA培养基,待凝固后在平板中央接种葡萄灰霉病菌菌饼(6 mm),以加入等量无菌水的培养基作为对照,每个处理重复3次。25℃培养7d后测量菌落直径,计算不同浓度的T2发酵液对葡萄灰霉菌菌丝的生长抑制率,计算公式如下:

1.3.10 重寄生作用的观察
分别在几丁质培养基、羧甲基纤维素钠培养基和酪蛋白培养基平板上,使用滤纸片法接入待测菌株,每种培养基平板重复3次,于28℃培养箱中倒置培养。观察菌株在以上3种培养基上产生水解圈的情况,测量水解圈直径大小[27]。
将直径为6mm的葡萄灰霉菌菌饼放于PDA平板中央,然后等距离3 cm接T2菌株,置于培养箱中25℃培养7 d,挑取病菌菌落边缘的菌丝置于事先滴有无菌水的载玻片上,压片后在显微镜下观察菌丝形态。以只接灰霉病菌为对照。
1.3.11 数据统计与分析
采用Excel 2003和SPSS 18.0软件进行数据分析。
2 结果与分析
2.1 拮抗菌的筛选
经离体实验和活体实验,以抑菌带宽为评价指标,从59株新疆植物内生菌中初筛得到11株对葡萄灰霉菌具有较好抑制作用的细菌,结果见表1和表2。
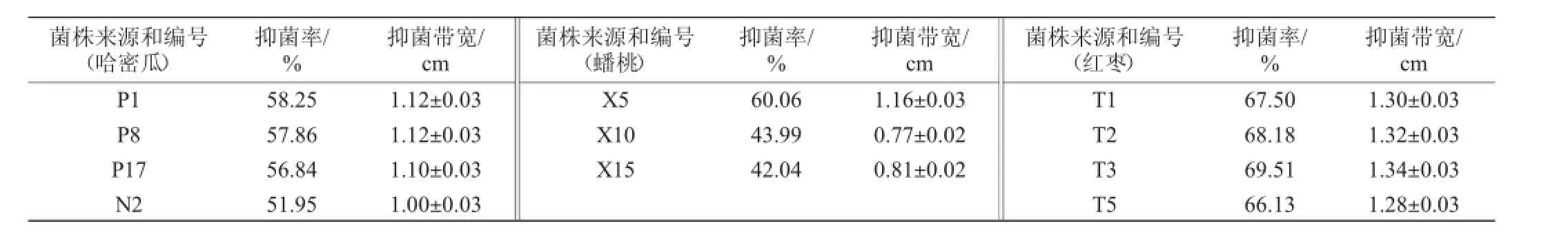
表1 内生菌的离体抑菌实验结果Table 1In vitroantibacterial experiments results of endophytic bacteria
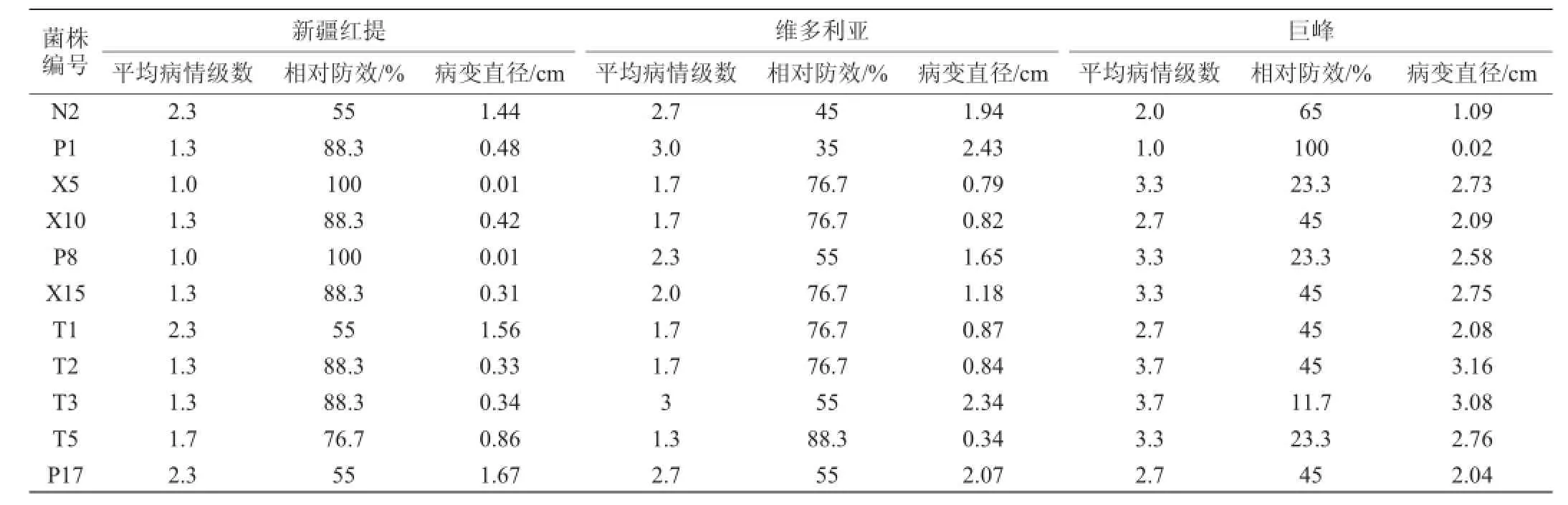
表2 内生菌对不同品种葡萄果实的拮抗作用结果Table 2 Antagonistic experiments results of endophytic bacteria on different varieties of grapes
对11株菌进行低温作用、农药耐受性及广谱抗性的考察,结果见图1、图2及表3。经复筛获得1株性能最优的目标菌株T2,该菌源自红枣,0℃下对葡萄灰霉的抑菌率达58.43%。考虑到鲜食葡萄表面残留的农药会影响菌株生长,因此希望拮抗菌对农药具有一定抗性。实验证明T2能耐受葡萄中常见的4种农药代森锰锌、甲霜灵、腐霉利、氯氰菊酯,农药耐受性达到68.2%~98.4%,说明菌株T2对农药具有较好耐受性。该菌对桃褐腐病菌、葡萄炭疽菌、草莓灰霉菌均有良好的抑制效果。
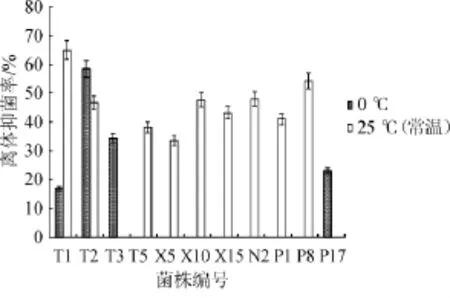
图111 株拮抗菌低温条件下的离体抑菌率Fig.1 Antibacterial rates of 11 antagonistic strains at low temperature
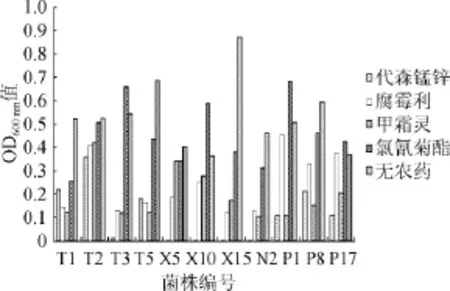
图24 种农药对11株拮抗菌生长的影响Fig.2 Effect of four pesticides on 11 antagonistic strains growth
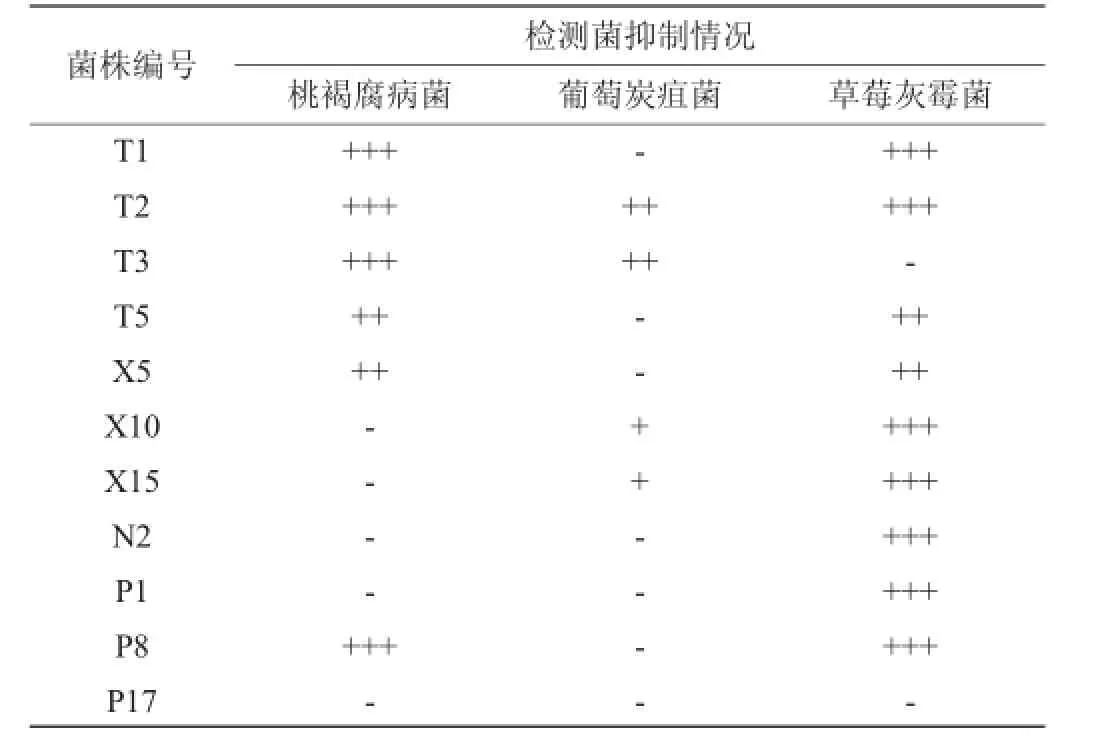
表311 株拮抗菌对多种病原菌的抑制效果分析Table 3 Effect of 11 antagonistic strains on inhibition of various pathogenic bacteria
2.2 目标菌株T2的鉴定
2.2.1 T2的形态鉴定和生理生化鉴定
观察T2在NA固体平板上的菌落形态,发现菌落为乳白色、不透明、圆形,菌落表面干燥、边缘整齐。显微镜下观察T2菌体形态,菌体呈杆状、革兰氏染色阳性,可产芽孢[28]。
菌株T2生理生化鉴定结果显示,接触酶反应、耐盐性实验(7%、17%)、pH5.7生长实验、淀粉水解实验、柠檬酸盐利用实验均呈阳性;石蕊牛奶实验结果为阴性。
2.2.2 T2的分子生物学鉴定
通过16S rDNA序列比对分析,建立系统发育树,结果见图3。结合形态、生理生化及分子生物学鉴定结果,判定该菌为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)[29]。

图3 基于16S rDNA序列构建的拮抗菌T2系统发育树Fig.3 Phylogenetic tree of strain T2 based on 16S rDNA sequences
2.3 T2拮抗葡萄灰霉机理的初探
2.3.1 抗生作用
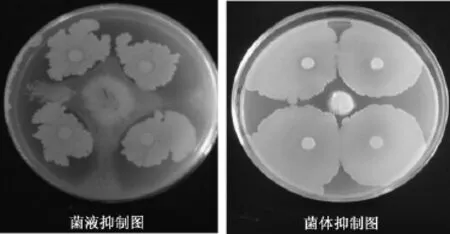
图4 分离后的菌体、菌液对葡萄灰霉的离体抑制效果Fig.4In vitroinhibition effect of cell and solution onBotrytis cinerea
自然界中大多数细菌可以产生对自身或其他微生物有抑制作用的拮抗物质。为了解目标菌株T2对葡萄灰霉的拮抗机理是否因为抗生作用,对菌株T2进行菌体及菌液分离后的离体拮抗实验,结果见图4。从图4可以明显看出,菌体和菌液对葡萄灰霉均有抑制作用,其中菌体的抑制作用大于菌液的抑制作用,可见T2菌体本身对葡萄灰霉产生主要抑制作用。
2.3.2 T2对葡萄灰霉菌菌丝生长的影响
拮抗细菌T2对葡萄灰霉菌菌丝生长的抑制作用见表4。从表4可以看出,在生长速率实验中,各浓度梯度的T2发酵液均对葡萄灰霉菌的菌丝生长有不同程度的抑制作用。其中,菌株T2发酵液原液对葡萄灰霉菌菌丝生长的抑制率高达81.9%,后随稀释倍数的增大,抑制作用逐渐减弱,但浓度稀释至500倍时仍对灰霉菌菌丝的生长有31.6%的抑制率。因此推测菌株T2在发酵培养过程中,可能产生了能抑制葡萄灰霉病菌生长的抑菌物质。
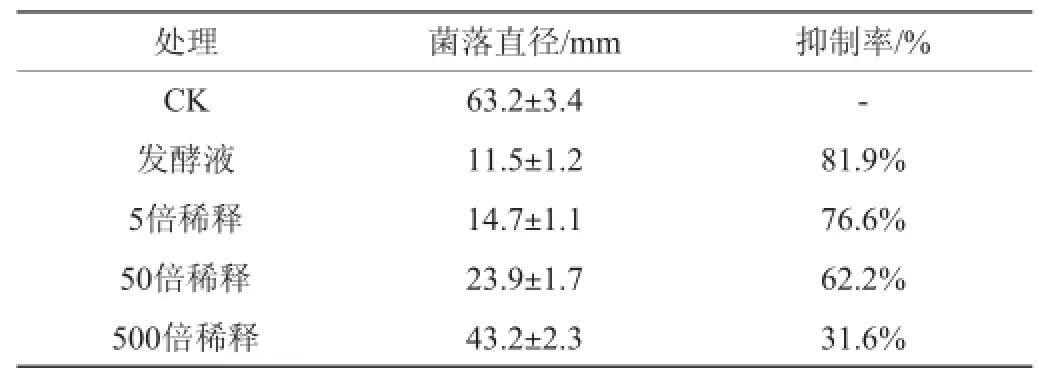
表4 拮抗细菌T2对葡萄灰霉菌菌丝生长的抑制作用Table 4 Inhibitory effect of antagonistic strain T2 on mycelium growth ofBotrytis cinerea
2.3.3 重寄生作用的观察
对菌株T2产几丁质酶、纤维素酶和蛋白酶的活性进行检测,发现几丁质培养基和酪蛋白培养基上没有出现水解圈,羧甲基纤维素钠培养基上出现了水解圈(直径为2.0 mm)。说明该菌不产生几丁质酶和蛋白酶,产生纤维素酶但活性较低。
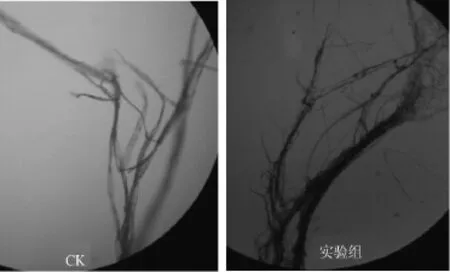
图5 拮抗菌T2对葡萄灰霉菌的重寄生作用Fig.5 Mycoparasitism effects of antagonistic bacteria T2 against Botrytis cinerea
重寄生作用实验发现,对照组葡萄灰霉菌菌落边缘圆滑而整齐,菌落边缘新生的菌丝比较稀疏,内部的菌丝生长较茂密。实验组葡萄灰霉菌菌落的边缘同对照组一样,圆滑而整齐,但菌丝的生长速度明显缓慢,生长量也明显减少,而菌落较对照组厚且密。挑取两组病原菌菌落边缘的菌丝置于显微镜下观察发现(见图5),对照组的菌丝粗细均匀、舒展而饱满,而实验组的菌丝则粗细不均匀,部分菌丝有膨大、变形甚至出现断裂的现象,发生了畸变。经推测,菌株T2可能产生具有溶菌作用的活性物质,导致了重寄生现象的发生[30]。
3 结论
本研究从红枣中分离得到的内生细菌T2,在离体实验和活体试验中均对葡萄灰霉病具有较好的防效。对低温(0℃),农药代森锰锌、甲霜灵、腐霉利和氯氰菊酯具有一定耐受性,对其他果蔬病害具有一定广谱抗性。初探其拮抗机理,发现菌株T2本身具有抗生作用,并能通过重寄生作用抑制病害的发生。菌株T2经鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。
本实验分离得到的拮抗细菌T2对葡萄灰霉病具有较好的防效,并具有广谱抗性。接下来将进一步深入探讨该菌株的拮抗机理和特性,研发与制备生防制剂,为我国鲜食葡萄及其他果蔬的采后贮藏保鲜技术提供新的可能性。
[1]周海莲.葡萄有孢汉逊酵母(Hanseniaspora uvarum)对灰霉病抑制机理的探讨[D].南京:南京农业大学,2012.
[2]熊艳.草莓灰葡萄孢拮抗菌株的筛选,鉴定及其抗菌活性物质研究[D].成都:四川师范大学,2011.
[3]CAHIL L.Evaluation of the new active fludioxinil in the product maxim 100 FS ftmgicide seed treatlnent[M].Canberra:National Registration Authority for Agricultural and Veterinary Chemicals,2004,1-3.
[4]朱华,王建菊,钱永祥,等.阿米西达防治茄子灰霉病药效试验[J].上海蔬菜,2009(1):66-67.
[5]潘东,杨红,刘贤进.葡萄中嘧菌环胺的气相色谱分析[J].江苏农业学报,2009,25(5):1199-1200.
[6]MOLINE H,HUBBARD J E,KARNS J S,et al.Selective isolation of bacterial antagonists ofBotrytis cinerea[J].Eur J Plant Pathol,2004, 28:95-101.
[7]黄晓亚,常永义,崔欣,等.拮抗菌P1,P5对葡萄灰霉病菌的抑制作用及其抗真菌谱的测定[J].植物保护,2009,35(4):134-137.
[8]王伟,李术娜,李红亚,等.番茄灰霉病拮抗细菌的筛选与X-75菌株鉴定[J].园艺学报,2010,37(2):307-312.
[9]胡朋,申琳,范蓓,等.番茄灰霉病拮抗细菌Bacillus-1的筛选和鉴定[J].食品科学,2008,29(6):276-279.
[10]郑燕玲.石斛兰(Dendrobium chrysopterum)内生菌的分离及其生物防治功能研究[D].广州:中山大学,2006.
[11]国辉,毛志泉,刘训理.植物与微生物互作的研究进展[J].中国农学通报,2011,27(9):28-33.
[12]阿里玛斯.辣椒疫病拮抗内生放线菌的筛选及其发酵培养条件研究[D].杨凌:西北农林科技大学,2007.
[13]冯金龙.马铃薯病原真菌拮抗细菌鉴定及其生物学功能研究[D].兰州:甘肃农业大学,2013.
[14]SUMARAH M W,KESTING J R,MILLER J D,et al.Antifungal metabolites from fungal endophytes ofPinus strobus[J].Phytochemistry,2011,72(14):1833-1837.
[15]田恩琴,常永义,朱建兰,等.2株拮抗菌的抑菌作用及产酶能力初探[J].甘肃农业大学学报,2011,46(6):41-45.
[16]李燕津,邱服斌,陈美娟,等.骏枣内生生防细菌的分离、筛选与鉴定[J].微生物学通报,2011,38(7):1031-1035.
[17]程凯,江欢欢,沈标,等.棉花黄萎病拮抗菌的筛选及其生物防治效果[J].植物营养与肥料学报,2011(1):166-174.
[18]PARAFATI L,VITALE A,RESTUCCIA C,et al.Biocontrol ability and action mechanism of food-isolated yeast strains againstBotrytis cinereacausingpost-harvestbunchrotoftablegrape[J].Food Microbiol, 2015,47:85-92.
[19]宋开艳,再那吉阿米尼古丽,冯宏祖.南疆葡萄采后致病菌分离鉴定及拮抗菌的筛选[J].新疆农业科学,2011,48(5):871-876.
[20]候美玲,辛媛媛,郝志敏,等.玉米内生芽胞杆菌的抗菌活性物质及其拮抗玉米大斑病菌机理的初步研究[J].农业生物技术学报,2012,20(9):1018-1027.
[21]史忠良.辣椒青枯病生防菌的分离和鉴定[J].安徽农业科学,2015, 18:128-129.
[22]刘邮洲,陈志谊,梁雪杰,等.番茄枯萎病和青枯病拮抗细菌的筛选,评价与鉴定[J].中国生物防治学报,2012,28(1):101-108.
[23]汪雪静,卜春亚,靳永胜,等.草莓根腐病菌拮抗细菌的分离与鉴定[J].园艺学报,2011,38(9):1657-1666.
[24]徐亚军,赵龙飞.野生艾蒿浸提物对大肠杆菌的抑制作用[J].江苏农业科学,2012,40(4):306-308.
[25]侯启会.向日葵菌核病根际拮抗菌的筛选,鉴定及其作用机理的初步研究[D].泰安:山东农业大学,2010.
[26]洪坚平,来航线.应用微生物学[M].北京:中国林业出版社,2011:85-87.
[27]曹明慧,冉炜,杨兴明,等.烟草黑胫病拮抗茵的筛选及其生物效应[J].土壤学报,2011,48(1):151-159.
[28]QIN X J,XIAO H M,XUE C H,et al.Biocontrol of gray mold in grapes with the yeastHanseniaspora uvarumalone and in combination with salicylic acid or sodium bicarbonate[J].Postharvest Biol Tec,2015, 100:160-167.
[29]CASTORIA R,DE CURTIS F,LIMA G,et al.β-1,3-glucanase activity of two saprophytic yeasts and possible mode of action as biocontrol agents against postharvest diseases[J].Postharvest Biol Tec,1997,12 (3):293-300.
[30]申光辉,薛泉宏,张晶,等.草莓根腐病拮抗真菌筛选鉴定及其防病促生作用[J].中国农业科学,2012,45(22):4612-4626.
Screening of bio-control strain againstBotrytis cinereaand preliminary research on its antagonistic mechanisms
LUO Lin1,WANG Qihui1,ZHAO Haixia2,ZHANG Dianpeng3,LIU Ya1*
(1.College of Food Science,Shihezi University,Shihezi 832000,China;2.Institute of Product Quality Supervision,Bayingol Mongolian Autonomous Prefecture,Kuerle 841100,China;3.Institute of Plant Protection,Beijing Academy of Agriculture and Forestry Sciences, Beijing 100097,China)
Using 59 endophytic strains isolated from Xinjiang hami melon,flat peach and red dates as test materials,byin vitroandin vivoexperiments,11 strains which had strong antagonism effects onBotrytis cinereawere screened.Through low temperature antagonism,pesticides tolerance and broad spectrum disease resistance tests,the optimal endophytic strain T2 that isolated from red date was screened.Its antibacterial rate on B.cinereawas 58.43%at 0℃and its pesticide resistance was up to 68.2%-98.4%.Besides,it proved that the endophytic bacteria had good inhibitory effects onMonilinia fructicolaand strawberryBotrytis cinerea(diameter both less than 30 mm)andColletotyichun gloesporioides(diameter less than 50 mm).After morphology identification and 16S rDNA sequence analysis,strain T2 was identified asBacillus amyloliquefaciens.The antagonistic mechanism onB.cinereawas mainly by the bacteria itself and hyperparasitism effect.
Botrytis cinerea;biological control;endophytic bacteria;screening;antagonistic mechanism
TS201.3
0254-5071(2017)04-093-06
10.11882/j.issn.0254-5071.2017.04.020
2016-11-15
兵团博士资金专项(2014BB006)
罗琳(1993-),女,硕士研究生,研究方向为食品加工与安全。
*通讯作者:刘娅(1974-),女,教授,博士,研究方向为食品生物技术。

