酶解法提取蓝莓果汁的研究
程红,隋秀芳*
(黔东南州质量技术监督检测所,贵州凯里556000)
酶解法提取蓝莓果汁的研究
程红,隋秀芳*
(黔东南州质量技术监督检测所,贵州凯里556000)
为提高蓝莓果汁的提取率和营养品质,利用酶解技术,在单因素试验的基础上进行正交试验优化酶解工艺条件,并对果汁出汁率、总可溶性固形物、花青素含量进行测定。结果表明,酶解法提取蓝莓果汁最优工艺条件为果胶酶∶纤维素酶=3∶1,酶用量0.20%,酶解时间180 min,酶解温度50℃。在此最佳酶解工艺条件下,蓝莓果汁出汁率为73.37%,总可溶性固形物含量为11.8°Bx,花青素含量为300.7 mg/kg。
蓝莓果汁;出汁率;酶解;总可溶性固形物;花青素
蓝莓(blueberry)学名越桔,属于杜鹃花科越桔属植物。蓝莓的果实中含有丰富的花色苷(花青素),主要有抗生素、抗自由基、抗视力退化、抗动脉硬化和血栓形成的作用[1]。蓝莓可100%鲜食,也可加工成果汁饮料、果酒饮品等。
由于蓝莓属于小浆果类,生长季节性强,收获期集中,采后不耐储存,故将鲜果加工成果汁是有效的解决途径之一。但由于蓝莓果实富含果胶等黏性物质,影响出汁率且易使汁液浑浊,降低果汁品质[2]。果汁提取方法报道较多,主要有冷提取法、热提取法、生物酶解法等。其中生物酶解法利用酶催化反应可有效提高果汁出汁率和澄清度[3-5]。李长春等[6-7]研究表明,补充纤维素酶以协同、促进果胶酶作用,可以显著提高水果出汁率。本研究以果胶酶纤维素酶对蓝莓果浆进行酶解,选择单因素及正交试验分析方法,研究复合酶比例、酶用量、酶解温度、酶解时间对出汁率、总可溶性固形物(totalsoluble solid,TSS)含量的影响,并测定其花青素含量,从而确定酶解法提取蓝莓果汁的适宜工艺条件,以期为蓝莓果的深加工提供基础研究。
1 材料与方法
1.1 材料与试剂
新鲜蓝莓果:产于贵州省麻江县,挑选新鲜、充分成熟、无霉变果,清洗沥干水分,聚乙烯薄膜包装后于-18℃冰柜冷冻贮藏备用。
果胶酶(酶活1000U/mg)、纤维素酶(酶活1800U/mg):郑州超凡化工有限公司;飞燕草色素(纯度≥96%)、矢车菊色素(纯度≥98%)、矮牵牛色素(纯度≥96%)、天竺葵色素(纯度≥96%)、芍药素(纯度≥98%)、锦葵色素(纯度≥96%):上海同田生物技术股份有限公司。
1.2 仪器与设备
JJ1000电子天平:美国双杰兄弟(集团)有限公司;TDL-5低速大容量离心机:上海安亭科学仪器;TU-1901型双光束紫外可见分光光度计:北京普析通用仪器有限责任公司;WAY-2S型阿贝折射仪:上海精密科学仪器有限公司;DL-360A超声波清洗器:上海之信仪器有限公司;Agilent 1260高效液相色谱(high performance liquid chromatography,HPLC)仪:美国安捷伦科技有限公司。
1.3 方法
1.3.1 生物酶解法提取蓝莓果汁工艺流程[8]
新鲜蓝莓原料→解冻→打浆→酶处理→压榨、过滤
从冰柜中取出蓝莓冻果,在冰箱4℃环境中解冻,用破碎机将蓝莓果打浆。称取100 g蓝莓果浆按照酶解条件进行酶解处理。酶解处理过程中用保鲜膜密封反应容器,防止水分蒸发;酶解后迅速用冷水降到室温。用两层纱布过滤,除掉粗纤维及果渣,取汁。以蓝莓果打浆后未加酶直接进行压榨过滤的蓝莓果汁作为对照组。
1.3.2 酶解工艺优化
(1)单因素试验
根据预试验结果,以出汁率和总可溶性固形物含量为评价指标,对影响果汁酶解效果主要因素即酶用量(0、0.05%、0.10%、0.15%、0.20%、0.25%)、复合酶比例(1∶2、1∶1、2∶1、3∶1、4∶1)、酶解时间(60min、90 min、120 min、150 min、180 min)和酶解温度(30℃、40℃、50℃、60℃、70℃)进行分析。
(2)正交试验
在单因素试验基础上,选取酶用量(A)、果胶酶与纤维素酶比例(B)、酶解时间(C)、酶解温度(D)4个影响因素,采用L9(34)正交试验设计,以出汁率和总可溶性固形物含量为考察指标,进行正交试验,因素与水平见表1。

表1 酶解工艺优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for enzymolysis process optimization
1.3.2 测定指标与方法
出汁率的计算公式如下:

总可溶性固形物含量的测定:采用阿贝折射仪。
花青素的测定采用高效液相色谱法:分别配制飞燕草色素、矢车菊色素、矮牵牛色素、天竺葵色素、芍药素和锦葵色素共6种花青素单标储备液,将单一标准储备液进行混合,用10%盐酸甲醇溶液作为溶剂,逐级稀释成0.5 mg/L、1.0 mg/L、5.0 mg/L、25.0 mg/L、50 mg/L的花青素混合标准使用液,进行高效液相色谱分析并绘制标准曲线。
称取酶解果汁和对照组(即未处理样)5.00g左右于50mL具塞比色管中,加入提取液定容,摇匀1 min后,超声提取30 min。超声提取后,于沸水浴中水解1h,取出冷却后,用提取液定容。静置,取上清液过膜待测。
高效液相色谱条件:C18色谱柱(250mm×4.6mm×5μm);流动相A为含1%甲酸水溶液,流动相B为含1%甲酸乙腈溶液;检测波长:530nm;柱温:35℃;进样量:20 μL;梯度洗脱条件参照农业行业标准NY/T2640—2014《植物源性食品中花青素的测定高效液相色谱法》。
2 结果与分析
2.1 酶解条件优化试验结果
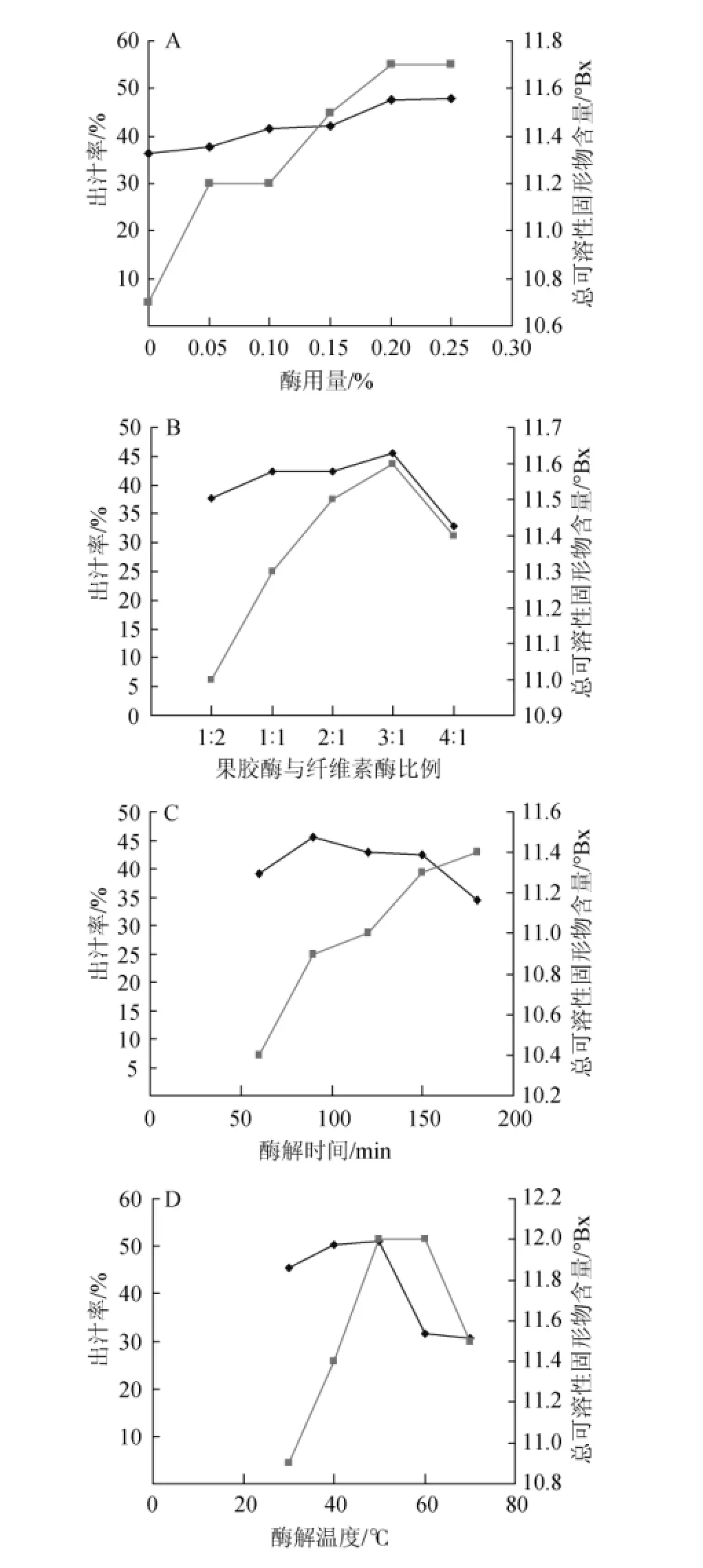
图1 酶用量(A)、果胶酶与纤维素酶比例(B)、酶解时间(C)及酶解温度(D)对蓝莓汁提取的影响Fig.1 Effects of enzyme addition(A),ratio of pectinase and cellulase(B),enzymolysis time(C)and temperature(D) on blueberry juice extraction
由图1A可知,随着酶用量的增加,出汁率、总可溶性固形物含量也随之增加。在加酶量<0.2%时,两者值增加较明显。加酶量>0.2%后,两者值增幅很小。因为在一定条件下,加酶量低于最佳值时,酶解未进行完全;达到最佳值时,酶解进行的较彻底[9-10],过多的添加酶只是加快酶解速度,不能提高产量,结合生产成本分析,选定酶用量为0.2%。
由图1B可知,当果胶酶∶纤维素酶为1∶1~3∶1时,出汁率与总可溶性固形物含量随果胶酶的增加而增大;当果胶酶∶纤维素酶为3∶1时,出汁率与总可溶性固形物含量最高;当果胶酶∶纤维素酶>3∶1之后,出汁率与总可溶性固形物含量随果胶酶的增加而下降。故选择复合酶配比3∶1为宜。
由图1C可知,当酶解时间为50~180 min时,随着酶解时间的延长,出汁率呈先增加后降低的趋势,可溶性固形物含量呈增长趋势;当酶解时间为150 min时,出汁率为42.42%,可溶性固形物含量为11.3°Bx。考虑果汁长时间在较高温度下处理会导致出汁率降低,营养流失,故选择酶解时间为150 min。
由图1D可知,当酶解温度为30~50℃时,随着酶解温度的升高,出汁率、总可溶性固形物含量也随之增加;当酶解温度达到50℃时,出汁率、总可溶性固形物含量达到最大值;当酶解温度>50℃,出汁率反而下降,总可溶性固形物含量在酶解温度>60℃以后也下降。分析原因,果汁长时间在较高温度下,水分蒸发快,导致出汁率下降;过高的温度会使果胶酶纤维素酶失活,影响酶解效率;高温会分解果汁中碳水化合物,导致可溶性固形物含量下降[11-13]。故酶解温度选择50℃为宜。
2.2 正交试验结果及方差分析
在单因素试验基础上,选取酶用量(A)、果胶酶:纤维素酶(B)、酶解时间(C)、酶解温度(D)4个影响因素,以出汁率和总可溶性固形物含量为考察指标,正交试验结果与分析见表2,方差分析见表3。
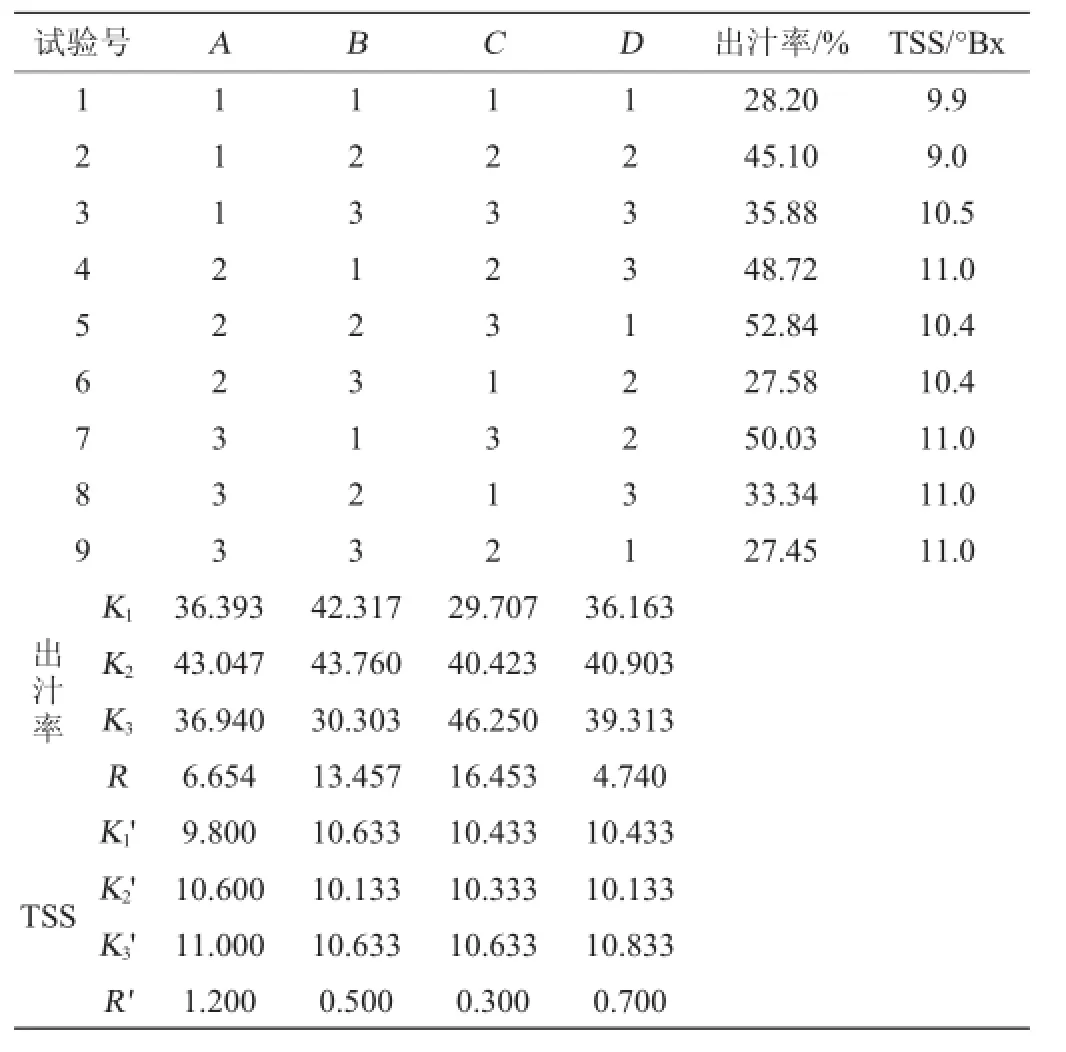
表2 酶解工艺优化正交试验结果与分析Table 2 Results and analysis of orthogonal experiments for enzymolysis process optimization
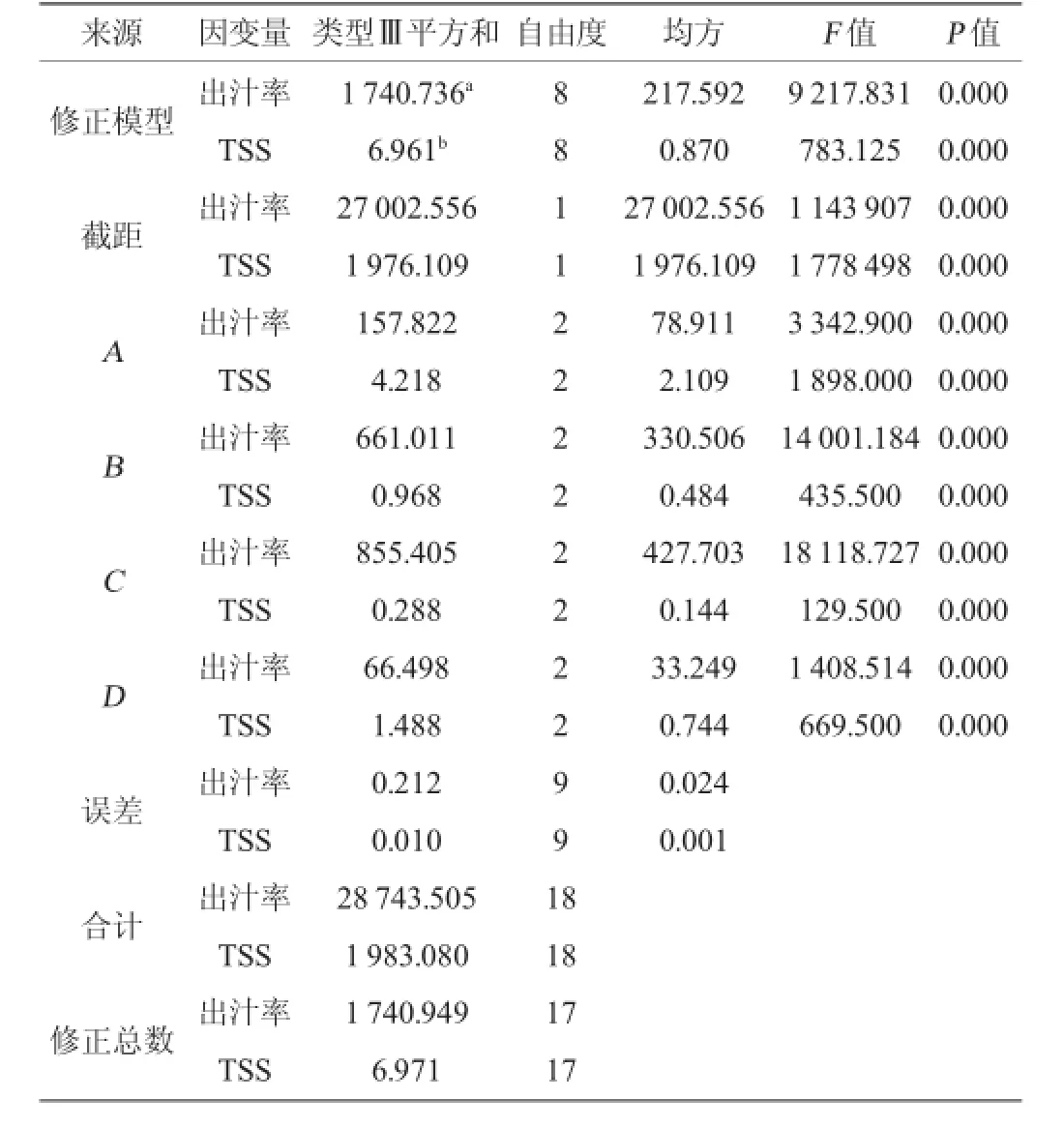
表3 正交试验结果方差分析Table 3 Variance analysis of orthogonal experiments results
由表2可知,以出汁率为评价指标,4个因素的影响程度顺序为C>B>A>D,即对出汁率影响最大的是酶解时间,依次是果胶酶∶纤维素酶、酶用量、酶解温度,最佳组合为A2B2C3D2。以总可溶性固形物含量为评价指标,4个因素的影响程度顺序为A>D>B>C,即对总可溶性固形物含量影响最大的是酶用量,其次是酶解温度、果胶酶∶纤维素酶、酶解时间,最佳组合为A3B1C3D3。按照两组最佳组合分别进行3组验证试验,出汁率分别为69.77%和73.37%,总可溶性固形物含量分别为11.7°Bx和11.8°Bx。综合考虑,最佳组合为A2B2C3D2,即酶用量0.2%,果胶酶∶纤维素酶为3∶1,酶解时间180 min,酶解温度50℃。
由表3可知,修正模型的P<0.05,说明正交试验方差分析模型是适用的,酶用量、果胶酶:纤维素酶、酶解时间、酶解温度对出汁率和总可溶性固形物含量的影响达到极显著水平(P<0.01)。
2.3 花青素含量测定结果
按照最优组合,即酶用量0.2%,果胶酶∶纤维素酶为3∶1,酶解时间150 min,酶解温度55℃处理蓝莓,得到酶解果汁,同对照组分别进行花青素含量分析,标准溶液、对照品及样品高效液相色谱图结果见图2~图4。
由图2可知,6种花青素标准品分离效果较好,出峰时间分别为:飞燕草色素8.941 min、矢车菊素10.497 min、矮牵牛色素13.801 min、天竺葵色素16.355 min、芍药素16.889 min、锦葵色素17.034 min。
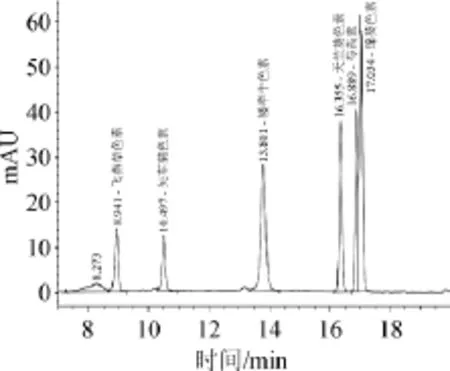
图2 花青素混合标准溶液高效液相色谱图Fig.2 HPLC chromatogram of anthocyanidins mixed standard solution
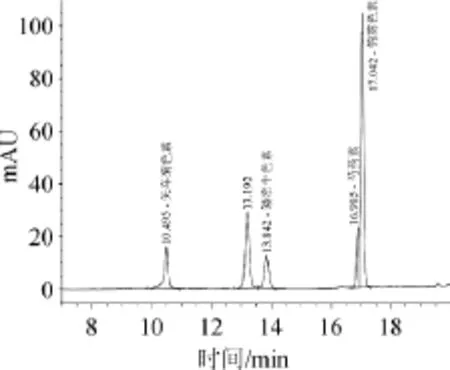
图3 对照组花青素高效液相色谱图Fig.3 HPLC chromatogram of anthocyanidins control group
由图3可知,根据标准品保留时间定性,对照组含有矢车菊素(10.495 min)、矮牵牛色素(13.842 min)、芍药素(16.905 min)和锦葵色素(17.042 min)。飞燕草色素和天竺葵色素均未检出。
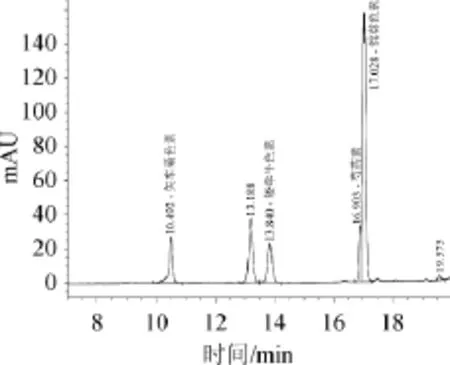
图4 酶解蓝莓果汁花青素高效液相色谱图Fig.4 HPLC chromatogram of anthocyanidins in enzymolysis blueberry juice
由图4可知,根据标准品保留时间定性,酶解蓝莓果汁中含有矢车菊素(10.492 min)、矮牵牛色素(13.840 min)、芍药素(16.903 min)和锦葵色素(17.028 min)。飞燕草色素和天竺葵色素均未检出。
此外,图3与图4中出峰时间在13.19 min左右所对应的化合物可能是另一种花青素,对其定性定量还有待进一步研究。李颖畅[14]研究表明蓝莓含有17种花色苷单体,包含飞燕草色素不包含天竺葵色素,不同于本实验结论。原因在于花青素的种类与含量受蓝莓果实的品种、成熟时间等影响,存在一定的差异。各个花青素含量计算结果见表4。

表4 蓝莓汁中花青素含量测定结果Table 4 Determination results of anthocyanidins content in blueberry juicemg/kg
由表4可知,酶解果汁各个花青素含量均高于对照组。根据花青素含量计算要求,样品中花青素含量为6种花青素含量之和,得出蓝莓果汁中花青素含量。酶解果汁花青素含量高出对照组99.3 mg/kg,提升了蓝莓果汁中花青素的含量。原因在于果胶酶和纤维素酶的加入有助于蓝莓果皮细胞壁的分解,使得果皮中花色苷等物质溶于果汁中,经水解形成花青素[15-17]。
3 结论
通过单因素试验和正交试验探讨了复合酶比例、酶用量、酶解时间和酶解温度对蓝莓果汁出汁率和总可溶性固形物含量的影响,优化出最佳酶解工艺为果胶酶:纤维素酶=3∶1,酶用量0.20%,酶解时间180 min,酶解温度50℃。按照最佳酶解工艺参数制得蓝莓果汁出汁率为73.37%,总可溶性固形物含量为11.8°Bx。
对酶解前后蓝莓果汁进行花青素含量分析得出,蓝莓果汁中含有矢车菊素、矮牵牛色素、芍药素和锦葵色素,飞燕草色素和天竺葵色素均未检出;酶解后蓝莓果汁花青素含量300.7 mg/kg,高于对照组中花青素含量201.4 mg/kg。
结果说明酶解法提取蓝莓果汁不仅能显著提高出汁率,而且可以进一步提升果汁营养价值,适宜在实际生产中推广应用。
[1]胡雅馨,李京,惠伯梩.蓝莓果实中主要营养及花青素成分的研究[J].食品科学,2006,27(10):600-603.
[2]林慧,王维民.酶处理对菠萝果汁提取率的影响研究[J].农产品加工:创新版,2009(4):40-42.
[3]SREEKANTIAH K R,JALEEL S A,RAO T N R.Utilization of fungal enzyme in the liquefaction of soft fruits extraction and clarification of fruit juice[J].J Food Sci Technol,1971,8(4):201-203.
[4]JOSHI V K,CHAHAN S K,LAL B B.Extraction of juices from peaches, plumsandapricotsbypectinolytictreatment[J].J Food Sci Technol,1991, 28(1):65-66.
[5]KAURS,SARKARBC,SHARMA H K,et al.Optimization of enzymatichydrolysis pretreatment conditions for enhanced juice recovery from guava fruit using response surface methodology[J].Food Bioprocess Technol,2009,2(1):96-100.
[6]李长春,王捷,张久红,等.复合酶对沙棘果汁出汁率的影响[J].国际沙棘研究与开发,2006,4(4):8-11,16.
[7]杨建军,马齐,宋宏新.复合酶在苹果汁加工中的应用研究[J].食品科技,2005(3):76-78.
[8]刘刚,马岩,孟宪军,等.响应面法优化酶法提取蓝莓果汁工艺条件[J].食品科学,2013,34(14):68-72.
[9]李亚东,张志东,吴林.蓝莓果实的成分及保健机能[J].中国食物与营养,2002(1):27-28
[10]李丽敏,吴林.蓝莓深加工的研究进展[J].中国农机化学报,2014,35(4):174-179.
[11]叶春苗.蓝莓深加工技术研究进展[J].农业科技与装备,2015(10):63-64.
[12]陈祖满,江凯.果肉型低糖蓝莓果酱加工工艺研究[J].中国酿造,2014,33(6):164-167.
[13]刘华戎,谷大海.蓝莓果汁饮料加工工艺研究[J].农产品加工,2012(8):76-81.
[14]李颖畅.蓝莓花色苷提取纯化及生理功能研究[D].沈阳:沈阳农业大学,2008.
[15]毕金峰,魏宝东.酶法提取树莓汁的研究[J].食品科学,2002,23(12):83-85.
[16]CARNEIRO L,IRALLA D,SANTOS S A.Cold sterilization and clarification of pineapple juice by tangential microfiltration[J].Desalination, 2002,148(1):93-98.
[17]李金星,胡志和,马立志,等.蓝莓加工过程中出汁率及花青素的稳定性[J].食品科学,2014,35(2):120-125.
Research on the extraction of blueberry juice by enzymolysis method
CHENG Hong,SUI Xiufang*
(Institute of Quality and Technology Supervision of Qiandongnan,Kaili 556000,China)
In order to improve the extraction rate and nutritional quality of blueberry juice,using enzymatic hydrolysis technology,on the basis of single factor experiments,the enzymolysis conditions were optimized by orthogonal experiments,and the juice yield,total soluble solid(TSS)and anthocyanidins content were determinated.The results showed that the optimum enzymolysis extraction process conditions of blueberry juice were pectinase∶cellulase 3∶1,enzyme addition 0.20%,enzymolysis time 180 min,temperature 50℃.Under the optimum extraction process conditions,the juice yield of blueberry juice was 73.37%,the contents of TSS and anthocyanidins were 11.8°Bx and 300.7 mg/kg,respectively.
blueberry juice;juice yield;enzymolysis;total soluble solid;anthocyanidins
TS264.2
0254-5071(2017)04-0153-05
10.11882/j.issn.0254-5071.2017.04.032
2016-12-12
贵州省科技厅社会发展攻关项目(黔科合SY字[2013]3115号)
程红(1968-),女,高级工程师,本科,研究方向为食品加工与安全。
*通讯作者:隋秀芳(1987-),女,工程师,硕士,研究方向为食品加工与安全。

