替莫唑胺联合全脑放疗治疗肺癌脑转移的疗效评价
赵蕾+孙萍

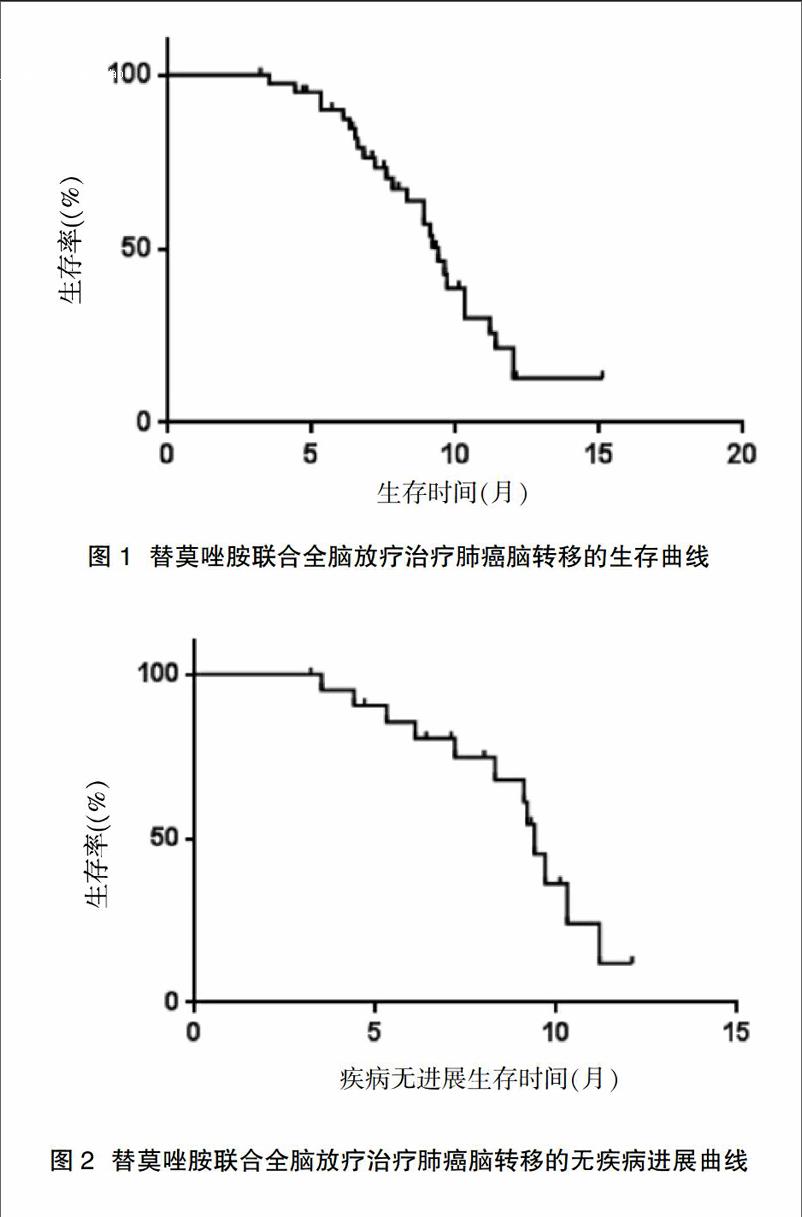

[摘要] 目的 观察替莫唑胺联合全脑放疗治疗肺癌脑转移的临床疗效、不良反应及生存时间。 方法 回顾性分析43例肺癌脑转移患者,全脑放疗采用CT模拟定位三维适形放射治疗(3D-CRT)技术,1次/d,每周5次,共2周。在给予全颅脑放疗的同时给予替莫唑胺同期化疗,150 mg/(m2·d),每周期为28 d,根据患者的耐受情况可继续口服替莫唑胺4~6周期。利用Kaplan-Meier法计算生存率。 结果 43例患者客观缓解率为79.1%(34/43),其中CR为14.0%(6/43),PR为65.1%(28/43),PD 出现9例。截止至2016年11月30日,43例患者中死亡7例,其中1例因颅内病灶进展死亡,6例因合并转移其他重要脏器衰竭死亡。全组患者随访至截止日期的生存率(OS)和无疾病进展率(PFS)分别为 49.1%和 56.9%。替莫唑胺联合全脑放疗的不良反应较轻,患者均可耐受。 结论 替莫唑胺联合全脑放疗治疗肺癌脑转移有较好的临床疗效,同时患者对治疗可耐受。
[关键词] 替莫唑胺;全脑放疗;肺癌;脑转移
[中图分类号] R734.2 [文献标识码] B [文章编号] 1673-9701(2017)07-0075-04
[Abstract] Objective To observe the clinical efficacy, adverse reactions and survival time of temozolomide combined with whole brain radiotherapy in lung cancer. Methods 43 patients with lung cancer combined with brain metastases were retrospectively analyzed. Whole-brain radiotherapy was performed by CT simulated location and three-dimensional conformal radiotherapy(3D-CRT) technique, once a day, 5 times a week for 2 weeks. During the same time of whole brain radiotherapy, temozolomide concurrent chemotherapy was given, 150 mg/(m2·d), each cycle for 28 days. According to the patient's tolerance, the temozolomide could be orally given for 4 to 6 cycles continuously. The survival rate was calculated using the Kaplan-Meier method. Results The objective remission rate was 79.1% (34/43) in 43 patients, among whom CR was14.0%(6/43), PR was 65.1%(28/43), and 9 cases showed PD. As of November 30, 2016, among the 43 patients, 7 cases were died, of whom 1 case died of progressive intracranial lesions, and 6 cases died of other important organ failure due to metastasis. The overall survival(OS) and disease-free progression rate(PFS) were 49.1% and 56.9% respectively follow up to the deadline. The adverse reactions of temozolomide combined with whole brain radiotherapy were less, and the patients were able to tolerate. Conclusion Temozolomide combined with whole brain radiotherapy has a good clinical effect in the treatment of brain metastases from lung cancer, while the patients have a good tolerability.
[Key words] Temozolomide; Whole brain rediotherapy; Lung cancer; Brain metastases
據报道,从20世纪30年代开始,肺癌的发病率急速上升,并且很快成为全世界第一位的癌症死因[1]。进入20世纪90年代后,尽管部分发达国家男性肺癌发病率缓慢下降,但是更多的发展中国家和发达国家的女性肺癌例数却每年递增。因此,肺癌的发病率仍居全世界恶性肿瘤的前列,并且肺癌发病率和死亡率均随着年龄增长而上升,一般40岁以后肺癌发病率明显上升,发病率和死亡率到75岁左右达到高峰,然后有所下降。中晚期肺癌容易转移到全身各处,而颅脑是肺癌较为常见的转移部位之一。肺癌脑转移已经严重影响患者生活质量及总生存时间,且合并脑转移的肺癌患者的5年生存率大大下降[2]。由于肺癌患者已有远处转移,没有手术机会切除肿块,因此对这类患者常常以姑息对症支持治疗为主[3,4]。全脑放疗是肺癌脑转移姑息治疗的最重要手段,全脑放疗目前已被NCCN指南列入治疗恶性肿瘤脑转移的标准治疗方式。替莫唑胺(temozolomide,TMZ)是新型的烷化剂类化疗药物,它容易透过血-脑脊液屏障,药物有效利用率较高,不良反应较小,而且服用方法简便,患者也具有良好的依从性,同时与放疗联合应用可增加放疗增敏性[5]。本研究选择2015年2月~2016年2月烟台毓璜顶医院口服替莫唑胺联合全脑放疗的43例肺癌脑转移患者进行回顾性分析,旨在观察和探讨替莫唑胺联合全脑放疗对肺癌脑转移患者的临床治疗效果、不良反应及生存曲线。
1 资料与方法
1.1 一般资料
收集我院2015年2月~2016年2月的肺癌脑转移患者共43例,均满足以下条件:(1)均有肺癌病理诊断并行颅脑增强MRI或者增强CT加以证实;(2)年龄35~72岁;(3)体力状况ECOG评分0~1分,预计生存期≥3个月;(4)患者血液学检验及心脏、肝脏等重要器官功能无明显异常。一般资料见表1。
1.2 治疗方法
放疗方法及剂量均相同,全脑放疗采用CT模拟定位三维适形放射治疗(3D-CRT)技术,1次/d,每周5次,在全脑放疗的同时给予口服替莫唑胺化疗,150 mg/(m2·d),连续口服5 d,停药23 d后再次给予替莫唑胺,每周期为28 d(要求继续替莫唑胺全身化疗的患者不再接受其他相关抗肿瘤治疗),根据患者是否可耐受的情况继续给药4~6周期。除此之外,若患者出现因脑转移瘤或全脑放疗引起头痛、头晕、恶心、呕吐等症状应及时给予地塞米松及甘露醇等脱水、降颅内压治疗。联合治疗的同时需监测血象变化,如有白细胞或血小板降低应及时给予重组人粒细胞集落因子及重组人白介素-11皮下注射行升白细胞及血小板治疗。若有胃肠道反应,如恶心、呕吐等不适,则给予止吐等缓解症状的支持治疗。
1.3 随访
后期的随访主要是通过门诊复查随访和电话随访。随访是从每例患者开始治疗的第1天起,直至随访截止日期,或患者死亡、失访。随访的截止日期为2016年11月30日。随访的间隔日期为1~3个月。失访者则按最后1次随访时间计算生存时间。
1.4 疗效评价
基线标准是每位患者治疗前1个月内的颅脑增强MRI/CT的影像学检查结果。患者在治疗期间每周均需复查1次血液学检验,包括血常规及血肝肾功检验。全部治疗结束后1个月需复查1次影像学检查,如颅脑增强MRI或者颅脑增强CT,用以评价近期治疗效果。2个月后再次复查影像学检查进行评价治疗效果,此后每3个月需要复查1次颅脑增强MRI/CT评价临床疗效。按照实体瘤的RECIST标准[6,7]评价近期治疗效果:完全缓解(Complete Remission,CR)、部分缓解(Partial Remission,PR)、稳定(Stable Diseasse,SD)和疾病进展(Progressive Disease,PD)。口服替莫唑胺期间应详细记录服用替莫唑胺出现的相关不良反应,及不良反应出现的时间和程度。不良反应则使用由美国国立卫生研究院(National Institute of Health,NIH)制订的通用不良事件术语标准4.0(Common Terminology Criteria Adverse Events Version 4.0,CTCAE v4.0)[8]进行评估是否需要调整替莫唑胺剂量。而患者的生存指标主要观察总生存率(Overall Survival rate,OS)和无进展生存率(Progression Free Survival,PFS)。
1.5 统计学方法
采用SPSS 19.0统计学软件进行统计学分析,自放疗第1日开始计算其生存时间。观察并记录所有患者的总生存时间(OS)和疾病的无进展生存时间(PFS)。用Kaplan-Meier法绘制生存曲线以描述患者的存活时间。
2 结果
2.1 随访情况
随访时间3.1~15.2个月,中位随访时间为8.2个月,其中3例失访(按最后一次随访之月计算生存时间),随访率93.02%。
2.2 近期療效
43例患者客观缓解率(CR+PR)为79.1%(34/43),其中CR为14.0%(6/43),PR为65.1%(28/43),PD为20.9%(9/43)。截止至2016年11月30日,43例患者中死亡7例,其中1例因颅内病灶进展死亡,6例因合并转移至其他重要脏器衰竭死亡。全组患者随访至截止日期的生存率(OS)和无疾病进展率(PFS)分别为 49.1%和 56.9%(图1、2)。
2.3 不良反应
口服替莫唑胺化疗期间,主要不良反应集中在血液学和胃肠道(表2)。在本组患者中,并没有观察到有关肝、肾等主要脏器的毒性反应,也没有患者因不良反应而减少替莫唑胺剂量。只有1例患者在全脑放疗期间因3级胃肠道反应中断口服替莫唑胺1 d,表明患者对替莫唑胺耐受性较好。
3 讨论
目前肺癌是威胁人类生命的恶性肿瘤之一,预后较差,较早出现远处转移,其中脑转移较为常见。虽然目前全脑放疗已作为肺癌脑转移的一线治疗措施,但是仍有一部分患者因颅内转移灶进展或者并发症发生而死亡。而且目前能够通过血脑屏障的化疗药物有限,替莫唑胺作为第二代烷化剂-咪唑四嗪类衍生物的一种新型口服药物[9],被大多数人用于治疗原发性和复发性的恶性脑胶质瘤。替莫唑胺在酸性环境下不宜分解,但它可以在生理条件下的pH值可通过一些化学反应转化为有活性的产物5-(3-甲基)-1-三氮烯-1-咪唑基-4-氨甲酰(MTIC)[10,11],它可以在肿瘤细胞分裂的各个时期发挥作用,从而烷基化肿瘤细胞,发挥它的细胞毒作用[12,13]。替莫唑胺可以通过血脑屏障,而它的口服生物利用率约100%,在中枢神经系统的药物浓度为血浆药物浓度的40%[14]。长期小剂量的替莫唑胺持续给药可以降低肿瘤细胞的耐药性。有文献报道,只有极少数的患者会在口服替莫唑胺治疗过程中出现血液学不良反应,因此在治疗过程中基本没有患者需要减少药物剂量或调整治疗时间[15]。替莫唑胺可以通过联合放疗获得增敏性,而放疗本身具有对细胞的杀伤作用,与替莫唑胺代谢产物所具有的细胞毒性可以协同治疗脑多发转移瘤。提前1~2 h口服替莫唑胺可以更大地发挥替莫唑胺的放疗增敏性,与全脑放疗协同发挥抗肿瘤作用[15]。Motomura等[16]研究证实,替莫唑胺联合精确放疗具有协同作用以及良好的耐受性。
大多数学者认为在有限的生存时间内尽可能地提高患者的生存质量、延长患者的总生存期是对中晚期恶性肿瘤患者,尤其是合并远处转移的患者来说最有益的观念[17,18]。目前颅脑多发转移瘤最主要的治疗措施之一就是全脑放疗,但在采用全脑放疗治疗脑转移瘤时,如何照射、用多大剂量照射及照射多长时间是我们临床上需要解决的主要问题。
综上所述,替莫唑胺联合全脑放疗,大部分患者耐受性良好,且颅脑相关症状得到明显缓解,替莫唑胺联合全脑治疗有明显的治疗效果。与此同时药物的不良反应也无明显增加,可显著延长患者的生命,提高患者的生存质量,该治疗方法值得我们在临床上广泛应用,减轻患者及其家属痛苦。但是本研究的病例数较少,随访时间较短,对其远期疗效及不良反应的研究还需要大样本和长时间的随访观察。
[参考文献]
[1] 钱桂生.为提高我国呼吸系统疾病的诊治水平而努力[J].中华肺部疾病杂志,2012,5(1):1-3.
[2] 钱浩.肺癌综合治疗[M].南京:江苏科学技术出版社,2008:508-512.
[3] Alberg AJ,Ford JG,Samet JM.Epidemiology of lung cancer:AG-CP evidence-based clinical practice guidelines(2nd edition)[J].Chest,2007,132(Suppl 3):29S-55S.
[4] 张海波.对转移性肺癌诊断与治疗的分析与研究[J].吉林医学,2011,32(36):7776.
[5] Balana C,Capellades J,Teixidor P,et al.Clinical course of highfrade glioma patients with a “biopsy-only” surgical apporach:A need for individuallysed treatment[J].Clin Transa Oncol,2007,9(12):797-803.
[6] Daviskas E,Anderson SD.Hyperosmolar agents and clearance of mucus in the diseased airway[J].J Aerosol Med,2006,19(1):100-109.
[7] Mandelberg A,Amirav I.Hypertonic Saline or High Volume Normal Saline for Viral Bronchiolitis:Mechanisms and Rationale[J].Pediatric Pulmonology,2010,45(1):36-40.
[8] 卜擎燕,熊寧宁,邹建东,等.ICH国际医学用语词典(MedDRA):药事管理的标准医学术语集[J].临床药理学,2008,12(5):587-590.
[9] 赵晓辉,贾漪涛,王志敏,等.血管内皮抑素联合影像引导放疗治疗非小细胞肺癌脑转移患者的效果[J].中国肿瘤生物治疗杂志,2010,17(6):661-664.
[10] 傅浩,万林林,杨灵,等.放疗联合口服替莫唑胺治疗恶性脑胶质瘤术后患者的临床疗效研究[J].中国全科医学,2011,13(14):13.
[11] 梁惠,董士丽.国内恶性脑胶质瘤术后放疗联合替莫唑胺化疗疗效与安全性的Meta分析[J].现代肿瘤医学,2010,17(12):2345-2348.
[12] Cavahere R,Wen PY,Schiff D.Novel therapies for malignant gliomas[J].Neurol Clin,2007,25(4):1141-1171.
[13] Brandes AA,Basso U,Reni M,et al.First-line chemotherapy with cisplatin plus fractionated temozolomide in recurrent glioblastoma multfforme:A phase 1I study of the Gmppe Italiano Cooperativo di Neuro-Oncologia[J].J Clin Oncol,2004,22(9):1598-1604.
[14] Stupp R ,Gander M ,Leyvraz,et al.Current and future developmengts in the use of temozolomide for thee treatment of brain tumors[J].Lancet Oncol,2001,2(9):552-560.
[15] Wen QL,Meng MB,Yang B,et al.Endostar, a recombined humanized endostatin enhances the radioresponse for human nasopharyngeal carcincma and human lung adenocarcinoma xenogrsfts inmice[J].Cancer Sci,2009,100(8):1510-1519.
[16] Motomura K,Natsume A,Kishida Y,et al.Benefits of interferon-βand temozolomide combination therapy for newly diagnosedprimary glioblastoma with the unmethylated MGMT promoter:A multicenter study[J].Cancer,2011,117(8):1721-1730.
[17] Kawabe T,Phi JH,Yamamoto M,et al.Traetment of brain metastasis from lung cancer[J].Prog Neuro Surg,2012,25:148-155.
[18] Kyritsis AP,Markoula S,Levin VA.A systematic approach to the management of patients with brain metastases of known or unknown primary site[J].Cancer Chemother Pharmacol,2012,69(1):1-13.
(收稿日期:2017-01-07)

