不同炮制时间下的西洋红参对免疫力低下小鼠免疫功能的影响
李生斌 赵 峥 万 娇 赵 惠 刘爱玲 白媛媛 刘春军
(1 榆林市星元医院中药房,榆林,719000; 2 宝鸡市中心医院药剂科,宝鸡,721008)
不同炮制时间下的西洋红参对免疫力低下小鼠免疫功能的影响
李生斌1赵 峥1万 娇1赵 惠1刘爱玲1白媛媛1刘春军2
(1 榆林市星元医院中药房,榆林,719000; 2 宝鸡市中心医院药剂科,宝鸡,721008)
目的:探讨不同炮制时间下西洋红参水提物对对免疫力低下小鼠免疫功能的影响。方法:清洁级小鼠70只,随机平均分为空白组、阳性药组、模型组、2 h炮制组、4 h炮制组、6 h炮制组及生药组,每天分别给予等量生理盐水、左旋咪唑(30 mg/kg)、2 h炮制的西洋红参水提物(200 mg/kg)、4 h炮制的西洋红参水提物(200 mg/kg)、6 h炮制的西洋红参水提物(200 mg/kg)及生药水提物(200 mg/kg)。对除空白组外小鼠采用环磷酰胺(50 mg/kg)腹腔给药诱导小鼠免疫低下模型。分别检测脾脏及胸腺指数;应用碳廓清实验、ConA与LPS诱导小鼠脾淋巴细胞增殖反应;检测各组小鼠T淋巴细胞亚群值。结果:各种炮制时间的西洋红参及生药均可不同程度的提高免疫低下小鼠的脾脏及胸腺指数、廓清指数、吞噬指数、脾淋巴细胞增殖反应、CD4+及CD8+细胞数,且可升高CD4+/CD8+细胞比值。在各炮制组中,2 h炮制的西洋红参水提物免疫调节功能优于其余炮制组及生药组。结论:不同炮制时间的西洋红参水提物对免疫力低下小鼠的免疫调节作用均不相同,其中2 h炮制时间活性最佳,值得进行深入研究。
炮制;西洋参;免疫力低下
西洋参为五加科植物西洋参(拉丁名:PanaxquinquefoliumL.)的干燥根,原产于美国北部及加拿大南部[1]。现代药学研究显示,西洋参炮制品西洋红参对于提高免疫力、抗癌、抗疲劳及抗心肌缺血等多方面均具有较好的活性,而提高免疫力活性为其最主要的应用价值之一[2]。有研究表明,炮制时间及温度的不同对于西洋红参的化学成分影响均较大,故对于该药物的药理活性亦具有一定的影响[3],而截止目前,医学界尚未对于不同的炮制时间对该药物提高免疫活性影响展开研究,对该药物的炮制及其应用等方面均造成一定的困扰。为此,本课题组通过研究不同炮制时间对西洋红参水提物治疗小鼠免疫力低下的作用,为进一步了解其使用特点提供一定的借鉴,现报道如下。
1 材料与方法
1.1 材料
1.1.1 动物 70只体质量为(18±2)g的清洁级ICR(Institute of Cancer Research)小鼠,雌雄各半,由西安交通大学实验动物中心提供,质量合格证号:SCXK(陕)2014-0219。上述小鼠于实验前适应性喂养7 d,自然光照,自由饮水及摄食,室温控制为(20±2)℃,本课题中动物的实验操作流程需严格遵循《实验动物保护条例》。
1.1.2 药物
1.1.2.1 药材选取 生药材购买于美国威斯康星州Hill Up植物药材有限公司(美国威斯康星州麦迪逊市产),该药材由西安交通大学生药学系陈虎教授鉴定为五加科植物西洋参(PanaxquinquefoliumL.)的干燥根,药材的质量符合2010版中国药典(一部)中对该药物的相关规定。
1.1.2.2 西洋红参的炮制方法 根据2010版中国药典(一部)[4]、《北京市中药饮片炮制规范》[5]中对于西洋红参的炮制方法,将购买的五年西洋参生药洗净,去除支根及须根后置于密封容器中,分别隔水蒸2 h、4 h及6 h,将上述炮制时间不同的西洋参切片(3~5 mm厚)置于-20 ℃冰箱中48 h后冷冻干燥,即分别得炮制时间为2 h、4 h及6 h的西洋红参。
1.1.2.3 西洋红参炮制品水提物的制备 参考相关文献[7]中西洋红参的提取方法,取上述炮制时间为2 h、4 h及6 h的药材与西洋参生药材,分别加入20倍体积纯水,95 ℃提取4次,2 h/次,合并提取液并减压蒸馏,浓缩即得到炮制时间为2 h、4 h及6 h的西洋红参水提物与西洋参生药材水提物浸膏,分别加水配制为相当于西洋红参1.5 g/mL的浓度的水提液。
1.1.3 试剂与仪器 环磷酰胺购自江苏恒瑞医药公司,批号:2014120836;左旋咪唑、二硝基氟苯(DNFB)及印度墨汁均购自美国SIGMA公司,批号分别为79110198、79178321和79129832;小牛血清、脂多糖(LPS)、刀豆蛋白A(ConA)及溴化-3(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑(MTT)均由武汉博士德生物科技有效公司,批号分别为2014120312、2014110923、2014100821及2015010234;RPMI 1640培养液购自美国Gibco公司,批号为8909323。
96孔细胞培养板(美国CORNING公司);Bio-Rad550型酶标仪(日本Bio-Rad公司);MODEL550型台式冷冻离心机(德国Eppendorf公司)。
1.2 方法
1.2.1 分组与给药方法 将上述小鼠随机分为空白组、阳性药组、模型组、炮制组(2 h炮制组、4 h炮制组、6 h炮制组)及生药组,共7组,每组10只。按照参考文献中北美产西洋参及其炮制品用于小鼠模型的一般剂量,确定2 h炮制组、4 h炮制组、6 h炮制组及生药组西洋参给药剂量均为150 g/kg(按生药量计算),即200 mg/kg的水提取液。
炮制组小鼠每天灌胃给予200 mg/kg西洋红参;阳性药组每天灌胃给予30 mg/kg左旋咪唑;空白组与模型组小鼠则给予等量蒸馏水。连续给药7 d,其中在给药的第3 d对正常组外的其他组别小鼠进行50 mg/kg环磷酰胺腹腔注射,1次/d,连续注射2 d。给药7 d后,脱椎处死各组小鼠,并进行下一步实验。
1.2.2 检测指标与方法
1.2.2.1 各组小鼠脏器指数的检测 如1.2.1中所述,处死小鼠后于无菌条件下取脾脏及胸腺,称湿重,检测并计算各组小鼠脾脏指数及胸腺指数,其中小鼠脾脏指数为脾脏重/体重(mg/g);胸腺指数为胸腺重/体重(mg/g)。
1.2.2.2 各组小鼠单核细胞吞噬碳粒能力的检测 如1.2.1中所述,第7天给药结束后,对每组小鼠尾静脉注射离心后的20%印度墨汁(注射剂量0.10 mL/10 g),用专用取血管在注射后0.5 min及6 min分别对各组小鼠进行眼眶后静脉取血,取血量为0.025 mL。取血后,立刻将上述静脉血吹入0.1%碳酸钠溶液2 mL中,再取0.025 mL空白组小鼠静脉血溶解于0.1%碳酸钠溶液210 mL中进行校零,检测分光光度计675 nm波长处的比色值,利用文献中公式计算小鼠吞噬指数K与吞噬系数α。
1.2.2.3 各组小鼠脾淋巴细胞增殖反应的检测 取1.2.2.1中各组小鼠部分无菌脾脏,制备细胞密度为5×106个/mL的脾细胞悬液并加入96孔板(每孔100 μL),每孔再分别加入100 μL LPS(20 mg/L)或ConA(5 mg/L),在37 ℃及5%CO2培养箱中对上述细胞培养液连续培养48 h后,每孔加入20 μL的MTT(5 g/L PBS液),继续培养5 h。利用高速离心机对其进行离心,弃去上清后以DMSO溶解,利用酶标仪检测570 nm处吸光度(A)。每组均设5个复孔,并取平均值。
1.2.2.4 各组小鼠T淋巴细胞亚群值的检测 取1.2.2.1中小鼠剩余无菌脾脏,以PBS常规制备各组脾细胞悬液,加0.84%氯化铵溶液于悬液中使红细胞裂解,调整上述悬液的细胞浓度至5×108~5×109/L,取50 μL上述悬液与1 mL PBS于离心管,利用高速离心机离心除去上清。分别取10 μL FITC-抗CD4+Ab及10 μL PE-抗CD8+Ab于离心管中,混匀后在避光条件下反应30 min,利用流式细胞仪检测其中CD4+、CD8+细胞数,并计算CD4+/CD8+。

2 结果
2.1 各组小鼠脏器指数比较情况 模型组脾脏指数及胸腺指数较空白组与阳性药组出现明显降低(P<0.01);各西洋红参炮制组及生药组脾脏指数及胸腺指数均明显高于模型组,各组相关数据分别与模型组比较,差异均具有统计学意义(P<0.05);其中在各炮制组中,2 h炮制组小鼠脾脏及胸腺指数均高于其余炮制组及生药组。见图1。

图1 各组小鼠脏器指数比较情况(***P<0.001)
2.2 各组小鼠单核细胞吞噬碳粒能力比较情况 正常组小鼠的碳廓清指数K与吞噬指数α均明显高于模型组,2组相比较,差异均具有统计学意义(P<0.05)。各西洋红参炮制组及生药组K与α均明显高于模型组(P<0.05);其中在各炮制组中,2 h炮制组小鼠碳的廓清指数与吞噬指数均高于其余炮制组及生药组。见表1。

表1 各组小鼠碳廓清指数及吞噬指数比较情况
注:各组分别与模型组相比较,*P<0.05;**P<0.01。
2.3 各组小鼠脾淋巴细胞增殖反应检测结果 模型组小鼠ConA与LPS诱导后脾淋巴细胞增殖反应明显低于正常组,2组相比较,差异均具有统计学意义(P<0.05)。各西洋红参炮制组及生药组则均可提高脾淋巴细胞增殖反应,各组分别与模型组相比较,差异均具有统计学意义(P<0.05),其中2 h炮制组小鼠脾淋巴细胞增殖情况均大于其余炮制组及生药组。见图2。

图2 各组小鼠脾淋巴细胞增殖反应检测情况(***P<0.001)
2.4 各组小鼠T淋巴细胞亚群值的检测结果 如表2所示,模型组小鼠T淋巴细胞亚群比例失调,CD4+及CD8+细胞数明显低于空白组(P<0.01);与模型组相比较,阳性药组、各西洋红参炮制组及生药组小鼠T淋巴细胞亚群值则得到明显升高,各组分别与模型组相比较,差异均具有统计学意义(P<0.05),其中2 h炮制组小鼠上述值均大于其余炮制组及生药组。见表2。
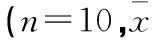
表2 各组小鼠T淋巴细胞亚群值的检测情况±s)
注:各组分别与模型组相比较,*P<0.05;**P<0.01。
3 讨论
西洋参是人参的一种,原产于美国北部及加拿大南部一带,以威斯康辛州产西洋参品质最佳,可作为保健食品服用[7]。传统中医药学认为,西洋参生药及其炮制品为凉性补益药,可用于临床阴虚内热证等疾病的治疗,其中西洋红参为应用最为广泛的一类炮制品[8]。西洋参皂苷是西洋红参中最主要的活性成分,其中以三萜类化合物居多,化学结构与人参皂苷具有一定的相似之处,可分为Ra组、Rb组和Rg组等3大类群,其中Rb组及Rg组的药理活性较强[9]。现代药学研究证实,西洋红参具有提高免疫力、保护心血管系统、增强中枢神经系统功能、促进血液活力及抗糖尿病等活性,其中西洋红参的促进免疫活性是该炮制品最为广泛的研究领域之一[10]。黄艳飞[11]等的研究结果表明,炮制时间、方法等炮制工艺的不同对西洋参中皂苷类化合物的影响均较大,尤其是能够显著影响西洋参中最主要的活性成分Rg1及Rg2的含量,故西洋参的药理活性亦能够产生明显变化,该结论与本研究中不同炮制时间的西洋红参水提物免疫调节活性之间具有差异这一结果基本一致。Mathur A[12]则从化学结构上阐述了西洋参提高免疫的物质基础,其结果发现,一系列含有过氧键的皂苷类化合物是西洋参免疫调节的重要前体活性成分,对其进行适当的高温处理,可在氧气的作用下将其过氧键破坏形成羟基,而长时间的持续高温又可将羟基氧化为较为稳定的终产物羰基皂苷;在这3种皂苷中,羟基皂苷活性最强,羰基活性次之,含有过氧键的皂苷则最弱。在本研究中,高温炮制2 h的西洋参活性最佳,随着炮制时间的延长活性逐渐降低,而所有炮制组活性均优于生药组,该结果与上述Mathur A的研究结论基本一致,但炮制时间的选择还需要通过LC-MS等方法进一步的探讨。尽管临床对西洋红参炮制的研究极为广泛,但对炮制时间影响该药物免疫活性的研究却较少涉及,本课题参考上述研究结果,比较了不同的炮制时间下的西洋红参水提物的免疫调节活性,为探讨西洋参炮制工艺提供了一定的借鉴。
胸腺及脾脏等免疫器官的脏器指数是衡量机体免疫功能情况的初步指标[13-14];而单核巨噬细胞吞噬能力则能够有效衡量机体非特异性免疫功能,其中巨噬细胞碳廓清指数与吞噬指数可有效反映内皮网状系统的吞噬功能强弱[15-16];迟发型变态反应则是一种常见的免疫反应,是通过T细胞介导的细胞免疫应答形式[17];血液中T细胞亚群数目及其比值检测则是评价体内免疫调节平衡状态的重要参数[18-19]。本研究表明,各组西洋红参水提物不仅均能明显改善由于环磷酰胺所导致的小鼠的脾和胸腺萎缩,还可调节碳廓清指数及吞噬指数,对免疫抑制小鼠网状内皮系统吞噬能力亦有一定的促进作用,而2 h炮制的西洋红参上述指标最接近空白组,提示西洋红参炮制品及生药水提物均可以增强小鼠非特异性免疫功能,其中2 h炮制的西洋红参活性最优。此外,各组西洋红参水提物还能促进小鼠低下的淋巴细胞增殖反应,提高CD4+、CD8+细胞数及CD4+/CD8+比值,且2 h炮制的西洋红参促进作用与阳性药组更接近,提示西洋红参可增强机体特异性细胞免疫功能,而2 h炮制的西洋红参的促进作用强于其余炮制组。
由于本课题的目的主要是探讨炮制时间的不同对西洋红参药理活性的影响,故在研究中仅使用单一剂量进行阐述,而给药剂量的量效关系还需要在后期研究中进行深入探讨。
综上所述,本研究发现,与生药相比较,炮制后的西洋红参水提取物对免疫力低下小鼠具有更好的免疫调节活性,且炮制时间为2 h的西洋红参活性最佳,但其具体机制还不明确,仍需要进行深入研究。
[1]国家中医药管理局《中华本草》编委会.中华本草(上册)[M].上海:上海科技出版社,2002:346-353.
[2]Liu M,Xue M,Wang XR,et al.Panax quinquefolium saponin attenuates cardiomyocyte apoptosis induced by thapsigargin through inhibition of endoplasmic reticulum stress[J].J Geriatr Cardiol,2015,12(5):540-546.
[3]Chen Y,Xu L,Zhao Y,et al.Tissue-specific metabolite profiling and quantitative analysis of ginsenosides in Panaxquinquefolium using laser microdissection and liquid chromatography-quadrupole/time of flight-mass spectrometry[J].Chem Cent J,2015,9:66.
[4]国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2010:164.
[5]北京市药品监督管理局.北京市中药饮片炮制规范(上册)[M].北京:化学工业出版社,2008:139.
[6]Wang C,Li YZ,Wang XR,et al.Panax quinquefolium saponins reduce myocardial hypoxia-reoxygenation injury by inhibiting excessive endoplasmic reticulum stress[J].Shock,2012,37(2):228-233.
[7]Bai Y,Zhao L,Qu C,et al.Microwave degradation of floatation-enriched ginsenoside extract fromPanaxquinquefoliumL.leaf[J].J Agric Food Chem,2009,57(21):10252-10260.
[8]Chen Y,Xu L,Zhao Y,et al.Tissue-specific metabolite profiling and quantitative analysis of ginsenosides in Panaxquinquefolium using laser microdissection and liquid chromatography-quadrupole/time of flight-mass spectrometry[J].Chem Cent J,2015,9:66.
[9]Guo CY,Ma XJ,Wang JS,et al.Effects of Panax quinquefolium saponin on phosphatidylinositol 3-kinase/serine threonine kinase pathway of neonatal rat myocardial cells subjected to hypoxia[J].Chin J Integr Med,2015,21(5):384-388.
[10]Li J,Ding X,Li Y,et al.Determination of ginsenosides Rg1,Re and Rb1in Panax quinquefolium by micellar electrokinetic capillary chromatography[J].Se Pu,2011,29(3):259-264.
[11]黄艳菲,孙美,许云章,等.2不同炮制方法对加拿大产西洋参中10种人参皂苷的影响[J].中国中药杂志,2014,39(20):3950-3954.
[12]Mathur A,Gangwar A,Mathur AK,et al.Growth kinetics and ginsenosides production in transformed hairy roots of American ginseng-PanaxquinquefoliumL[J].Biotechnol Lett,2010,32(3):457-461.
[13]Kashem SW,Riedl MS,Yao C,et al.Nociceptive Sensory Fibers Drive Interleukin-23 Production from CD301b+ Dermal Dendritic Cells and Drive Protective Cutaneous Immunity[J].Immunity,2015,43(3):515-526.
[14]宋媛媛,周越,孙守兵,等.丁香苷对免疫功能低下小鼠的免疫调节作用[J].中药药理与临床,2013,29(2):44-47.
[15]Roscoe C,Gilles R,Reed AJ,et al.Poliovirus immunity in newly resettled adult refugees in Idaho,United States of America.Vaccine[J].2015,33(26):2968-2970.
[16]孙燕,王冬梅.小牛脾提取物注射液对免疫功能低下小鼠的免疫调节作用[J].中国生化药物杂志,2014,2(34):58-60.
[17]Rey-Jurado E,Riedel CA,González PA,et al.Contribution of autophagy to antiviral immunity[J].FEBS Lett,2015,589(22):3461-3470.
[18]陈奇.中药药理研究方法学[M].北京:人民卫生出版社,2006:759-760.
[19]Surace L,Lysenko V,Fontana AO,et al.Complement is a central mediator of radiotherapy-induced tumor-specific immunity and clinical response[J].Immunity,2015,42(4):767-777.
(2016-04-27收稿 责任编辑:白桦)
Effects of Panax quinquefolium L.Water Extraction under Different Processed Time on Hypoimmunity in Mice
Li Shengbin1,Zhao Zheng1,Wan Jiao1,Zhao Hui1,Liu Ailing1,Bai Yuanyuan1,Liu Chunjun2
(1Departmentofpharmacy,YulinXingyuanHospital,Yulin719000,China;2Departmentofpharmacy,CentralHospitalofBaoji,Baoji721008,China)
Objective:To explore the effects ofPanaxquinquefoliumL.under different processed time on hypoimmunity in mice.Methods:Seventy KM mice,randomly divided into a blank control group and positive drug group,model group,2 h processed group,4 h processed group,6 h processed group and crude drug group,were given same amount of normal saline,levomisole (30 mg/kg),2 h extract (200 mg/kg),4 h extract (200 mg/kg),6 h extract (200 mg/kg) and crude drug extract (200 mg/kg) each day,respectively.Except the blank group,the other mice were treated by cyclophosphamide (50 mg/kg) through abdominal administration to induce low immune mice model.To detect the spleen and thymus index,indexes of the clearance rate of carbon,ConA and LPS were applicated to induce spleen lymphocyte proliferation response,testing each value of T lymphocyte subsets in mice.Results:All kinds of processing time of ginseng and crude drugs can influence the levels of spleen and thymus index,expurgation index,index,spleen lymphocyte proliferation reaction and the number of CD4+and CD8+cells,and can increase the ratio of CD4+/ CD8+cells in the lower immune mice.In each processing group,2 h group was more active than the other groups.Conclusion:Different processing time ofPanaxquinquefoliumL.water extract on hypoimmunity in mice varies in effect,in which 2 h processed time has the best activity and is worth of further research.
PanaxquinquefoliumL.; Processed; Hypoimmunity
李生斌(1975.05—),男,本科,主管中药师,研究方向:中药鉴定和炮制,E-mail:lishengbing1975@163.com
刘春军(1981.04—),男,本科,主治医师,研究方向:药物治疗内科肿瘤,E-mail:lcj-email@126.com
R283.1;R-332
A
10.3969/j.issn.1673-7202.2017.03.037

