大孔GT/PCL电纺材料作为软骨组织工程支架的可行性研究
郑 蕊 赵仕芳 朱月倩 周广东
大孔GT/PCL电纺材料作为软骨组织工程支架的可行性研究
郑 蕊 赵仕芳 朱月倩 周广东
目的探讨大孔径GT/PCL电纺材料作为软骨组织工程支架的可行性。方法取猪耳郭软骨细胞为种子细胞。大孔径GT/PCL电纺纳米材料设为实验组,无纺布GT/PCL电纺纳米材料设为对照组,对二者的形貌特征和孔隙率进行观察比较,在二维平面比较二者与软骨细胞的黏附率和细胞增殖能力,并在三维空间比较软骨细胞的浸润情况。结果扫描电镜显示,实验组材料孔径明显大于对照组,孔隙率测试数据也支持该结果;二维平面上,两组材料对软骨细胞的黏附和增殖能力无显著性差异,SEM显示实验组软骨细胞可长入材料内部;三维空间中,软骨细胞在实验组的浸润深度明显大于对照组。结论大孔GT/PCL电纺材料不影响软骨细胞的黏附与增殖,明显利于软骨细胞的长入和浸润,在软骨组织工程的应用上具有良好的前景。
大孔电纺材料软骨组织工程孔隙率
纳米纤维电纺材料作为一种新型材料,已广泛应用于多种组织工程的支架构建[1-3]。常用无纺布电纺纳米材料纤维直径小、排列密集,模仿了细胞外基质结构,有利于细胞黏附[4];但是,因其密集的纤维排列和极小的孔径,限制了细胞长入和营养渗透。
大孔径电纺纳米材料在电纺纤维的基础上,极大地扩大了材料的孔径范围,成为解决这一问题的有效途径。本研究中使用的大孔径GT/PCL电纺纳米材料,是绝缘模板静电纺制备的新型大孔径电纺材料,制作简单、图案精美、孔径范围大[5]。
为了证实这种新型大孔径电纺材料在组织工程软骨中的应用可能,我们以GT/PCL无纺布电纺膜片为对照,比较两者在软骨组织构建中的相关参数。
1 材料与方法
1.1 实验动物
新生杂交猪(上海甲干生物科技有限公司),雌雄不限,体质量2~5 Kg。实验过程均依照动物实验保护指南进行。
1.2 实验试剂和仪器
胰蛋白酶(Hyclone公司,美国);Ⅱ型胶原酶(Worthington公司,美国);高糖DMEM培养基(Gibco公司,美国);胎牛血清(Hyclone公司,美国);无纺布GT/PCL电纺膜、大孔GT/PCL电纺膜(东华大学化学化工与生物工程学院,GT∶PCL=70∶30)。
真空干燥箱(上海一恒科技有限公司,中国);扫描电子显微镜(JEOL公司,日本);荧光正置显微镜(Nikon公司,日本);酶标仪(Thermo,美国)。
1.3 细胞获取
取猪耳郭软骨,洗净,切成1 mm×1 mm×1 mm大小,加入5倍于组织体积的0.25%胶原酶,摇床消化过夜,次日,用75 μm孔径的滤网滤过后离心。细胞沉淀PBS漂洗2遍,以含10%胎牛血清(FBS)的高糖DMEM培养液配成细胞悬液,按2×106个/皿(直径10 cm培养皿)密度接种,37℃、5%CO2的培养箱培养。细胞生长达90%融合时传代[6],取第二代软骨细胞用于后续实验。
1.4 孔隙率测试
取干燥的大孔GT/PCL支架和无纺GT/PCL支架,分别设为实验组和对照组,制备成直径15 mm的小圆片,用分析天平称量得其干重(W),并用螺旋测微器测量得其厚度(T)。通过PCL和明胶在复合支架中的质量比,计算得出支架的平均密度Δ为0.7823 g/cm3,其结果由公式①计算得出;支架的表观密度Δ1(g/cm3)由公式②计算得出;支架的空隙率K(%)由公式③计算得出。
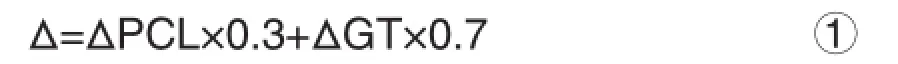
其中ΔPCL为PCL的密度1.021 g/cm3,ΔGT为明胶的密度0.68 g/cm3。

其中W为支架的干重,T为复合支架的厚度,R为支架的直径。

其中Δ1为支架的表观密度,Δ为支架的平均密度。
1.5 细胞黏附与增殖实验
细胞黏附实验:采用细胞计数的方法。在24孔板上以2.0×105个/孔的细胞密度,将软骨细胞接种于GT/PCL纳米纤维电纺膜表面,6片/组,24 h后,吸取上清,用细胞计数仪计数,每孔计数3次,根据公式计算黏附率。黏附率=(接种细胞-未黏附细胞-流失细胞)/(接种细胞-流失细胞),计算出两组GT/ PCL纳米纤维电纺膜与软骨细胞的黏附率[3]。
细胞增殖实验:采用CCK-8法,取大孔GT/PCL材料和无纺布GT/PCL材料(0.5 mm×15 mm)放入24孔板中,75%乙醇浸泡30 min,PBS冲洗3次,晾干,在其上接种软骨细胞,密度为2.0×104个/孔,选取第1、3、5、7、9、11天进行检测[7]。样本数量为6个标本/组·时间点。
1.6 扫描电镜观察
单纯材料:制备的GT/PCL大孔材料和无纺布材料放于真空干燥箱中干燥,用剪刀将其剪切成小片,导电胶固定,喷金,在10 KV的加速电压下,扫描电镜观察静电纺纳米纤维的形貌[3]。每个试样取三个平行样品。
细胞-材料复合物:消化收集软骨细胞,将直径15 mm的GT/PCL纳米纤维电纺膜放入24孔板培养皿内,以2.0×105个/孔的细胞密度接种软骨细胞,置于37℃、5%CO2培养箱培养7 d,复合物取出后2.5%戊二醛固定,扫描电镜观察。
1.7 三维细胞材料复合物构建
将大孔图案化纳米纤维膜层层叠加至0.5 mm厚度,构建出3D大孔支架;另将无纺布纳米纤维膜层层叠加至0.5 mm厚度,构建出3D无纺布支架。真空冻干消毒[2]。取软骨细胞按照50.0×106cells/mL密度接种于上述三维支架上,体外培养,24 h后取材,-80℃保存。
1.8免疫荧光检测
取细胞材料复合物,冰冻切片,DAPI染色剂染细胞核,荧光显微镜观察软骨细胞在材料中的浸润状况。
1.9 统计分析
2 结果
2.1 材料形貌观察
SEM显示实验组电纺纤维选择性沉积,在空洞部分沉积较少,形成规律的大孔结构(图1A),纤维稀疏,孔径明显变大(图1C)。对照组电纺纤维分布均匀,层层叠加(图1B、D),孔径小于10 μm。

图1 扫描电镜下不同材料的形貌特征Fig.1 SEM image showing the nanofibrous morphology of the scaffolds
2.2 孔隙率测试
纳米纤维支架的孔隙率对于营养物质的交换、废物排出,以及细胞的长入至关重要。孔隙率测试显示,大孔材料的孔隙率高于无纺布材料,两者有显著性差异(图2)。
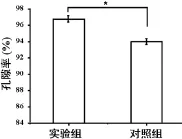
图2 不同电纺材料的孔隙率(*:P<0.05)Fig.2 The porosity of different scaffolds(*:P<0.05)
2.3 软骨细胞与材料黏附率与细胞增长曲线
细胞材料黏附率显示,实验组和对照组在软骨细胞黏附方面无明显差异(图3A)。细胞增长曲线显示,软骨细胞在两组材料上均生长良好,无明显统计学差异(图3B),这可能跟材料本身明胶含量较高,利于细胞黏附与增殖有关。
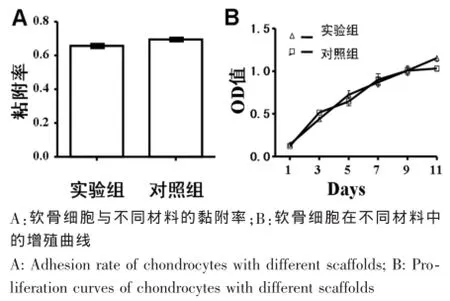
图3 软骨细胞与不同材料的黏附率和细胞增殖曲线Fig.3 Adhesion rate and proliferation curves of chondrocytes with different scaffolds
2.4 电镜下细胞材料黏附情况
软骨细胞接种于材料表面7 d后进行SEM检测,结果显示,两组材料表面细胞均伸展良好,显示出良好的细胞相容性;实验组软骨细胞明显进入大孔材料内部(图4A),而对照组细胞黏附于材料表面,无法深入内部(图4B)。
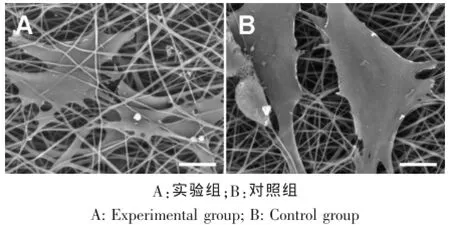
图4 扫描电镜下软骨细胞在不同材料表面生长的形貌(标尺为10 μm)Fig.4 SEM image showing the cell morphology on different scaffolds(scale bars:10 μm)
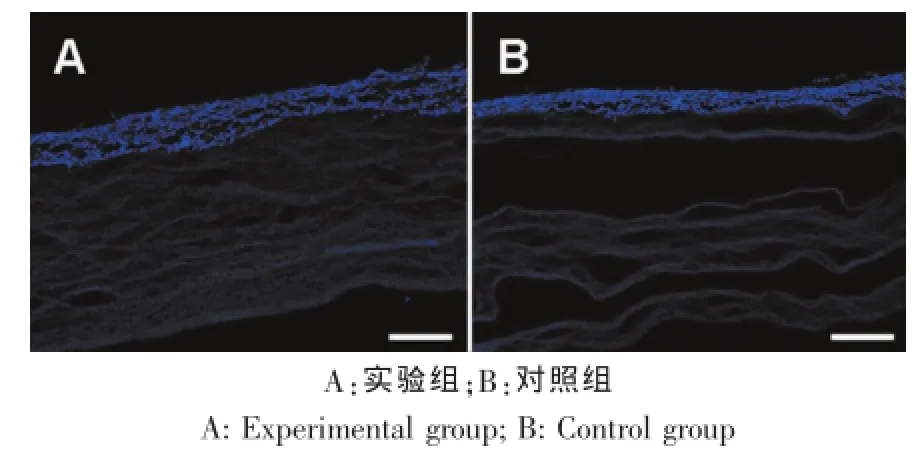
图5 细胞在不同三维支架材料中的浸润情况(标尺为100 μm)Fig.5 The cellular infiltration on the different 3D materials (scale bars:100 μm)
2.5三维支架细胞渗透情况检测
细胞材料复合物体外培养24 h后进行免疫荧光检测,结果显示,实验组软骨细胞进入三维支架的深度明显高于对照组(图5A、B),且大孔支架显示出良好的均质性。无纺布材料相对更容易分层。
3 讨论
材料的孔径大小、形态和孔隙率是组织评价组织工程支架的重要指标,在组织构建中,这些参数极大地影响细胞的黏附、伸展以及营养的渗透。
电纺纳米材料由于具有和天然基质相似的微观结构而被广泛应用于多种组织的构建,如皮肤、软骨、神经等[1-2,8]。但是,静电无纺布膜极细的纤维和较小的孔径也引发一些问题。据文献报道,只有小的纳米粒子(<300 nm)可以穿过静电纺无纺布膜,而大于1 μm的颗粒则被截留[9]。已知多数动物细胞的直径在10~100 μm。因此,传统的静电无纺布膜片极大限制了细胞的长入和营养渗透,不利于三维组织的构建。
本研究所使用的图案化大孔电纺材料很好地弥补了这一不足。近年来,多种方法被用于扩大电纺材料的孔径,如粒子致孔法、激光刻蚀法、超声法,以及多种接收装置改进的办法[10-13],但这些方法都有各自的局限,如:支架机械性能差;支架的孔径小或孔不连通;孔径过大,导致了很多细胞堆积在一个孔中,无法发挥纳米纤维优势等。本研究中所使用的绝缘模板静电纺制备的图案化材料,通过改进接收装置,发明了一种简便有效的规律性大孔纳米纤维材料制备方法[5],首次发现不导电模板也可以精确地控制纤维的沉积和图案结构的形成,填补了图案化纤维领域的空白,具有操作简便、时间短、成本低的优点。
研究结果显示,通过绝缘模板静电纺的方法制备的电纺材料孔径和孔隙率明显大于传统的电纺无纺布材料,且孔径分布规律;细胞黏附和细胞增殖曲线显示,大孔材料具有和无纺布材料类似的细胞相容性,说明孔径的增大没有影响电纺纳米材料的细胞黏附能力;且实验组软骨细胞明显长入材料内部,而对照组细胞仅黏附于材料表面,说明孔径的扩大明显利于细胞在材料中的浸润;细胞材料复合物的免疫荧光检测也显示出同样的趋势,大孔材料组的细胞长入材料的深度明显高于无纺布材料组。这些结果提示我们,无论是在平面材料还是三维材料支架中,电纺纤维孔径的扩大明显促进了软骨细胞在支架材料中的渗透。未来,我们还将对大孔材料在长时间软骨三维构建中的作用进行进一步研究。
4 结论
本研究首次对绝缘模板静电纺制备的图案化大孔材料,进行细胞和组织学检测,证实其在增加材料孔径的基础上,仍然具有良好的细胞相容性,利于软骨细胞的生长和营养渗透,具有良好的应用前景。
[1]Chong EJ,Phan TT,Lim IJ,et al.Evaluation of electrospun PCL/ gelatin nanofibrous scaffold for wound healing and layered dermal reconstitution[J].Acta Biomater,2007,3(3):321-330.
[2]Xue J,Feng B,Zheng R,et al.Engineering ear-shaped cartilage using electrospun fibrous membranes of gelatin/polycaprolactone [J].Biomaterials,2013,34(11):2624-2631.
[3]Zheng R,Duan H,Xue J,et al.The influence of Gelatin/PCL ratio and 3-D construct shape of electrospun membranes on cartilage regeneration[J].Biomaterials,2014,35(1):152-164.
[4]Zhang Y,Ouyang H,Lim CT,et al.Electrospinning of gelatin fibers and gelatin/PCL composite fibrous scaffolds[J].J Biomed Mater Res B Appl Biomater,2005,72(1):156-165.
[5]Zhao S,Zhou Q,Long YZ,et al.Nanofibrous patterns by direct electrospinning of nanofibers onto topographically structured non-conductive substrates[J].Nanoscale,2013,5(11):4993-5000.
[6]Luo X,Liu Y,Zhang Z,et al.Long-term functional reconstruction of segmental tracheal defect by pedicled tissue-engineered trachea in rabbits[J].Biomaterials,2013,34(13):3336-3344.
[7]陶然,刘浥,殷宗琦,等.利用软骨细胞膜片技术在山羊皮下构建软骨样组织的研究[J].组织工程与重建外科,2013,9(2):61-65.
[8]Pham QP,Sharma U,Mikos AG.Electrospinning of polymeric nanofibers for tissue engineering applications:a review[J].Tissue Eng,2006,12(5):1197-1211.
[9]Oh SH,Park IK,Kim JM,et al.In vitro and in vivo characteristics of PCL scaffolds with pore size gradient fabricated by a centrifugation method[J].Biomaterials,2007,28(9):1664-1671.
[10]Kim TG,Chung HJ,Park TG.Macroporous and nanofibrous hyaluronic acid/collagen hybrid scaffold fabricated by concurrent electrospinning and deposition/leaching of salt particles[J].Acta Biomater,2008,4(6):1611-1619.
[11]Sundararaghavan HG,Metter RB,Burdick JA.Electrospun fibrous scaffolds with multiscale and photopatterned porosity[J].Macromol Biosci,2010,10(3):265-270.
[12]Lee JB,Jeong SI,Bae MS,et al.Highly porous electrospun nanofibers enhanced by ultrasonication for improved cellular infiltration[J].Tissue Eng Part A,2011,17(21-22):2695-2702.
[13]Vaquette C,Cooper-White JJ.Increasing electrospun scaffold pore size with tailored collectors for improved cell penetration[J]. Acta Biomater,2011,7(6):2544-2557.
The Feasibility of the Macroporous GT/PCL Electrospun Material as Scaffold for Cartilage Tissue Engineering
ZEHNG Rui1,3,4,ZHAO Shifang2,ZHU Yueqian3,4,ZHOU Guangdong3,4.1 Department of Dermatology,Shanghai Ninth People's Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200011,China;2 College of Chemistry, Chemical Engineering&Biotechnology,Donghua University,Shanghai 201620,China;3 Shanghai Key Laboratory of Tissue Engineering,Shanghai 200011,China;4 National Tissue Engineering Center of China,Shanghai 200241,China. Corresponding author:ZHOU Guangdong(E-mail:Guangdongzhou@126.com).
ObjectiveTo investigate the feasibility of the macroporous gelatin/polycaprolactone(GT/PCL)electrospun material as scaffold for cartilage tissue engineering.MethodsThe auricular chondrocytes of porcine were harvested as seed cells.Two kinds of electrospun membrane were prepared and compared:the macroporous membranes(experimental group) and the non-woven membranes(control group)as scaffolds.The structure and porosity of the two materials were observed. Adhesion and proliferation of chondrocytes on the two membranes were examined in two-dimensional level(2D).And the depth of cellular infiltration were observed in three-dimensional level(3D).ResultsScanning electron microscope(SEM) results suggested that the pore size of the experimental group was significantly bigger than the control group,and the data of porosity supported this result.In 2D level,there was no significant difference in adhesion and proliferation of chondrocytes between the two groups.However,SEM showed that chondrocytes grew into the interior of the macroporous material.In 3D level,the infiltration depth of chondrocytes in the experimental group was significantly greater than that in the control group. ConclusionThe macroporous GT/PCL membranes do not affect the adhesion and proliferation of chondrocytes,and it is beneficial to the growth and infiltration of chondrocytes.It could be a promising scaffold for cartilage tissue engineering.
Macroporous electrospun material;Tissue engineering;Porosity
R318.08
A
1673-0364(2017)02-0066-04
2017年2月5日;
2017年3月17日)
10.3969/j.issn.1673-0364.2017.02.002
国家自然科学基金(81401532);江苏省自然科学基金(BK20160350)。
200011上海市上海交通大学医学院附属第九人民医院皮肤科(郑蕊);201620上海市东华大学化学化工与生物工程学院(赵仕芳);200011上海市上海市组织工程研究重点实验室(郑蕊,朱月倩,周广东);200241上海市组织工程国家工程中心(郑蕊,朱月倩,周广东)。
周广东(E-mail:guangdongzhou@126.com)。

