叶用莴苣热激蛋白基因LsHsp70-2711的克隆及高温胁迫下的功能分析
李雅博,李婷,韩莹琰,范双喜
(北京农学院植物科学技术学院,北京 102206)
叶用莴苣热激蛋白基因LsHsp70-2711的克隆及高温胁迫下的功能分析
李雅博,李婷,韩莹琰,范双喜
(北京农学院植物科学技术学院,北京 102206)
【目的】通过克隆Hsp70相关基因,并利用VIGS分析叶用莴苣热胁迫下Hsp70表达量和形态变化,为解析热激蛋白基因Hsp70在高温胁迫下的响应机制及分子机理奠定基础。【方法】通过同源克隆及RACE技术,获得叶用莴苣热激蛋白LsHsp70-2711的cDNA全长序列,利用实时荧光定量PCR(qRT-PCR)分析该基因在不同温度和不同高温时间下的叶用莴苣热敏品种‘P-S11’和耐热品种‘G-S59’的表达差异,确定基因和高温的相关性。根据VIGS技术,构建pTRV-LsHsp702711瞬时沉默载体,转化农杆菌GV1301,注射法侵染叶用莴苣叶片,三周后经PCR鉴定得到阳性植株。对照组和阳性组在基因表达和形态上进行对比,对照植株和阳性植株热胁迫和干旱处理后再次分析LsHsp70-2711的表达特性,观测形态变化。【结果】LsHsp70-2711 cDNA全长为2 226 bp,开放阅读框为2 154 bp,编码718个氨基酸,与拟南芥(NP_187864.1)、番茄(NP_001266213.1)、水母雪莲花(AAB99745.1)等物种的Hsp70同源性达到80%以上,证明此基因属于Hsp70家族。根据qRT-PCR结果,高温胁迫下该基因在两个品种中的表达均上调,在耐热品种中总体表达水平均高于热敏品种,耐热品种LsHsp70-2711的表达量最大值出现在42℃、60 min,37℃、60 min时热敏品种基因表达量达最大值,且在42℃高温下热敏品种‘P-S11’中基因表达随着胁迫时间的增加受到抑制,而耐热品种‘G-S59’则能长时间保持较高的表达水平,此结果和田间两品种间耐热差异表现相符合。亚细胞定位显示,LsHsp70-2711主要在细胞质中。将构建好的载体侵入叶用莴苣,鉴定后获得阳性植株。由定量PCR结果可知,未进行胁迫处理的阳性植株与对照株相比,LsHsp70-2711表达量下降,茎长明显增长。热胁迫和干旱处理后的阳性植株LsHsp70-2711表达量显著低于对照植株,高温处理对LsHsp70-2711的影响大于干旱胁迫。【结论】LsHsp70-2711属于Hsp70基因家族,其与叶用莴苣耐热性相关。研究结果为解析叶用莴苣热激蛋白LsHsp70-2711在叶用莴苣高温抽薹方面的功能提供了理论支持。
叶用莴苣;Hsp70;基因克隆;高温胁迫;基因沉默
0 引言
1 材料与方法
1.1 试验材料与试剂、菌株
从300个叶用莴苣种质资源中,大田筛选出具有典型抽薹特性的2个品种,即热敏品种‘P-S11’和耐热品种‘G-S59’。每个品种各称取1 g种子,种子24 h催芽后播种于穴盘,待幼苗长到4—5片叶时,定植后放入培养箱,培养条件:温度25℃,光照12 000 lx,光照/黑暗时间为16 h/8 h。在光照培养箱中对幼苗进行温度处理,处理温度分别为25℃(对照)、37℃、42℃,处理时间为0、15、30、60、120、180、240和300 min,取其第3、4片叶,-80℃保存备用。
总 RNA快速提取试剂盒购于艾德莱生物公司;高保真LA taq酶、克隆载体pMD19-T Vector、DH5α感受态细胞、RACE试剂盒购于宝生物工程有限公司;Xbal I酶和Kpn I酶、T4连接酶购于NEB生物公司;pTRV、GV3101农杆菌载体由北京农学院果树系惠赠。
1.2 方法
1.2.1 叶用莴苣LsHsp70-2711的克隆 在GenBank中查找与基因同源性较高、已公布植物的Hsp70保守片段,并利用 DNAMAN软件设计简并引物进行Hsp70-2711保守序列的扩增。PCR产物经1%的琼脂糖凝胶电泳分离,利用DNA凝胶回收试剂盒回收目的条带,回收产物与pMD19-T载体连接,转化DH5α大肠杆菌,阳性克隆送华大公司测序。表1 叶用莴苣LsHsp70-2711克隆、表达分析和Vigs载体构建所用引物
第一,严格教师资格和准入制度。把政治标准放在首位,突出警察学院教师既是人民教师又是人民警察的双重身份特点,对新入职的教师的师德师风进行综合考察和严格把关,不合格的坚决不允许入职。第二,建立和完善政治轮训制度。为了提升教师政治素质和培养实践能力,定期在全体教师中开展政治轮训,通过系统讲授党的最新会议精神,了解党的重大路线、方针、政策,了解党的发展历史,了解当前时事热点,从而进一步提升政治素养,坚定理想信念。第三,落实基层锻炼制度。明确教师每隔一段时间到基层一线单位参加实战锻炼,切实解决教师从校门进校门、不了解实战的问题,实现公安院校教师和实战单位民警双向交流,推动理论与实践的有机结合。
Table 1 Primers used for cloning,construction of vector and gene expression of LsHsp70-2711

1.2.2 叶用莴苣LsHsp70-2711全长的获得 测序结果于NCBI上进行比对,确定与其他植物HSP70的同源性,测序结果得到的中间片段分别设计基因5′端和3′端引物:27-5′GSP1、27-5′ GSP2和 27-3′GSP1、27-3′GSP2。引物5′端cDNA的合成和3′端cDNA的合成按照5'-Full RACE Kit和3'-Full RACE Kit试剂盒说明书进行。UPM通用引物由RACE试剂盒提供。
1.2.3 LsHsp70-2711表达分析 根据宝生物公司Real Master Mix(SYBR Green)PCR试剂盒操作步骤进行,标准品cDNA和待测样品均设置3次重复。内参及LsHsp70-2711的引物序列由Primer Premier软件设计,目的基因特异性引物:2711-Y F、2711-Y R。按照以下程序进行实时定量反应:94℃预变性2 min,94℃变性 20 s,55℃退火30 s,72℃延伸30 s,40次循环,每次循环第3步进行荧光采集,最后95℃变性1 min,退火至55℃(每隔10 s上升0.15℃)后保温1 min,接着检测其荧光值,绘制熔点曲线。对‘G-S59’和‘P-S11’两个品种不同温度、不同时间处理的叶片组织进行LsHsp70-2711实时荧光定量分析。以热敏品种‘P-S11’在25℃下的叶片表达量为1,采用2-△△Ct法计算并作图。
1.2.4 LsHsp70-2711 VIGS基因沉默体系 选取LsHsp70-2711开放阅读框中500 bp左右的片段设计引物2711-V F和2711-V R。从叶用莴苣‘P-S11’cDNA中克隆出 500 bp左右片段。将克隆得到的质粒和pTRV2空载体分别双酶切(Xbal I内切酶、Kpn I内切酶)。T4连接酶连接,转化后筛选出阳性菌落。最后双酶切鉴定,测序。将鉴定好的重组质粒转入农杆菌GV3101中,并配置侵染液。
选取长至 4片叶的‘P-S11’品种,用无菌注射器对叶片进行注射。干旱处理:将侵染第3周植株从营养土中取出,轻轻抖动根部去除土壤,在干燥的滤纸上室温静置2 h。热胁迫处理:侵染3周后,取植株在37℃下处理1 h,然后25℃正常培养。取侵染后第3周、2 h干旱处理和37℃热胁迫处理植株嫩叶的cDNA,用特异引物TRV(表1),PCR扩增,检测TRV病毒。同时用引物2711-V(表1)对叶用莴苣 LsHsp70-2711做 RT-PCR。通过软件Quantity One根据条带的明暗程度进行分析。为观察基因沉默植株形态变化,分别测量侵染 3、4周未热胁迫及热胁迫处理一周后的植株茎长。
1.3 数据处理及分析
利用Excel软件统计数据并绘制图表,SPSS进行方差分析。
2 结果
2.1 LsHsp70-2711的克隆
通过测序获得两条长度分别为822 bp和1 065 bp的中间片段,拼接后在NCBI上进行同源性比较的结果表明,与水母雪莲花、番茄、黄瓜等植物的同源性均达79%以上,初步推断所得片段属于Hsp70基因家族,拼接得到1 424 bp长度的中间片段。后再通过5'RACE和3'RACE技术获得Hsp70-2711的5'端和3'端序列,开放阅读框长度为2 154 bp,多次拼接后最终得到Hsp70-2711基因cDNA全长序列为2 226 bp,命名该基因为LsHsp70-2711。用DNAMAN软件对所得Hsp70-2711全长cDNA序列进行翻译及分析,结果表明,该基因编码一个718个氨基酸完整开放阅读框。
2.2 叶用莴苣LsHsp70-2711的蛋白质理化性质和序列分析
使用 InterProScan在线软件对基因编码的氨基酸序列进行理化性质分析。结果表明,LsHsp70-2711分子量约为79.69 kD,理论等电点是8.58,总负电荷残基数(Asp+Glu):90,总正电荷残基数(Arg+Lys):97,在氨基酸组成中所占百分比最大的是甘氨酸 Gly(G)10.3%,最小的是组氨酸 His(H)1.4%,预测半衰期2 min(Escherichia coli,in vivo)、2 min(yeast,in vivo),不稳定指数是35.72,小于40,所以属于稳定蛋白。总平均亲水性系数是-0.363,因此预测为亲水性蛋白。
2.3 LsHsp70-2711蛋白同源性分析
将所得氨基酸序列在NCBI上用BLAST在线软件进行同源性比对,LsHsp70-2711与其他几种植物的Hsp70氨基酸同源性在90%以上,进一步推测本试验所得到的基因序列属于 Hsp70基因家族。采用DNAMAN软件分别将氨基序列与其他几种植物进行多重序列比对。
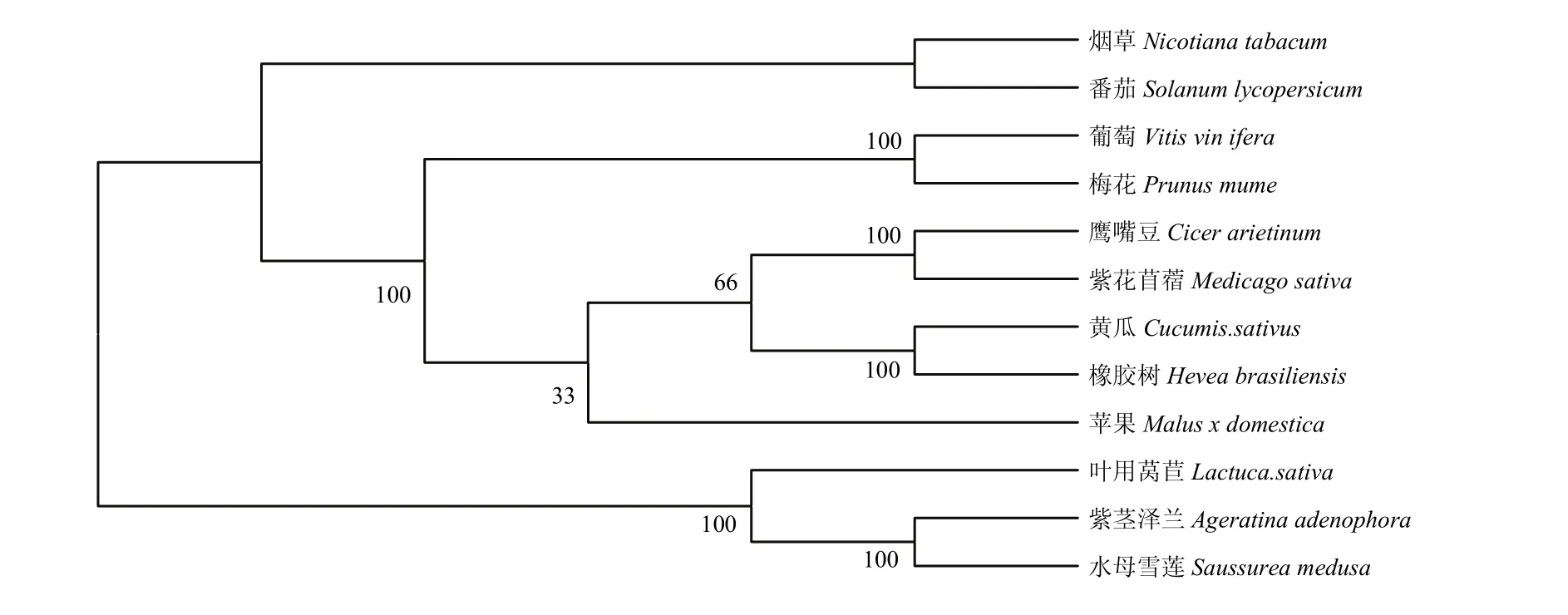
图1 叶用莴苣LsHsp70-2711与其他植物Hsp70氨基酸系统进化树Fig. 1 Phylogenetic tree of the deduced amino acid sequences of plant LsHsp70-2711
利用MEGA 5.0软件,通过NCBI的在线BLAST比对,将数据库中已近登陆的其他物种的Hsp70氨基酸序列与本研究得到的叶用莴苣的 LsHsp70-2711氨基酸序列进行系统进化树分析。结果表明,叶用莴苣与水母雪莲和紫茎泽兰属于同一分支即亲缘关系与其他植物相比更近(图1),这一结果同在NCBI的比对结果相一致。
2.4 亚细胞定位预测
通过在线软件Wolf psort对LsHsp70-2711蛋白进行亚细胞定位。结果显示:细胞质(6)、叶绿体(2)、线粒体(3)、内质网(2)。进一步利用在线预测软件 TargrtP 1.1对LsHsp70-2711 蛋白进行亚细胞定位,二者结果预测显示均主要定位在细胞质中。由此判断,LsHsp70-2711蛋白主要定位于细胞质中。
2.5 LsHsp70-2711基因的表达分析
iCycleriQTM自动测出的内参基因18S rRNA的PCR扩增效率和相关系数分别为97.8 %和0.999;LsHsp70-2711扩增效率和相关系数分别为108.1 %和0.996。经熔点曲线分析,18S rRNA 和LsHsp70-2711两个基因各自都只有一个Tm值,分别为87℃和80.5℃。

图2 LsHsp70-2711在叶用莴苣热敏品种P-S11中的表达量分析Fig. 2 Expression analysis of LsHsp70-2711 of heat-sensitive type P-S11
图2为LsHsp70-2711在叶用莴苣热敏品种‘P-S11’中的表达结果,热激处理15—300 min时,37℃处理组LsHsp70-2711的表达量是25℃的对照组的10倍以上,42℃处理组LsHsp70-2711的表达量是对照组的2倍以上;37℃热激60 min的表达量是30 min的2.1倍,是120 min的4.1倍;42℃热激15 min的表达量是热激30 min的9.8倍。分析可知,与25℃对照相比,在37℃热激胁迫15 min时,LsHsp70-2711在叶用莴苣品种‘P-S11’中的表达量迅速升高,同时随着热激处理时间的延长而表现先升高后降低的趋势;42℃热激处理在15 min时出现最大值,随后变化趋势不明显。两处理表达量均明显高于对照,说明此基因表达受高温胁迫影响。LsHsp70-2711表达量的最大值出现在37℃、60 min,说明这个基因对两个高温处理均作出响应,其中对37℃的高温胁迫更显著和更敏感。
图 3为 LsHsp70-2711在叶用莴苣耐热品种‘G-S59’中的表达结果,37℃热激下,30 min时LsHsp70-2711的表达量达到最高,是15 min的13.5倍,60 min 的 2.3倍;42℃热激下,60 min时LsHsp70-2711的表达量达到最高,是30 min的1.7倍,120 min的8倍。与对照相比,在37℃和42℃的热激处理下,LsHsp70-2711在‘G-S59’的表达趋势大致为先升高后降低,且表达量上也均明显高于对照,表达趋势与在品种‘P-S11’中的表达类似。LsHsp70-2711表达量的最大值出现在42℃、60 min。

图3 LsHsp70-2711在叶用莴苣耐热品种G-S59中的表达量分析Fig. 3 Expression analysis of LsHsp70-2711 of heat-resistant type G-S59
通过图2和图3对比发现,在‘P-S11’和‘G-S59’中最大值出现时相对应处理条件分别是 37℃的 60 min和42℃的60 min,这一结果也证明在相同时间下‘G-S59’比‘P-S11’更耐热。在‘P-S11’中 42℃处理下的表达量只在15 min、240 min、300 min时比37℃处理时稍高,其他时间下都比37℃处理时低;而在‘G-S59’中42℃处理的表达量几乎都比37℃下的处理高,说明热敏品种‘P-S11’比耐热品种‘G-S59’对高温刺激更加敏感,更易受到高温胁迫的伤害。此结果与试验过程中观察到的在相同热激处理条件下,‘P-S11’比‘G-S59’更早出现萎蔫和萎蔫程度更严重的现象相符合。表明LsHsp70-2711的表达受到高温诱导,且该基因在耐热品种中的表达高于热敏品种,据此推测LsHsp70-2711的表达与耐热性有一定的相关性。
2.6 LsHsp70-2711 VIGS基因沉默体系
2.6.1 载体构建及农杆菌转化 利用 LsHsp70-2711的特异性引物,以叶用莴苣的cDNA为模板扩增出500 bp左右的片段。测序结果与LsHsp70-2711同源性100%,扩增出的片段即为所需基因片段。将克隆获得的质粒和pTRV2空载体分别双酶切,T4连接酶连接。Xbal I和Kpn I双酶切验证,确定重组质粒中含有 LsHsp70-2711片段。将阳性质粒转入农杆菌GV3101,用LsHsp70-2711片段特异引物PCR验证,获得500 bp左右的片段,表达载体已成功转入到农杆菌GV3101中。
2.6.2 分子检测 以空白对照和侵染植株的 cDNA为模板,用TRV的特异引物进行PCR扩增。侵染植株的叶片中检测出600 bp左右的条带(图4),未侵染 TRV 病毒的植株叶片中没有检测出条带,结果表明,能检测到病毒特异性条带的植株叶片,说明TRV病毒已成功侵入植株中。
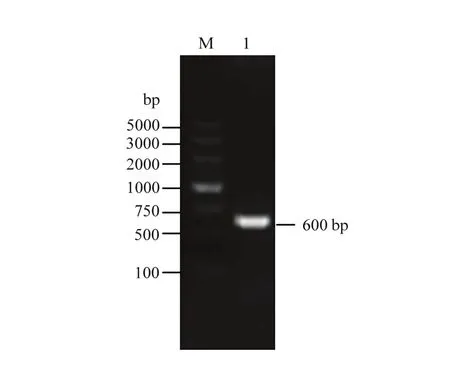
图4 叶用莴苣TRV病毒检测Fig. 4 Detection of TRV virus in lettuce
2.6.3 侵染病毒的叶用莴苣LsHsp70-2711相对表达量分析 利用RT-PCR技术对不同沉默植株LsHsp70-2711cDNA的表达水平进行相对定量分析,运用Quantity One软件,以Action为参照。结果表明,侵染 3周后的阳性植株 LsHsp70-2711表达量在mRNA水平上均有所降低。阳性植株中 LsHsp70-2711表达量和阴性对照相比较侵染后基因的相对表达量下降了60%,37℃处理1 h的阳性植株与阴性植株相比下降了48%。在2 h干旱处理的叶用莴苣LsHsp70-2711的相对表达量中,阳性植株的表达量比对照植株低33%,干旱阳性植株比未处理的阳性植株低10%。高温处理和干旱处理相比,高温处理对 LsHsp70- 2711的表达影响更明显。以上分析表明,构建的叶用莴苣 VIGS体系能有效降低LsHsp70-2711转录水平的表达量;热激处理后的植株表达量高于未处理植株,可推测LsHsp70-2711与叶用莴苣耐热性相关;干旱处理的植株表达量低于未处理植株,可见干旱对LsHsp70-2711的表达有抑制作用。
图5 侵染后叶用莴苣LsHsp70-2711相对表达量
Fig. 5 Relative expression of LsHsp70-2711 in lettuce leaves
2.6.4 侵染病毒的叶用莴苣的表型性状 从侵染第3周开始对照植株和阳性植株茎长都有显著伸长。从图6可以看出,第3周阴性对照茎长略长于空白对照,但两者间没有明显差异。阴性对照与阳性植株的茎长却有显著差异。第4周差异的显著性与第3周相似,其中第3周到第4周期间叶用莴苣的茎长有明显的伸长。侵染3周及热胁迫处理的阳性植株与对照植株茎长相比都有明显增长(图7、8)。结合处理间的数据可知,不同处理期的阳性植株茎长均显著长于对照植株,同时阳性植株LsHsp70-2711的相对表达量也明显低于对照植株。由此推测,基因沉默抑制了LsHsp70-2711的表达,使叶用莴苣茎长明显伸长,降低了叶用莴苣抵抗高温的能力,LsHsp70-2711可能在叶用莴苣耐热方面发挥重要作用。
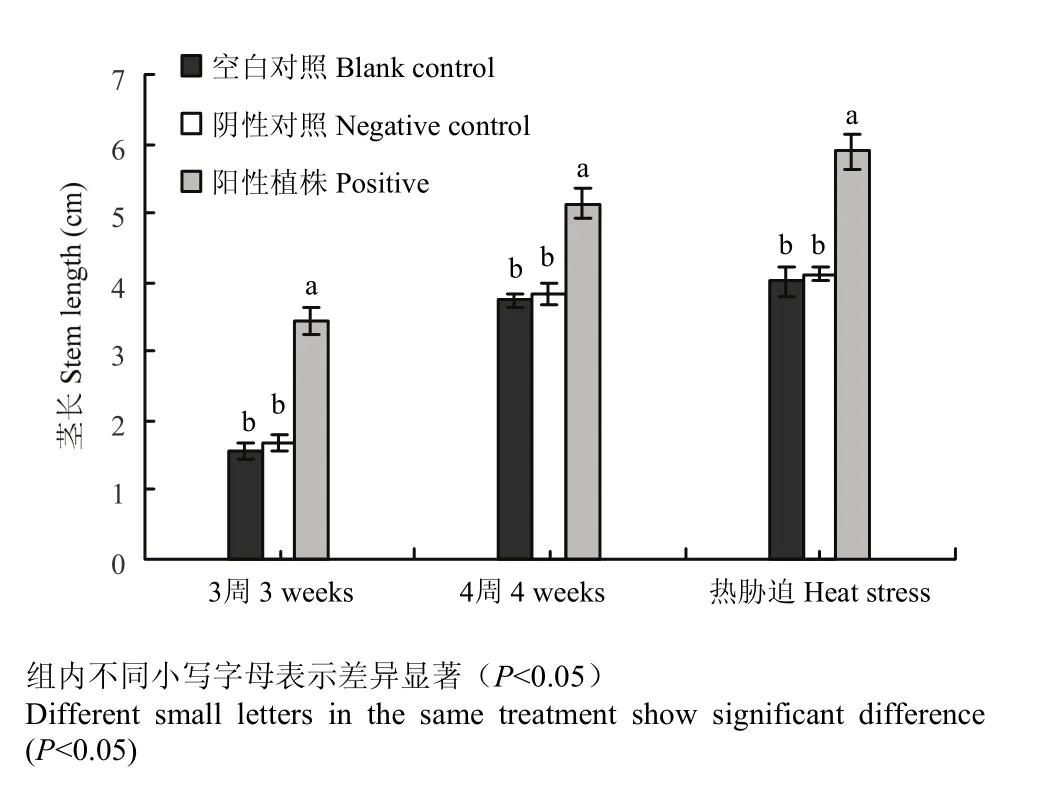
图6 侵染3、4周及热胁迫处理叶用莴苣的茎长Fig. 6 Stem length of lettuce in third, fourth week and heat stress

图7 侵染3周后茎长长度Fig. 7 Stem of the infected leaf after three weeks
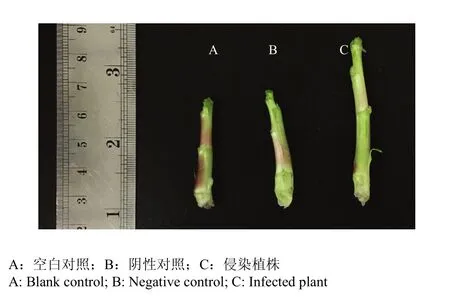
图8 热胁迫7 d后茎长长度Fig. 8 Stem of heat stress after 7 days
3 讨论
目前研究表明,植物中Hsp70基因家族成员广泛参与植物的逆境胁迫和代谢调控[27]。将本研究所得基因的氨基酸序列与其他物种Hsp70的氨基酸序列进行同源性比对分析发现同源性均在90%以上,推测本研究克隆获得的叶用莴苣基因序列属于 Hsp70基因家族。亚细胞定位预测结果显示,LsHsp70-2711蛋白主要定位于细胞质中,预测结果与卢承琼等[28]研究结果相同。
宋洪兵等[29]通过实时定量PCR表达分析表明,不结球白菜BcHSP70-1基因的表达量在不同耐热性的栽培种中有较大差异。SRIKANTHBABU等[30]研究指出,经过高温胁迫诱导的豌豆幼苗内Hsp70的mRNA量增高,而且经过直接高温胁迫后的豌豆幼苗中Hsp70转录物比经过热驯化的幼苗积累量少,且恢复生长的速度也没有经过热驯化后的幼苗快,这也说明Hsp70对提高植物的耐热性起到一定作用。此研究结果与本研究结果相似,在一定高温处理下叶用莴苣LsHsp70-2711过量表达,说明其与叶用莴苣的耐热性相关。在叶用莴苣热敏型品种‘P-S11’中,LsHsp70-2711对37℃的响应程度显著高于42℃,在耐热型品种‘G-S59’中LsHsp70-2711是对42℃时的响应程度显著高于 37℃,且耐热品种‘G-S59’比热敏品种‘P-S11’更耐高温胁迫。LsHsp70-2711沉默效率较高,侵染3周的基因沉默植株表达量显著低于对照植株,热胁迫处理和干旱处理的沉默阳性植株表达量也显著低于对照植株。在形态方面,热胁迫处理和不处理的阳性植株茎长都显著大于对照植株,这与基因表达量结果相同。相对而言,叶用莴苣中LsHsp70-2711的表达在高温处理比干旱处理更明显。因此,从基因的表达量和形态变化上可以看出,LsHsp70-2711与叶用莴苣的耐热性相关性较大,干旱也会有抑制作用。下一步计划通过遗传转化方法,获得LsHsp70-2711转基因植株,分析基因表达情况和功能鉴定,同时结合LsHsp70-2711蛋白研究,进一步深化认识植物响应高温胁迫进行适应性生长的分子机制。
4 结论
从叶用莴苣叶片中克隆到Hsp70的同源基因,命名为LsHsp70-2711。该基因开放阅读框长度为2 154 bp,编码718个氨基酸。qRT-PCR表明LsHsp70-2711的表达受高温诱导,且该基因在耐热品种中的表达高于热敏品种,推断LsHsp70-2711的表达与耐热性有一定相关性。VIGS基因沉默体系构建证明LsHsp70-2711的沉默降低了叶用莴苣抵抗高温的能力,热胁迫阳性植株在表达量和表型上都显著有别于对照植株,表明LsHsp70-2711与叶用莴苣耐热性相关。
[1] MULABAGAL V, NGOUAJIO M, NAIR A. In vitro evaluation of red and green lettuce (Lactuca sativa) for functional food properties. Food Chemistry, 2010, 118: 300-306.
[2] 许俊强, 汤青林, 宋明, 王志敏. 蔬菜抽薹的遗传规律及机理研究.长江蔬菜, 2011(8): 7-10.
XU J Q, TANG Q L, SONG M, WANG Z M. Research on inheritance and mechanism of bolting in vegetables. Changjiang Vegetables, 2011(8): 7-10. (in Chinese)
[3] 王荣青, 万红建, 李志邈, 叶青静, 阮美颖, 周国治, 姚祝平, 杨悦俭. 番茄 Hsp70基因鉴定及系统发育关系分析. 核农学报, 2014, 28(3): 378-385.
WANG R Q, WAN H J, LI Z M, YE Q J, RUAN M Y, ZHOU G Z, YAO Z P, YANG Y J. Identification and phylogenetic relationships of Hsp70 genes in tomato. Nuclear Agricultural Sciences, 2014, 28(3): 378-385. (in Chinese)
[4] 齐妍, 徐兆师, 李盼松, 陈明, 李连城, 马有志. 植物热激蛋白 70的分子作用机理及其利用研究进展. 植物遗传资源学报, 2013, 14(3): 507-511.
QI Y, XU Z S, LI P S, CHEN M, LI L C, MA Y Z. Research progress on Molecular Mechanism and applicatio of HSP70 in plants. Plant Genetic Resources, 2013, 14(3): 507-511. (in Chinese)
[5] BOSTON R S, VIITANEN P V, VIERLING E. Molecular chaperones and protein folding in plant. Plant Molecular Biology, 1996, 32(1/2): 191-222.
[6] POLIER S, DRAGOVIC Z, HARTL F U. Strucrural basis for the cooperation of Hsp70 and Hsp110 chaperones in protein folding. Cell, 2008, 133: 1068-1079.
[7] SCHUERMANN J P, JIANG J, CUELLAR J. Structure of the Hsp70: Hsc70 nucleotide exchange machine. Molecular Cell, 2008, 31: 232-243.
[8] LEE G J, POKALA N, VIERLING E. Structure and in vitro molecular chaperone activity of cytosolic small heat shock proteins from pea. Biological Chemistry, 1995, 270(18): 10432-10438.
[9] SANMIYA K, SUZUKI K, EGAWA Y, SHONO M. Mitochondrial small heat-shock protein enhances thermotolerance in tobacco plants . FEBS Letters, 2004, 55(1/3): 265-268.
[10] AHN Y J, CLAUSSEN K, ZIMMERMAN J L. Genotypic differences in the heat-shock response and thermotolerance in four potato cultivars . Plant Science, 2004, 166(4): 901-911.
[11] 肖艳萍, 宫伟娜, 万方浩, 李正跃, 谢丙炎. 紫茎泽兰热激蛋白 70基因的克隆与序列分析. 中国农业科技导报, 2010, 12(1): 111-117.
XIAO Y P, GONG W N, WAN F G, LI Z Y, XIE B Y. Cloning and sequence analysis of heat shock protein 70 gene from Ageratina adenophora. Agricultural Science and Technology, 2010, 12(1): 111-117. (in Chinese)
[12] 安艳秋, 蔺瑞明, 芦冯晶, 王风涛, 徐世昌, 许玉凤. 小麦热激蛋白基因 TaHSP70克隆及其在植物防卫和抗逆反应中的表达分析.分子植物育种, 2011, 9(4): 402-409.
AN Y Q, LIN R M, FENG J, WANG F T, XU S C, XU Y F. Cloning of heat shock protein gene TaHSP70 from wheat and its expression in plant defense and anti reverse reaction. Molecular Plant Breeding, 2011, 9(4): 402-409. (in Chinese)
[13] SUN Y, MACRAE T H. The Small heat shock proteins and their role in human disease. FEBS Journal, 2005, 272(11): 2613-2627.
[14] TANAKA K I, NAMBA T, ARAI Y, FUJIMOTO M, ADACHI H, SOBUE G, TAKEUCHI K, NAKAI A, MIZUSHIMA T. Genetic evidence for a protective role for heat shock factor and heat shock protein 70 against colitis. Biological Chemistry, 2007, 282: 23240-23252.
[15] FRACY E, SERPENTINI A, FIEVET B, LEBEL J M. Identification of cDNAs encoding HSP70 and HSP90 in the abalone Haliotis tuberculata: Transcriptional induction in response to thermal stress in hemocyte primaryculture. Comparative Biochemistry and Physiology Part B, 2007, 146: 540-550.
[16] 赵雁, 毕玉芬, 邵辰光. 牧草和饲料作物蛋白质变化与耐热性的关系.云南农业大学学报(自然科学版), 2012, 27(3): 440-446.
ZHAO Y, BI Y F, SHAO C G. The relationship between protein changes and heat tolerance of forage and feed crops. Yunnan Agricultural University (Natural Science Edition), 2012, 27(3): 440-446. (in Chinese)
[17] HARTL F, HAYER-HARTL M. Molecular chaperones in the cytosol from nascent chain to folded protein. Science. 2002, 295: 1852-1858.
[18] JOLLY C, MORIMOTO R. Stress and the cell nucleus: Dynamics of gene expression and structural reorganization. Gene Expression, 1999, 7: 261-270.
[19] MYCKO, CWIKLINSKA M P, WALCZAK H , LIBERT A, RAINE C, SELMAJ C S, KRZYSZTOF W. A heat shock protein gene (Hsp70) is critically involved in the generation of the immune response to myelinantigen. Eurpean Journal of Immunology, 2008, 38: 1999-2013.
[20] SUNG D Y, GUY C. Physiological and molecular assessment of altered expression of Hsc70-1 in Arabidopsis evidence for pleiortopic consequences. Plant Physiology, 2003, 132: 979-987.
[21] SCAFARO A P, HAYNES P A, ATWELL B J. Physiological and molecular changes in Oryza meridionalis Ng., A heat-tolerant species of wild rice. Journal of Experimental Botany, 2010, 61(1): 191-202.
[22] QI Y C, WANG H J, ZOU Y. Over-expression of mitochondrial heat shock protein 70 suppresses programmed cell death in rice. FEBS Journal, 2011, 585: 231-239.
[23] 李慧聪, 郭秀林, 王冬梅. 玉米热激蛋白 70基因对温度胁迫的响应. 河北农业大学学报, 2010, 33(6): 12-15.
LI H C, GUO X L, WANG D M. Responses of HSP70 gene expression to temperature stresses in maize. Journal of Agricultural University of Hebei, 2010, 33(6): 12-15. (in Chinese)
[24] 胡秀丽, 李艳辉, 杨海荣. HSP70可提高干旱高温复合胁迫诱导的玉米叶片抗氧化防护能力. 作物学报, 2010, 36(4): 636-644.
HU X L, LI Y H, YANG H R. Heat shock protein 70 may improve the ability of antioxidant defense induced by the combination of drought and heat in maize leaves. Acta Agronomica Sinica, 2010, 36(4): 636-644. (in Chinese)
[25] PRATT W B, TOFT D O. Regulation of signaling protein function and trafficking by the hsp90/hsp70-based chaperone machinery. Experimental Biology and Medicine, 2003, 228: 111-133.
[26] YOUNG J C, BARRAL J M, ULRICH HARTL F. More than folding: localized functions of cytosolicchaperones. Trends in Biochemical Sciences, 2003, 28: 541-547.
[27] SUNG D, VIERLING E, GUY C L. Comprehensive expression profile analysis of the Arabidopsis Hsp70 gene family. Plant Physiology, 2001, 126(2): 789-800.
[28] 卢承琼, 曾其伟, 向仲怀, 何宁佳. 桑树小分子热激蛋白基因的鉴定及在逆境胁迫下的表达. 蚕业科学, 2014, 40(6): 965-973.
LU C Q, ZENG Q W, XIANG Z H, HE N J. Identification of Mulberry small heat shock protein genes and their expression under abiotic stresses. Science of Sericulture, 2014, 40(6): 965-973. (in Chinese)
[29] 宋洪兵, 宋小明, 周晶晶, 刘环环, 李英, 侯喜林. 不结球白菜BcHSP70-1基因的克隆与进化及其表达分析. 西北植物学报, 2013, 33(8): 1508-1515.
SONG H B, SONG X M, ZHOU J J, LIU H H, LI Y, HOU X L. Phylogenetic and expression analysis of BcHSP70-1 gene from brassica campestris ssp.chinensis. Acta Botanica Boreali-Occidentalia Sinica, 2013, 33(8): 1508-1515. (in Chinese)
[30] SRIKANTHBABU V, GANESHKUMAR, KRISHNAPRASAD B T. Identification of pea genotypes with enhanced thermotolerance using temperature induction response technique (TIR). Plant Physiology, 2002, 159: 535-545.
(责任编辑 赵伶俐)
Cloning and Function Analysis of Heat-Shock-Protein LsHsp70-2711 Gene Under High Temperature Stress in Leaf Lettuce (Lactuca sativa L.)
LI YaBo, LI Ting, HAN YingYan, FAN ShuangXi
(College of Plant Science and Technology, Beijing University of Agriculture, Beijing 102206)
【Objective】Through cloning of genes related to Hsp70, and using VIGS to analyze Hsp70 expression and morphological change of leaf lettuce under heat stress to lay a foundation for analysis of the response mechanism and molecular mechanism of heat shock protein under heat stress.【Method】The full-length cDNA gene of LsHsp70-2711 gene was obtained byhomologous cloning and RACE technology. By real-time fluorescence quantitative PCR (qRT-PCR), the expression of the gene from P-S11and G-S59 was analyzed. According to the VIGS technology, the pTRV-LsHsp702711 vector was constructed and transformed into Agrobacterium GV1301. The leaves of lettuce were infected by the injection method. After three weeks, the positive plants were identified by PCR. The gene expression and morphology were compared between the control group and positive group, and the expression characteristics of LsHsp70-2711 were analyzed again after heat stress and drought treatment. 【Result】The sequence analysis indicated that the full-length cDNA was 2226 bp, the open reading frame was 2154 BP, encoding 718 amino acids, and its homology compared with that of Arabidopsis (NP_187864.1), tomato (NP_001266213.1), Saussurea Medusa (AAB99745.1), and other species. qRT-PCR results showed that the expression of the gene in the two cultivars was up-regulated, and the expression level of heat resistant cultivars was significantly higher than the heat sensitive cultivar, and the gene expression of P-S11 was inhibited by the increase of stress time, and the expression level of G-S59 was higher in the heat resistant variety. In heat resistant variety, the maximum expression of LsHsp70-2711 appeared at 42℃, 60 min, and the maximum expression of heat sensitive variety reached at 37℃, 60 min. Prediction of subcellular localization showed that LsHsp70-2711 was mainly in the cytoplasm. The constructed vector was used to invade the leaves of lettuce, and the positive plants were obtained after identification. LsHsp70-2711 expression decreased after it was silenced by VIGS, compared with the control, the stem length of the positive plants was significantly increased. After heat stress and drought treatment, the expression of LsHsp70-2711 was significantly lower than the control, and the influence of high temperature treatment on LsHsp70-2711 was greater than drought stress.【Conclusion】 LsHsp70-2711 gene belongs to Hsp70 gene family, and is related to the heat resistance in lettuce. The research results of the study will provide theoretical supports for the analysis of function of high temperature in bolting of lettuce.
Lactuca sativa L.; Hsp70; clone; temperature stress; VIGS
2016-09-13;接受日期:2016-12-02
国家自然科学基金(31372057,31401883)、北京市叶类蔬菜创新团队建设专项(blvt—02)、北京市农业科技项目(20140134)、北京市科技成果转化提升计划项目(PXM2015-D14207 000012)
联系方式:李雅博,E-mail:505237137@qq.com。通信作者范双喜,E-mail:fsx20@163.com

