高迁移率族蛋白1及其炎症信号通路在大鼠扩张型心肌病中的表达及意义*
沈丽娟,陆 曙△,周永华,邢清敏,李 岚,周春刚
(1.南京中医药大学无锡附属医院,江苏无锡 214071;2.江苏省血吸虫病防治研究所/卫生部重点实验室,江苏无锡 214064)
论著·基础研究
高迁移率族蛋白1及其炎症信号通路在大鼠扩张型心肌病中的表达及意义*
沈丽娟1,陆 曙1△,周永华2,邢清敏1,李 岚1,周春刚1
(1.南京中医药大学无锡附属医院,江苏无锡 214071;2.江苏省血吸虫病防治研究所/卫生部重点实验室,江苏无锡 214064)
目的 研究高迁移率族蛋白1(HMGB1)及其炎症信号通路[HMGB1-Toll样受体4(TLR4)/晚期糖基化终产物受体(RAGE)-核因子κB(NF-κB)-细胞因子]在大鼠扩张型心肌病(DCM)中的表达,并探讨其在DCM发生、发展中的意义。方法 以SD大鼠构建DCM模型,雄性大鼠42只,分为对照组(20只)和DCM组(22只)。以腹腔注射阿霉素进行造模,DCM组腹腔注射阿霉素1.0 mg/kg(生理盐水稀释至1 mg/mL),对照组腹腔注射等量生理盐水,1周2次,用药6周,停药观察2周。造模后随机抽取2只大鼠行心脏彩超及病理检查证实造模是否成功,余大鼠行心脏彩超检查;留取血标本,进行血清白细胞介素(IL)-1、IL-6、肿瘤坏死因子-α(TNF-α)、脑利钠肽(BNP)、C反应蛋白(CRP)水平的测定;处死大鼠留取左心室心肌组织标本,进行心肌组织HMGB1、TLR4、RAGE、NF-κB的mRNA表达测定;进行心肌组织病理及电镜检查。结果 8周后对照组无死亡,DCM组死亡4只,其余18只随机抽取2只大鼠证实造模成功。DCM组左心室舒张末期内径(LVEDD)、左心室收缩末期内径(LVESD)较对照组明显升高(P<0.05);左心室射血分数(LVEF)、左心室短轴收缩率(FS)较对照组明显下降(P<0.05)。DCM组心肌组织HMGB1、TLR4、RAGE、NF-κB mRNA的表达较对照组明显升高(P<0.05);HMGB1 mRNA与TLR4 mRNA、RAGE mRNA及NF-κB mRNA呈正相关(r=0.873,P=0.005;r=0.949,P=0.000;r=0.898,P=0.002)。血清IL-1、IL-6、TNF-α、CRP、BNP水平较对照组明显升高(P<0.05);HMGB1 mRNA的表达分别与IL-1、IL-6、TNF-α、CRP水平呈正相关(r=0.944,P=0.002;r=0.988,P=0.000;r=0.968,P=0.000;r=0.961,P=0.000)。结论 HMGB1及其炎症信号通路(HMGB1-TLR4/RAGE -NF-κB-细胞因子)在大鼠DCM中呈现高表达,并与心腔大小及心功能相关,提示其可能是DCM发生、发展的病理生理机制之一。
心肌病,扩张型;高迁移率族蛋白1;信号通路;TLR4;RAGE;NF-κB;细胞因子
扩张型心肌病(dilated cardiomyopathy,DCM)是一种以一侧或双侧心腔扩大、心脏收缩功能障碍为主要表现的心肌疾病,其临床表现以心力衰竭、心律失常、血栓事件或猝死为多见[1]。DCM是多种致病因素引起心肌损害的最后结果,是心力衰竭的第三位原因,也是心脏移植的最常见原因[2]。虽然DCM的发病机制未完全明确[3],但大量研究证实,炎性反应是介导DCM发生的重要机制之一[4],持续的炎性反应是心肌细胞受损、心肌间质纤维化及心脏重构、心脏收缩功能降低的主要原因[5]。高迁移率族蛋白1(high mobility group box 1,HMGB1)是一种典型的核内非组蛋白,其可以通过活化细胞的主动分泌和坏死细胞的被动释放两种方式到达胞外,并参与炎性反应,它是一种重要的炎症介质和促炎细胞因子[6]。研究显示,HMGB1及炎症细胞因子可能参与了DCM的病理生理进程[7]。但在DCM中,HMGB1是通过什么信号通路发挥作用的,是通过直接抑制下游炎症因子白细胞介素(IL)-6、C反应蛋白(CRP)等发挥作用,还是通过对Toll样受体(Toll-like receptor 4,TLR4)或者晚期糖基化终产物受体(receptor for advanced glycation end product,RAGE)信号通路的调节干预DCM的发生、发展,前期研究也未能阐释。
本研究拟通过构建大鼠DCM模型来研究HMGB1及其炎症信号通路(HMGB1-TLR4/RAGE-NF-κB-细胞因子)在大鼠DCM中的表达,探讨其在DCM发生、发展中的意义,为后期用相关特异性抗体或者中草药延缓甚至逆转心腔扩大和心力衰竭的发展提供理论依据。
1 材料与方法
1.1 实验动物 选用42只健康8周龄雄性SD大鼠[北京维通利华公司,合格证:SCXK(京)2012-0001],体质量250~280 g。
1.2 仪器设备 041BR111422Bio-RAD电泳装置(美国Bio-RAD公司);多用脱色摇床SYC-2101(苏州捷美);BM450A全自动组织包埋机(常州派斯杰医疗);LeicaDMI6000B倒置显微镜(北京中仪光科科技发展有限公司);LeicaRM2235切片机(北京中仪光科科技发展有限公司);JEM-1010透射电子显微镜(日本电子公司);CURIEMENTOR 3型活度计(德国PTW公司);AS210型电子天平(德国Sartorius公司);Philips CX50超声诊断仪及12 MHz超声探头(美国Philips公司);Elx-800酶联免疫分析仪(美国BioTek公司);5417R冰冻高速离心机(德国Eppendorf公司);BCS-1300IIA2生物安全柜(苏州安泰空气技术有限公司);Thermo902低温冰柜(美国Thermo公司);LightCycler480基因扩增仪(美国BioER公司)。
1.3 材料与试剂 水合氯醛(青岛宇龙海藻药业有限公司);ELISA试剂盒(苏州科创生物技术有限公司);苏木素伊红染色试剂盒(上海碧云天生物技术有限公司);TrizolRNAIsolation(美国Invitrogen公司);逆转录试剂盒[宝生物工程(大连)有限公司];SYBR®Premix ExTaqTMⅡ试剂盒[宝生物工程(大连)有限公司];注射用盐酸多柔比星(ADR)每瓶10 mg(深圳万乐药业有限公司);氯仿(上海静融生物科技有限公司);异丙醇(上海联试化工试剂有限公司);DEPC水(上海申能博彩生物有限公司)。
1.4 方法
1.4.1 造模 大鼠称体质量标记,分为对照组(20只)和DCM组(22只),参照文献[8]构建阿霉素诱导的DCM大鼠模型:阿霉素用生理盐水稀释成1 mg/mL,DCM组大鼠腹腔注射阿霉素每次1 mg/kg,对照组腹腔注射1 mg/kg生理盐水,每周2次,连续6周,共12次。每次根据大鼠体质量调整阿霉素剂量,6周后停药观察2周。实验过程中观察大鼠的体质量、一般情况、病死率。造模后随机抽取2只大鼠行心脏彩超及病理检查证实造模是否成功。
1.4.2 超声检查 造模后大鼠行心脏超声检测,以腹腔注射10%水合氯醛(3 mL/kg)麻醉,麻醉成功后将大鼠胸部朝上固定,左胸部脱毛,放置探头,获得满意的左室长轴切面、心脏四腔切面和M型超声心动图,测量后获得大鼠左心室舒张末期内径(left ventricular end diastolic diameter,LVEDD)、左心室收缩末期内径(left ventricular end systolic diameter,LVESD)、左心室射血分数(left ventricular ejection fraction,LVEF)、短轴缩短率(fraction shortening,FS)等数据。
1.4.3 大鼠血液、心肌标本的采集 提前禁食12 h,造模前经尾静脉采血,造模后通过下腔静脉采血,后处死,摘取心脏,生理盐水冲洗,滤纸吸干水分,解剖获得左心室心肌。取一块-80 ℃保存用于mRNA测定;取一块用多聚甲醛固定,用于HE染色;取一块用戊二醛固定,用于电镜检查。
1.4.4 大鼠血清IL-1、IL-6、肿瘤坏死因子α(TNF-α)、CRP、脑利钠肽(BNP)检测 将血液试管置于离心机中,于3 000 r/min离心15 min。提取上清液于EP管中,标记后于-70 ℃冰箱保存,后统一用按照说明书使用ELISA法测定表达水平。
1.4.5 大鼠左室心肌组织匀浆制备与HMGB1、TLR4、RAGE、NF-κB mRNA表达 将50 mg的冷冻心肌组织按照说明书提取总RNA。-80 ℃保存。参考文献方法[9]采用RT-PCR两步法进行检测,通过溶解曲线、2%琼脂糖凝胶电泳确定产物的准确性,采用Real time-PCR方法进行相对定量,标准化比值计算公式采用2-△△CT法[10]。以大鼠β-actin作为内参基因,检验所用引物序列见表1。

2 结 果
2.1 大鼠一般情况及病死率 8周后对照组大鼠毛发有光泽,活动度、进食如常,体质量稳步增长,无腹水形成,无死亡。DCM组大鼠毛发凌乱,无光泽,活动度差,进食量减少,第3周体质量开始下降,第5周又呈上升趋势(考虑与腹水形成有关)。DCM组72.7%(16/22)大鼠腹水形成,18.2%(4/22)大鼠死亡。尸体解剖发现死亡大鼠肝脏肿大,腹腔中等量至大量腹水。见图1。

图1 两组大鼠体质量变化曲线及生存分析图
2.2 心脏超声 8周后DCM组大鼠LVEDD、LVESD大于对照组(P<0.05),LVEF、FS小于对照组(P<0.05)。见表2。
2.3 两组心肌组织HMGB1、TLR4、RAGE、NF-κB mRNA表达及相关性分析 DCM组心肌组织HMGB1、TLR4、RAGE、NF-κB mRNA表达较对照组明显升高,差异有统计学意义(P<0.05),见图2、3,表3。DCM组心肌组织HMGB1 mRNA表达分别与TLR4、RAGE、NF-κB mRNA表达呈正相关关系(r=0.873,P=0.005;r=0.949,P=0.000;r=0.898,P=0.002),见图4。

表2 两组大鼠心脏超声结果比较±s)
*:P<0.05,与对照组比较。

表3 两组大鼠心肌组织mRNA表达比较±s)
*:P<0.05,与对照组比较。

图2 HMGB1、TLR4、RAGE、NF-κB mRNA溶解率
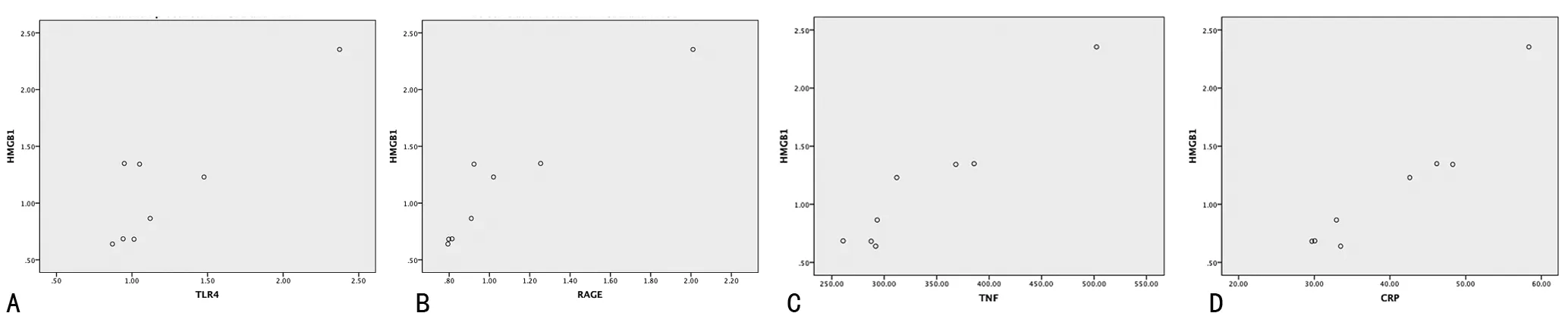
2.4 两组血清IL-1、IL-6、TNF-α、CRP、BNP水平及相关性分析 DCM组血清IL-1、IL-6、TNF-α、CRP、BNP水平较对照组明显升高,差异有统计学意义(P<0.05),见表4。DCM组心肌组织HMGB1 mRNA表达分别与血清IL-1、IL-6、TNF-α、CRP水平呈正相关关系(r=0.944,P=0.000;r=0.988,P=0.000;r=0.968,P=0.000;r=0.961,P=0.000),见图5。

图3 HMGB1、TLR4、RAGE、NF-κB mRNA溶解曲线

A:HMGB1与TLR4的关系;B:HMGB1与RAGE的关系;C:HMGB1与NF-κB的关系。

图4 DCM组心肌组织HMGB1 mRNA与TLR4、RAGE、NF-κB mRNA表达相关性分析表4 两组大鼠血清IL-1、IL-6、TNF-α、CRP、BNP水平比较
*:P<0.05,与对照组比较。
A:HMGB1与TLR4的关系;B:HMGB1与RAGE的关系;C:HMGB1与TNF-α的关系;D:HMGB1与CRP的关系。
图5 DCM组心肌组织HMGB1 mRNA与血清IL-1、IL-6、TNF-α、CRP水平相关性分析

图6 两组病理HE染色及电镜结果比较
2.5 病理HE染色及电镜检查 HE染色:对照组大鼠心肌纤维无断裂,排列整齐,心肌细胞胞质均匀丰富,无破坏;细胞排列整齐,无间质纤维化,细胞间隙正常。DCM组大鼠心肌细胞变性、坏死,心肌组织受损;心肌细胞排列紊乱,组织间质纤维化,细胞间隙增宽,炎症细胞浸润,呈心肌病样改变。电镜:对照组心肌纤维排列整齐,线立体大小均匀,无肿胀,内膜嵴正常。DCM组心肌纤维断裂,线立体肿胀,空泡变性,内膜嵴缺失。见图6。
3 讨 论
DCM是多种致病因素引起心肌损害的最后结果[2]。虽然DCM的发病机制并未完全明确[3],但主要机制可能与病毒持续感染、自身免疫反应、基因与遗传等有关[4]。大量研究证实,炎性反应是介导DCM发生的重要机制[5],持续的炎性反应是心肌细胞受损、心肌间质纤维化及心脏重构、心脏收缩和舒张功能降低的主要原因[6]。
CRP是一种急性时相反应蛋白,研究发现DCM患者的心肌细胞、心内膜内皮细胞和微血管上皮细胞内有CRP和其mRNA的合成和表达[11]。CRP通过激活补体系统和诱导巨噬细胞的趋化导致心肌损伤[12]。在DCM患者中,CRP的升高与炎症的活动相关,并与心功能不全相关,可反映DCM的预后[13]。细胞因子主要分为两大类:促炎性细胞因子和抗炎性细胞因子,IL-1、IL-6、TNF-α为促炎性细胞因子,IL-1、TNF-α与相应受体结合后,可启动级联机体免疫及炎性反应。研究证实,DCM患者TNF-α、IL-6、IL-1β等异常增高[14]。TNF-α、IL-6,IL-1β等通过直接降低心肌收缩力、促进心肌细胞增生肥大、进行性凋亡,导致心肌重构;其还可以诱导氧化应激,降低心肌细胞抗氧化能力[15]。
HMGB1是典型的核内非组蛋白,可以通过活化细胞的主动分泌和坏死细胞的被动释放两种方式到达胞外,并介导炎性反应,它是一种重要的炎症介质和促炎性细胞因子[6],它既是炎症的早期启动者(坏死细胞被动释放HMGB1),又是炎症晚期的促进者(HMGB1从巨噬细胞的主动分泌)[16-17]。胞外HMGB1的受体有两个,一个是RAGE,另一个是TLR。HMGB1与RAGE或TLR结合可诱导趋化因子和细胞因子产生,并参与免疫细胞成熟、迁移和表面受体表达。
有研究证实,HMGB1与 RAGE在细胞表面结合可引起 RAGE表达上调[18]。HMGB1与RAGE结合后经偶联G蛋白,活化Ras/Raf、Rac/cdc42,激活丝裂原活化蛋白激酶(mitogen activated protein kinases,MAPK)级联通路,活化MAPK家族中的p38 MAPK、c-Jun N 端激酶(c-Jun N-terminal kinases,JNK)、细胞外信号调节激酶(extracellular regulated protein kinases,ERK1),激活下游的NF-κB的转录[19-20]。NF-κB与靶基因调控元件中的κB 序列特异性结合,使含有κB 结合位点的其他炎症因子和黏附分子共同转录,如:TNF-α、IL-1、IL-6、血管细胞黏附分子-1(VCAM-1)、细胞间黏附分子-1(ICAM-1),诱发大量炎性因子释放引起严重的全身性炎性反应、多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)[21],进一步导致组织细胞坏死,刺激免疫细胞大量释放HMGB1至胞外,引起正反馈调节。有研究发现,阻断 HMGB1和RAGE的结合能抑制MAPK和NF-κB活化及转录[18],亦可部分抑制HMGB1诱导的炎性细胞因子的产生[22]。
TLR2/4是HMGB1的另一种受体。TLR广泛存在于机体的免疫细胞和非免疫细胞(如:心肌细胞)中。通过髓样分化蛋白(MyD88)-肿瘤坏死因子受体相关受体(TRAFs)-I-κB 诱导激酶(IKKs)通路,使 NF-κB 从 NF-κB/I-κB复合体中活化。另外在TRAFs处与HMGB1-RAGE信号通路存在重叠交叉,即通过TRAFs可以激活MEK激酶(MEKKs),进而活化MAPKs和下游的NF-κB[23]。研究显示,在缺血/再灌注损伤模型中,抑制TLR4可减少其与HMGB1的相互结合,抑制了下游信号通路的激活,阻止了组织器官发生损伤的级联反应[24]。
HMGB1可能通过上述信号传导通路引起炎性反应、组织修复再生和心力衰竭[25]。研究证实,HMGB1在动脉粥样硬化、心肌梗死、缺血再灌注损伤、心力衰竭等心血管疾病中高表达[25]。炎症在心力衰竭患者中普遍存在,并成为不良预后的预测因子[26]。胞外HMGB1是一种重要的炎症介质和促炎细胞因子。细胞水平实验证实,若离体心肌细胞暴露于HMGB1中,其肌原纤维收缩力几分钟内即能下降70%,提示HMGB1参与了心力衰竭的发展,加速了心功能的减退[27]。抑制HMGB1表达后,Ⅰ、Ⅲ型胶原蛋白表达下降[22],能抑制心肌纤维化和心室重构[23]。动物实验发现,小鼠腹腔注射HMGB1,发现小鼠并没有立即表现出心肌的功能障碍,而表现为血循环中HMGB1水平的升高,循环HMGB1水平升高可能与随后的小鼠心肌功能障碍有关,同时,通过腹腔注射HMGB1拮抗剂A-box或HMGB1抑制剂可以缓解这种心肌功能障碍[28]。临床观察提示,心力衰竭患者血浆HMGB1水平升高,与心力衰竭的严重程度密切相关,可作为心脏终点事件和心脏移植的独立预测因子。提示HMGB1可能作为一种炎症介质参与了心力衰竭的炎症过程[26]。
目前关于HMGB1与DCM关系的研究相对较少,离体实验显示,HMGB1的负性收缩作用与RAGE和TLR4有关[26]。临床研究显示,HMGB1及炎症细胞因子(TNF-α、IL-6)可能参与了DCM的病理生理进程[6]。但在DCM中HMGB1是通过与哪个受体结合激活下游信号通路参与DCM发生、发展的,目前暂无研究报道。
本研究通过构建DCM大鼠模型,观察HMGB1及其炎症信号通路(HMGB1- TLR4/RAGE - NF-κB-细胞因子)在DCM大鼠心肌组织中的表达,发现DCM大鼠心肌组织HMGB1的基因表达高于对照组,同时HMGB1与BNP水平、LVEDD呈正相关关系,与LVEF呈负相关关系。这与上述研究结果一致,提示HMGB1参与了DCM的发生、发展。本研究还发现,DCM大鼠心肌组织TLR4、RAGE、NF-κB的基因表达均高于对照组,HMGB1分别与TLR4、RAGE、NF-κB呈正相关关系,本研究还发现HMGB1分别与TNF-α、IL-1、IL-6、IL-10、CRP呈正相关关系,提示HMGB1参与DCM的病理生理进程可能是通过与TLR4或者RAGE结合,激活NF-κB的释放,促使后续细胞因子及炎性介质的释放,介导心肌细胞损伤,最终导致心腔扩大,心功能减退。
目前对HMGB1及其炎症信号通路与DCM关系的研究尚处于起步阶段,虽然已经取得一定的进展,但仍有很多问题有待进一步研究,比如各种病原微生物是如何通过HMGB1信号通路对DCM产生不同的生物学效应,针对HMGB1及其炎症信号通路的药物和特异性抑制剂的研发等。这些问题的解决,势必为HMGB1在临床上作为重要靶点提供全新的视野,也将为DCM病因的阐明及其治疗开创美好的前景。
[1]Yuko I,Hitomi O,Osamu S,et al.Blockade of sarcolemmal TRPV2 accumulation inhibits progression of dilated cardiomyopathy[J].Card Res,2013,99(8):760-768.
[2]Zipes DP,Camm AJ,Borggrefe M,et al.ACC/AHA/ESC 2006 guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death-executive summary:a report of the American College of Cardiology /American Heart Association Task Force and the European Society of Cardiology Committee for Practice Guidelines[J].Eur Heart J,2006,27(30):2099-2140.
[3]Hershberger RE,Siegfried JD.Update 2011:clinical and genetic issues in familial dilatedcardiomyopathy[J].J Am Coll Cardiol,2011,57(20):1641-1649.
[4]张晓伟,蔡文锋,胡卓伟.扩张型心肌病免疫病理学发病机制研究进展[J].心血管病学进展,2009,30(5):814-817.
[5]张艳春,董剑廷.正五聚蛋白3与特发性扩张型心肌病的相关性[J].临床心血管病杂志,2013,29(2):105-108.
[6]Ulloa L,Messmer D.High-mobility group box 1(HMGB1) protein:Friend and foe[J].Cytokine Growth Factor Rev,2006,17(3):189-201.
[7]吴辉,杨俊,丁家望,等.扩张型心肌病患者血清中高迁移率族蛋白B白细胞介素-6及肿瘤坏死因子的表达[J].临床心血管病杂志,2013,29(2):88-90.
[8]Gava FN,Zacche E,Ortiz EM,et al.Doxorubicin induced dilated cardiomyopathy in a rabbit model:an update[J].Res Vet Sci,2013,94(2):115-121.
[9]Zhou ML,Shi JX,Hang CH,et al.Expression of Toll-like receptor 4 in the brain in a rabbit experimental subarachnoid haemorrhage model[J].Inflamm Res,2007,56(3):93-97.
[10]Livak KJ,Schmittgen TD.Analysis of gelative gene expression data using real-time quantitative PCR and the 2-△△CTmethod J[J].Method,2001,25(4):402-408.
[11]Satoh M,Nakamura M,Akatsu T,et al.C-reactive p rotein co-expresses with tumor necrosis factor-α in the myocardium in human dilated cardiomyopathy[J].Eur J Heart Fail,2005,7(5):748-754.
[12]Zimmermann O,Bienek-Ziolkowski M,Wolf B,et al.Myocardial in ammation and non-ischaemic heart failure:is there a role for C-reactive protein?[J].Basic Res Cardiol,2009,104(6):591-599.
[13]Mamamtavrishvili ND,Kvirkveliia AA,Abashidze RI,et al.Role of immune inflammatory activity in chronic heart failure progress[J].Georgian Med News,2008(160/161):30-34.
[14]Yu M,Wen S,Wang M,et al.TNF-α-secreting B cells contribute to myocardial fibrosis in dilated cardiomyopathy[J].J Clin Immunol,2013,33(5):1002-1008.
[15]Haudek SB,Taffet GE,Schneider MD,et al.TNF provokes cardiomyocyte apoptosis and cardiac remodeling through activation of multiple cell death pathways[J].Clin Invest,2007,117(9):2692-2701.
[16]Scaffidi P,Misteli T,Bianchi ME. Release of chromatin protein HMGB1 by necrotic cells triggers inflammation[J].Nature,2002,418(6894):191-195.
[17]Vande Walle,Kanneganti TD,Lamkanfi M.HMGB1 release by inflammasomes[J].Virulence,2011,2(2):162-165.
[18]Rauvala H,Rouhiainen A.RAGE as a receptor of HMGB1 (Amphoterin):roles in health and disease[J].Curr Mol Med,2007,7(8):725-734.
[19]Degryse B,Bonaldi T,Scaffidi P,et al.The high mobility group (HMG) boxes of the nuclear protein HMG1 induce chemotaxis and cytoskeleton reorganization in rat smooth muscle cells[J].J Cell Biol,2001,152(6):1197-1206.
[20]Huttunen HJ,Fages C,Rauvala H.Receptor for advanced glycation end products (RAGE)-mediated neurite outgrowth and activation of NF-κB require the cytoplasmic domain of the receptor but different downstream signaling pathways[J].J Biol Chem,1999,274(28):19919-19924.
[21]高小清,姜红,邹云增.热休克转录因子 1 在心肌及其他组织中的抗炎作用[J].中国分子心脏病学杂志,2008,8(6) :371-374.
[22]Kokkola R,Andersson A,Mullins G,et al.RAGE is the major receptor for the proinflammatory activity of HMGB1 in rodent macrophages[J].Scand J Immunol,2005,61(1):1.
[23]闵笑颜.热休克蛋白27 对 LPS 诱导小鼠心功能不全保护机制的研究[D].南京:南京医科大学,2007.
[24]Shimamoto A,Pohlman TH,Shomura S,et al.Toll-like receptor 4 mediates lung ischemia-reperfusion injury[J].Ann Thorac Surg,2006,82(6):2017-2023.
[25]于鹏,姜红.高迁移率族蛋白 1 与心血管疾病关系概述[J].中国分子心脏病学杂志,2013,13(2):509-512.
[26]Volz HC,Laohachewin D,Schellberg D,et al.HMGB1 is an independent predictor of death and heart transplantation in heart failure[J].Clin Res Cardiol,2012,101(6):427-435.
[27]Tzeng HP,Fan J,Vallejo JG,et al.Negative inotropic effects of high-mobility group box 1 protein in isolated contracting cardiac myocytes[J].Am J Physiol Heart Circ Physiol,2008,294(3):H1490-1496.
[28]苏兆亮.HMGB1在心肌炎中的致病机制及调控作用研究[D].镇江:江苏大学基础医学与医学技术学院,2011.
Expression and effect of HMGB1 and its inflammatory signaling pathway in ratmodel of DCM*
ShenLijuan1,LuShu1△,ZhouYonghua2,XingQingmin1,LiLan1,ZhouChungang1
(1.WuxiHospitalAffiliatedtoNanjingUniversityofChineseMedicine,Wuxi,Jiangsu214071China;2.JiangsuProvincialInstituteofSchistosomiasisControl/KeyLaboratoryofMinistryofHealth,Wuxi,Jiangsu214064China)
Objective To investigate the expression and effect of high mobility group box 1(HMGB1) and its signaling pathway(HMGB1-RAGE/TLR4-NF-κB-cytokines)in rats with dilatd cardiomyopathy(DCM).Methods The rats were divided into two groups:normal control group (control,n=20) which treated with physiological saline,and DCM group(n=22) which treated with adriamycin(1 mg/kg twice a week)for 6 weeks,and then observed for 2 weeks.Echocardiography was performed at the end of the study.Plasma IL-1,IL-6,TNF-α level were measured by the flow cytometry.The CRP,BNP concentrations were measured by enzyme linked immunosorbent assay (ELISA).The expression of HMGB1 mRNA,TLR4 mRNA,RAGE mRNA,NF-κB mRNA were measured by real-time PCR.Results There were four rats dead in the DCM group;two rats were randomly selected from the DCM group to certified modeled successfully by echocardiography and pathological examination.Left ventricular end-diastolic diameter(LVEDD) and left ventricular end systolic diameter (LVESD) in DCM group were significantly higher than those in the normal control group(P<0.05);left ventricular ejection fraction (LVEF),left ventricular short axis contractility(FS) in DCM group was significantly lower than that in normal control group(P<0.05).The expression of HMGB1 mRNA,TLR4 mRNA,RAGE mRNA and NF-κB mRNA in myocardial tissue were significantly increased in DCM group than in the normal control saline group (P<0.05),The expression of HMGB1 mRNA were positively correlated with TLR4 mRNA,RAGE mRNA and NF-κB mRNA(r=0.873,P=0.005;r=0.949;P=0.000;r=0.898,P=0.002).The serum levels of IL-1,IL-6,TNF-α and CRP were significantly higher in DCM group.The expression of HMGB1 mRNA in myocardial tissue was positively correlated with IL-1,IL-6,TNF- α and CRP(r=0.944,P=0.002;r=0.988,P=0.000;r=0.968,P=0.000;r=0.961,P=0.000).Conclusion HMGB1 and it′s inflammation signaling pathway (HMGB1-TLR4/RAGE-NF-κB-cytokines) were highly expressed in dilated cardiomyopathy,and have relationship with left ventricular diameter and cardiac function,they may be involved in the development of DCM.
cardiomyopathy,dilated;high mobility group box 1;signaling pathway;RAGE;TLR4-;NF-κB;cytokines
10.3969/j.issn.1671-8348.2017.11.005
无锡市医管中心科研面上项目(YGZXM14047)。 作者简介:沈丽娟(1981-),主治医师,博士,主要从事心血管疾病研究。△
E-mail:panda55007@163.com。
R542.2
A
1671-8348(2017)11-1457-06
2016-10-19
2016-12-25)

