酒制对大黄中游离蒽醌在大鼠体内组织分布的影响
吴育+彭晓清+姜晓燕+石美琴+杨水英+符映均+彭敏+蔡艳+蒋晟昰+许彦


[摘要] 传统炮制理论指导思想“酒制升提”,大黄经过炮制成为饮片酒大黄治疗上焦病症,如目赤肿痛,口舌生疮等疾病,炮制前后大黄药性的改变使得其临床应用侧重点不同,为研究中药炮制理论的科学内涵,该文同时建立测定大鼠组织中芦荟大黄素、大黄酸和大黄素的液-质联用方法,通过分别灌胃给予SD大鼠大黄生品和酒制品水煎液,采用LC-MS测定组织(心、肺、脑、肝、肾)中芦荟大黄素、大黄酸和大黄素的含量,探讨酒制对大黄中游离蒽醌成分在大鼠体内组织分布的影响。试验结果显示大黄酒制能明显改变芦荟大黄素、大黄酸和大黄素在大鼠体内的分布,其中各成分在心与肺组织中的分布增加,在肝和肾中的分布与生品组相比变化不大,而在脑中没有检测到3种成分,提示芦荟大黄素、大黄酸、大黄素不能透过血脑屏障。酒制对大黄中游离蒽醌成分在大鼠体内的药物组织分布有较大影响,这也验证了传统中医理论,酒大黄多用于治疗上焦病症,该研究结果为探讨大黄炮制机制提供了实验依据。
[关键词] 芦荟大黄素;大黄酸;大黄素;组织分布;液-质联用
Effects of wine processed Rheum palmatum on tissue
distribution of aloe-emodin, rhein and emodin in rats
WU Yu1,PENG Xiao-qing2, JIANG Xiao-yan1, SHI Mei-qin1, YANG Shui-ying1,
FU Ying-jun1, PENG Min1, CAI Yan1, JIANG Sheng-shi1 , XU Yan1 *
(1. Department of Pharmacy, Nantong Chinese Medicine Hospital, Nantong 226001, China;
2. Medical School of Nantong University, Nantong 226001, China)
[Abstract] Under the traditional processing theory "wine processing could promote the efficacy", Rhubarb after wine processing could treat the upper energizer diseases such as red swelling, and breath sores. Processing changes the medicinal properties of rhubarb, and thus results in different focuses in clinical application. In this study, a sensitive and specific method was developed for the determination of aloe-emodin, rhein and emodin in rats tissue. Rhubarb raw materials and its wine processed decoction were given to SD rats respectively by gavage administration, and then the contents of aloe-emodin, rhein and emodin in the tissues (heart, lung, brain, liver, kidney) were determined by HPLC-MS to explore the effect of wine processing on free anthraquinones in rat tissues. Experimental results showed that wine processing can significantly change the distribution of aloe emodin, rhein and emodin in rats in vivo, and the distribution of these components was increased in heart and lung tissues.There was no significant change of distribution in the liver and the kidney as compared with raw product group, and these three ingredients were not detected in the brain, indicating that aloe-emodin, rhein, emodin can not pass through the blood brain barrier.Therefore, wine processing had greater effect on distribution of free anthraquinones in rat tissues.This also verified the theory of traditional Chinese medicine, providing experimental basis for rhubarb processing mechanism.
[Key words] aloe-emodin; emodin; rhein; tissue distribution; HPLC-MS
大黃始载于《神农本草经》,为我国临床应用最为广泛的中药材之一,是传统泻下类中药的代表,来源于蓼科植物掌叶大黄Rheum palmatum L.、唐古特大黄R. tanguticum Maxim. ex Balf.或药用大黄R. officinale Baill.的干燥根及根茎,具有泻下攻积、清热泻火、凉血解毒、逐瘀通经、利湿退黄之功效[1],大黄具多类药效活性成分,其中以蒽醌类、二蒽酮类、茋类鞣质和多糖研究最多;其药理作用主要有调节胃肠功能、抗病原微生物、抗肿瘤、保护心脑血管、抗炎保肝、抗衰老、抗菌抗病毒、降压降脂、抗肿瘤等作用[2-7]。
中药饮片入药是中医药临床用药的一大特色,也是区别中药和天然药物的显著标志。中药炮制基本原理的核心是中药饮片炮制后其药性发生了改变,而根源还是炮制后其内在物质基础内涵发生了改变。2015年版《中国药典》中记载了大黄生品、酒大黄、熟大黄和大黄炭[8]。大黄酒制后,引药上行,临床广泛用来治疗上焦病症,如目赤肿痛,口舌生疮等,疗效显著。现代研究表明,酒制能显著影响大黄中主要活性成分含量,游离蒽醌含量增加,结合蒽醌类衍生物含量下降[9-10],从而降低大黄生品泻下效力。另有研究表明,大黄酒制后对金黄色葡萄球菌、痢疾杆菌、伤寒杆菌的抑制作用较大黄生品好[11]。
近年来,大黄药材或复方中蒽醌类成分体内的药动学及组织分布研究多有报道[12-14]。然而,酒制对大黄中有效成分在大鼠体内组织分布影响的研究尚未见报道。本文采用液相色谱-质谱联用的方法,比较大黄生品和酒制品灌胃给药后大黄酸、芦荟大黄素和大黄素在大鼠体内的组织分布状况,进一步揭示大黄酒制的炮制机制,为临床用药提供参考。
1 材料与方法
1.1 仪器与试剂
LC-MS 2020高效液相色谱-质谱联用仪(日本岛津公司),包括SPD-M20A二极管阵列检测器,质谱为LC-MS-2020单极四级杆,电喷雾离子源(ESI);QF-3800氮气吹干仪;AG285电子天平(瑞士Mettler Toledo公司);KQ-2200B型超声波清洗器(昆山市超声仪器有限公司);弗鲁克F6/10型组织匀浆机(上海达平仪器有限公司);TGL-16B台式离心机(上海安亭科学仪器厂);XW-80A微型漩涡混合仪(上海沪西分析仪器厂)。
甲醇(色谱纯,美国Tedia公司);乙酸乙酯、乙酸(分析纯,上海凌峰化学试剂有限公司);乙酸铵、乙酸钠、维生素C、盐酸(分析纯,南京化学试剂有限公司)。大黄Radix et Rhizoma Rhei购自于安徽省亳州市药材总公司,经南京中医药大学药学院中药鉴定教研室刘训红教授鉴定为蓼科植物掌叶大黄的干燥根及根茎。酒大黄按照2010年版《中国药典》一部规定的炮制方法制得。芦荟大黄素、大黄酸、大黄素、1,8-二羟基蒽醌对照品(纯度>98%)均购自于中国食品药品检定研究院。SD大鼠,雄性,体重200~230 g,由上海斯莱克动物实验中心提供。
1.2 色谱质谱分析条件和数据处理
1.2.1 色谱条件 Kromsail C18色谱柱(4.6 mm×150 mm,5 μm);流动相甲醇-3 mmol·L-1乙酸铵(75∶25)等度洗脱,流速1 mL·min-1;柱温40 ℃;检测波长为254 nm。
1.2.2 质谱条件 采用负离子选择性检测(SIM)模式,选择的检测离子质荷比为268.8(大黄素、芦荟大黄素),282.8(大黃酸),239.9(内标,1-8二羟基蒽醌)。其他工作参数设置为:电喷雾电离(ESI);探针温度350 ℃;曲形脱溶剂装置(CDL)温度280 ℃;加热模块温度320 ℃;探针电压4.5 kV;检测器电压1.5 kV;CDL电压50 V;Q-array电压为DC 50 V,RF 120 V;干燥气流速5 L·min-1;雾化气流速1.5 L·min-1。实验获得的数据采用中国药理学会数学药理专业委员会编制的药代动力学参数计算软件3P97处理。
1.3 生大黄及酒大黄供试品溶液制备
大黄生药54 g,600 mL纯净水冷浸30 min,煎煮45 min,过滤;药渣加入300 mL纯净水,煎煮20 min,合并滤液,浓缩至300 mL,4 ℃保存。酒大黄供试液制备同生品。
1.4 组织分布研究
雄性SD大鼠60只,随机分为2组,其中1组为生品组,1组为酒制组,每组30只,实验前12 h禁食不禁水。按照大黄提取物10.0 mL·kg-1的灌胃剂量给药,于给药后5,15,30,60,120,240 min(每个时间点10只大鼠,每组各5只)断头处死大鼠,立即解剖采集心、肺、脑、肝、肾样品。当即用0.9%冰生理盐水冲净表面血液及内容物后,用滤纸吸干,称重,加入2倍量冰生理盐水匀浆,得到匀浆液,-20 ℃冷冻保存,备用。
1.4.1 样品处理 精密吸取大鼠血浆或组织匀浆液100 μL,加入内标10 μL(161 mg·L-1),再加入50 μL pH为5的醋酸盐缓冲剂和50 μL维生素C (100 g·L-1),涡旋30 s,加50 μL 0.1%HCl溶液,及0.8 mL乙酸乙酯,涡旋3 min,4 000 r·min-1离心5 min,分离乙酸乙酯层,吹干,用100 μL乙腈复溶,取上清液,12 000 r·min-1离心3 min,取20 μL进样,LC-MS测定。
1.4.2 标准溶液配制 精密称取芦荟大黄素、大黄酸和大黄素对照品适量,用甲醇配制成混合标准溶液(芦荟大黄素 14.5 mg·L-1,大黄酸120 mg·L-1,大黄素 10 mg·L-1)。另精密称取内标(1,8二羟基蒽醌)适量,用甲醇配制成质量浓度为161 mg·L-1的标准溶液。取上述溶液适量(除内标外),用甲醇稀释得质量浓度分别为芦荟大黄素 0.014 5~14.5 mg·L-1,大黄酸0.12~120 mg·L-1,大黄素 0.025~10 mg·L-1的标准系列溶液,于冰箱(4 ℃)内保存备用。
2 结果
2.1 方法学验证
2.1.1 方法专属性 空白组织、空白组织加入一定浓度的标准溶液、大鼠给药后组织样品色谱图见图1,可见组织中的内源性物质不干扰药物的测定。组织样品以肝组织为例。
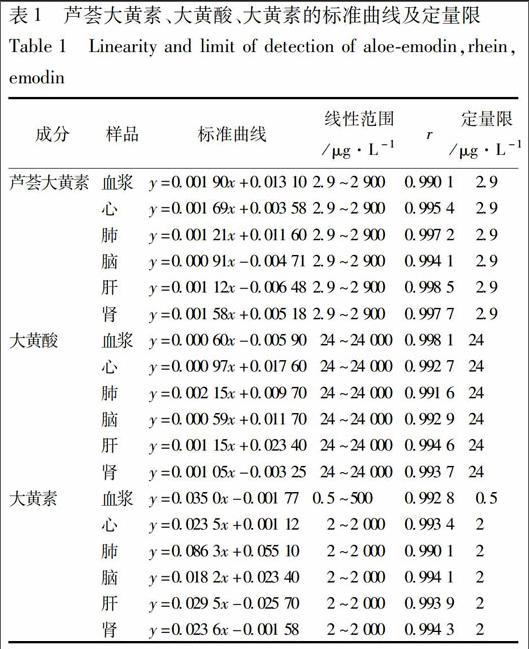
2.1.2 标准曲线和定量限 取空白组织匀浆80 μL,加入20 μL混合标准系列溶液,配制成相当于芦荟大黄素质量浓度为2.9,5.8,11.6,58,290,1 450,2 900 μg·L-1,大黄酸质量浓度为24,48,96,480,2 400,12 000,24 000 μg·L-1,大黄素质量浓度为2,4,8,40,200,1 000,2 000 μg·L-1的样品,按1.4项下方法操作,进行色谱分析。以待测物与内标物的峰面积比值y为纵坐标,待测物浓度x为横坐标,用最小二乘法进行计算得回归方程,结果见表1,各成分在测定范围内线性关系良好。
2.1.3 精密度和准确度 精密吸取芦荟大黄素、大黄酸和大黄素对照品混标溶液20 μL加入100 μL空白肝组织匀浆液,配制高、中、低3个浓度的质量控制(QC)样品(芦荟大黄素1 450,58,5.8 μg·L-1;大黄酸12 000,480,48 μg·L-1;大黄素1 000,40,4 μg·L-1)的含药组织样品,除不加入甲醇20 μL外,按“组织样品处理”操作,每一浓度进行6样本分析,连续测定3 d,计算QC样品的测得浓度,与配制浓度对照,求得测定方法的准确度(以RE表示)和精密度(以RSD表示),其中组织样品测定数据见表2。由表可知,生物样本的分析方法符合有关规范要求。
2.1.4 提取回收率 精密吸取芦荟大黄素、大黄酸和大黄素对照品混标溶液20 μL加入100 μL空白肝组织匀浆液,配制高、中、低3个浓度的质量控制(QC) 样品含药组织样品,除不加入甲醇20 μL外,按“组织样品处理”操作,每一浓度进行6样本分析,以提取后的色谱峰面积与未经提取直接进样获得的色谱峰面积之比,考察样品的提取回收率。其中组织样品测定数据见表3。
2.1.5 稳定性 按2.1.2项下方法配制芦荟大黄素、大黄酸、大黄素在组织样品中的高、中、低3个浓度的QC样品,每一浓度进行3样本分析,将上述3个浓度的样品置于-20 ℃冷冻,分别贮存14 d后解冻以及3次冻融循环,考察生物样本处理后室温放置24 h的稳定性。3个浓度QC样品测定结果的RSD均小于10%,表明芦荟大黄素、大黄酸和大黄素在室温下放置12 h和-20 ℃贮存14 d后解冻以及3次冻融循环条件下都具有较好的稳定性。结果3個浓度QC样品测定结果的RSD均小于10%,表明生物样本处理后室温放置24 h稳定。
2.2 组织分布研究
2.2.1 非房室模型分析 按1.4项下方法操作,测定大鼠组织样品,代入相应的标准曲线计算各时刻样品中芦荟大黄素、大黄酸、大黄素的浓度。然后将大鼠各组织中各成分浓度经时过程采用3P97程序进行统计矩分析,求得芦荟大黄素、大黄酸、大黄素在各组织中的AUC并用其表示各成分在组织中的分布情况。各成分在组织中的分布见图2。酒制能明显改变芦荟大黄素、大黄酸和大黄素在大鼠体内的分布,其中各成分在心与肺组织中的分布增加,在肝和肾中的分布与生品组相比变化不大,而在脑中没有检测到3种成分,说明芦荟大黄素、大黄酸和大黄素较难透过血脑屏障。
3 讨论
3.1 色谱质谱分析条件优化
为了实现峰形对称并且能在较短时间内同时测定分析3种成分,故对本实验中的色谱质谱条件进行了优化。发现3种成分在甲醇-3 mmol·L-1醋酸铵体系中有较高的响应。同时,对流动相中甲醇的比例也进行了考察,最终使用75%甲醇等度洗脱可使各成分达到基线分离,峰形对称。在上述色谱条件下,可实现样品中3种成分在较短时间内的同时分析。
芦荟大黄素、大黄酸、大黄素和1,8-二羟基蒽醌(内标)的质谱图见图3。本实验对质谱的射频电压(RF)、雾化气流速、毛细管电压等参数进行了优化,确定了质谱分析条件。同时考察了正离子模式和负离子模式下各成分的响应,发现负离子模式比正离子模式的响应值更高。另外,经过对各成分的全扫描确定了芦荟大黄素、大黄酸、大黄素和内标的质荷比,分别为268.85,268.85,282.80,239.95。
3.2 样品预处理方法优化
样品预处理是建立可靠、准确的LC-MS分析方法的关键步骤。为了确保从组织中提取的分析成分有较高的回收率并且无内源性物质干扰,故对生物样品的预处理方法进行了优化。比较了蛋白沉淀法和液-液萃取法2种较为常用的处理方法,结果发现使用蛋白沉淀无法消除样品中内源性物质的干扰。另外,考察了液-液萃取法,研究了不同的萃取溶剂(乙酸乙酯,乙醚,二氯甲烷,甲基叔丁基醚)对生物样品预处理的影响。结果发现乙酸乙酯作为萃取溶剂时可降低基质效应并得到较高的提取回收率。
3.3 靶向性评价
酒制后3种有效成分具有较强的心脏、肺脏趋向性,这与传统中医药理论中的“酒制升提”理论是相符合的,同时也对大黄经酒制后能够治疗上焦病症这一药效进行了有效的验证。
4 结论
传统中药炮制理论认为:药物酒制后有升提作用。从古至今,酒制法是中药炮制的重要方法之一。中医传统炮制理论和临床实践均采用酒制品治疗上焦病症。本实验建立了同时测定大鼠组织(心、肺、脑、肝、肾) 中芦荟大黄素、大黄酸、大黄素3种蒽醌类成分含量的LC-MS法;并采用本法比较了灌胃给药大黄生品/酒制品提取物后3种蒽醌类成分在体内组织分布的差异,结果发现,灌胃给予大鼠大黄生品/酒制品提取物后,芦荟大黄素、大黄酸和大黄素在动物体内分布迅速,且芦荟大黄素、大黄酸、大黄素不能透过血脑屏障。同时大黄酒制后各成分在心与肺组织中的分布增加,在肝和肾中的分布与生品组相比变化不大甚至有较小幅度降低。前期大鼠体内药动学实验结果显示大黄酒制后有助于促进芦荟大黄素和大黄素的吸收,其生物利用度增加,体内代谢较快,大黄酸的药动学参数变化不大[15],提示酒制对大黄物质基础有一定影响,从而影响有效成分的组织分布。传统中药炮制理论认为,药物酒制后有升提作用。本实验为临床应用酒大黄治疗上焦病症,如目赤肿痛,口舌生疮等疾病提供了科学依据。本实验通过比较大黄酒制前后游离蒽醌在大鼠体内的药动学和组织分布,为大黄酒制机制研究提供了实验依据。 深入炮制机制和药效研究,探明中药炮制改变药性的科学内涵变化规律,阐明饮片的炮制原理,丰富了中药药性理论的科学内涵,为临床应用奠定基础。
[参考文献]
[1] 中国药典. 一部[S].2015:23.
[2] 南海江,许旭东,陈士林,等.大黄属植物研究进展[J].天然产物研究与开发,2009,21(4):690.
[3] 谢燕,李国文,马越鸣.大黄多糖研究进展[J].中国新药杂志,2010,19(9):755.
[4] 郭志伟,刘琳娜.大黄及其有效成分的药理研究概况[J].中国药房,2006,17(22):1741.
[5] He Z H,Zhou R,He M F,et al.Anti-angiogenic effect and mechanism of rhein from Rhizoma Rhei[J].Phytomedicine,2011,18(6):470.
[6] 马永涛,玄延花,曹东铉.大黄醇提液抗柯萨奇B3病毒的初步研究[J].中国中医药科技,2001,8(5): 308.
[7] 姜晓峰,甄永苏.大黄素逆转肿瘤细胞多药抗药性的作用[J].药学学报,1999,34(3): 164.
[8] 中国药典.一部[S].2010:20.
[9] 孙佩.大黄三种饮片的质量标准研究[D].成都:成都中医藥大学,2008.
[10] 周现军. 不同炮制工艺对大黄中蒽醌成分含量的影响[J].辽宁中医药大学学报,2008(10):130.
[11] 田文艺.大黄的研究近况[J].湖南中医杂志,1992,11(4):51.
[12] 方芳,王伽伯, 赵艳玲,等.生熟大黄总提取物灌胃给药后游离蒽醌在SD大鼠组织中的分布差异研究[J].药学学报,2011,46(3):350.
[13] Shia C S, Tsai S Y, Lin J C. Steady-state pharmacokinetics and tissue distribution of anthraquinones of Rhei Rhizoma in rats[J]. J Ethnopharmacol,2011, 137: 1388.
[14] Tong L, Wan M X, Zhang L H. Simultaneous determination of baicalin, wogonoside, baicalein, wogonin, oroxylin A and chrysin of Radix Scutellariae extract in rat plasma by liquid chromatography tandem mass spectrometry [J]. J Pharm Biomed Anal, 2012,11(20):6.
[15] 吴育,蒋晟昰.酒制对大黄中游离蒽醌在大鼠体内的药动学的影响[C]. 石家庄:2014年中国药学大会暨第十四届中国药师周,2014.
[责任编辑 曹阳阳]

