微生物脂肪酶的性质及应用研究
杨 媛,张 剑
(山西大学化学化工学院,山西太原,030006)
微生物脂肪酶的性质及应用研究
杨 媛,张 剑
(山西大学化学化工学院,山西太原,030006)

脂肪酶是重要的工业酶制剂之一,微生物是其主要来源。脂肪酶广泛应用于医药领域、食品工业、洗涤剂工业以及相关的领域。对脂肪酶的种类以及发酵过程中所涉及的基因工程菌的构建、优化发酵工艺、分离提纯等进行了综述,并结合脂肪酶的分子结构,对脂肪酶的性质和应用方面进行了总结,为今后关于脂肪酶的进一步研究提供了便利。
脂肪酶;微生物;洗涤剂;发酵工艺
脂肪酶广泛存在于动植物和微生物中。其最早是从动物中发现的,1834年发现了兔胰脂肪酶,1864年发现了猪胰脂肪酶,1871年在植物种子中发现了脂肪酶。直到1901年才发现微生物脂肪酶[1-3]。微生物中细菌、真菌和酵母中的脂肪酶含量较为丰富。微生物种类多、繁殖快、易发生遗传变异,具有比动植物更广的作用pH、作用温度范围以及底物专一性,其可以在不需要辅酶的条件下,催化酯类化合物的水解、醇解、酯化、转酯化及酯类的逆向合成反应等,催化条件温和、能耗低、副产物少,具有高效、高选择性、环境友好等特点[4],改变了传统的酯化或转酯化反应所需要的高温、强酸、强碱等相对苛刻的条件。因此,微生物脂肪酶是工业用脂肪酶的重要来源。
1 微生物脂肪酶的种类
产生脂肪酶的微生物种类很多,迄今己报道的有65个属[5],其中细菌28个属,酵母菌10个属,放线菌4个属,其他真菌23个属。目前,脂肪酶产生菌中得到深入研究的主要集中在根霉[6]、曲霉[7-9]、青霉[10-11]、毛霉[12]、假单胞菌[13]等具有工业应用价值的菌种以及与医学相关的金黄色葡萄球菌、钩端螺旋体、粉刺状杆菌等。
2 微生物脂肪酶的发酵
近20年来,微生物脂肪酶发酵研究[14-15]主要集中在高产菌株的筛选、常规诱变育种、基因工程菌的构建、发酵工艺条件优化、发酵工艺放大和酶的分离纯化等方面。
2.1 高产菌株的筛选
筛选脂肪酶高产菌[16-18]的方法常见的是采用含甘油三酯琼脂平板。吴慧浩、陈强等人[17]在油脂培养基平板上进行培养初筛,在经过培养后若培养基呈红色(如图1),表明该菌株能产生脂肪酶。之后用聚乙烯醇选择性培养基挑选菌株中产酶能力较高的菌株,利用透明光圈和菌落直径比的大小能很清晰地了解菌株的产酶能力,直径比越大表示其产酶能力越高(如图2)。HaiKuan WANG等[19]研究4种产脂肪酶的不同菌株在维多利亚蓝琼脂平板上进行筛选,结果如图3所示,图3中,2是从洋葱伯克霍尔德菌分离的lp08脂肪酶,1、3和4是其他菌株脂肪酶,A是在25℃,pH=8的条件下各菌株的反应,B是在25℃,pH=9条件下各菌株的反应,C是在35℃,pH=9条件下各菌株的反应。从图3中得出菌株lp08在25℃,pH=9条件下有最大的酶活性。
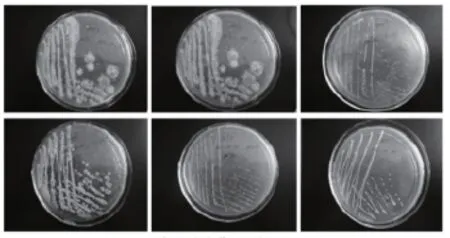
图1 产脂肪酶菌株初筛结果[17]

图2 产脂肪酶菌株复筛结果[17]
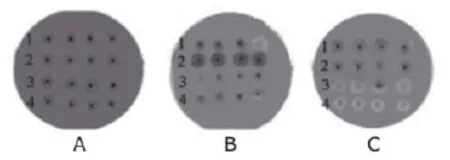
图3 4种不同菌株产的脂肪酶在维多利亚蓝琼脂平板上形成的环的大小[19]
2.2 常规诱变育种
目前,脂肪酶菌株诱变育种中,物理诱变剂是以紫外线为主,紫外光谱的作用光谱正好与细胞内核酸的吸收光谱相一致,因此,在紫外光作用下能使DNA链断裂、DNA分子内和分子间发生交联形成嘧啶二聚体,从而,导致菌体的遗传性状发生改变。谭珍连、梁静娟等人[20]以白地霉GXU08为出发菌,对其进行原生质体紫外诱变选育,其结果:筛选得到6株脂肪酶活力比出发菌株GXU08高的突变菌株,其中,菌株4-39的酶活比GXU08提高了63.2%。突变株经9次传代,3次摇瓶复筛,其脂肪酶的酶活性保持稳定,为今后进一步研究不同的育种方法进一步提高脂肪酶的产量打下了基础。化学诱变剂常用的有亚硝酸、亚硝酸胍、硫酸二乙酯等,例如亚硝酸主要作用于DNA分子的嘌呤碱基。吕熹、王刚等人[21]以蜡状芽孢杆菌SW06为出发菌株,通过紫外诱变筛选得到突变株BZ-3,其产脂肪酶的活力较SW06高2.49倍。再对BZ-3进行亚硝酸钠诱变,得到突变株BF-3,产脂肪酶活力较SW06提高4.11倍。将BF-3传到第5代,其产酶较稳定。一般可以通过诱变育种将脂肪酶的产量提高1~10倍。
2.3 脂肪酶基因工程菌的构建
通常情况下,常规育种方法很难满足工业化生产的需要,通过基因工程[22-23]手段克隆相应的脂肪酶基因,然后在异源宿主菌中实现大量表达,从而大幅提高脂肪酶的产量。1988年丹麦Novo公司成功将柔毛腐质霉的碱性脂肪酶基因克隆导入适合发酵生产的米曲霉工程菌株中,脂肪酶产量提高了近1000倍,实现了年产几百吨的工业化生产[24]。这是第一个运用基因工程技术生产脂肪酶从实验室走向市场的成功范例。Ma等采用强启动子大量表达枯草芽孢杆菌(B.subtilis)脂肪酶,酶产量较原始菌株提高了100倍[25]。
2.4 脂肪酶培养基
工业发酵过程中,设计一个发酵培养基是至关重要的。培养基一般由碳源、氮源及无机盐等组成。速效碳源有利于细菌脂肪酶的形成,黄家岭[26]研究发现:细菌发酵产脂肪酶的最佳碳源和最佳氮源分别是蔗糖和酵母粉。有报道指出:当培养基中含有单糖、双糖和甘油会抑制脂肪酶产生[27]。一般认为,复合氮源对微生物生长及产酶效果较好[28]。Rashid的研究表明:添加EDTA于反应体系中能完全抑制嗜冷假单胞菌KB700A所产的低温脂肪酶的活力,而添加Ca2+能显著提高酶活[29]。培养基的组成影响产品浓度、产量和效率;在商业化生产中,培养基的成本明显影响总生产成本。优化培养基涉及大量的实验研究,是一个耗费时间精力的过程。
2.5 发酵工艺优化
影响发酵过程的因素有很多,主要包括培养基组成、接种量、种龄、培养温度、转速、装液量、发酵周期、溶氧、pH值和通气条件等,这些因素往往又不是独立影响发酵过程的,常常是交互作用。除传统的单因子法、正交设计法[30]在生物过程优化中得到广泛应用外,响应面法[31]在发酵培养基的优化及过程控制中逐步得到推广应用,并日益显示出优越性。张蕾等人[32]通过单因素实验、Plackett-Burrman设计及响应面法对芽孢杆菌T3-4的产脂肪酶条件进行优化。确定最适C 、N 源分别为麦芽糖、蛋白胨+硫酸铵,碳氮比为1:3。其最适产酶条件为:七水硫酸镁0.05%,蓖麻油1.5%,蛋白胨0.75%,磷酸氢二钾0.1%,麦芽糖0.5%,硫酸铵0.3%,pH6.5 ,接种量10%。在此条件下,发酵脂肪酶活力可达 805.836 U/mL 。优化后的培养基组成摇瓶发酵酶活力与初始相比,约提高24.79倍 。
2.6 高密度发酵[33]
高效的表达手段是获得足够量目的产物的关键。毕赤酵母[35-36](Pichia pastoris)能在廉价的培养基上生长至较高的细胞密度而被广泛用于高密度发酵。由于甲醇能够诱导毕赤酵母表达载体中醇氧化酶启动子高效表达,柯锋[34]对含有GCL B基因的重组毕赤酵母(Pichia pastoris)甲醇利用正型(Mut+)和甲醇利用慢型(Muts)工程菌进行研究发现:通过Mut+菌株的摇瓶发酵条件优化得出其最佳产酶条件的甲醇添加量为1%,而后进行10L发酵罐高密度发酵产酶条件优化,酶活生产率为30.69U/(mL·h);通过Muts菌株的摇瓶发酵条件优化得出其最佳产酶条件的甲醇添加量为0.6%,10L发酵罐高密度发酵后,酶活生产率为27.69U/(mL·h)。
2.6 酶的分离提纯[37]
酶的分离纯化一般包括3个基本步骤:即抽提、纯化、结晶或制剂。首先,将所需的酶从原料中引入溶液,此时不可避免地夹带着一些杂质。然后,再将此酶从溶液中选择性地分离出来,或者从此溶液中选择性地除去杂质。再其后,制成纯化的酶制剂。
3 脂肪酶的分子结构
研究表明,多数脂肪酶是一种糖蛋白,其糖基部分占分子量的2%~15%,以甘露糖为主,整个分子由亲水部分和疏水部分组成,活性中心靠近分子的疏水端;来源不同的脂肪酶,其氨基酸组成数目从270~641不等,从已报道的文献来看,相对分子质量为16~200kD[38-39]。目前,脂肪酶蛋白分子的3D结构(见图4)已经得到初步的阐明,大多脂肪酶都具有水解酶折叠的结构特征,即α螺旋和β折叠(见图5)[40]。典型的α/β水解酶折叠为一个八链的平行α/β结构。该结构包含一条反平行于其他链的β2。第一个和最后一个螺旋αA和αF位于折叠片的一面,其他的螺旋位于另一面。α/β折叠结构能够为酶的活性位点提供一个稳定的支撑结构。
虽然来源于不同微生物的脂肪酶在分子量、氨基酸序列、底物特异性及其他理化性质上存在较大的差异,但是它们都具有相似的α/β水解酶折叠。人们已经利用X-衍射等手段和定向修饰等技术确定了组成脂肪酶活性中心的三元组(triad)结构。脂肪酶的催化活性中心是由丝氨酸(Ser)、 组氨酸(His)、 天冬氨酸(Asp)组成的催化三联体结构[41]。
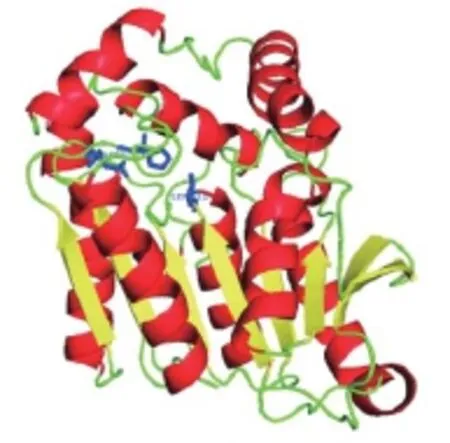
图4 脂肪酶的3D结构[40]
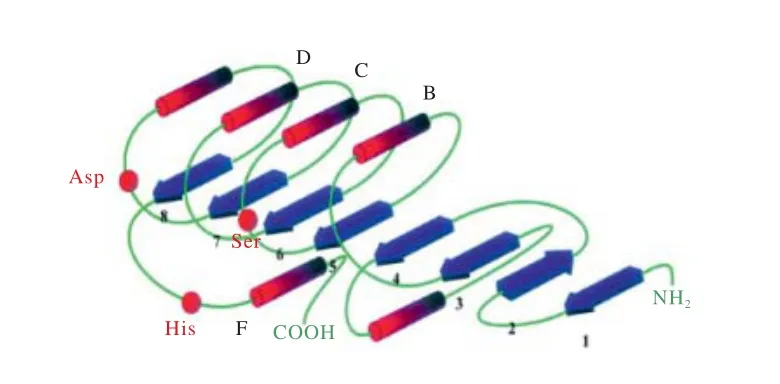
图5 α/β水解酶折叠图解[40]
[40]
4 脂肪酶的特性[42-43]
4.1 催化特性
脂肪酶不同活性的发挥依赖于反应体系的特点,在油水界面促进酯水解,而在有机相中可以酶促合成和酯交换(图6)。脂肪酶的催化特性在于:在油水界面上其催化活力最大,溶于水的酶作用于不溶于水的底物,反应是在两个彼此分离的完全不同的相界面上进行[44]。这是脂肪酶区别于酯酶的一个特征。酯酶(EC3.1.1.1)作用的底物是水溶性的,并且其最适底物是由短链脂肪酸(≤C8)形成的酯[45]。
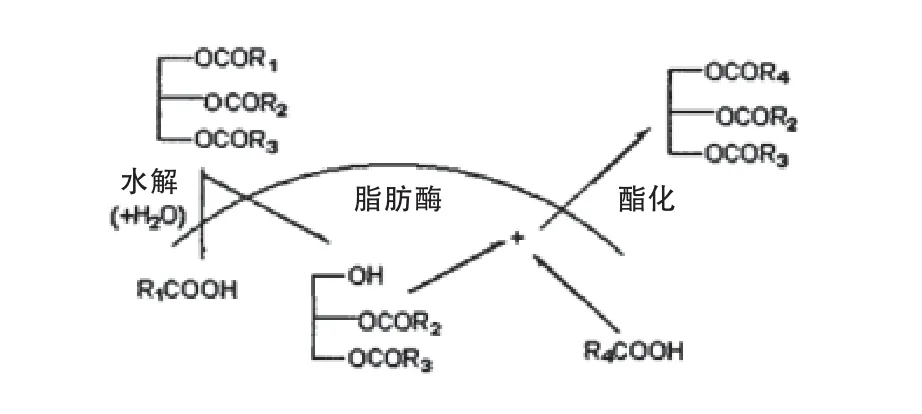
图6 油脂酯交换反应过程中脂肪酶在油水界面被活化的示意图[45]
4.2 底物特异性
不同来源的脂肪酶对底物油脂中脂肪酸的链长、不饱和度及不饱和脂肪酸的双键位置表现出不同的脂肪酸特异性[46]。例如圆弧青霉脂肪酶对短链(C8以下)脂肪酸形成的甘油三油酸酯有特异性,黑曲霉脂肪酶对C2-C18范围的脂肪酸均可水解,根霉和白地霉脂肪酶对中等链长(C8-C12)脂肪酸有强烈特异性。玉米、蓖麻子、油菜籽等植物种子的脂肪酶分别对三癸酸和三亚麻酸甘油酯、三蓖麻醇酸甘油酯、廿二碳酸甘油酯有很高的水解活力.猪胰脂肪酶对短链酸(特别是三丁酸甘油酯)水解特异性高。
4.3 位置特异性[46]
大部分脂肪酶作用于三脂酰甘油的初级位(1 位或3 位)酯键。研究发现:猪胰脂肪酶仅水解1位和3位酯键;Noma用放射性标记法研究蓖麻子脂肪酶特异性发现:其对1或3和2位酯键水解速度相同;Okumura研究了4种微生物脂肪酶水解甘油三油酸酯的位置特异性,结果如图7所示:黑曲霉和根霉脂肪酶仅催化1或3位酯键水解,对2位酯键无作用;白地霉和圆弧青酶脂肪酶无位置特异性,能水解甘油三酯的所有酯键。
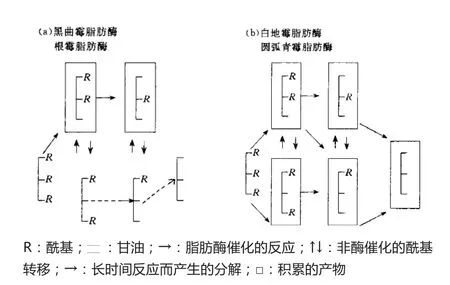
图7 四种微生物脂肪酶水解甘油三酯机制[46]
来源于卡门柏青霉 U-150 和米曲霉的脂肪酶存在一类较特殊的脂肪酶,它仅作用于单脂酰或二脂酰甘油,而对三脂酰甘油完全不起催化作用,与三脂酰甘油脂肪酶一起使用时,能协助或加速三脂酰甘油的彻底水解,所以被称为单-双脂酰甘油脂肪酶[47]。
4.4 立体特异性
酶作用的底物应具有特定的立体结构才能被催化。脂肪酶对三脂酰甘油立体对应结构1 位和3位具有选择性水解能力,并且能够以不同的反应速率选择性催化两种对映体。Akesson 等发现:来源于荧光假单胞菌脂肪酶水解2 位和3 位酯键的二酰基甘油比水解它的对应体速度快得多。因此,可利用脂肪酶这种立体选择性进行动力学拆分得到高产率的光学活性产物[48]。
5 脂肪酶的应用
5.1 在医药中的应用
脂肪酶是脂肪代谢最基本的酶,它的缺乏必将引发严重的健康问题。脂肪酶的外部调节可以帮助消化,此外,脂肪酶还是一种重要的中间体标记物或药物靶[49]。作为诊断工具,脂肪酶的活性水平和血液中脂肪酶的水平可分别用于心脏疾病和胰脏疾病的诊断和预测,脂肪酶还用于消化不良、肠胃功能紊乱和恶性肿瘤等的治疗。
5.2 在食品中的应用
国内外大量的研究表明:sn-1,3位专一性脂肪酶适用于生产结构脂质、母乳脂肪替代品、类可可脂和甘油二酯等[50-51]。利用脂肪酶作用反应后,释放出链较短的脂肪酸能增加和改进食品的风味和香味,特别是奶油和奶酪的风味在人造黄油、点心和冷糕点等的制作中是不可缺少的;利用脂肪酶催化的醇解和醋(酯)化反应生产各种香精醋(酯)作调料剂;用有专一性的微生物脂肪酶,如使用青霉属的丝状菌产生的脂肪酶将二酰甘油选择性水解成甘油和脂肪酸,从而,增加油脂中三酰甘油的含量,提高棕榈油等食用油的营养价值,制备精制油脂,改善面包质量,添加脂肪酶防止来自蛋黄的污染脂肪混入产品中引起发泡能力的下降,改善蛋白的发泡等。
5.3 在造纸工业与皮革加工中的应用
脂肪酶在造纸工业上的应用主要集中在废纸脱墨和树脂控制这两方面。研究表明:脂肪酶能直接分解废纸上的油墨、涂料及色料,达成脱墨效果;去除纸浆中的树脂,去除造纸用白水及冷却水的黏泥。使用脂肪酶对废纸进行脱墨,不但脱墨效果较好,而且可以显著减少化学制剂如烧碱、硅酸钠、双氧水的使用,对纸浆纤维无损伤,大大减轻污水处理的压力,综合成本显著降低[52-53]。
作为一种高效无污染的脱脂剂,脂肪酶在皮革脱脂工艺上尤其具有重要的用途,在碱性条件下使得脂肪更易从皮中除去[54]。黄建忠等人[55]的研究表明:碱性脂肪酶不仅可以脱尽皮板深层油脂,而且可以软化皮板。酶法脱脂的皮革其抗张强度、伸长率、撕裂强度以及崩裂高度均优于碱法和表面活性剂法,提高了皮革的等级率。酶法脱脂皮板柔软、富有弹性、粒面毛孔清晰,且毛光亮柔软,对皮革质量有明显的提高。
5.4 在洗涤工业中的应用[56-57]
对人们衣服所附污垢进行详细分析发现:脂肪污垢约占总污垢的3/4。以前的洗涤剂主要靠表面活性剂和助剂的作用去除,效果不是很理想,尤其是甘油三脂[58]。由于脂肪酶能高效地将甘油三酯分解为容易去除的脂肪酸和甘油,因此,在洗涤剂中添加脂肪酶可以大大提高对脂肪污垢的去除效果。此外,由于添加酶制剂,可以减少洗涤剂中的表面活性剂及无机助剂(尤其是三聚磷酸钠)的用量,可以大大减少环境污染。
5.5 催化合成生物柴油
如今,人类对不可再生能源的依赖不断增强,以生物手段研发新的可再生能源成为人们关注的课题,生物柴油就是其中一种。它是指以可产生油料的动物、植物、微生物及各种油脂(如动物油脂、油料作物、垃圾油等)为原料,以合适的生物手段将其转化成为可再生性柴油燃料,而最典型的生物柴油是脂肪酸甲酯[59]。姚志龙、 闵恩泽[60]在研究中指出,生物柴油是以动植物油脂、餐饮业废油或工程微藻等为原料制成的高级脂肪酸甲酯。由于脂肪酶较多适用于长链脂肪醇的转酯化反应,对短链脂肪醇的效果不甚明显,所需酶类的成本较高,重复利用率又不高等缺点,目前,国内外都尚未将脂肪酶催化合成生物柴油进行较大规模化的工业生产。
[1] 陈雄金.脂肪酶的研究及其应用[J].科技资讯,2008(19):58.
[2] P.Kanmani,J.Aravind.An insight into microbial lipase and their environmental facet[J]. International Journal of Environmental Science and Technology,2015,3(12):1147-1162.
[3] Saisubramanian Nagarajan.New Tools for Exploring “Old Friends Microbial Lipases”[J]. Applied Biochemistry and Biotechnology,2012,5(168):1163-1196.
[4] 杨柳.脂肪酶的应用与研究现状[J]. 硅谷,2012.
[5] 汪小锋,王俊,杨江科,等.微生物发酵生产脂肪酶的研究进展[J].生物技术报,2008,4:47-53.
[6] 颜兴和,王栋,徐岩.根霉脂肪酶的研究进展[J].工业微生物,2005,35(3):45-49.
[7] 杨学昊,尹春华,傅四周,等.根霉脂肪酶发酵优化和酶性质的研究[J].中国油脂,2004,29(7):29-32.
[8] De Chen, Zhengyu Shu, Longyin Xue, et al.Construction of Aspergillus niger lipase mutants with oil-water interface independence[J].生物工程学报,2011,27(6):860-867.
[9] Jin-lan Xia,Bin Huang,Zhen-yuan Nie,et al.Production and characterization of alkaline extracellular lipase from newly isolated strain Aspergillus awamori HB-03[J].Journal of Central South University of Technology,2011,18:1425.
[10] Zhengping Zhang, Jiangke Yang, Li Xu, et al.Cloning, codon optimization and expression of mature lipase gene Penicillum expansum[J].微 生物学通报,2010,50(2):228-235.
[11] De AL,Gomes P,Sant AG.Production and Regulation of Lipase Activity from Penicillium restrictum in Submerged and Solid-state Fermentations[J].Current Microbiology,2007,54(5):361-365.
[12] 肖春玲,宋欣,曲音波.毛霉脂肪酶的研究[J].微生物学通报,1998,25(5):274-277.
[13] 孙苗苗,陈辉,吴坚平,等.产碱假单胞脂肪酶的克隆表达及酶学性质研究[J].微生物学通报,2012,39(11):1580-1588.
[14] 鲍家兰,李能树.霉菌产脂肪酶发酵条件的研究[J].安徽大学学报,2001,25(1):96-99.
[15] 文乐雷.脂肪酶的发酵工艺[D].武汉:湖北大学,2011,1-8. [16] 郭冉冉.高产脂肪灭菌株的筛选及酶学性质的研究[D].重庆:西南大学,2010,1-46.
[17] 吴慧昊,陈强,钟琦,等.高产脂肪酶菌株筛选[J].西北民族大学学报,2015,36(100):51-54.
[18] Saoussen Turki.Toward the development of systems for high-yield production of microbial lipase[J].Biotechnology Letters,2013,10(35):1551-1560.
[19] Haikuan WANG,Ruijuan LIU,et al.A novel alkaline and low-temperature lipase of Burkholderia cepacia isolated from Bohai in China for detergent formulation[J].Annals of Microbiology,2009,59(1):105-110.
[20] 谭珍连,梁静娟,庞宗文,等.原生质体紫外诱变选育白地霉GXU08脂肪酶高产菌株[J].生物技术,2007,17(2):42-44.
[21] 吕熹,王刚,李俊,等.紫外、亚硝酸钠诱变筛选高产耐有机溶剂脂肪酶菌株[J].吉林农业大学学报,2010,32(4):394-397.
[22] 舒正玉,王爱玲,杨江科,等.提高微生物脂肪酶产量、活性的稳定性的方法研究[J].工业微生物,2007,37(3):52-57.
[23] Wenjuan Yang,Hai Cao,Li Xu,et al. A novel eurythermic and thermostale lipase LipM from Pseudomonas moraviensis M9 and its application in the partial hydrolysis of algal oil[J].2015,15:94-108.
[24] Adrio JL,Demain AL.Genetic improvement of processes yielding microbial products[J].FEMS Microbiology Reviews,2006,30(2):187-214.
[25] Ma J, Zhang Z, Wang B.Overexpression and characterization of a lipase from Bacillus subtilia[J].Protein expression and Purification,2006,45(1):22-29.
[26] 黄家岭.细菌源脂肪酶的发酵生产及其纯化和固定化工艺研究[D].贵阳:贵州师范大学,2009,1-11.
[27] Fickers P, Fudalej F, Nicaud JM.Selection of new over-producing derivatives for the improvement of extracellular lipase production by the nonconventional yeast Yarrowia lipolytica[J].Journal of Biotechnology,2005,115(4)379-386.
[28] 杨学昊,王炳武,谭天伟.根霉产脂肪酶的碳源和氮源选择优化[C].第四届中国酶工程学术交流讨论会,2003.
[29] Rashid N, Shimada Y, Ezaki S. Low-temperature lipase from psychrotrophic Pseudomonas sp strain KB700A[J].2001,67(9):4064-4069.
[30] 陈雪平,周友明,马强,等.混合水平正交设计的最优选择[J].数理统计与管理,2016,35(5):403-410.
[31] Elisangela Wolski,Elisangele Menusi,et al.Response Surface Methodology for Optimization of Lipase Production by an Immobilized Newly Isolated Penicillium sp[J].Industrial &Engineering Chemistry Research,2008,47(23):9651-9657.
[32] 张蕾,黎继烈,蒋丽娟.响应面法优化芽孢杆菌产脂肪酶发酵条件[J].中南林业科技大学学报,2010,30(9):126-131.
[33] M.N.I.Salehmin,M.S.M.Annuar.High cell density fed-batch fermentations for lipase production:feeding strategies and oxygen transfer[J]. Bioprocess and Biosystems Engineering,2013,11(36):1527-1543.
[34] 柯峰.毕赤酵母高密度发酵生产白地霉脂肪酶研究[D].武汉:华中科技大学,2012,1-65.
[35] Hak-ryul Kim,In-Hwan Kim,et al.Production of a Novel Cold-Active Lipase from Pichia Iynferdii Y-7723[J].Agricultural and Food Chemistry,2011,58(2):1322-1326.
[36] Sun-Young Park,Ji-Yeon Kim,et al.Optimization of Culture Conditions for Production of a Novel Cold-Active Lipase from Pichia Iynferdii Y-7723[J].Agricultural and Food Chemistry,2013,61(4):882-886.
[37] 舒正玉,杨江科,闫云君,等.黑曲霉F044脂肪酶的分离纯化及酶学性质研究物工程学报,2007,23(1):96-100.
[38]刘虹蕾,繆铭,江波,等.微生物脂肪酶的研究与应用[J].食品工业科技,2012,12:376-381.
[39] Helen Treichel.A Review on Microbial Lipase Production[J].Food and Bioprocess Technology,2010,2(3):182-196.
[40] 韦宇拓,滕昆.脂肪酶的分子结构及应用研究进展[J].广西科学,2014,21(2):93-98.
[41] 郭诤,张根旺.脂肪酶的结构特征和化学修饰[J].中国油脂,2003,28(7):5-10.
[42] Serpil Ugras.Sebnem Uzmez.Characterization of a newly identified lipase from a lipas e- producing bacterium[J].Frontiers in Biology,2016,4(11):323-330.
[43] 陈倩婷.脂肪酶特性与应用[J].饲料研究,2011,6:5-8.
[44] 李香春,甄宗园.脂肪酶特性及其应用[J].粮食与油脂,2003,3:19-20.
[45] 刘书来.脂肪酶催化的研究进展[J].化工科技市场,2003,26(4):16-20.
[46] 曹淑桂.脂肪酶的底物特异性及其应用潜力[J].生物化学与生物物理进展,1995,22(1):9-13.
[47] Xiao-Sheng Lin,Kai-Hua Zhao,et al.Aspergillus oryzae lipase-catalyzed synthesis of glucose laurate with excellent productivity[J]. Bioresources and Bioprocessing,2016,3:2-7.
[48] 韦晗宁,石玲玲,武波.筛选立体特异性脂肪酶拆分消旋扁桃体酸甲酯制备S-扁桃酸[C].第二届中国青年学者微生物遗传学学术研讨会,2006.
[49] 王智,董桓,曹淑桂.脂肪酶在手性药物中间体制备中的应用[J].药物生物技术,2003,10(2):112-115.
[50] 曹茜,冯凤琴.微生物脂肪酶的研究进展及其在食品中的应用[J].中国食品学报,2013,13(10):136-143.
[51] 韦伟,冯凤琴.sn-1,3位专一性脂肪酶在食品中的应用[J].中国粮油学报,2012,27(2):122-128.
[52] 戴苏.两种脂肪酶基因在毕赤酵母中的表达及其对旧报纸脱墨的评价[D].广州:华南理工大学,2012.
[53] 王洪振.脂肪酶等在造纸过程中的应用及机理研究[D].济南:山东轻工业学院,2011,1-3.
[54] 王玉增,刘彦.脂肪酶的发展概况及在制革中的应用[J].中国皮革,2014,43(17):36-41.
[55] 黄建忠,郑毅,施巧琴,等.中温碱性脂肪酶的研究[J].工业微生物,1996,26(4):7-10.
[56] Slim Cherif ,Sami Mnif,et al.A newly high alkaline lipase: an ideal choice for application in detergent formulations[J].Lipids in health and disease,2011,10(1):221-228.
[57] Yang Dong jie,Qiu Xue qin,Chen Huan qin. Studies on the Application of Lipase in Detergency[J]. Journal of South China University of Technology,2002,30(1):75-78.
[58] 郑毅,吴松刚,施巧琴.洗涤剂—碱性脂肪酶的研究概述[J].日用化学工业,2001,31(1):35-38.
[59] Abdul Razack Sirajunnisa.An alternative method for production of microalgal biodiesel using novel Bacillus lipase[J].Springer,2014,5:715-725.
[60] 姚志龙,闵恩泽.生物柴油(脂肪酸甲酯)化工利用技术进展[J].天然气工业,2010,30(1):127-132.
Study on Properties and Application of Microbial Lipase
Yang Yuan, Zhang Jian
(College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan030006, Shanxi, China)
Lipase is one of the important industrial enzymes. Microorganism is the main source of the lipase. Lipase is widely used in the field of medicine, food industry, washing industry and related areas. Types of lipase and the construction of genetic engineered bacteria, optimization of fermentation, separation and purification involved in fermentation process were reviewed, and properties and application of lipase were summarized based on the molecular structure of lipase, which provides convenience for further study of lipase in the future.
microorganism; lipase; detergent; fermentation
TQ925;TQ649
A
1672-2701(2017)04-47-08
2016年度山西省重点研发计划国际合作资助项目(201603D421029)。
杨 媛女士,研究生; E-mail:1162403532@qq.com。
张 剑女士,教授,博士; E-mail:zhangjian0923@vip.sina.com。

