二次培养对大龙骨藻总脂、EPA及PUFA含量的影响
丁玉惠,蒋霞敏,张泽凌,韩庆喜,梁晶晶
(宁波大学 海洋学院,浙江 宁波 315211)
生物工程
二次培养对大龙骨藻总脂、EPA及PUFA含量的影响
丁玉惠,蒋霞敏,张泽凌,韩庆喜,梁晶晶
(宁波大学 海洋学院,浙江 宁波 315211)
为探究二次培养(低温和高光照强度胁迫)对大龙骨藻(Tropidoneismaxima)总脂、EPA及PUFA 含量的影响,将大龙骨藻置于适宜条件(温度25℃,光照强度36 μmol/(m2·s),盐度25)下培养10 d后,采用单因子试验,在低温(10℃)或高光照强度(80 μmol/(m2·s))条件下进行二次培养,并进一步进行低温、高光照强度二因子三水平二次培养试验。结果表明:二次培养最佳时间为3 d;低温10℃有利于EPA和PUFA积累,分别可达(28.48±0.47)%和(43.28±1.06)%;光照强度80 μmol/(m2·s)有利于总脂、EPA和PUFA积累,分别可达(43.19±1.29)%、(27.11±0.25)% 和(41.78±0.22)%;在低温10℃、高光照强度80 μmol/(m2·s)交互作用下更有利于总脂、EPA、PUFA积累,分别可达(42.99±2.51)%、(32.83±0.58)%和(46.43±0.22)%。综上所述,二次培养方式有利于藻生长和油脂积累达到较高水平,为提高微藻产油量提供了一种新的培养方法,值得深入研究。
大龙骨藻;二次培养;总脂;EPA;PUFA
近年来产油微藻由于生长快速、产油量高[1],可以在短期内获得大量油脂而成为生物能源开发的重点[2]。同时因其油脂中所含的高不饱和脂肪酸是人类及动物的生理活性物质[3],因此如何提高微藻的油脂含量成为了一项重要的研究。大部分含油微藻通过光合作用依靠还原戊糖磷酸途径(C3途径)[4]将H2O、CO2及无机盐转化为油脂,其主要成分为甘油三酯(80%)和C14~C22的长链脂肪酸,是组成细胞膜结构、细胞代谢物及能量的来源[5-6]。培养环境的变化会影响细胞中酶的活性、脂肪酸的代谢速率以及细胞膜的流动性等,同时也影响藻细胞中的油脂积累量[7-10],因此对培养环境的研究既可以提高产油微藻的生物量,还可以提高油脂的积累量。
大龙骨藻(Tropidoneismaxima)隶属硅藻门、羽纹纲、舟形藻目、舟形藻科、龙骨藻属,是新分离的海洋微藻,具有生长快、易收集、油脂含量高、EPA含量丰富等特点[11],是较理想的产油微藻。但培养中发现该藻快速生长和油脂积累(特别是EPA)所适应的理化因子条件不同,生物量及油脂含量较难统一。
一般来说,理化因子对藻生长和油脂含量的影响分为“适宜模式”和“胁迫模式”[12]。“适宜模式”指在适宜生长的条件下能促进藻生物量提高[13-14],而“胁迫模式”虽不利于藻快速生长,但能使油脂含量提高[15]。针对一次培养难以解决生物量与油脂含量的矛盾,我们提出了二次培养方法,即将微藻先置于最适环境中培养,至生长指数后期(达到最大生物量)迅速转入胁迫环境下培养,以提高油脂积累量,使生物量及油脂含量均达到较高水平[16]。但不同微藻对胁迫因子适应能力不同,为探究大龙骨藻的富油的最佳胁迫因子,本试验采用单因子试验和正交试验研究了低温、高光照强度二次培养对大龙骨藻总脂、脂肪酸组成、EPA含量的影响,以期为大龙骨藻的规模化培养和综合利用提供理论依据。
1 材料与方法
1.1 试验材料
试验藻种大龙骨藻是本实验室从浙江渔山列岛海域(121°30′~123°25′E、29°32′~31°04′N)拖网,水样带回实验室,采用微吸管分离、纯化得到,由宁波大学饵料生物培养室保藏。培养用水采用象山港天然海水,经沙滤、暗沉淀、脱脂棉过滤和烧开冷却。培养容器为3 L锥形瓶,培养水体各2 L。营养盐:氮质量浓度26.5 mg/L,磷质量浓度2 mg/L,铁质量浓度0.5 mg/L,硅质量浓度0.5 mg/L;接种藻密度5×104cell/mL,置于GXZ智能型光照培养箱(宁波江南仪器厂)培养。控制适宜条件:温度25℃,光照强度36 μmol/(m2·s),光暗周期12 h∶12 h,盐度25,pH 8.10。
1.2 试验方法
1.2.1 低温二次培养试验
大龙骨藻在1.1适宜培养条件下培养10 d,移入低温10℃(低温条件根据张泽凌等[15]温度筛选确定)进行二次培养,设对照组(25℃),各15个平行,培养时间4 d,每日定时取3个平行样,测定藻的总脂含量及脂肪酸组成。
1.2.2 高光照强度二次培养试验
大龙骨藻在1.1适宜培养条件下培养10 d,移入高光照强度(80 μmol/(m2·s))(高光照强度条件根据张泽凌等[15]光照强度筛选确定)下进行二次培养,设对照组(36 μmol/(m2·s)),各15个平行,培养时间4 d,每日定时取3个平行样,测定藻的总脂含量及脂肪酸组成。
1.2.3 低温、高光照强度二因子二次培养试验
采用低温、高光照强度二因子三水平试验。将1.1适宜培养条件下培养10 d的大龙骨藻,进行二因子(光照强度和温度)三水平二次培养试验(见表1),各3个平行,培养时间为3 d,试验结束测定藻的总脂含量及脂肪酸组成,其他条件同1.1。
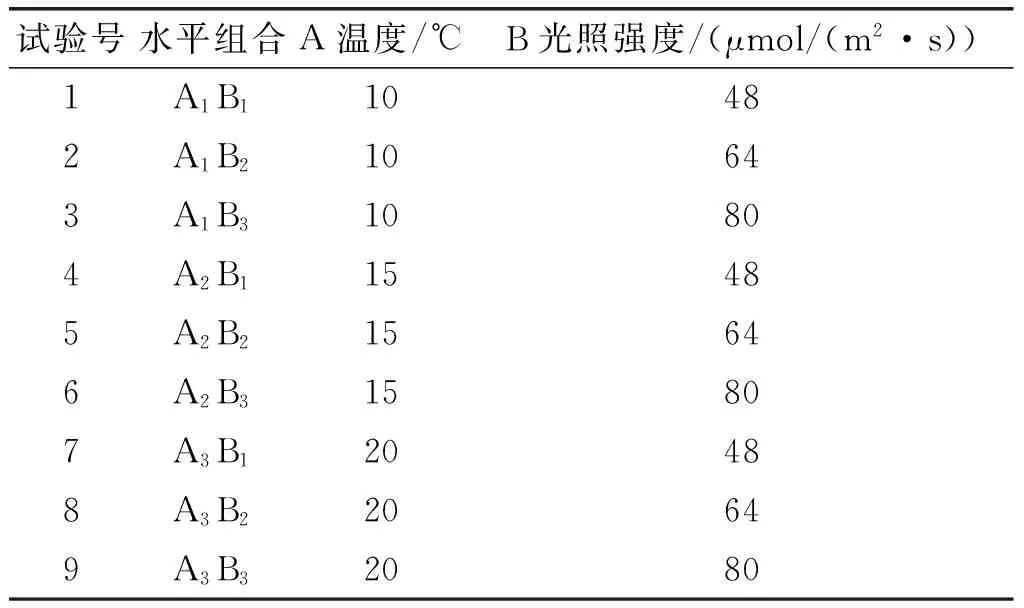
表1 二因子三水平二次培养试验
1.2.4 总脂含量及脂肪酸组成的测定
1.2.4.1 样品处理
试验藻先静放,去上清液,底部藻液离心(4 000 r/min)10 min,用蒸馏水洗涤,再离心,反复2次。将离心后得到的藻泥放入冰箱,-20℃下冷冻。1 d后进行冷冻干燥(FD5-3T立式冷冻干燥机,Gold-SIM),称重。
1.2.4.2 总脂含量测定
称取100 mg左右的藻粉,采用改良后的 Bligh-Dyer法抽提总脂,分层后下层氯仿层旋转蒸发至恒重,得到总脂含量。
1.2.4.3 脂肪酸组成测定
提取到的总脂加入5%~6%KOH-甲醇水溶液(体积比 4∶1),14%BF3-甲醇溶液,进行皂化甲酯化[17-18],采用QP2010气相色谱-质谱分析仪(日本SHIMADZU公司)进行分析[19-20],用面积归一化法计算各脂肪酸相对含量。
1.2.5 数据处理
试验所得数据用“平均值±标准偏差”表示,采用SPSS 17.0统计软件进行单因素方差分析和Duncan多重比较分析(P=0.05),利用Excel进行图表制作。
2 结果与分析
2.1 低温二次培养
2.1.1 低温二次培养对大龙骨藻总脂含量的影响(见图1)
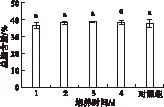
注:不同小写字母表示P<0.05水平下差异显著。
图1 低温(10℃)二次培养对大龙骨藻总脂含量的影响
由图1可知,低温二次培养对大龙骨藻的总脂含量影响不显著(P>0.05)。藻在10℃低温培养条件下,随着培养时间的延长,藻的总脂含量略有升高,在3 d时获得最大总脂含量(39.10±0.34)%,但与对照组和其他组无显著差异(P>0.05)。
2.1.2 低温二次培养对大龙骨藻脂肪酸组成的影响(见表2)
由表2可知,低温二次培养对大龙骨藻脂肪酸组成有显著影响(P<0.05)。二次培养初期,脂肪酸含量开始改变。随着培养时间的延长,EPA含量逐渐增加,在4 d时获得最大EPA含量(28.65±0.21)%,显著高于对照组的(25.38±1.31)%(P<0.05),而与3 d时的含量无显著差异(P>0.05);DHA含量也随着培养时间的延长逐渐增加,在4 d达到最大值(4.77±0.30)%,显著高于对照组的(3.28±0.77)%(P<0.05);PUFA含量在3 d时达到最大值(43.28±1.06)%,与4 d时的含量无显著差异(P>0.05),而显著高于对照组的(39.13±0.94)%(P<0.05);n-3 PUFA含量在4 d时达到最大值(33.42±0.48)%,与3 d时的含量无显著差异(P>0.05),而显著高于对照组的(27.66±0.87)(P<0.05)。
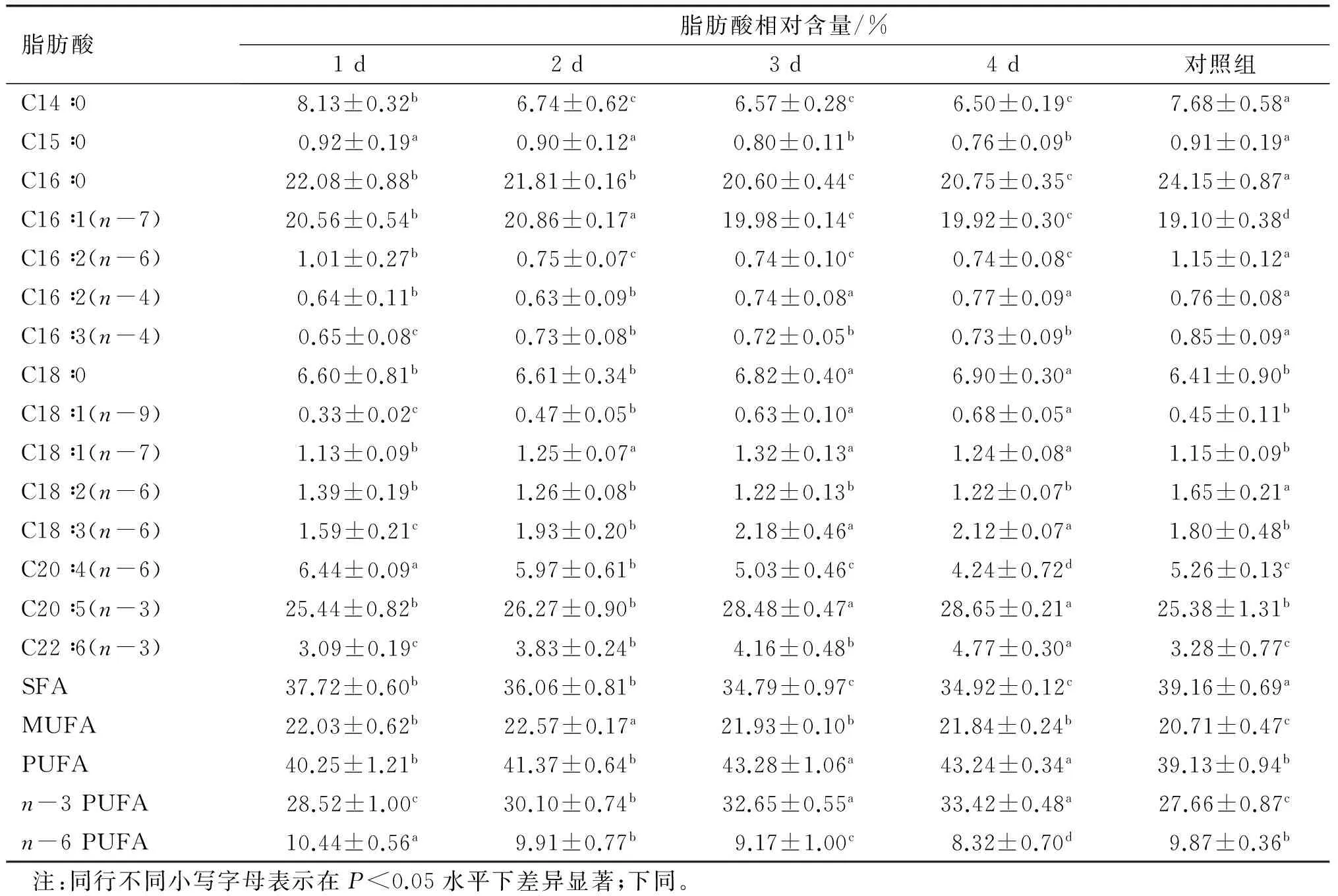
表2 低温(10℃)二次培养对大龙骨藻主要脂肪酸组成的影响
2.2 高光照强度二次培养
2.2.1 高光照强度二次培养对大龙骨藻总脂含量的影响(见图2)
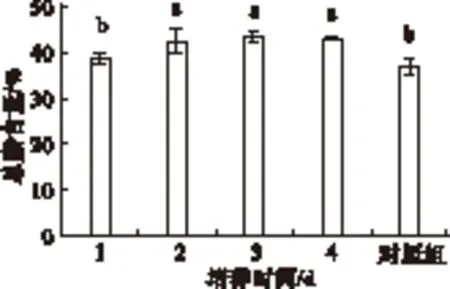
图2 高光照强度(80 μmol/(m2·s))二次培养
由图2可知,高光照强度二次培养对大龙骨藻总脂含量有显著影响(P<0.05)。大龙骨藻在高光照强度80 μmol/(m2·s)的培养条件下,总脂含量呈现先升高后降低的趋势,在3 d时的总脂含量达到最大(43.19±1.29)%,显著高于对照组的(36.87±1.93)%和高光照强度处理1 d时的总脂含量(P<0.05),而与2、4 d时的含量无显著差异(P>0.05)。
2.2.2 高光照强度二次培养对大龙骨藻脂肪酸组成的影响(见表3)
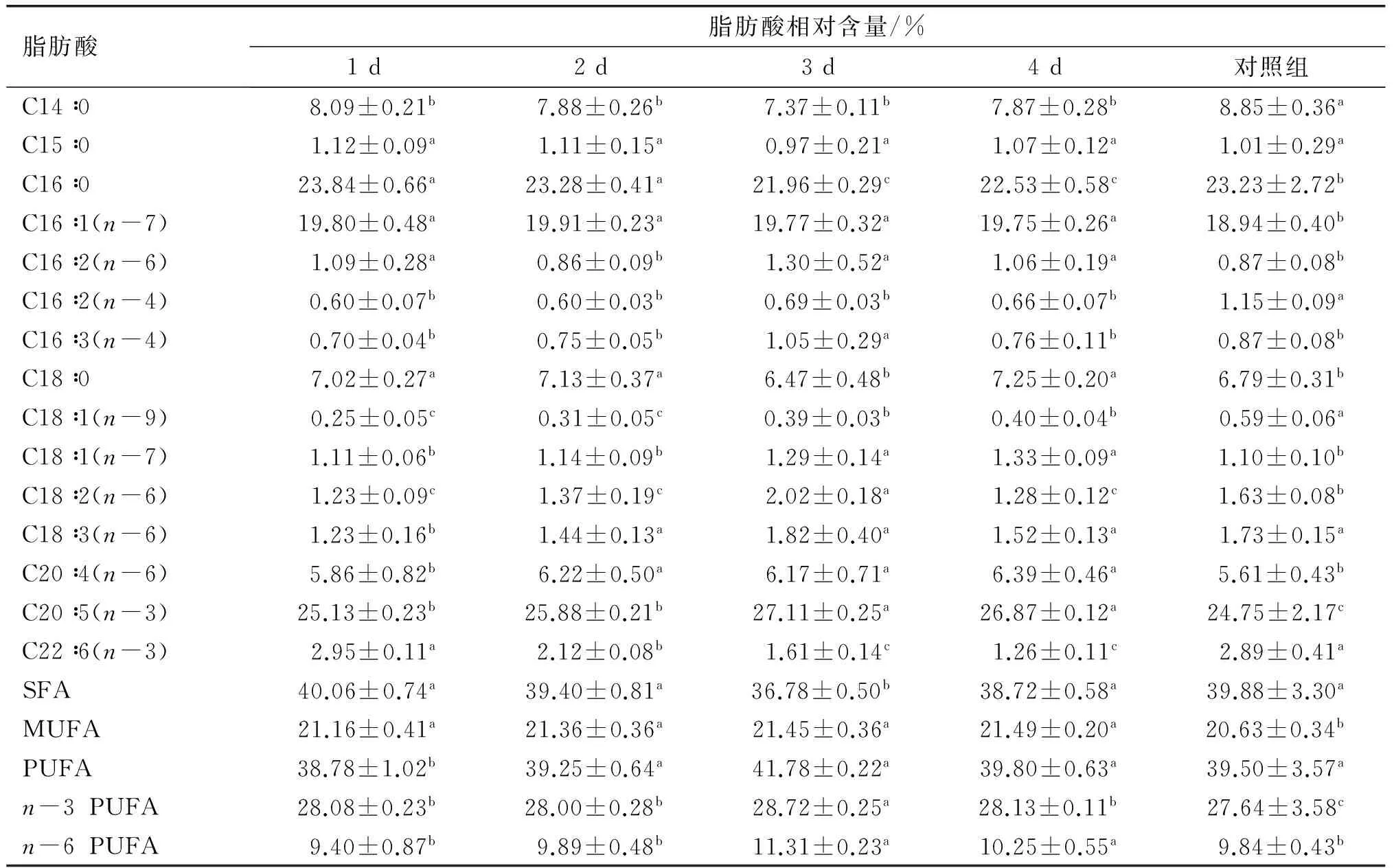
表3 高光照强度(80 μmol/(m2·s))二次培养对大龙骨藻主要脂肪酸组成的影响
由表3可知,高光照强度二次培养对大龙骨藻脂肪酸组成影响显著(P<0.05)。随着培养时间的延长,PUFA与n-6 PUFA含量都先增加后减少,在3 d时分别达最大值((41.78±0.22)%、(11.31±0.23)%),且n-6 PUFA含量显著高于对照组的(9.84±0.43)%(P<0.05)。EPA含量也在3 d时达到最大(27.11±0.25)%,显著高于对照组的(24.75±2.17)%(P<0.05)。而DHA含量则随着培养时间的延长逐渐降低,在4 d时仅为(1.26±0.11)%,显著低于对照组的(2.89±0.41)%(P<0.05)。
2.3 低温、高光照强度条件下的二次培养
2.3.1 低温、高光照强度对大龙骨藻总脂含量的影响(见表4)
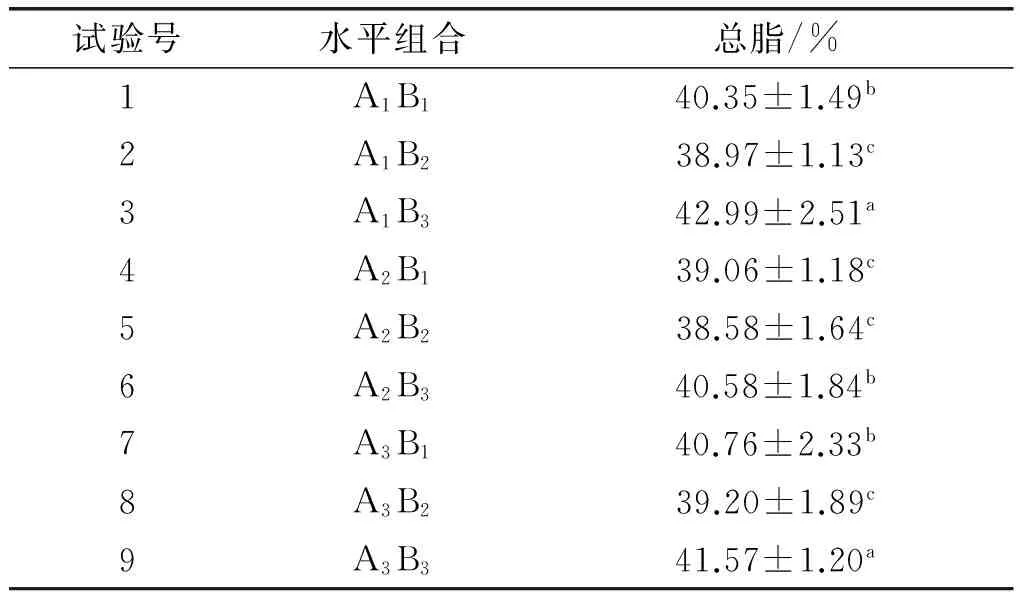
表4 低温、高光照强度二因子培养试验的总脂含量
由表4可知,低温、高光照强度对大龙骨藻总脂含量有显著影响(P<0.05)。温度与光照强度的交互作用在温度10℃、光照强度80 μmol/(m2·s)(A1B3)时效果最佳,此时大龙骨藻的总脂含量为(42.99±2.51)%,其次是温度20℃、光照强度80 μmol/(m2·s)(A3B3)组,该组大龙骨藻的总脂含量为(41.57±1.20)%,A1B3与A3B3两组的总脂含量无显著差异(P>0.05),但显著高于其他各组的(P<0.05)。
2.3.2 低温、高光照强度对大龙骨藻脂肪酸组成的影响(见表5)
由表5可知,低温、高光照强度对大龙骨藻脂肪酸组成有显著影响(P<0.05)。从整体上看,温度对大龙骨藻脂肪酸组成的影响要大于光照强度对大龙骨藻脂肪酸组成的影响。在温度和光照强度的交互作用影响下,C16∶0、C16∶1(n-7)、C18∶0、C20∶4(n-6)、EPA等变化较明显。除了温度20℃、光照强度48 μmol/(m2·s)(A3B1)组外,脂肪酸含量均表现出以下大小关系:PUFA>SFA>MUFA。EPA含量在温度10℃、光照强度80 μmol/(m2·s)(A1B3)组具有最大值(32.83±0.58)%,此时该组的C14∶0、C15∶0、C16∶0 和C18∶0等都具有最小值。PUFA含量也在温度10℃、光照强度80 μmol/(m2·s)(A1B3)组达到最大(46.43±0.22)%,与温度10℃、光照强度48 μmol/(m2·s)(A1B1)组以及温度10℃、光照强度64 μmol/(m2·s)(A1B2)组无显著差异(P>0.05),而显著大于其他各组的(P<0.05)。
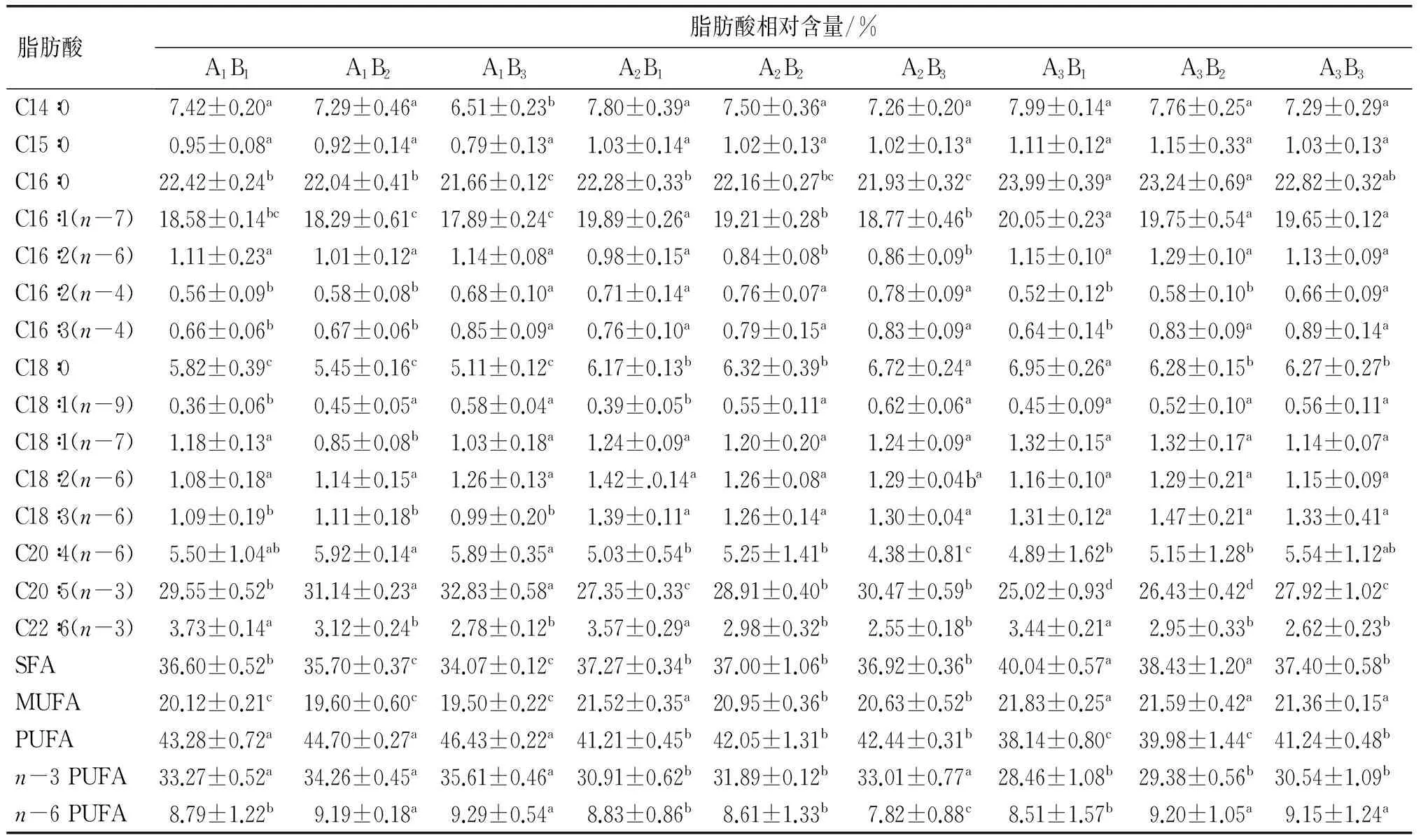
表5 低温、高光照强度对大龙骨藻的主要脂肪酸组成的影响
3 结 论
大龙骨藻经低温10℃胁迫3 d后,EPA、PUFA含量显著高于对照组的(P<0.05),分别为(28.48±0.47)%和(43.28±1.06)%,在80 μmol/(m2·s)光照强度条件下胁迫3 d总脂、EPA和PUFA达到最大,分别可达(43.19±1.29)%、(27.11±0.25)%和(41.78±0.22)%。温度与光照强度的二因子培养试验表明,低温与高光照强度二次培养对EPA的富集效果较为显著。在低温10℃、高光照强度80 μmol/(m2·s)条件下,大龙骨藻具有最大的总脂含量(42.99±2.51)%、EPA含量(32.83±0.58)% 和PUFA含量(46.43±0.22)%,显著高于对照组的(P<0.05)。这对优化藻的EPA含量提供了一定的理论依据。
综上所述,将藻置于最适条件下培养,使得藻快速生长获得较高的生物量,通过降低温度、增加光照强度,进行二次培养,可以获得较高的总脂、EPA及PUFA。最佳二次培养条件为温度10℃、光照强度80 μmol/(m2·s)、培养时间3 d。二次培养的培养方式结合藻类最适生长条件及最利于藻类油脂积累条件以获得较高的脂肪酸产量,为大龙骨藻大规模综合利用提供理论依据。
[1] CHISTI Y. Biodiesel from microalgae[J]. Biotechnol Adv, 2007, 25: 294-306.
[2] 姚茹, 程丽华, 徐新华, 等. 微藻的高油脂化技术研究进展[J]. 化学进展, 2010, 22(6): 1221-1232.
[3] PRUVOST J, VAN G, COGNEG G, et al. Investigation of biomass and lipids production withNeochlorisoleoabundansin photobioreactor[J]. Bioresour Technol, 2009, 100(23): 5899-5995.
[4] PACKER M. Algal capture of carbon dioxide; biomass generation as a tool for greenhouse gas mitigation with reference to New Zealand energy strategy and policy[J]. Energy Policy, 2009, 37(9): 3428-3437.
[5] METTING F B. Biodiversity and application of microalgae[J]. Inorg Biochem, 1996, 17(5): 477-489.
[6] 颜治, 陈晶. 微生物油脂及其开发利用研究进展[J]. 粮食与油脂, 2003(7): 13-15.
[7] SAKAMOTO T, HIGASHI S, WADA H, et al. Low-temperature-induced desaturation of fatty acids and expression of desaturase genes in the cyanobacteriumSynechococcussp. PCC7002[J]. FEMS Microbiol Lett, 1997, 152(2): 313-320.
[8] 杨品官, 张继民, 魏东, 等. 温度逆境处理提高拟微球藻(Nannochloropsisoculata)EPA 含量的研究[J]. 海洋学报, 2002, 24(4): 132-136.
[9] ZHU S D, WU Y X, CHEN Q M, et al. Dissolution of cellulose with ionic liquids and its application: a mini-review[J]. Green Chem, 2006, 37(30): 325-327.
[10] 孙传范, 赵耕毛, 唐运来. 环境因子对微藻油脂积累的影响[J]. 安徽农业科学, 2011, 39(19): 11723-11724, 11736.
[11] 高秀芝. 富EPA海洋微藻的分离、筛选及培养条件优化[D]. 浙江 宁波: 宁波大学, 2014.
[12] 张桂艳, 温小斌, 梁芳. 重要理化因子对小球藻生长和油脂产量的影响[J]. 生态学报, 2011, 31(80): 2076-2085.
[13] 丁彦聪, 高群, 刘家尧, 等. 环境因子对小球藻生长的影响及高产油培养条件的优化[J]. 生态学报, 2011, 31(18): 5307-5315.
[14] 班剑娇, 冯佳, 王志强, 等. 理化因子对谷皮菱形藻细胞密度及中性脂肪酸含量的影响[J]. 生态学报, 2015, 35(10): 3349-3356.
[15] 张泽凌, 蒋霞敏, 孙志鹏, 等. 几种环境因子对大龙骨藻生长与油脂合成的影响[J]. 中国油脂, 2014, 39(7): 30-36.
[16] 徐进, 徐旭东, 方仙桃, 等. 高产油小球藻的筛选及其油脂分析[J]. 水生生物学报, 2012, 36(3):426-432.
[17] 蒋霞敏, 柳敏海, 邢晨光. 不同生态条件对绿色巴夫藻生长与脂肪酸组成的影响[J]. 水生生物学报, 2007, 12(1): 88-93.
[18] METCALFE L D, SCHMITZ A A, PELKA J R. Rapid preparation of fatty acid esters from lipids for gas chromatographic analysis[J]. Anal Biochem, 1966, 38(3): 514-515.
[19] CHEN Y C. The biomass and total lipid content and composition of twelve species of marine diatoms cultured under various environments[J]. Food Chem, 2012, 131(1): 211-219.
[20] 徐继林, 严小军, 周成旭, 等. 19种(株)海洋微藻脂肪酸组成及充气产生的影响[J]. 宁波大学学报(理工版), 2006, 29(2): 180-185.
Effect of the secondary culture on contents of total lipids,EPA and PUFA ofTropidoneismaxima
DING Yuhui, JIANG Xiamin, ZHANG Zeling, HAN Qingxi, LIANG Jingjing
(School of Marine Sciences, Ningbo University, Ningbo 315211, Zhejiang, China)
To explore the effects of the secondary culture (low temperature and high light intensity stress)on the contents of total lipids, EPA and PUFA ofTropidoneismaxima,Tropidoneismaximawas cultured for 10 d under the conditions of temperature 25℃, light intensity 36 μmol/(m2·s) and salinity 25, then was secondarily cultured under low temperature(10℃) or high light intensity (80 μmol/(m2·s)) by single factor experiment, and the two-factor three-level secondary culture experiment of low temperature and high light intensity was further conducted.The results showed that the optimal secondary culture time was 3 d;low temperature of 10℃ was beneficial to the accumulation of EPA and PUFA, and they could reach (28.48±0.47)% and (43.28±1.06)%, respectively;the light intensity of 80 μmol/(m2·s) also had a positive effect on the accumulation of total lipids, EPA and PUFA, reaching(43.19±1.29)%, (27.11±0.25)% and (41.78±0.22)%, respectively. And it was more beneficial to the accumulation of total lipids, EPA and PUFA under the interaction between low temperature 10℃ and light intensity 80 μmol/(m2·s), and their contents were (42.99±2.51)%, (32.83±0.58)% and (46.43±0.22)%, respectively. Above all, the secondary culture was favorable to obtain higher levels of growth and lipid accumulation of algae. It provided a novel culture method for improving lipid production of algae, and was worthy for further study.
Tropidoneismaxima; secondary culture; total lipids; EPA; PUFA
2016-07-14;
2016-11-21
国家海洋公益项目(201305022)
丁玉惠(1993),女,硕士研究生,研究方向为海洋微藻培养(E-mail)dingyuhuid@163.com。
蒋霞敏,教授(E-mail)jiangxiamin@nbu.edu.cn。
TS222;Q815
A
1003-7969(2017)02-0107-06

