缺氧对肝泡状棘球蚴原头节血管内皮生长因子和CD34表达的影响研究
张 怀,张示杰,陈 骞,王 岩,苏争明,吴向未,孙 红
·论著·
缺氧对肝泡状棘球蚴原头节血管内皮生长因子和CD34表达的影响研究
张 怀,张示杰*,陈 骞,王 岩,苏争明,吴向未,孙 红
目的 探讨体外缺氧条件下肝泡状棘球蚴原头节中血管内皮生长因子(VEGF)、CD34表达水平的变化。方法 2016年4—10月,选取实验用腹腔感染肝泡状棘球蚴18周的长爪沙鼠30只,采用颈椎脱臼法处死,选取光滑、成簇的游离于腹腔或附着在腹壁、肠系膜、肝表面的肝泡状棘球蚴组织。培养肝泡状棘球蚴原头节,分为两组,对照组和实验组(给予含100 μmol/L二氯化钴的RPMI 1640培养基),培养第0、6、12、18、24 h倒置显微镜下观察肝泡状棘球蚴原头节活力。培养12、24 h采用酶联免疫吸附试验(ELISA)法检测肝泡状棘球蚴原头节中缺氧诱导因子1α(HIF-1α)、VEGF、CD34表达水平,Western blotting法检测肝泡状棘球蚴原头节中VEGF、CD34的表达。结果 培养0、6、12、18、24 h,对照组与实验组肝泡状棘球蚴原头节活力比较,差异均无统计学意义(P>0.05)。培养12、24 h,实验组肝泡状棘球蚴原头节HIF-1α、VEGF、CD34表达水平较对照组升高(P<0.05)。结论 缺氧可以使肝泡状棘球蚴原头节中VEGF和CD34表达水平升高,这可能是肝泡状棘球蚴病呈浸润性生长的重要机制之一。
棘球蚴病,肝;缺氧;血管内皮生长因子类;CD34
张怀,张示杰,陈骞,等.缺氧对肝泡状棘球蚴原头节血管内皮生长因子和CD34表达的影响研究[J].中国全科医学,2017,20(14):1702-1706.[www.chinagp.net]
ZHANG H,ZHANG S J,CHEN Q,et al.Effect of anoxia on expression of vascular endothelial growth factor and CD34in hepatic alveolar echinococcosis protoscolex[J].Chinese General Practice,2017,20(14):1702-1706.
本研究背景及创新点:
血管内皮生长因子(VEGF)是血管新生的关键递质之一,CD34为公认的标记肝癌新生血管特异性最好的指标之一;实验研究发现缺氧引起的血管新生是肝癌浸润性生长的重要原因;因此VEGF、CD34被广泛应用于肝癌的研究中。肝泡状棘球蚴病的浸润方式与肝癌的浸润生长方式相似,本实验较创新地把VEGF、CD34用在肝泡状棘球蚴病的研究中,通过体外模拟肝泡状棘球蚴在人体内生长环境,利用外源性二氯化钴成功建立肝泡状棘球蚴缺氧模型,给予缺氧一定时间后,发现VEGF、CD34表达水平升高,说明缺氧可以导致VEGF、CD34表达上调,这与肝癌研究中得出的缺氧引起血管新生导致肝癌呈浸润性生长的结论相吻合,说明缺氧引起的血管新生可能是肝泡状棘球蚴病呈浸润性生长的关键途径之一,为治疗肝泡状棘球蚴病提出了一种新的可行性方法。
肝泡状棘球蚴病是由多房棘球蚴的幼虫感染引起的人兽共患病,因此又被称为多房棘球蚴病,该病对人体健康的危害十分严重[1-2]。经消化道进入血液后,成虫几乎全部寄生在肝脏,呈类似于恶性肿瘤的浸润性生长,并且主要通过血行扩散、种植转移、浸润扩散、淋巴结转移的方式向远处组织器官进行转移,临床上与肝癌鉴别困难,故又称为“虫癌”或“恶性包虫病”[3]。研究证明,缺氧引起的血管新生是导致肝癌浸润性生长的主要原因之一,而血管内皮生长因子(VEGF)和CD34在肿瘤新生血管形成及侵袭性生长过程中起重要作用[4]。因此,本实验通过二氯化钴模拟体内缺氧条件,培养肝泡状棘球蚴原头节,观察缺氧对肝泡状棘球蚴原头节VEGF、CD34表达的影响。
1 材料与方法
1.1 材料与试剂 2016年4—10月,于新疆医科大学动物实验中心购买实验用腹腔感染肝泡状棘球蚴18周的雌性长爪沙鼠30只,体质量(50±5)g;RPMI 1640培养基购于美国Hyclone公司;二氯化钴购于美国Sigma公司;小鼠VEGF单克隆抗体购于美国Abcam公司;小鼠CD34单克隆抗体购于美国Santa公司;山羊抗小鼠二抗(型号ZB-2305)购于北京中杉金桥生物技术有限公司;缺氧诱导因子1α(HIF-1α)酶联免疫吸附试验(ELISA)试剂盒、VEGF ELISA试剂盒、CD34ELISA试剂盒购于武汉伊莱瑞特生物科技有限公司(Elabscience)。
1.2 方法
1.2.1 肝泡状棘球蚴原头节的提取 采用颈椎脱臼法处死种鼠,无菌剖腹,选取光滑、成簇的游离于腹腔或附着在腹壁、肠系膜、肝表面的肝泡状棘球蚴组织,置于无菌盘中,磷酸盐缓冲液(PBS)漂洗3次,依次剪碎,匀浆,过筛,PBS漂洗3次,0.5%伊红染色,5 min后,倒置显微镜下观察,肝泡状棘球蚴原头节染色情况即肝泡状棘球蚴原头节的活力。
1.2.2 体外肝泡状棘球蚴原头节的培养与缺氧诱导 肝泡状棘球蚴原头节置于RPMI 1640培养基中,分为两组,对照组37 ℃、5%CO2培养箱中培养;实验组给予含100 μmol/L二氯化钴的RPMI 1640培养基,37 ℃、5%CO2培养箱中培养。
1.2.3 肝泡状棘球蚴原头节活力检测 培养第0、6、12、18、24 h分别取实验组与对照组肝泡状棘球蚴原头节,倒置显微镜下观察生长发育状况及运动情况,并且每孔取10 μl肝泡状棘球蚴原头节悬混液,置于载玻片上,再加入等体积的0.5%伊红溶液,5 min后,倒置显微镜下观察肝泡状棘球蚴原头节活力。实验重复3次,取均值。
1.2.4 ELISA法检测肝泡状棘球蚴原头节中HIF-1α、VEGF、CD34表达水平 分别收集实验组与对照组培养12、24 h的肝泡状棘球蚴原头节,PBS反复冲洗后,用超声破碎仪碎裂肝泡状棘球蚴原头节,ELISA双抗体夹心法测定肝泡状棘球蚴原头节中的HIF-1α、VEGF、CD34表达水平,操作严格按照试剂盒说明书进行。采用波长为450 nm的全自动酶标仪进行测定。绘制标准曲线后,通过测试标本的吸光度,并于标准曲线查出其对应浓度。实验重复3次,取均值。
1.2.5 Western blotting法检测肝泡状棘球蚴原头节中VEGF、CD34的表达 分别收集实验组与对照组培养12、24 h的肝泡状棘球蚴原头节,PBS反复冲洗后,用超声破碎仪碎裂肝泡状棘球蚴原头节,并在100 ℃下煮沸10 min,蛋白变性后保存于-80 ℃备用。各取等量蛋白样品10 μg进行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳。然后将蛋白转移至45 μm的聚偏二氟乙烯(PVDF)膜,经5%脱脂奶粉封闭2 h,分别加入小鼠VEGF单克隆抗体(1∶1 000)及小鼠CD34单克隆抗体(1∶500)一抗,4 ℃过夜,TBST洗涤6次;山羊抗小鼠IgG辣根酶标记(1∶50 000)及山羊抗小鼠IgG辣根酶标记(1∶2 000)二抗,室温孵育2 h,TBST洗涤6次,增强化学发光试剂(ECL)显色,暗房曝光。以β-actin为内对照,以各目标蛋白条带与内对照比值作为阳性条带的相对表达值。采用法国Vilber Lourmat公司的Biorad数码成像分析软件对结果进行灰度扫描分析。
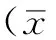
2 结果
2.1 肝泡状棘球蚴原头节活力比较 培养0、6、12、18、24h,对照组与实验组肝泡状棘球蚴原头节活力比较,差异均无统计学意义(P>0.05,见表1)。

Table1Comparisonofechinococcosisprotoscolexactivitybetweencontrolgroupandexperimentgroup
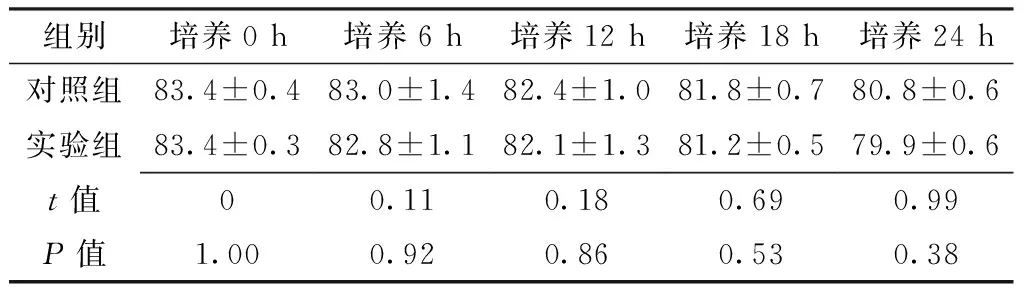
组别培养0h培养6h培养12h培养18h培养24h对照组83.4±0.483.0±1.482.4±1.081.8±0.780.8±0.6实验组83.4±0.382.8±1.182.1±1.381.2±0.579.9±0.6t值00.110.180.690.99P值1.000.920.860.530.38
2.2 HIF-1α表达水平比较 培养12、24 h,实验组肝泡状棘球蚴原头节HIF-1α表达水平较对照组升高,差异均有统计学意义(P<0.05,见表2)。

Table2ComparisonofHIF-1αexpressionlevelinechinococcosisprotoscolexbetweencontrolgroupandexperimentgroup
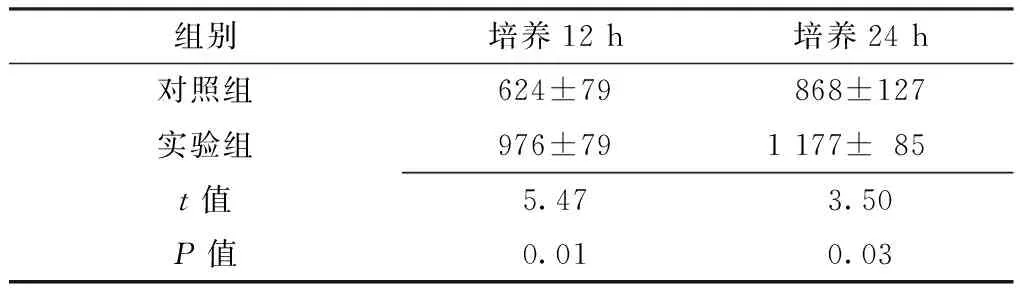
组别培养12h培养24h对照组624±79868±127实验组976±791177±85t值5.473.50P值0.010.03
2.3 VEGF表达水平比较 培养12、24 h,实验组肝泡状棘球蚴原头节VEGF表达水平较对照组升高,差异均有统计学意义(P<0.05,见表3、图1)。
2.4 CD34表达水平比较 培养12、24 h,实验组肝泡状棘球蚴原头节CD34表达水平较对照组升高,差异均有统计学意义(P<0.05,见表4、图2)。

Table3ComparisonofexpressionlevelofVEGFinechinococcosisprotoscolexbetweencontrolgroupandexperimentgroup
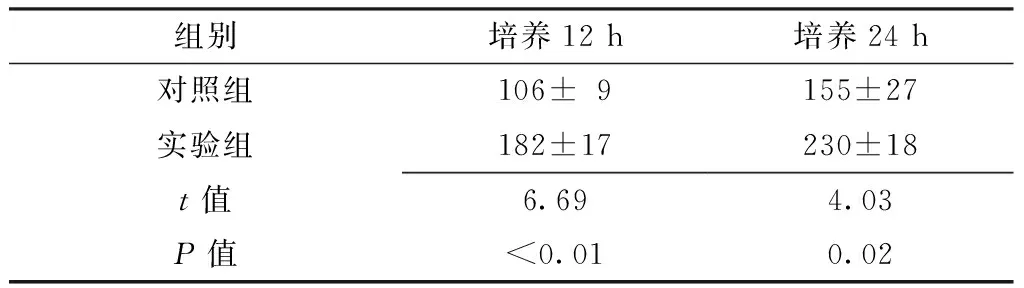
组别培养12h培养24h对照组106±9155±27实验组182±17230±18t值6.694.03P值<0.010.02
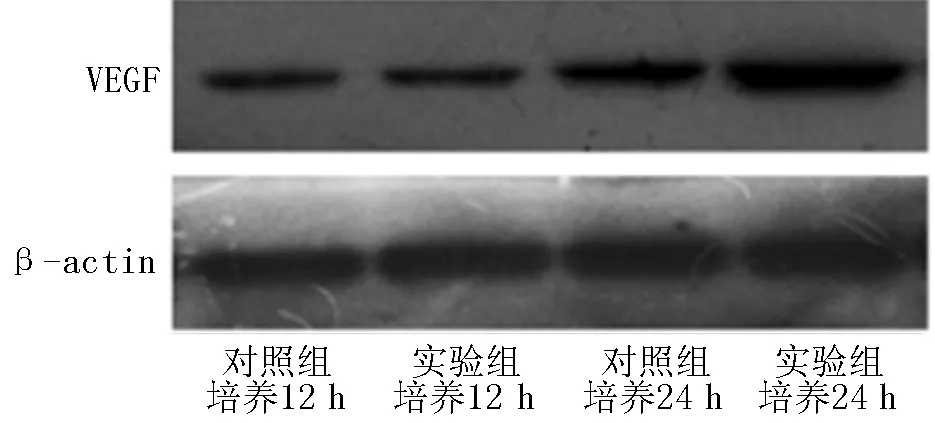
注:VEGF=血管内皮生长因子
图1 Western blotting法检测两组肝泡状棘球蚴原头节VEGF表达
Figure 1 Detection of expression of VEGF in echinococcosis protoscolex by Western blotting method

Table4ComparisonofexpressionlevelofCD34inechinococcosisprotoscolexbetweencontrolgroupandexperimentgroup
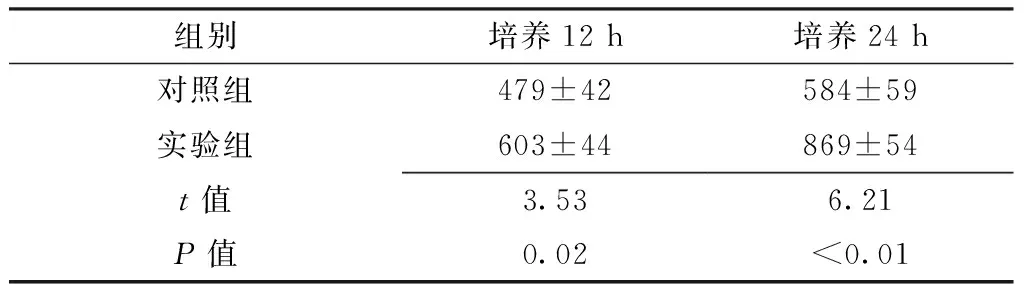
组别培养12h培养24h对照组479±42584±59实验组603±44869±54t值3.536.21P值0.02<0.01
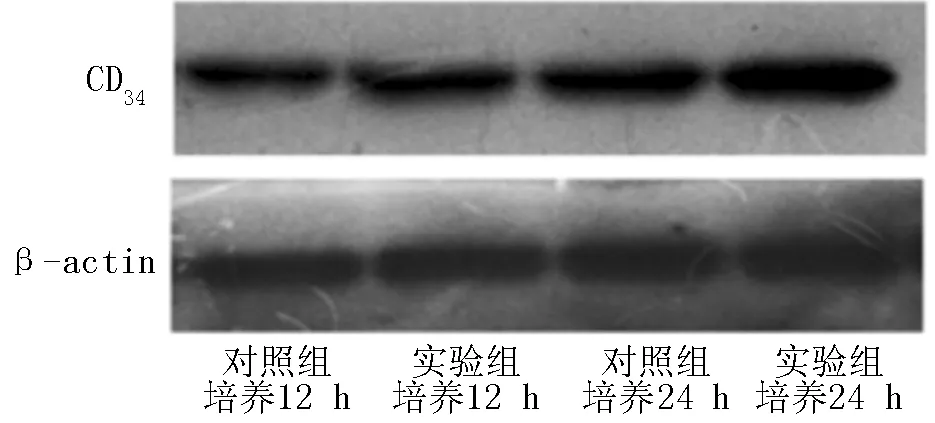
图2 Western blotting法检测两组肝泡状棘球蚴原头节CD34表达
Figure 2 Detection of expression of CD34in echinococcosis protoscolex by Western blotting method
3 讨论
既往研究证明,在异常情况下的血管新生是导致恶性肿瘤浸润性生长的关键,而在人体正常组织中血管新生是被高度管制的行为[5]。在血管新生中,VEGF是其中的关键递质之一。而目前所有已知血管内皮标志物中公认的最能特异性标记肝癌的新生血管指标是CD34。研究发现,血管新生主要是由缺氧诱导,其触发因素中最重要的是组织缺氧[6]。而HIF-1α的表达呈负氧依赖性,即在低氧的环境下,HIF-1α呈高表达[7]。因此,本研究通过二氯化钴模拟体内缺氧条件培养肝泡状棘球蚴原头节,观察缺氧对肝泡状棘球蚴原头节VEGF、CD34表达的影响。
研究证明,随着肿瘤细胞不断增殖,造成了肿瘤组织中心区域的乏氧,因此,缺氧是肿瘤生长发育过程中的必然因素[8]。此时,缺氧区域的营养来源依赖于瘤体血管的新生。体外研究中常用的办法是在培养基中加入一定剂量的二氯化钴(100 μmol/L)、去铁敏(100 μmol/L)等药物来创造缺氧环境,以此模拟体内缺氧微环境。本研究通过二氯化钴诱导肝泡状棘球蚴原头节缺氧环境,结果显示:培养12、24 h,实验组HIF-1α表达水平明显升高,说明二氯化钴缺氧模型建立成功[9]。两组培养0、6、12、18、24 h肝泡状棘球蚴原头节活力均无差异,表明二氯化钴诱导24 h内,缺氧对肝泡状棘球蚴原头节活力没有影响。
多种肿瘤细胞可分泌VEGF,VEGF是目前学术界已知的促进血管生成的最强因子之一,可以增加血管的通透性,诱导肿瘤中的血管生成,进一步导致肿瘤的侵袭性生长及转移[10]。李兴睿等[11]在研究中发现,肝癌细胞系HepG2缺氧培养24 h,VEGF水平明显升高。同时,陈俊伟等[12]成功地利用二氯化钴建立缺氧模型,在大鼠肝癌细胞株RH35中,VEGF mRNA表达与缺氧程度呈正相关,且随着HIF-1α的增加而上升。本研究对肝泡状棘球蚴原头节进行缺氧培养,ELISA和Western blotting法检测肝泡状棘球蚴原头节VEGF表达,结果显示,培养12、24 h,实验组肝泡状棘球蚴原头节VEGF表达水平较对照组升高,说明缺氧导致VEGF表达增多,这可能与缺氧导致体内HIF-1α表达增多,进一步上调VEGF表达有关,但是具体的机制有待于进一步研究。
CD34是常用的血管内皮细胞标志物,实验研究表明,CD34既有促进内皮细胞转移的功能,同时又具备了造血功能,这就使得血管新生具备了条件,为肿瘤的浸润性生长提供了所需的营养物质[13]。CUI等[14]对大鼠的心肌细胞进行缺氧培养,发现低氧会上调CD34的表达来促进血管新生。NISHIMURA等[15]在实验中发现,缺氧可以上调C57BL6雄性小鼠肺血管内皮细胞CD34的表达。本研究中,培养12、24 h,实验组肝泡状棘球蚴原头节CD34表达水平较对照组升高,这可能与CD34促进内皮细胞的转移来促进组织血管的生成有关[13],缺氧使得肝泡状棘球蚴原头节迫切需求新生血管提供的氧及其他营养物质。
综上所述,本研究利用二氯化钴建立缺氧模型,结果显示缺氧可导致VEGF、CD34表达上调,说明肝泡状棘球蚴的浸润性生长可能与缺氧引起VEGF、CD34表达升高导致的血管新生有关;国内外暂未见相关研究报道,本研究为肝泡状棘球蚴的浸润性生长的原因提供了新的可能;但是,本研究仅从体外方面提出缺氧与VEGF、CD34表达的关系,还需动物实验进一步证明,这也是本课题组今后的工作重点。同时,在临床治疗过程中,可以给予相关的抑制干预处理,为药物治疗肝泡状棘球蚴病提出了一种新的可行性方法。
作者贡献:张怀、张示杰进行文章的构思与设计,对文章整体负责,监督管理;张怀、陈骞进行研究的实施与可行性分析;张怀进行数据收集,统计学处理,撰写论文;张怀、王岩进行数据整理;张怀、苏争明进行结果的分析与解释;张示杰、吴向未进行论文的修订;孙红负责文章的质量控制及审校。
本文无利益冲突。
[1]ECKERT J,CONRATHS F J,TACKMANN K.Echinococcosis:an emerging or re-emerging zoonosis?[J].Int J Parasitol,2000,30(12/13):1283-1294.
[2]崔刚,郑强.1977—2004年我国泡型棘球蚴病的文献统计[J].地方病通报,2007,22(2):75-77.DOI:10.3969/j.issn.1000-3711.2007.02.030. CUI G,ZHENG Q.Alveolar echinococcosis literature statistics in China,1977—2004[J].Endemic Diseases Bulletin,2007,22(2):75-77.DOI:10.3969/j.issn.1000-3711.2007.02.030.
[3]张继增.泡状棘球蚴病[J].诊断病理学杂志,2001,8(5):261-262. ZHANG J Z.Alveolar hydatid disease[J].Journal of Diagnostic Pathology,2001,8(5):261-262.
[4]荔童,张示杰.血管新生在肝泡球蚴浸润性生长中的作用[J].中国人兽共患病学报,2014,30(10):1071-1074.DOI:10.3969/cjz.j.issn.1002-2694.2014.10.018. LI T,ZHANG S J.A review of vascular regeneration in the invasive growth process of echinococcus multilocularis[J].Chinese Journal of Zoonoses,2014,30(10):1071-1074.DOI:10.3969/cjz.j.issn.1002-2694.2014.10.018.
[5]HANAHAN D,WEINBERG R A.The hallmarks of cancer[J].Cell,2000,100(1):57-70.
[6]SCHAPER W,SCHOLZ D.Factors regulating arteriogenesi[J].Arterioscler Thromb Vasc Biol,2003,23(7):1143-1151.
[7]SEMENZA G L.HIF-1:mediator of physiological and pathophysiological responses to hypoxia[J].J Appl Physiol(1985),2000,88(4):1474-1480.
[8]FOLKMAN J.Role of angiogenesis in tumor growth and metastasis[J].Semin Oncol,1992,3(2):65-71.
[9]李云霞,詹青,丁素菊,等.不同缺氧方法诱导皮质神经元表达缺氧诱导因子1α及促红素的实验方法比较[J].中风与神经疾病杂志,2008,25(6):655-657. LI Y X,ZHAN Q,DING S J,et al.Influence of different hypoxic methods on the expression of HIF-1α and EPO in neurons[J].Journal of Apoplexy and Nervous Diseases,2008,25(6):655-657.
[10]KLEESPIES A,GUBA M,JAUCH K W,et al.Vascular endothelial growth factor in esophageal cancer[J].J Surg Oncol,2004,87(2):95-104.
[11]李兴睿,廖晓峰,易继林.缺氧对肝癌细胞系HepG2表达VEGF的影响[J].中国普外基础与临床杂志,2005,12(5):477-479.DOI:10.3969/j.issn.1007-9424.2005.05.016. LI X R,LIAO X F,YI J L.Effect of hypoxia on the expression of VEGF in HepG2 cell[J].Chinese Journal of Bases and Clinics in General Surgery,2005,12(5):477-479.DOI:10.3969/j.issn.1007-9424.2005.05.016.
[12]陈俊伟,胡晓俊,林曲,等.氯化钴作用下大鼠肝癌细胞株RH35的HIF-1α与VEGF表达及侵袭性影响的研究[J].新医学,2014,45(12):790-795.DOI:10.3969/g.issn.0253-9802.2014.12.003. CHEN J W,HU X J,LIN Q,et al.Effect of CoCl2on expression of HIF-1α and VEGF,and tumor invasion in rat RH35 hepatoma cells[J].New Medicine,2014,45(12):790-795.DOI:10.3969/g.issn.0253-9802.2014.12.003.
[13]SIEMERINK M J,KLAASSEN I,VOGELS I M,et al.CD34marks angiogenic tip cells in human vascular endothelial cell cultures[J].Angiogenesis,2012,15(1):151-163.DOI:10.1007/s10456-011-9251-z.
[14]CUI X B,PANG X L,LI S,et al.Elevated expression patterns and tight correlation of the PLCE1 and NF-κB signaling in Kazakh patients with esophageal carcinoma[J].Med Oncol,2014,31(1):791.DOI:10.1007/s12032-013-0791-5.
[15]NISHIMURA R,NISHIWAKI T,KAWASAKI T,et al.Hypoxia-induced proliferation of tissue-resident endothelial progenitor cells in the lung[J].Am J Physiol Lung Cell Mol Physiol,2015,308(8):L746-758.DOI:10.1152/ajplung.00243.2014.
(本文编辑:陈素芳)
Effect of Anoxia on Expression of Vascular Endothelial Growth Factor and CD34in Hepatic Alveolar Echinococcosis Protoscolex
ZHANGHuai,ZHANGShi-jie*,CHENQian,WANGYan,SUZheng-ming,WUXiang-wei,SUNHong
TheFirstAffiliatedHospital,SchoolofMedicine,ShiheziUniversity,Shihezi832000,China
*Correspondingauthor:ZHANGShi-jie,Professor,Mainresearchdirections:hepatobiliarysurgery;E-mail:zhangshijiewk1@sina.com
Objective To investigate the expression level of vascular endothelial growth factor(VEGF) and CD34in the hepatic alveolar echinococcosis protoscolex under the condition of vitro anoxia.Methods From April to October in 2016,the 30 cases gerbils of abdominal infection with hepatic alveolar echinococcosis for 18 weeks were selected for experiment,and were sacrificed by cervical dislocation.The smooth clusters of hepatic alveolar echinococcosis tissues isolated in abdominal cavity or tissues adhere to the abdominal wall,mesentery,liver surface were selected.The hepatic alveolar echinococcosis protoscolex was cultured to divide into control group and experiment group(RPMI 1640 medium containing 100 μmol/L cobalt chloride).The hepatic alveolar echinococcosis protoscolex activity was observed by inverted microscope at the beginning,and the 6th,12th,18th,24th hour of the culture process.At the 12th and 24th hour of the culture process,enzyme-linked immunosorbent assay(ELISA) was used to detect the expression level of hypoxia-inducible factor 1 alpha(HIF-1α),VEGF and CD34in hepatic alveolar echinococcosis protoscolex.Western blotting method was applied to detect the expression of VEGF and CD34.Results The echinococcosis protoscolex activity at the 0th,6th,12th,18th,24th hour of the culture process was not significantly different between control group and experiment group(P>0.05).Compared with the control group,the expression level of HIF-1α,VEGF,CD34were significantly increased at the 12th and 24th hour of the culture process in the experiment group(P<0.05).Conclusion Hypoxia can increase the expression level of VEGF and CD34in echinococcosis protoscolex,and this may be one of the important mechanisms of invasive growth presented by hepatic alveolar echinococcosis.
Echinococcosis,hepatic;Anoxia;Vascular endothelial growth factors;CD34
国家自然科学基金资助项目(81560518)
R 532.32
A
10.3969/j.issn.1007-9572.2017.14.011
2016-11-12;
2017-02-22)
832000新疆石河子市,石河子大学医学院第一附属医院
*通信作者:张示杰,教授,主要研究方向:肝胆外科;E-mail:zhangshijiewk1@sina.com

