猴头菇多糖的提取工艺优化及抗氧化活性研究
贾毓宁 朱静

摘要[目的]优化猴头菇多糖的提取工艺,并对其抗氧化活性进行研究。[方法]分别采用单因素试验与正交试验对猴头菇多糖的提取工艺进行优化,并以羟自由基清除力、过氧化氢清除力、还原力等试验对猴头菇多糖的抗氧化活性进行研究。[结果]猴头菇多糖的最佳提取工艺是提取温度85 ℃、液料比1∶20、提取次数3次、提取时间1.5 h/次;猴头菇多糖具有良好的羟基自由基、过氧化氢能力清除能力和一定程度的还原力。[结论]通过优化获得的猴头菇多糖水提工艺稳定可靠,糖得率高;猴头菇多糖具有一定的抗氧化活性,提示可能与其发挥其他药理作用相关。
关键词猴头菇;多糖;提取工艺优化;单因素试验;正交试验;抗氧化活性
中图分类号S646文献标识码A文章编号0517-6611(2017)31-0148-03
Abstract[Objective] The research aimed to optimize the extraction process of Hericium erinaceus polysaccharide(HEP), and study its antioxidant activity.[Method]Singlefactor test and orthogonal test were used to optimize the extraction process of HEP. The antioxidant activities of HEP were tested by hydroxyl radical scavenging power, hydrogen peroxide scavenging power and reducing power.[Result]The optimum extraction conditions of HEP were extracted at 85 ℃, solidliquid rate 1∶20, for 3 times and 1.5 hours per time. HEP had good hydroxyl radical and hydrogen peroxide scavenging ability and a certain degree of reducing power.[Conclusion]HEP obtained by optimum extraction conditions is stable and reliable, the yield of sugar is high. HEP has a certain antioxidant activity, suggesting that it may be related to other pharmacological effects.
Key wordsHericium erinaceus;Polysaccharides;Extraction process optimization;Singlefactor test;Orthogonal test;Antioxidative activity
自然界的真菌種类极其繁多,其中担子菌科的一些腐生菌是为人们熟知的食物。近年来,国内外对真菌的药用价值进行了深入研究,并开发出一大批真菌类药物与保健品[1],其中来自真菌的多糖尤其令人瞩目。真菌多糖存在于真菌菌丝、子实体及其发酵液中,具有免疫增强、抗肿瘤、降血脂、抗病毒等生物活性[2-5],已成为医药及食品科学等领域的研究热点。
猴头菇(Hericium erinaceus)是一种常见于阔叶树干断面或树洞中的大型肉质菌,成熟后变为黄棕色,呈毛茸状,极似毛猴的脑袋,是一种名贵的药食同源真菌[6]。中医学认为,猴头菇性平、味甘,利五脏,助消化;具有健胃、补虚、抗癌、益肾精之功效[7];主治食少便溏、胃及十二指肠溃疡、浅表性胃炎、神经衰弱、食道癌、胃癌、眩晕、阳痿等病症[8-9]。大量研究结果显示,猴头菇提取物营养丰富,功效显著,因而可成为各类保健品、功能性食品的添加原料,猴头菇化学成分众多,其中多糖被认为是猴头菇具有多种药理活性的物质基础之一[10-11]。
笔者拟采用单因素与正交试验对猴头菇多糖的提取工艺进行优化,并对提取得到的猴头菇多糖的抗氧化活性进行研究,以期为深入研究猴头菇药理活性与构效关系奠定理论基础。
1材料与方法
1.1仪器
恒温水浴锅(金坛医疗仪器厂,HH-W420);旋转蒸发仪(上海亚荣生化仪器厂,RE-52);紫外-可见分光光度计(上海美谱达仪器有限公司,UV-1100);电子分析天平(梅特勒-托利多仪器有限公司,ME104型);Multiskan酶标仪(Thermo Fisher公司)。
1.2试材
猴头菇经南京中医药大学翰林学院中药资源与开发实验室鉴定。其余试剂均为国产分析纯。
1.3方法
1.3.1单因素试验优化猴头菇多糖提取工艺。
1.3.1.1不同料液比对猴头菇多糖提取率的影响。
取猴头菇子实体粉末10.0 g,共5份,分别加150、200、250、300、350 mL蒸馏水浸提,75 ℃ 浸提1次,浸提完毕后采用4层纱布过滤,保留滤液。以蒸馏水作为空白对照,按硫酸苯酚法测定糖含量,计算提取率。
1.3.1.2提取次数对猴头菇多糖提取率的影响。
取猴头菇子实体粉末10.0 g,共5份,加蒸馏水200 mL,在75 ℃分别进行1、2、3、4、5次浸提,其余操作同“1.3.1.1”。
1.3.1.3提取时间对猴头菇多糖提取率的影响。
取猴头菇子实体粉末10.0 g,共5份,加蒸馏水200 mL,浸提1次,浸提时间分别为1.0、1.5、2.0、2.5、3.0 h,其余操作同“1.3.1.1”。
1.3.1.4提取温度对猴头菇多糖提取率的影响。
取猴头菇子实体干粉10.0 g,共5份,加蒸馏水200 mL,分别在70、75、80、85、90 ℃浸提1次,其余操作同“1.3.1.1”。
1.3.2正交试验优化猴头菇多糖提取工艺。
按单因素试验确定的试验结果,选择试验因素水平,采用表1进行正交试验。
1.3.3猴头菇多糖抗氧化试验。
1.3.3.1羟基自由基试验。
在酶标板上,每孔依次加入100 μL浓度分别为31.25、62.50、125.00、250.00、500.00、1 000.00、2 000.00 μg/mL 的待测液或浓度为62.5 μg/mL 的VC溶液(以蒸馏水为空白)、1.5 mmol/L硫酸亚铁溶液50 μL、6 mmol/L过氧化氢溶液35 μL,每种浓度6个平行,室温混匀10 min,前3组加2 mmol/L水杨酸钠溶液50 μL,后3组加水作对照,室温混匀10 min,避光于37 ℃培养箱孵育50 min,用酶标仪扫描,测A562。
1.3.3.2过氧化氢试验。
在糖管中,每管依次加入1 mL不同浓度待测液或浓度为62.5 μg/mL 的VC溶液(以蒸馏水为空白)、6 mmol/L过氧化氢溶液100 μL、3%钼酸铵溶液100 μL、2 mol/L硫酸溶液10 mL、1.8 mol/L碘化钾溶液7 mL,每组设3个平行,避光准确反应30 min,用5 mmol/L硫代硫酸钠滴定液滴定至黄色消失,记录所用的溶液体积。
1.3.3.3还原力测定试验。
在EP管中,每管依次加入100 μL 不同浓度待测液或浓度为62.5 μg/mL 的VC溶液(以蒸馏水为空白)、磷酸缓冲液100 μL、1%铁氰化钾100 μL,混匀于50 ℃恒温水浴中反应20 min,再加入10%三氯乙酸100 μL,混匀。取以上溶液100 μL于酶标板,设6个平行,前3组加20 μL三氯化铁和100 μL水,后3组加120 μL水作对照,混匀后用酶标仪扫描,测A700。
2结果与分析
2.1单因素试验
2.1.1
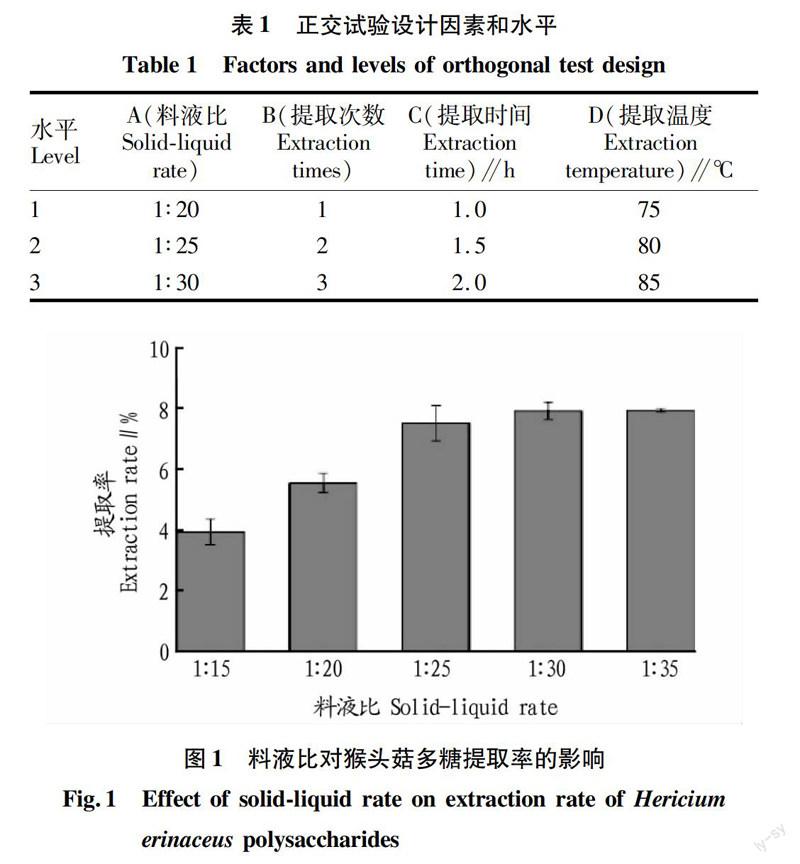
料液比对猴头菇多糖提取率的影响。从图1可以看出,多糖提取率随着液料比的增加,呈现不同程度的增长趋势。在料液比为1∶15~1∶35时,随着料液比的增加,猴头菇多糖的提取率逐渐递增;当液料比为1∶30 时,多糖提取率达到7.8%,当液料比达1∶35 时,多糖提取率没有再呈现增加的趋势,所以确定适宜的液料比为1∶30。
2.1.2
提取次数对猴头菇多糖提取率的影响。从图2可看出,
提取次数在1~3次对猴头菇多糖的提取率有明显变化,提取3次时,多糖提取率为7.2%,继续增加提取次数,提取率升高不明显。因此,提取次数选择3次。
2.1.3
提取时间对猴头菇多糖提取率的影响。从图3可看出,
提取时间对多糖提取率影响较小,单次提取时间由1 h逐渐增加至3 h,多糖的提取率仅有微小波动,因而可兼顾经济因素,考虑提取2 h/次。
2.1.4
提取温度对猴头菇多糖提取率的影响。从图4可看出,
提取温度在70~90 ℃,多糖提取率逐渐增加;但在90 ℃时,多糖发生美德拉反应的概率显著增加;在85 ℃时,提取率已达9.2%。综合以上,选择85 ℃作为提取温度。
2.2正交试验
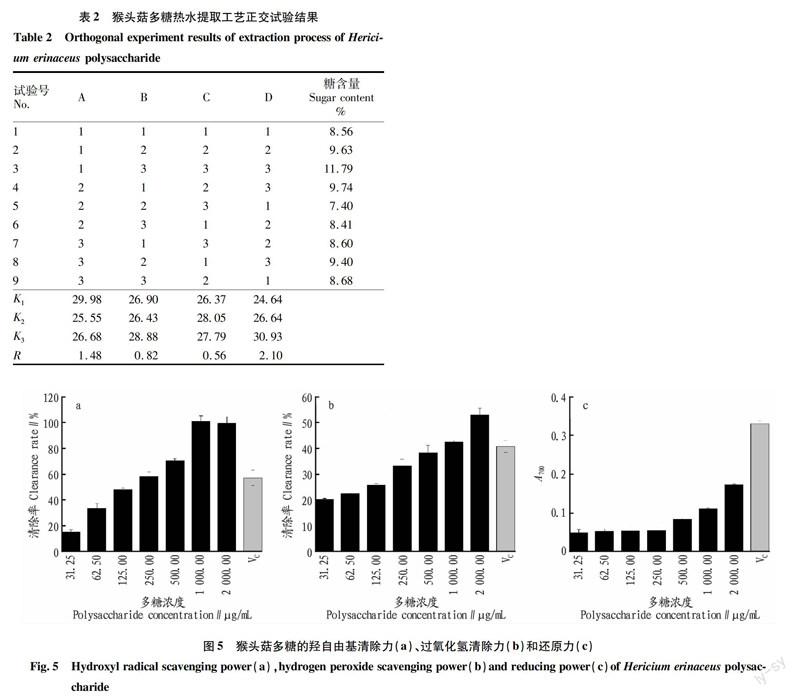
以单因素试验结果为基础,根据正交试验设计原则,采用4因素3水平分析方法对工艺参数进行优化的结果如表2所示。
从表2可看出,各因素对猴头菇多糖提取率的影响程度从大到小依次为D、A、B、C,即提取温度的影响程度最大,其次是料液比、提取次数,提取时间的影响程度最小。猴头菇多糖热水提取法的最佳提取条件为A1B3C2D3,即液料比1∶20、提取次数3次、提取时间1.5 h/次、提取温度85 ℃。针对正交试验优化的热水提取工艺进行3次工艺稳定性的研究,以多糖提取率为指标,提取率为10.58%±0.27%,结果表明该工艺具有较高的稳定性。
2.3抗氧化活性
由图5可见,猴头菇多糖中等浓度水平与VC的羟基自由基清除能力相当,在较高浓度水平的过氧化氢清除能力与VC相当,而最高浓度的还原力仅为VC的一半,表明猴头菇多糖具有良好的羟基自由基、过氧化氢清除能力和一定程度的还原力。
3小结与讨论
猴头菇多糖体外抗氧化试验结果显示,其具有良好的羟基自由基、过氧化氢清除能力和一定程度的还原力。多糖可
能通过有效提高抗氧化蛋白的活性,清除活性氧自由基,并
降低脂类以及DNA过氧化物产生,从而发挥保护细胞器、细胞内的氧化还原环境和机体功能的作用[12-13]。该研究证实猴头菇多糖具有较好的抗氧化活性,提示了猴头菇多糖的药理作用亦可能与抗氧化活性相关,关于猴头菇多糖药理活性与抗氧化性能的具体机制还有待于进一步研究。
安徽农业科学2017年
参考文献
[1] 徐铮奎.我国抗真菌药物市场前景分析——老品种继续畅销,新品种异军突起[J].中国制药信息,2008(7):28-31.
[2] 刘春兰,邓义红,杜宁,等.新疆雪莲水溶性多糖的分离纯化及生物活性研究[J].中药材,2008,31(1):101-104.
[3] 赵永勋,李克颖,张跃华.多脂鳞伞菌丝体多糖抗肿瘤活性研究[J].食用菌学报,2007,14(2):49-54.
[4] 张志军,李淑芳,魏雪生,等.灵芝多糖体外抗氧化活性的研究[J].化学与生物工程,2011,28(3):63-65.
[5] 沈小英,牛小义,段军娜,等.多糖对烟草花叶病毒(TMV)的抑制作用研究[J].西北農林科技大学学报(自然科学版),2012,40(12):115-120.
[6] 芮世华.介绍几种珍稀食用菌[J].农学学报,2000(8):34-36.
[7] 周跃勤.猴头菇营养素的生产工艺[J].食用菌,1995(4):40-41.
[8] 石耀荣.Culture medium and cultivation method of hericium erinaceus:CN 103304330 A[P].2013-06-28.
[9] 王琳琳.Sarcodactylis hot pot condiment capable of beautifying face and production method thereof:CN 103815364 A[P].2014.
[10] 徐杭民,谢志慧,张蔚羽,等.猴头菇多糖的免疫调节作用[J].中国中西医结合杂志,1994(7):427-428.
[11] 杨雪,张海悦,张鑫,等.猴头菇多糖对小鼠抗疲劳作用研究[J].食品工业科技,2015,36(13):368-370.
[12] AMAGASE H,SUN B X,BOREK C.Lycium barbarum (goji)juice improves in vivo antioxidant biomarkers in serum of healthy adults[J].Nutrition research,2009,29(1):19-25.
[13] 王心广,曹有龙.枸杞抗氧化功能研究进展[J].宁夏农林科技,2011,52(11):48-52.

