蛙携带虹彩病毒的分子流行病学研究
邵军辉++张利峰++王树云++李聪++罗杨志++陈孝煊++袁军法

摘要:运用多重实时PCR对多地的养殖和野生蛙类携带虹彩病毒的本底展开调查,并进行病毒分型。结果表明,检测的样品平均阳性率为8.90%,养殖蛙的平均阳性率为4.57%,野生蛙的平均阳性率为16.82%。从蛙种类来看,养殖牛蛙和黑斑蛙带毒率较低,而养殖的棘胸蛙和野外捕捉的斑腿树蛙带毒率较高。不同蛙携带的蛙病毒的分子序列比较结果显示,不同来源的蛙病毒高度保守,缺乏明显的宿主与地域特异性,表明人工繁育场暴发虹彩病毒可能对其他野生蛙类资源产生了负面影响,建议在野生动物人工驯养繁殖体系中引入病害监测和疫病防控措施。
关键词:蛙;虹彩病毒;多重实时PCR;流行病学
中图分类号:Q959.5+3 文献标识码:A 文章编号:0439-8114(2017)09-1702-04
DOI:10.14088/j.cnki.issn0439-8114.2017.09.025
Study on Molecular Epidemiology of Iridoviruses in Rana
SHAO Jun-hui1,ZHANG Li-feng2,WANG Shu-yun2,LI Cong1,LUO Yang-zhi1,CHEN Xiao-xuan1,YUAN Jun-fa1
(1. College of Fisheries, Huazhong Agricultural University, Wuhan 430070, China;2. Inspection and Quarantine Technical Center of Beijing Entry-Exit Inspection and Quarantine Bureau, Beijing 100026, China)
Abstract: The multiplex real-time PCR assay was used to investigate the prevalence of iridoviruses in farmed or wild frog. Results indicated that the average positive rate was 8.90%,in which the average positive rate in farmed and wild frog was 4.57% and 16.82%,respectively. The most significant prevalence of iridoviruses was found among the farmed Quasipaa spinosa and Polypedates megacephalus,while the species of Rana catesbeiana and Rana nigromaculata rarely. Sequences alignement of major capsid protein suggested that there were no obvious host and geographic specificity among these detected Rana iridoviruses,it indicated that the outburst of iridoviruses in farm produced negative effects on wild frogs,disease monitoring,disease prevention and control measures were proposed to introduce into the artificial domestication propagation system of wild animal.
Key words: Rana; iridoviruses; multiplex real-time PCR; epidemiology
近50年來,全球范围内多种两栖动物种群显著衰退,一些种类已经灭绝,部分物种濒危,原因包括气候变化、栖息地减少、环境污染以及疾病传播等[1,2]。其中蛙壶菌(Batrachochytrium dendrobatidis)和虹彩病毒(Iridoviruses)是引起两栖类种群数量下降的主要病原因素[3-5]。中国部分蛙种的资源量也因环境变化以及人为捕捉等因素急剧减少。如虎纹蛙(Hoplobatrachus ruguosus)、林蛙(Rana dybowskii)、棘胸蛙(Quasipaa spinosa)等种类因肉味鲜美、营养丰富遭到过度捕捉,导致这些蛙类野生资源量急剧减少[6,7]。近年来,为保护自然资源及满足市场需求,人们开展了多个蛙种的驯养及人工增养殖[8-10]。但人工增养殖的模式对野生蛙类资源以及当地自然生态环境的影响缺乏系统的评估,尤其是人工增养殖中虹彩病毒病的暴发对野生资源的影响缺乏深入研究。
虹彩病毒无囊膜,对环境适应力较强,可在土壤和水体中存活长达几个月而保持感染性[11]。为适应蛙的特殊生活习性,养殖场多位于较偏僻的山林地区,与周边环境存在许多交互作用。当蛙养殖场暴发虹彩病毒病后,养殖用水的不规范处理、蛙的逃逸以及带毒蛙的商业流动等对当地野生蛙类资源的影响亟需评估。先前,湖北省宜昌市某养殖场发生棘胸蛙的暴发性死亡,经鉴定为蛙病毒的感染所致[12],但其病毒来源以及蛙携带病毒的本底等基础问题尚未知。为此,本研究利用建立的蛙病毒多重检测方法[13],对不同来源的养殖和野生蛙类携带虹彩病毒进行初步调查,并进行病毒分型研究,以期为优化人工增养殖的蛙类资源保护模式提供参考。
1 材料与方法
1.1 样品采集
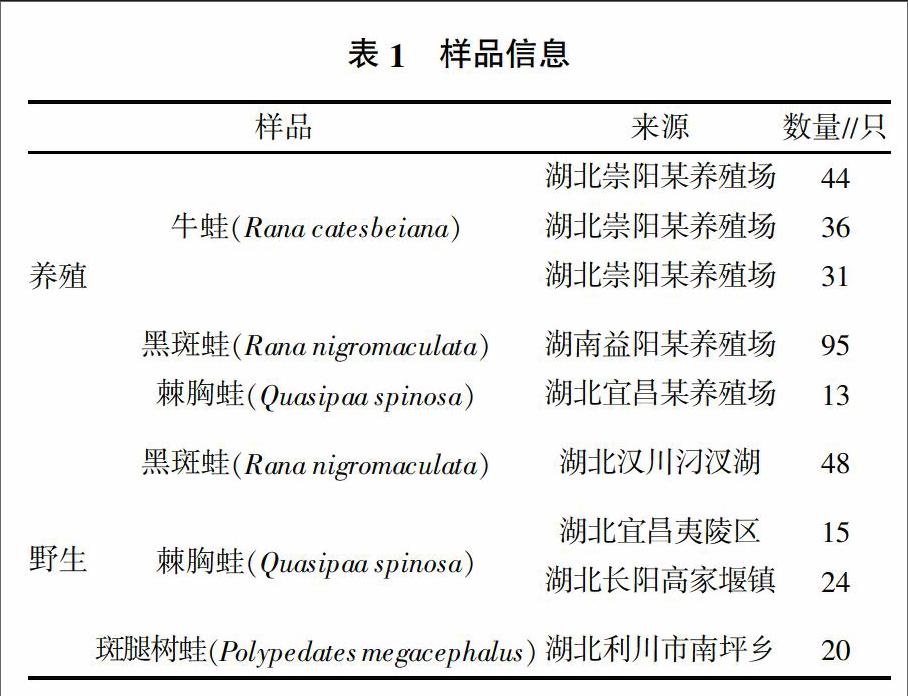
样品详细采样情况见表1。采集的蛙经麻醉后取脾或肾用于后续的检测。
1.2 样品DNA提取与筛查
组织DNA的提取采用康为世纪通用型柱式基因组提取试剂盒,取不超过0.1 g组织,按试剂盒说明书进行,组织DNA以50 μL的三蒸馏水洗脱,-20 ℃保存。
以优化的三重荧光PCR方法筛查[13]。优化的三重荧光PCR反应体系(25 μL)如下:5 μL DNA模板,10×recreation buffer 2.5 μL,25 mmol/L MgCl2 3 μL,10 mmol/L dNTP 0.5 μL,通用正向引物(20 μmol/L)1 μL,通用反向引物(20 μmol/L)1 μL,探针1(20 μmol/L)0.5 μL,探针2(20 μmol/L)0.5 μL,探针3(20 μmol/L)0.5 μL,Taq DNA聚合酶(5 U/μL)0.5 μL,用去离子水补足至总体积25 μL。采用Roche Light Cycler 480Ⅱ荧光PCR检测仪:第一阶段:95 ℃ 3 min;第二阶段:95 ℃ 15 s,54 ℃ 15 s, 60 ℃ 30 s,40个循环;60 ℃延伸时收集荧光。扩增结果以在相应的检测通道呈典型的“S”型扩增曲线及Ct值判定。
1.3 基因扩增与克隆
以蛙病毒保守引物RGVP1/P2(5-GACTTGGC
CACTTATGAC-3/5-GTCTCTGGAGAAGAAGAA-3)擴增“1.2”中准备的部分样品DNA,扩增循环条件为95 ℃ 30 s,50 ℃ 45 s,72 ℃ 30 s,35个循环,预期扩增片段为531 bp,预期目的条带经胶回收后直接测序验证。
以NCBI登陆的蛙病毒主要结构蛋白(major capsid protein,MCP)序列设计引物MCPF1/R1(5-ATGTCTTCTGTAACCGGTTCAG-3/5-TTACAAGA
TTGGGAATCCCATCG-3),用于扩增蛙病毒的MCP全长,扩增循环条件为95 ℃ 30 s,50 ℃ 45 s,72 ℃ 90 s,30个循环,预期扩增片段为1 392 bp。扩增产物经胶回收后连接至T-easy载体,每个基因选择3个阳性克隆子测序。
1.4 序列分析
以DNAstar进行常规的序列拼接与编辑,序列比对以Clustal 2.0软件进行,聚类分析以MEGA 6.0进行,以邻接法构建进化树,选择成对缺失模式,以bootstrip值进行验证,进化树以Treeview进行编辑。
2 结果与分析
2.1 样品筛查结果
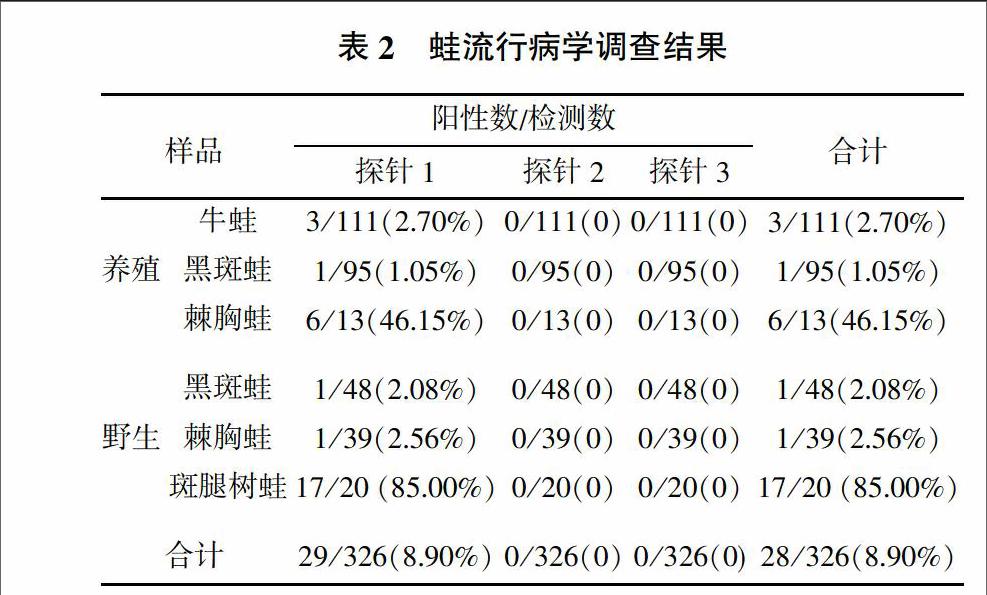
先前建立的三重荧光定量PCR可检测不同种类的蛙病毒,其中探针1可检测包含蛙病毒3型(Frog virus 3,FV3)、饰纹汀蛙虹彩病毒(Bohel iridovirus,BIV)、流行性造血器官坏死症病毒(Epizootic Haematopoietic Necrosis Virus,EHNV)、欧洲鮰鱼病毒(European catfish iridovirus,ECV)、欧鲶病毒(European sheetfish iridovirus,ESV)、中华鳖虹彩病毒(Soft-shelled Turtle iridovirus,STIV)、大鲵虹彩病毒(Andrias davidiamus iridovirus,ADIV)、沼泽绿牛蛙虹彩病毒(Rana grylio virus,RGV)、虎纹蛙病毒(Tiger frog virus,TFV)等的蛙病毒,探针2可检测大口黑鲈虹彩病毒(Largemouth bass ranavirus,LMBV)、裂唇鱼病毒(Doctor fish virus,DFV)和孔雀鱼病毒(Guppyfish iridovirus,GV6),探针3可检测新加坡石斑鱼虹彩病毒(Singapore grouper iridovirus,SGIV)[13]。样品筛查结果(表2)显示,探针1检测的阳性率为8.90%,从养殖的219份蛙样品中检出10份阳性,平均Ct值为26.45,最小Ct值为20.03。从野外捕捉的107份蛙样品中检出19份阳性,平均Ct值为28.18,最小Ct值为22.97。从蛙种类来看,牛蛙和黑斑蛙带毒率较低,而野外捕捉的斑腿树蛙带毒率较高。探针2和3均未检出阳性。
2.2 不同来源蛙携带病毒的比较
因探针1可检测多种蛙病毒,为确定检测到的蛙病毒属于哪一种,进一步以蛙病毒MCP保守引物进行扩增,扩增片段为531 bp,并进行测序。Blast比对结果(图1)显示,获得的MCP部分序列高度保守,同Rana grylio virus 9807高度保守,仅养殖来源的棘胸蛙(QSV46)同其他序列相差一个碱基,并导致一个氨基酸的差异。
为比较上述不同来源的蛙病毒的差异,设计引物扩增养殖的棘胸蛙来源(QSV46)与斑腿树蛙(PMV69)携带病毒的MCP全长。如图1所示,QSV46和PMV69的核苷酸序列仅相差4个碱基,并导致4个氨基酸的差异。同蛙病毒属的代表种FV3编码的MCP比较,QSV46同FV3相差5个氨基酸,PMV69同FV3仅相差2个氨基酸。值得指出的是,PMV69的序列同本实验室先前从某养殖场获得的QSV01 MCP全长序列完全一致[12],但两者种类不同、来源不一致、采样地点的距离超过400 km。同中国其他来源的蛙病毒比较显示,不同蛙类携带的FV3或FV3样病毒,如RGV、TFV同源性都非常高。
从GenBank获得虹彩病毒科各代表种的MCP全长序列,与本研究中获得的MCP全长进行比对,并构建进化树(图2),由图2可见,QSV01、QSV46以及PMV69同FV3和STIV聚为一支,均为蛙病毒属的成员。
以ClustalX2比对虹彩病毒科各代表种编码的MCP氨基酸序列,以MEGA6构建进化树。参考序列如下:STIV(EU627010)、RGV(JQ654586)、FV3(AY548484)、TFV(AF389451)、ATV(AY150217)、GSIV(AET51835.1)、ISKNV(AF371960)、RBIV(AY532606)、OSGIV(AY894343)、LCDV-C(AY380826)、LCDV-1(L63545)、IIV6(NP149737.1)、IIV3(DQ643392);QSV01、QSV46和PMV69为本研究涉及;GSIV-HN为华中农业大学水生动物病毒实验室于2012年从河南发病大鲵分离获得。
3 小结与讨论
近年来,气候变化与人类活动是导致蛙类种群数量下降的主要原因,但蛙壶菌和蛙病毒等病原生物的感染也是导致蛙种群数量降低的重要原因[1-5]。据报道,目前蛙病毒感染的两栖类种类多达74种,其中主要为无尾目(Anura)蛙科(Ranidae)的成員[4]。蛙病毒可能引起蛙类的致死性感染,如Green等[14]分析了1996-2001年间美国两栖类死亡事件,其中57%的两栖类死亡事件与蛙病毒有关。张奇亚等[15]、王晓红等[16]、刘晓东等[17]分别从沼泽绿牛蛙(Rana grylio)、虎纹蛙(Rana tigrina rugulosa)、牛蛙(Rana catesbeiana)等养殖蛙上分离到蛙病毒,李莉娟等[12]首次从人工养殖的患病棘胸蛙中分离到蛙病毒QSV01。蛙病毒除了致死性感染外,也能形成无临床症状的携带状态。如Xu等[18]对黑龙江省的东北林蛙携带蛙病毒的初步调查显示东北林蛙成体的带毒率为5%(9/180),夏季蝌蚪的平均带毒率高达42.5%(51/120)。本研究也显示从养殖或野外捕捉的蛙携带病毒的平均比例为8.90%(29/326)。野生蛙类的带毒状态对蛙类种群的潜在影响尚缺乏系统评估。存在因栖息地减少、食物缺乏以及环境剧变等强应激下,蛙病毒从携带感染(或潜伏感染)转化为急性感染、引起蛙的死亡的潜在威胁。亟需利用生态学与流行病学等多学科的研究手段,在生态学的大尺度上评估蛙携带病毒对其种群的影响。
综合已有的研究,野生蛙携带病毒的比率受调查种类、栖息环境以及采样季节的影响,波动幅度非常大(0%~80%)[4]。在本研究中,不同来源与种类的野生蛙带毒比率差别也非常大,其中斑腿树蛙的带毒率最高,黑斑蛙带毒率最低,仅2%,可能与不同蛙种对蛙病毒的敏感性有差异相关。Hoverman等[19]的研究已证实不同蛙类对蛙病毒的敏感性存在差异,他们在调查北美的19个蛙种中,木蛙(Lithobates sylvaticus)和穴蛙(L. capito)的敏感性最高。
通过比较不同蛙携带的蛙病毒的分子序列,显示不同来源的蛙病毒高度保守,缺乏明显的宿主与地域特异性。如从患病沼泽绿牛蛙中分离到蛙病毒(RGV9506、RGV9807、RGV9808)、从牛蛙中分离的蛙病毒(FJ049)、从虎纹蛙中分离的蛙病毒(TFV)以及从棘胸蛙分离的蛙病毒株(QSV01、MV69)都高度相似,氨基酸一致率在99%以上,其编码的MCP仅相差0~5个氨基酸(图1)。值得指出的是,QSV01来源于患病棘胸蛙,PMV69来源于野外捕捉的斑腿树蛙,两个样本来自不同地域,但两者编码的MCP完全一致,提示蛙病毒没有严格的宿主特异性,很可能存在跨种间传播的现象,为蛙类野生资源保护提出了更为严峻的现实难题。根据《中华人民共和国野生动物保护法》等规定,国家鼓励驯养繁殖野生动物。但人工驯养与增养殖的野生动物保护策略,尤其是蛙类、珍稀鱼类等群体生物,随着养殖密度的提高、养殖环境的应激增强等因素极大地增加了疾病传播的几率。同时,这些养殖场多同自然环境交互较密切,养殖废水的消毒不彻底、养殖对象的逃逸、带毒动物的商业化流通甚至放流等因素很可能对野生种质资源造成负面影响。因此在野生动物人工驯养繁殖体系中建立病害监测、引入系统的疫病防控策略显得尤为重要和迫切。
参考文献:
[1] STUART S N,CHANSON J S,COX N A,et al. Status and trends of amphibian declines and extinctions worldwide[J].Science,2004,306:1783-1786.
[2] RACHOWICZ L J,KNAPP R A,MORGAN J A,et al. Emerging infectious disease as a proximate cause of amphibian mass mortality[J].Ecology,2006,87(7):1671-1683.
[3] CHINCHAR V G,WALTZEK T B. Ranaviruses: not just for frogs[J].PLoS Pathog,2014,10(1):e1003850.
[4] MILLER D,GRAY M,STORFER A. Ecopathology of ranaviruses infecting amphibians[J].Viruses,2011,3(11):2351-2373.
[5] STOHR A C,LOPEZ-BUENO A,BLAHAK S,et al. Phylogeny and differentiation of reptilian and amphibian ranaviruses detected in Europe[J]. PLoS One,2015,10(2):e0118633.
[6] ESKEW E A,TODD B D. Parallels in amphibian and bat declines from pathogenic fungi[J].Emerging Infectious Diseases,2013,19(3):379-385.
[7] 刘 欣,张 伟,遇宝成,等.东北三省中国林蛙资源调查研究[J].林业资源管理,2007(3):82-85.
[8] 梅祎芸,叶容晖,宋婷婷,等.浙江省棘胸蛙养殖现状及发展对策[J].浙江农业科学,2015,56(7):1122-1125.
[9] 俞宝根,叶容晖,郑荣泉,等.人工环境下棘胸蛙(Paa spinosa)繁殖期的行为谱及活动节律[J].生态学报,2008,28(12):6371-6378.
[10] 王 兵. 辽宁省中国林蛙驯养繁殖现状、问题与对策建议[J].辽宁林业科技,2012(3):52-54.
[11] NAZIR J,SPENGLER M, MARSCHANG R E. Environmental persistence of amphibian and reptilian ranaviruses[J].Dis Aquat Organ,2012,98(3):177-184.
[12] 李莉娟,罗杨志,顾泽茂,等.蛙病毒3介导棘胸蛙的暴发性死亡[A].中国水产学会,中国科学院水生生物研究所,海南大学.2013年中国水产学会鱼病专业委员会学术研讨会论文集[C].海口,2016.
[13] 李江宇,王树云,王 姝,等.蛙病毒三重荧光PCR检测方法的建立[J].高技术通讯,2015,25(7):746-752.
[14] GREEN D E,CONVERSE K A,SCHRADER A K,et al. Epizootiology of sixty-four amphibian morbidity and mortality events in the USA,1996-2001[J].Ann NY Acad Sci,2002, 969(1):323-339.
[15] 張奇亚,李正秋,江育林,等.沼泽绿牛蛙病毒的分离及其细胞感染的初步研究[J].水生生物学报,1996,20(4):390-392.
[16] 王晓红,翁少萍,何建国.虎纹蛙病毒体外培养及其理化特性[J].水产学报,2002,26(4):363-367.
[17] 刘晓东,杨金先,龚 晖,等.一株牛蛙源虹彩病毒的分离及鉴定[J].中国动物传染病学报,2012,20(1):16-20.
[18] XU K,ZHU DZ,WEI Y,et al. Broad distribution of Ranavirus in free-ranging Rana dybowskii in Heilongjiang,China[J].Ecohealth,2010,7(1):18-23.
[19] HOVERMAN J T,GRAY M J,HAISLIP N A,et al. Phylogeny,life history,and ecology contribute to differences in amphibian susceptibility to ranaviruses[J].Ecohealth,2011,8(3):301-319.

