35例腹型过敏性紫癜临床特点和转归分析
谭 炜 时培美 曾 欣 谢渭芬
第二军医大学附属长征医院消化内科(200003)
35例腹型过敏性紫癜临床特点和转归分析
谭 炜*时培美 曾 欣 谢渭芬#
第二军医大学附属长征医院消化内科(200003)
背景:腹型过敏性紫癜(HSP)临床表现缺乏特异性,诊断困难,易发生误诊。目的:分析全年龄段腹型HSP患者的临床特点及其转归,为该病的早期诊断和治疗提供依据。方法:对2006年1月—2016年1月上海长征医院收治的35例腹型HSP患者的临床资料进行回顾性分析,并以电话形式进行预后随访。结果:入组患者中男性22例,女性13例,平均发病年龄33.6岁。最常见的发病季节为冬春两季,常见诱因为发病前异种蛋白饮食史和上呼吸道感染。57.1%的患者以腹痛为首发表现,腹痛部位最常见于脐周(42.9%),以阵发性绞痛为主(48.6%),腹部体征较轻。实验室检查中57.1%的患者白细胞计数升高,25.0%血清IgA升高。内镜下病变主要位于胃、十二指肠和直、结肠,表现为不同程度的黏膜点状出血、弥漫性充血水肿和糜烂,活检病理提示非特异性炎性细胞浸润。该病预后良好,复发率为21.9%,所有复发患者入院时均存在血清纤维蛋白原降解产物(FDP)和D-二聚体升高。结论:腹型HSP皮疹常晚于消化道症状出现,典型的临床和内镜表现有助于早期诊断和治疗。FDP和D-二聚体升高对预测复发可能有一定价值。
紫癜,过敏性; 体征和症状; 腹痛; 治疗结果; 回顾性研究
过敏性紫癜(Henoch-Schönlein purpura,HSP)是由免疫复合物介导的非血小板减少性系统性血管炎,常累及皮肤小血管、关节、消化道和肾脏,好发于儿童和青少年,成人中亦不罕见[1],病因和发病机制迄今仍不明确[2]。50%~85%的HSP患者有消化道累及[3],以腹痛、呕血、黑便等消化道症状为首发或突出表现,称为腹型HSP。腹型HSP临床表现缺乏特异性,诊断困难,易发生误诊。本研究通过分析全年龄段腹型HSP患者的临床特点及其转归,以期为该病的早期诊断和治疗提供依据。
对象与方法
一、研究对象
收集2006年1月—2016年1月在上海长征医院住院治疗,以消化道症状(腹痛、恶心、呕吐、呕血、黑便等)为首发或主要表现的HSP患者35例。HSP诊断标准(EULAR/PReS共识标准):可触性(必要条件)皮疹伴以下任何一项:①弥漫性腹痛;②任何部位活检示IgA沉积;③关节炎/关节痛;④肾脏受损表现[血尿和(或)蛋白尿][4]。排除标准:①血小板(PLT)计数<100×109/L;②其他原因引起的血管炎和紫癜。
二、方法
在取得患者或家属知情同意后,查阅住院病史,采集临床、实验室、内镜、病理以及诊断和治疗相关资料,以电话形式进行预后随访。无法获得出院后信息为失访。经治疗症状和体征消失1个月后再次出现与初次发病相同的症状和体征为复发。
三、统计学分析
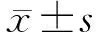
结 果
一、临床特点
35例腹型HSP患者中男性22例,女性13例,男女比例1.7∶1,平均发病年龄(33.6±23.7)岁,其中≤18岁17例,>18岁18例。患者的发病季节、诱因和主要临床表现见表1。最常见的发病季节为冬春两季(65.7%)。21例(60.0%)患者有明确发病诱因,其中最常见的是发病前海产品等异种蛋白饮食史,其次为上呼吸道感染。所有患者均有典型的皮疹和腹痛表现,以腹痛为首发表现者20例(57.1%),以胃肠道症状为最严重表现者23例(65.7%),其中腹痛22例,呕血1例。
最常见的腹痛部位为脐周痛(42.9%),腹痛性质主要为阵发性绞痛(48.6%)。伴随症状:关节肿痛15例,恶心、呕吐9例,蛋白尿8例,腹泻7例,黑便7例,便血5例,呕血2例,肛门停止排气排便、肉眼血尿和咽痛各1例。腹部体征:无固定压痛点5例,脐周压痛3例,中上腹、下腹正中、右下腹压痛各2例,左上腹压痛1例;34例患者腹部柔软,1例腹肌紧张,有反跳痛。既往史:抗菌药物过敏史7例,海产品、芒果等食物过敏史8例。发病至确诊中位天数30 d(4~1 096 d)。入院时1例患者误诊为克罗恩病(CD),误诊率为2.9%。
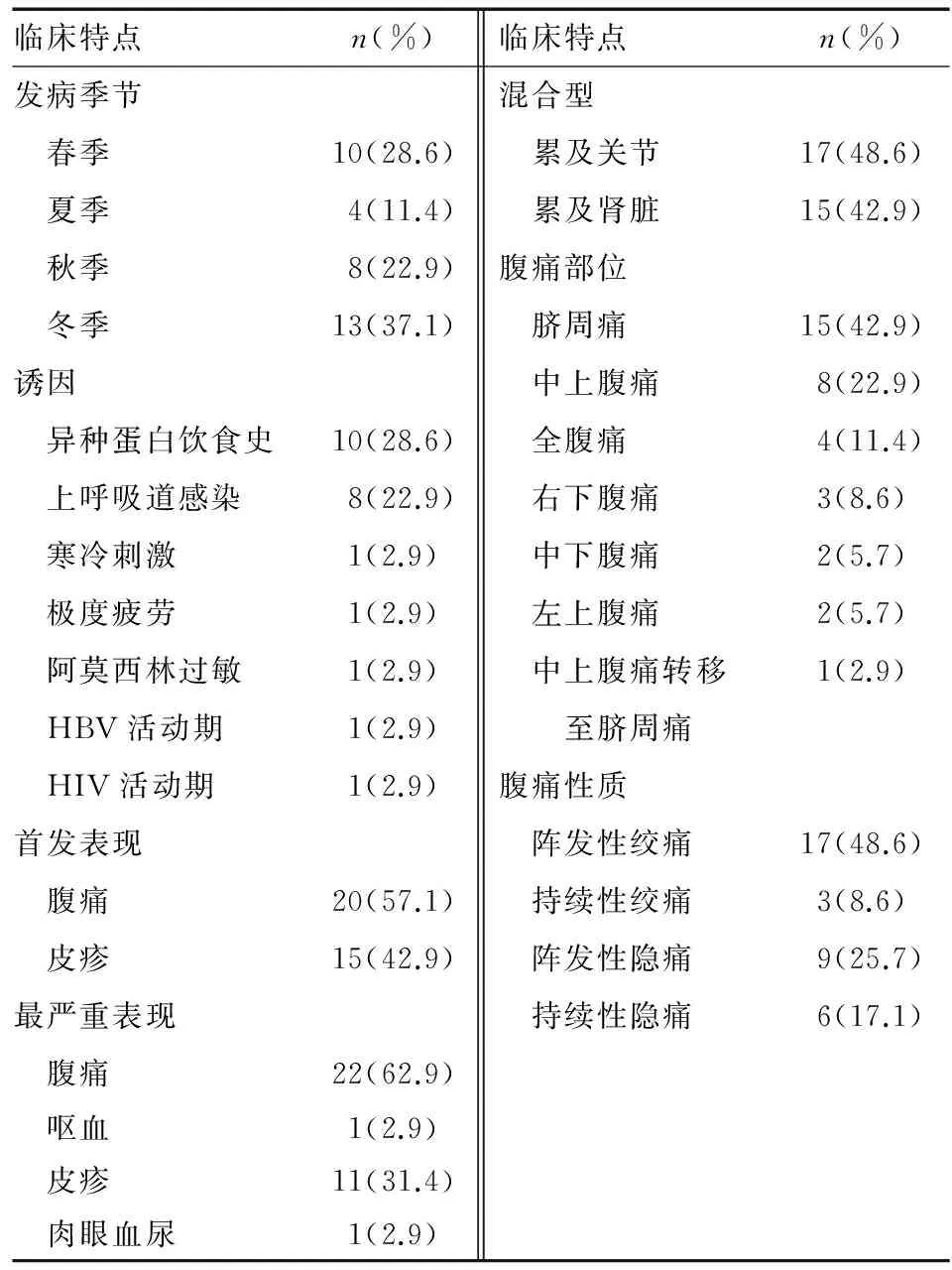
表1 35例腹型HSP患者的发病季节、诱因和主要临床表现
二、实验室检查
35例腹型HSP患者部分实验室指标检查结果见表2。入院时血常规白细胞(WBC)计数升高20例(57.1%),血红蛋白(Hb)降低9例(25.7%),嗜酸性粒细胞升高1例(2.9%),所有患者PLT计数均正常;粪隐血阳性11例(31.4%),粪便中均未找到虫卵;尿隐血阳性20例(57.1%),尿蛋白阳性21例(60.0%)。
部分患者行凝血相关指标检查,纤维蛋白原降解产物(FDP)升高3例(75.0%),D-二聚体升高7例(58.3%),纤维蛋白原升高8例(27.6%)。
部分患者行免疫学指标检查,血清IgA升高4例(25.0%),IgE升高10例(62.5%);补体C3或C4降低7例(41.2%);抗中性粒细胞胞质抗体(ANCA)、抗核抗体(ANA)阳性各1例(5.9%);23例检测抗O和类风湿因子者结果均在正常范围内;5例行过敏原测试者中3例(60.0%)阳性。
比较青少年组(≤18岁)与成人组(>18岁)主要实验室指标,发现成人组尿蛋白阳性率显著高于青少年组(94.4%对23.5%,P<0.05),其余指标两组间差异均无统计学意义(P>0.05)(表3)。
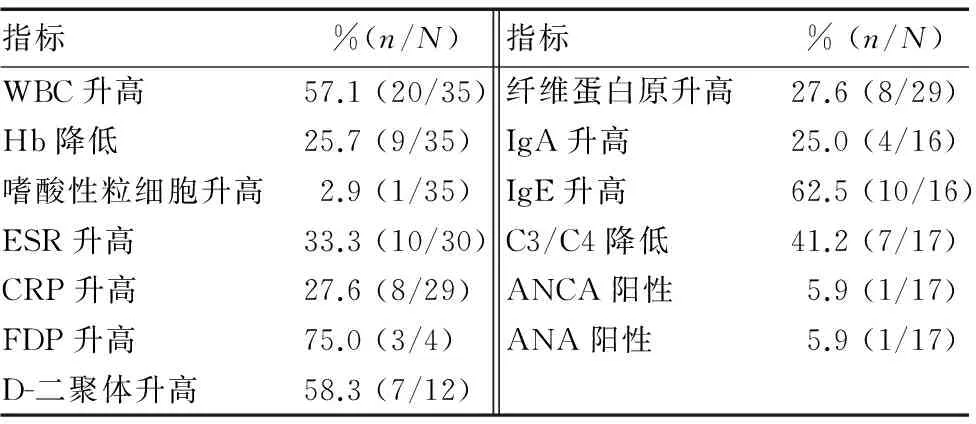
表2 35例腹型HSP患者部分实验室指标检查结果
判定标准:WBC升高,>9.5×109/L;Hb降低,男性<120 g/L,女性<110 g/L;嗜酸性粒细胞升高,>8%;ESR升高,>20 mm/h;CRP升高,>10 mg/L;FDP升高,>5 mg/L;D-二聚体升高,>500 μg/L;纤维蛋白原升高,>4.5 g/L;IgA升高,>3 g/L;IgE升高,>165 g/L;C3降低,<0.79 g/L;C4降低,<0.16 g/L
三、内镜和活检病理检查
35例患者中12例行内镜检查,其中胃镜8例,结肠镜4例。6例行胃镜检查者表现为不同程度的胃、十二指肠降部黏膜点状出血、弥漫性充血水肿和糜烂;1例合并乙型肝炎肝硬化患者见食管静脉中重度曲张和门静脉高压性胃病表现;1例见十二指肠球部溃疡。4例行结肠镜检查者中3例见不同程度的直、结肠黏膜弥漫性充血水肿和糜烂,1例见直肠黏膜下肿块。黏膜活检病理除1例为直肠神经内分泌肿瘤外,其余均显示非特异性炎性细胞浸润。
四、治疗和转归
20例以腹痛为首发表现者入院时给予对症支持治疗,包括饮食控制、抗菌药物、质子泵抑制剂、黏膜保护剂、解痉止痛药物等,但效果不佳。待出现典型紫癜样皮疹后,予糖皮质激素(其中2例联合免疫抑制剂)、抗组胺药物和钙剂,消化道症状和皮疹均显著缓解,于2~4周内治愈。
中位随访时间为50个月(7~86个月),3例患者失访,失访率为8.6%。32例获得随访资料者中7例复发,复发率为21.9%。复发诱因均与初发相同,复发时间最早为治愈后1个月,最晚为治愈后6年,予糖皮质激素、抗过敏等对症支持治疗后治愈。复发组入院时FDP、D-二聚体升高率均高于未复发组,但差异无统计学意义[100%(1/1)对66.7%(2/3),P=0.505;100%(3/3)对42.9%(3/7),P=0.091)。2例患者死亡,死因分别为HIV并发症和乙型肝炎肝硬化并发症。
讨 论
HSP是一种系统性血管炎, 多见于儿童和青少年,但成人患者亦不在少数,临床上可分为皮肤型、腹型、关节型、肾型和混合型,其中以消化道症状为首发或突出表现者称为腹型HSP。HSP的发病机制尚未完全明确,目前观点认为是机体对某些致敏物质发生变态反应,抗原-抗体复合物沉积于血管壁,引起广泛的毛细血管炎甚至坏死性小动脉炎[5],组织病理学特点为小血管多形核白细胞浸润并存在白细胞破碎,组织免疫荧光染色可见以IgA为主的免疫球蛋白沉积于小血管壁(毛细血管、小静脉、小动脉或肾小球)[6]。本研究通过分析腹型HSP的临床特点,以期为其早期诊断和治疗提供依据。
文献报道HSP发病人群中男性多于女性,好 发于冬春两季[1,5,7],本组患者男女比例为1.7∶1,65.7%的患者于冬春两季发病,与既往报道一致。尽管HSP病因不明, 但有报道认为感染尤其是上呼吸道感染、预防接种、药物、海产品等食物过敏是该病的可能诱因[1,5,7]。本组患者最常见的诱因为异种蛋白饮食史和上呼吸道感染,支持上述观点。
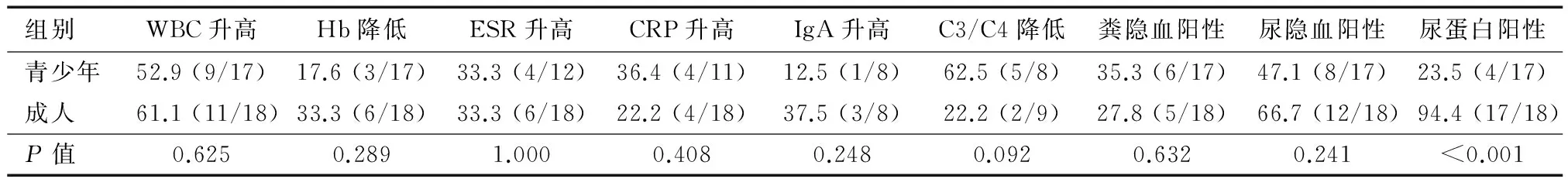
表3 青少年与成人腹型HSP患者主要实验室指标比较 %(n/N)
本研究中所有腹型HSP患者均存在腹痛症状,此种腹痛可能是小血管炎和继发的血栓栓塞导致消化道黏膜下和浆膜下出血所致[8]。腹痛部位最常见于脐周,以阵发性绞痛为主,与既往报道一致[5,7]。患者腹部体征较轻,仅1例出现腹肌紧张和反跳痛,后续证实该例患者系合并急性阑尾炎发作。
既往研究显示10%~40%的腹型HSP患者消化道症状先于紫癜样皮疹出现[9],本组57.1%的患者腹痛先于皮疹出现,略高于先前数据。典型对称性紫癜样皮疹是诊断HSP的必要条件,因此此类以消化道症状为首发表现的患者早期诊断困难,易发生误诊。自Akdamar等[10]于1973年首次报道HSP患者的胃十二指肠内镜表现以来,关于HSP胃肠道内镜表现的报道陆续发表[11-13],其在内镜下主要表现为黏膜充血水肿、散在出血点、糜烂、多发性溃疡、结节状改变等,上消化道最常见的累及部位为十二指肠降部。研究显示半数以上HSP患者存在十二指肠病变,最严重的病变部位亦为十二指肠,尤其是降部,表现为弥漫性溃疡、黏膜充血水肿、狭窄等[5,14-15]。十二指肠降部多发性不规则溃疡可能是腹型HSP的典型消化道表现,内镜下发现此类典型病变对于以消化道症状为首发表现的HSP患者的早期诊断具有重要意义。下消化道中,以末端回肠和直肠病变较为明显[5,14-15],然而CD、小肠结核等诸多疾病亦可累及回肠,临床上需进行鉴别诊断。本组1例以腹痛为首发表现的患者入院时因尚未出现皮疹而误诊为小肠CD,后行结肠镜活检病理检查未发现肉芽肿性病变,胸部X线片正常,既往无结核病史,激素治疗后症状完全消失,最终排除CD和小肠结核。本组12例患者行消化道内镜检查,发现病变主要累及胃、十二指肠降部和直、结肠,表现为不同程度的黏膜点状出血、弥漫性充血水肿和糜烂,与既往报道大致相符。本组患者未发现末端回肠病变,可能是由于大多数结肠镜检查仅到达回盲部,未能观察末端回肠。小肠镜、胶囊内镜等检查可增加腹型HSP的小肠病变检出率,有助于其早期诊断。本组除1例患者内镜活检病理提示直肠神经内分泌肿瘤外,其余均为非特异性炎症。有学者认为内镜活检仅限于黏膜表面而不能到达更深层的血管,其价值主要在于鉴别诊断,可排除炎症性肠病、肠结核等疾病[14]。
腹型HSP缺乏特异性实验室指标,PLT计数有助于与血小板减少性紫癜鉴别。HSP发作期间可见WBC计数、ESR、CRP升高[16-17],本组患者表现与之相符。文献报道HSP患者可有外周血嗜酸性粒细胞升高[5],但本组仅1例患者有此表现。血清和黏膜分泌物中的IgA在HSP发病中起重要作用[2],IgA1的异常糖基化聚合大分子复合物可激活补体旁路途径,并募集炎性细胞[9,18]。不同种类的IgA自身抗体与内皮细胞存在交叉反应,进而诱导补体依赖的细胞溶解[19]。有研究[20]发现HSP患者皮肤Langerhans细胞和肥大细胞中有IgE沉积,因而认为其发病与变态反应有关。本组25.0%的患者血清IgA升高,62.5% IgE升高,与既往研究结果相符。本研究对青少年组与成人组腹型HSP患者主要实验室指标的比较显示,两组间仅尿蛋白阳性率差异有统计学意义。成人组尿蛋白阳性率较高可能与其肾脏累及率高于儿童和青少年有关[1,16,21]。
腹型HSP对抑酸剂、黏膜保护剂和解痉剂应答不佳,糖皮质激素则可有效缓解消化道症状,改善预后[22]。因此一旦确诊腹型HSP,应尽早使用糖皮质激素,如疗效不佳、病变严重或合并紫癜性肾炎,可使用或联合使用免疫抑制剂。本组患者经单用糖皮质激素或联合免疫抑制剂治疗后,消化道症状和皮疹均显著缓解,于2~4周内治愈。
本组患者的随访结果显示腹型HSP总体预后较好,但有21.9%的患者在痊愈后复发。尽管复发组与未复发组间入院时FDP、D-二聚体升高率差异无统计学意义,但所有复发者均存在FDP、D-二聚体升高,提示这两项指标可能与预后有关。研究[17,23]证明FDP和D-二聚体与HSP疾病活动性有很强的相关性,在HSP急性期,两者反映HSP消化道累及的能力优于炎症指标。因此,FDP和D-二聚体升高可能对预测腹型HSP复发有一定价值。
本研究的不足之处主要在于以下两点:首先,本研究为单中心回顾性研究,纳入病例数有限。其次,消化道内镜检查对于确诊腹型HSP具有重要作用,而本组患者内镜检查率仅为34.3%。导致这一不足的原因为本组仅5例患者为消化内科住院患者,其余患者分布于皮肤科、普外科、肾内科,内镜检查率低与非消化专科临床医师未能正确认识内镜和活检病理检查在该病诊断中的重要性有关。
综上所述,腹型HSP皮疹常晚于消化道症状出现,典型的临床和内镜表现有助于早期诊断和治疗。临床医师需熟悉腹型HSP的临床特点,对于有明显消化道症状而诊断不明确者,尤其是在发病前有感染、过敏原接触史、药物服用史者,在皮肤紫癜样皮疹出现前即应考虑HSP的可能,并及时行消化道内镜和活检病理检查,从而有利于早期诊断,减少并发症发生。对于诊断明确的患者,应立即给予糖皮质激素,并联合抗组胺、抗感染、抑酸等对症治疗,必要时可单独或联合使用免疫抑制剂。入院时FDP和D-二聚体升高对预测腹型HSP复发可能有一定价值。
1 Blanco R,Martínez-Taboada VM,Rodríguez-Valverde V,et al.Henoch-Schönlein purpura in adulthood and childhood:two different expressions of the same syndrome[J].Arthritis Rheum,1997,40 (5):859-864.
2 Saulsbury FT.Henoch-Schönlein purpura[J].Curr Opin Rheumatol,2010,22 (5):598-602.
3 Szer IS.Henoch-Schönlein purpura:when and how to treat[J].J Rheumatol,1996,23 (9):1661-1665.
4 Ozen S,Ruperto N,Dillon MJ,et al.EULAR/PReS endorsed consensus criteria for the classification of childhood vasculitides[J].Ann Rheum Dis,2006,65 (7):936-941.
5 张安忠,杨崇美,刘吉勇,等.成人腹型过敏性紫癜的临床和内镜特征[J].中华消化内镜杂志,2005,22 (2):108-110.
6 Giangiacomo J,Tsai CC.Dermal and glomerular deposition of IgA in anaphylactoid purpura[J].Am J Dis Child,1977,131 (9):981-983.
7 Calvo-Río V,Loricera J,Mata C,et al.Henoch-Schönlein purpura in northern Spain:clinical spectrum of the disease in 417 patients from a single center[J].Medicine (Baltimore),2014,93 (2):106-113.
8 Robson WL,Leung AK.Abdominal pain in Henooh-Schönlein purpura[J].Arch Dis Child,1992,67 (2):256.
9 Saulsbury FT.Henoch-Schönlein purpura[J].Curr Opin Rheumatol,2001,13 (1):35-40.
10 Akdamar K,Agrawal NM,Varela PY.The endoscopic appearance of anaphylactoid purpura[J].Gastrointest Endosc,1973,20 (2):68-69.
11 Di Febo G,Gizzi G,Biasco G,et al.Colonic involvement in adult patients with Henoch-Schöenlein purpura[J].Endoscopy,1984,16 (1):36-39.
12 Banerjee B,Rashid S,Singh E,et al.Endoscopic findings in Henoch-Schönlein purpura[J].Gastrointest Endosc,1991,37 (5):569-571.
13 Sasaki K,Nukuda Y,Masuda T,et al.Endoscopically and histologically documented gastrointestinal lesions in an adult patient with Henoch-Schönlein purpura[J].Endoscopy,1994,26 (7):629-630.
14 Zhang Y,Huang X.Gastrointestinal involvement in Henoch-Schönlein purpura[J].Scand J Gastroenterol,2008,43 (9):1038-1043.
15 Esaki M,Matsumoto T,Nakamura S,et al.GI involvement in Henoch-Schönlein purpura[J].Gastrointest Endosc,2002,56 (6):920-923.
16 Lin SJ,Huang JL.Henoch-Schönlein purpura in Chinese children and adults[J].Asian Pac J Allergy Immunol,1998,16 (1):21-25.
17 Hong J,Yang HR.Laboratory markers indicating gastrointestinal involvement of henoch-schönlein purpura in children[J].Pediatr Gastroenterol Hepatol Nutr,2015,18 (1):39-47.
18 Yang YH,Chuang YH,Wang LC,et al.The immunobiology of Henoch-Schönlein purpura[J].Autoimmun Rev,2008,7 (3):179-184.
19 Yang YH,Yu HH,Chiang BL.The diagnosis and classification of Henoch-Schönlein purpura:an updated review[J].Autoimmun Rev,2014,13 (4-5):355-358.
20 Davin JC,Pierard G,Dechenne C,et al.Possible pathogenic role of IgE in Henoch-Schönlein purpura[J].Pediatr Nephrol,1994,8 (2):169-171.
21 Rieu P,No⊇l LH.Henoch-Schönlein nephritis in children and adults.Morphological features and clinicopathological correlations[J].Ann Med Interne (Paris),1999,150 (2):151-159.
22 Weiss PF,Klink AJ,Localio R,et al.Corticosteroids may improve clinical outcomes during hospitalization for Henoch-Schönlein purpura[J].Pediatrics,2010,126 (4):674-681.
23 Yilmaz D,Kavakli K,Ozkayin N.The elevated markers of hypercoagulability in children with Henoch-Schönlein purpura[J].Pediatr Hematol Oncol,2005,22 (1):41-48.
(2016-09-11收稿;2016-09-27修回)
Clinical Characteristics and Outcome of Gastrointestinal Involvement of Henoch-Schönlein Purpura:Analysis of 35 Cases
TANWei,SHIPeimei,ZENGXin,XIEWeifen.
DepartmentofGastroenterology,theSecondMilitaryMedicalUniversityAffiliatedChangzhengHospital,Shanghai(200003)
XIE Weifen,Email:weifenxie@medmail.com.cn
Purpura,Schoenlein-Henoch; Signs and Symptoms; Abdominal Pain; Treatment Outcome;Retrospective Studies
10.3969/j.issn.1008-7125.2017.05.008
*Email:tanwei_1987@163.com
#本文通信作者,Email:weifenxie@medmail.com.cn
Background:Gastrointestinal involvement of Henoch-Schönlein purpura (HSP) lacks specific clinical manifestations,which makes it difficult to be diagnosed and easy to misdiagnose.Aims:To analyze the clinical characteristics and outcome of gastrointestinal involved HSP across all ages and provide evidence for early diagnosis and treatment of the disease.Methods:A retrospective analysis was conducted on 35 gastrointestinal involved HSP patients admitted to Shanghai Changzheng Hospital from Jan.2006 to Jan.2016.The clinical outcome was followed up by phone interview.Results:Of the 35 gastrointestinal involved HSP patients,22 were male and 13 were female,with a mean age of disease onset at 33.6 years.The frequent disease onset seasons were winter and spring,and the most frequent precipitating events were eating foreign proteins and upper respiratory tract infection shortly before disease onset.Abdominal pain was the presenting manifestation in 35 patients (57.1%) and was most frequently at periumbilical area (42.9%),and 48.6% of the pain was of paroxysmal colicky pain.The abdominal signs were mild.Laboratory tests showed 57.1% of the patients had elevated leukocyte count and 25.0% had elevated serum IgA.Stomach,duodenum,rectum and colon were frequently involved endoscopically,and the endoscopic lesions included mucosal petechia,diffuse mucosal erythema,edema and erosion.Nonspecific inflammatory cells infiltration was demonstrated by biopsy pathology.The overall prognosis was good with a recurrence rate of 21.9%.Elevated serum fibrinogen degradation product (FDP) and D-dimer were found in all the recurrent patients at admission.Conclusions:Purpura rash usually appeared later than gastrointestinal symptoms in gastrointestinal involved HSP.Typical clinical manifestations and endoscopic appearances are helpful for early diagnosis and treatment.Elevated FDP and D-dimer might be the predictor of recurrence.

