HPV单一与多重型别感染子宫颈病变风险比较
毕 蕙,刘 燕,2,裴志飞,3
(1.北京大学第一医院妇产科,北京 100034;2.北京市第二医院妇科,北京 100031;3.北京市西城区妇幼保健院妇科,北京 100054)
[专题研究]
HPV单一与多重型别感染子宫颈病变风险比较
毕 蕙1,刘 燕1,2,裴志飞1,3
(1.北京大学第一医院妇产科,北京 100034;2.北京市第二医院妇科,北京 100031;3.北京市西城区妇幼保健院妇科,北京 100054)
目的 对比HPV单一与多重型别感染者子宫颈病变风险,探索相应的管理模式。方法 回顾性总结2010年至2012年在北京大学第一医院妇产科同时行子宫颈细胞学与HPV检测且高危型HPV阳性妇女7 192例的临床资料,分析HPV高危型单一与多重型别感染者子宫颈癌前病变及浸润癌的相关性。结果 7 192例HPV高危型感染者中单一及多重型别感染率分别占75.88%及24.12%。在单一及多重型别感染者中,最常检出的型别均为16型,其次为58型、52型、53型。单一与多重型别感染者中细胞学高级别异常及以上占比分别7.81%及8.24%,两者无统计学差异(χ2=0.343,P=0.574),Logistic回归分析发现HPV16、31、33型别感染与细胞学高级别及以上异常具有相关性[OR分别为3.700(95%CI:3.048~4.492)、2.038(95%CI:1.568~2.647)、1.563(95%CI:1.110~2.201)]。单一与多重型别感染者中CIN2+检出率分别为22.29%及23.04%,CIN3+检出率分别为11.72%及8.73%,两组感染者CIN2+检出无统计学差异(χ2=0.226,P=0.653),CIN3+检出有统计学差异(χ2=0.622,P=0.011),在HPV16、HPV16/18单一与多重型别感染者CIN2+检出均无统计学差异(χ2值分别为2.215、2.680,均P>0.05),CIN3+检出均有统计学差异(χ2值分别为0.622、11.112,均P<0.05),在非HPV16/18型单一及多重型别感染者CIN2+、CIN3+检出均无统计学差异(χ2值分别为2.747、0.199,均P>0.05)。Logistic回归分析发现HPV 16型、单一型感染、细胞学异常及高级别异常与子宫颈病变CIN2+具有相关性[OR值分别为2.358(95%CI:1.934~2.874)、1.264(95%CI:1.020~1.566)、2.216(95%CI:1.779~2.761)、9.599(95%CI:7.728~112.575);HPV16、33型别感染、细胞学异常及高级别异常与CIN3+具有相关性[OR值分别为4.192(95%CI:3.102~5.665)、1.806(95%CI:1.183~2.757)、2.919(95%CI:1.360~2.708)、10.357(95%CI:7.545~14.215)。结论 HPV多重型感染虽可导致更多的细胞学异常,但尚未导致更多的高级别细胞学异常;HPV单一型别、HPV16型别、16/18型别感染者的CIN3+风险增高,临床上应重视对这一人群的管理。
人乳头状病毒;型别;细胞学;子宫颈上皮内瘤变;子宫颈肿瘤(癌)
目前的研究已经证实人乳头瘤病毒(human papilomavirus,HPV)高危型别的持续感染是导致子宫颈浸润癌的必要条件,对于HPV感染所致的细胞学或组织学病变风险评估多针对某一型别,管理策略也主要针对单一型别,如16、18型别感染[1-4],同时存在两个及以上HPV型别感染,其之间的作用是相互竞争抑或相互协同,目前研究尚不一致,感染者的风险与单一型别是否一致?管理策略是否与单一型别一致?为了更好更合理地管理HPV多重感染者,我们回顾性对2010年1月-2012年12月在门诊同时行子宫颈细胞学+HPV检测双项检测且HPV阳性妇女的资料进行总结,分析HPV单一与多重型别感染者的子宫颈癌前病变以及浸润癌的风险,探索其管理模式。
1资料与方法
1.1标本来源
收集2010年1月至2012年12月就诊于北京大学第一医院妇产科门诊同时行子宫颈细胞学及HPV分型检测且HPV高危亚型阳性的7192例妇女的临床资料,比较HPV单一型别与HPV多重型别感染者子宫颈高级别及以上病变的风险的差异。
1.2子宫颈细胞学
采用液基细胞学进行检测,结果按2014年的TBS诊断系统进行评判,分为: 正常范围(with no intraepithelial leision,WNL)、不典型鳞状细胞-不能明确意义(atypical squamous cells of undetermined signification,ASC-US)、不典型鳞状细胞-不能除外高度上皮内瘤变(atypical squamous cells cannot exclude HSIL,ASC-H)、低度鳞状上皮内瘤变(low-grade squamous intraepithelial leision,LSIL)、高度鳞状上皮内瘤变(high-grade squamous intraepithelial leision,HSIL)、鳞状细胞癌(squamous cell carcinoma,SCC);不典型腺细胞(atypical glandular cells,AGC)、子宫颈原位腺癌(adenocarcinoma in situ,AIS)、腺癌(adenocarcinoma,)。
1.3 HPV分型检测
采用凯普医用核酸分子快速杂交基因分型试剂盒进行病毒HPV21种亚型分型检测。其中高危型(high-risk types,HR-HPV)15种,包括HPV16、18、31、33、35、39、45、5l、52、53、56、58、59、66和68,低危型(1ow-risk types,LR-HPV)6种,包括HPV 6、11、42、43、44和CP8304。
1.4 阴道镜检查指征
HPV高危型阳性的ASC-US及以上者;细胞学WNL但HPV 16、18型感染者以及HPV持续感染(1年及以上连续2次HPV检测阳性)者。
1.5阴道镜检查
采用阴道镜检查的标准程序进行操作。在阴道镜下全面评估子宫颈转化区,对可疑部位行多点活检;对于阴道镜下未见异常者但存在癌前病变或浸润癌高风险者行子宫颈四象限随机活检+子宫颈管内膜活检(endocervical curettage,ECC),并分别送病理学检查,以病理学结果为评判金标准。
1.6 统计学方法
采用SPSS 19.0软件分析,组间差异采用卡方检验,用Logistic回归分析HPV单一型别以及多重型别感染与子宫颈癌前病变及浸润癌相关性,P<0.05有统计学意义。
2结果
2.1 HPV分型检测结果
7 192例HPV高危型别感染者中单一型别感染5 457例,占75.88%(5 457/7 192);双重及以上型别感染者1 735例,占24.12%(1 735/7 192),最多者同时被检出六种型别感染。
2.1.1 HPV单一型别的检出率
在5 457例单一型别感染者中,15种型别均有检出,检出率分别为:16型别25.95%(1 416/5 457)、18型别5.11%(279/5 457)、31型别4.75%(259/5 457)、33别型6.05%(330/5 457)、35型别1.03%(56/5 457)、39型别2.80%(153/5 457)、45型别0.68%(37/5 457)、51型别1.45%(79/5 457)、52型别14.51%(792/5 457)、53型别8.23%(449/5 457)、56型别3.28%(179/5 457)、58型别15.06%(822/5 457)、59型别2.13%(116/5 457)、66型别4.61%(252/5 457)、68型别4.38%(239/5 457)。
2.1.2 HPV多重型别感染各型别的检出率
在1 735例多重型别感染者中,2重型别感染1 328例,占76.54%(1 328/1 735),三重型别感染314例,占18.10%(314/1 735),四重型别感染77例,占4.44%(77/1 735),五重型别感染1例,占0.06%(1/1 735),六重型别感染5例,占0.29%(5/1 735)。
在1 735例HPV多重型别感染中,15种型别均有检出,检出率分别为:16型别38.96%(676/1 735)、18型别11.07%(192/1 735)、31型别11.30%(196/1 735)、33型别22.94%(398/1 735)、35型别2.54%(44/1 735)、39型别8.30%(144/1 735)、45型别2.88%(50/1 735)、51型别4.21%(73/1 735)、52型别31.07%(539/1 735)、53型别24.09%(418/1 735)、56型别6.80%(118/1 735)、58型别38.10%(661/1 735)、59型别6.57%(114/1 735)、66型别11.59%(201/1 735)、68型别9.63%(167/1 735)(多重型别感染各亚型分别计算),见表1。
表1 HPV单一及多重型别感染者中各型别的检出率比较[n(%)]
Table 1 Comparison of the detection rate of various types among patients with single and multiple HPV infections[n(%)]

型别单一型别多重型别总计161416(25.95)676(38.96)2092(29.06)18279(5.11)192(11.07)471(6.55)31259(4.75)196(11.30)455(6.33)33330(6.05)398(22.94)728(10.12)3556(1.03)44(2.54)100(1.39)39153(2.80)144(8.30)297(4.13)4537(0.68)50(2.88)87(1.21)5179(1.45)73(4.21)152(2.11)52792(14.51)539(31.07)1331(18.51)53449(8.23)418(24.09)867(12.06)56179(3.28)118(6.80)297(4.13)58822(15.06)661(38.10)1483(20.62)59116(2.13)114(6.57)230(3.20)66252(4.61)201(11.59)453(6.30)68238(4.38)167(9.63)406(5.65)总计5457(75.88)1735(24.12)7192(100.00)
2.2 HPV单一及多重型别感染者的年龄分布
在5 457例单一型别感染者中,年龄17~82岁,平均年龄40.62±10.90岁;在1 735例HPV多重型别感染中年龄17~79岁,平均年龄40.88±11.56岁。两组感染者的年龄分布差异经χ2检验无统计学差异(χ2=71.908,P=0.289)。
2.3 HPV单一及多重型别感染者子宫颈细胞学检查结果
2.3.1 HPV单一及多重型别感染者子宫颈细胞学异常的检查结果比较
在5 457例单一型别感染者中1643例(30.11%,1 643/5 457)为细胞学结果ASC-US及以上;在1735例HPV多重型别感染中783例(45.13%,783/1 735)为细胞学结果ASC-US及以上;单一型别及多重型别感染者子宫颈细胞学检查结果间经χ2检验两者有统计学差异(χ2=132.888,P=0.000),单一型别及两种、三种、甚至六种型别感染者的细胞学异常检出率的比较有统计学差异(χ2=146.925,P=0.000),见表2。
表2 HPV单一及多重型别感染者中细胞学异常的检出率的比较[n(%)]
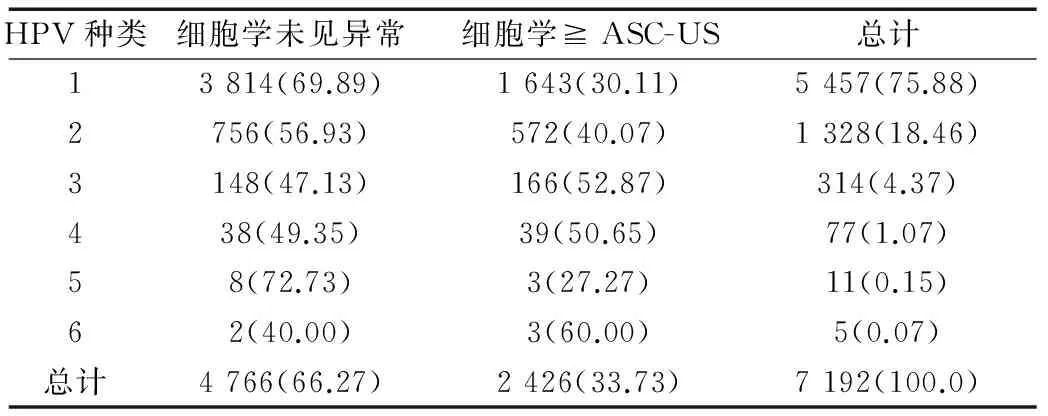
Table 2 Comparison of the detection rate of cytology abnormality among patients with single and multiple HPV infections [n(%)]
2.3.2 HPV单一及多重型别感染者子宫颈高级别细胞学异常的检查结果比较
在5 457例单一型别感染者中426(7.81%,426/5 457)为细胞学结果高级别异常(ASC-H、HSIL及以上、AGC及以上);在1 735例HPV多重型别感染中细胞学高级别异常143例(8.24%,143/1 735);两者经χ2检验两者无统计学差异(χ2=0.343,P=0.574),见表3。
表3 HPV单一及多重型别感染者中高级别细胞学异常的检出率的比较[n(%)]
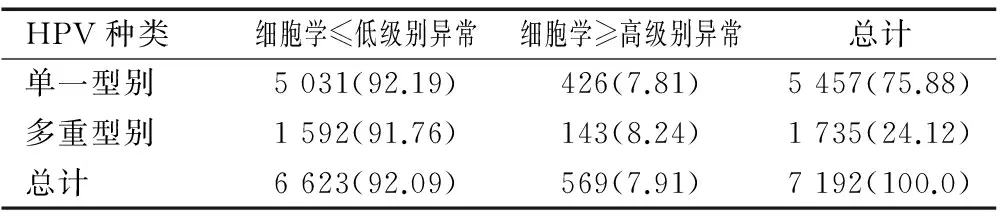
Table 3 Comparison of the detection rate of high-level cytology abnormality among patients with single and multiple HPV infections [n(%)]
2.3.3子宫颈高级别细胞学异常的相关影响因素
将患者年龄 、HPV单一/多重型别感染、高危型别按细胞学≤低级别异常以及≥高级别异常两种程度进行Logistic回归分析,发现HPV 16、31、33型别感染与细胞学≥高级别异常具有相关性,见表4.
表4 子宫颈细胞学高级别异常的相关影响因素

Table 4 Relevant influencing factors of high-level abnormality in cervical cytology
2.4 HPV单一及多重型别感染者子宫颈活检病理结果
2.4.1 HPV单一及多重型别感染者子宫颈活检病理结果的比较
在5 457例单一型别感染者中共有2 337例进行了阴道镜评估,检出CIN(cervical intraepithelial neoplasia)2级及以上(简称CIN2+)病例521例,占22.29%(521/2 337),检出CIN3级及以上病变(简称CIN3+)274例,占11.72%(274/2 337);在1735例HPV多重亚型别感染者中共有1 020例进行了阴道镜评估,检出CIN2+235例,占23.04%(235/1 020),检出CIN3+89例,占8.73%(89/1 020)。两组感染者CIN2+检出率无统计学差异(χ2=0.226,P=0.653),两组感染者CIN3+检出率有统计学差异(χ2=0.622,P=0.011),见表5。
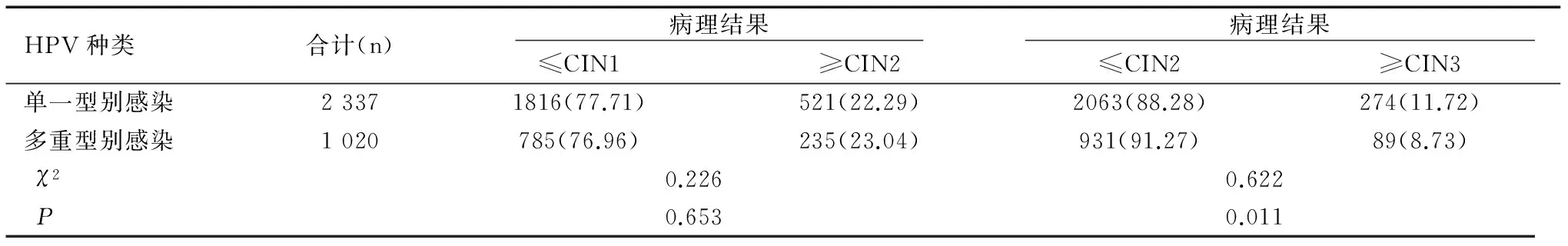
表5 HPV单一及多重型别感染者中病理异常检出率的比较[n(%)]
2.4.2 HPV16单一及多重型别感染者子宫颈活检病理结果的比较
在1 416例HPV16单一型别感染者中共有870例进行了阴道镜评估,检出CIN2+301例,占34.60%(301/870),检出CIN3+131例,占21.95%(191/870);在676例HPV16多重型别感染者中共有430例进行了阴道镜评估,检出CIN2+131例,占30.47%(131/430),检出CIN3+61例,占14.19%(61/430)。两组感染者CIN2+检出率无统计学差异(χ2=2.215,P=0.150),两组感染者CIN3+检出率有统计学差异(χ2=11.112,P=0.001),见表6。

表6 HPV16型单一及多重型别感染者中病理异常检出率的比较[n(%)]
2.4.3 HPV16/18单一及多重型别感染者子宫颈活检病理结果的比较
在1 695例HPV16/18单一型别感染者中共有1 016例进行了阴道镜评估,检出CIN2+323例,占31.79%(323/1 016),检出CIN3+205例,占20.18%(205/1 016);在868例HPV16/18多重型别感染者中共有509例进行了阴道镜评估,检出CIN2+141例,占27.70%(141/509),检出CIN3+64例,占12.57%(64/509)。两组感染者CIN2+检出率无统计学差异(χ2=2.680,P=0.111),两组感染者CIN3+检出率有统计学差异(χ2=13.495,P=0.000),见表7。
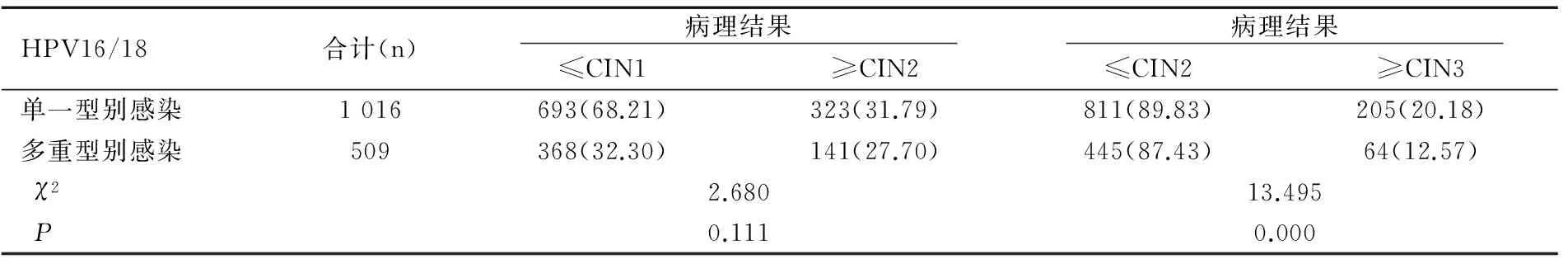
表7 HPV16/18单一及多重型别感染者中病理异常检出率的比较[n(%)]
2.4.4非HPV16/18单一及多重型别感染者子宫颈活检病理结果的比较
在4 629例非HPV16/18单一及多重型别感染者共有1 822例进行了阴道镜评估,其中在1 315例单一型别中检出CIN2+192例,占14.60%(192/1 315),检出CIN3+69例,占5.25%(69/1 315);在507例多重型别感染中检出CIN2+92例,占18.15%(92/507),检出CIN3+24例,占4.73%(24/507)。两组感染者CIN2+检出率无统计学差异(P=0.100),两组感染者CIN3+检出率无统计学差异(P=0.722),见表8。
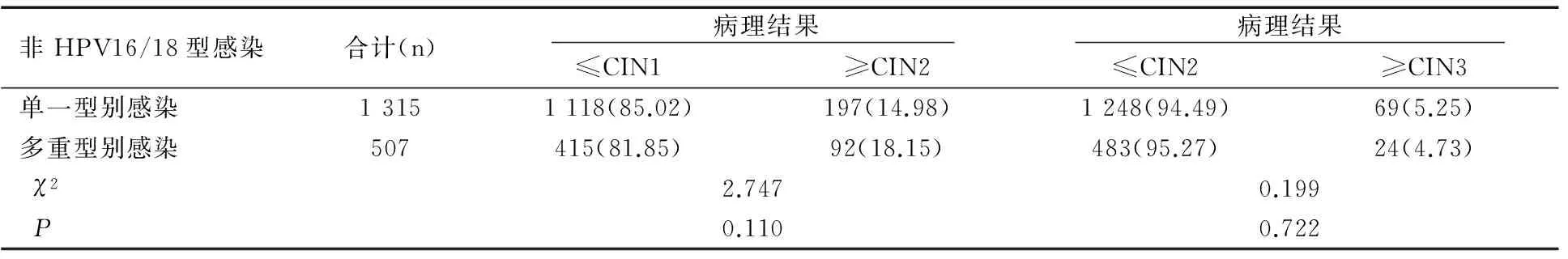
表8 非HPV16/18亚型单一及多重型别感染者中病理异常检出率的比较[n(%)]
2.4.5子宫颈病变CIN2+及CIN3+的相关影响因素
将患者年龄、细胞学≥ASC-US、细胞学≥LSIL、HPV单一/多重型别感染、高危型别按CIN2+及CIN3+两种病变程度进行Logistic回归分析,发现HPV 16型别感染、HPV单一/多重型别感染、细胞学异常(≥ASC-US)、细胞学高级别异常与子宫颈病变CIN2+具有相关性;HPV 16、33型别感染、细胞学异常(≥ASC-US)、细胞学高级别异常与CIN3+具有相关性,见表9。

表9 子宫颈病变CIN2+及CIN3+的相关影响因素
3讨论
3.1 HPV多重型别感染在人群中常见
在人群中HPV多重型别的共同感染非常常见,来自世界15个地区的荟萃分析发现人群HPV 多重亚型的感染率在 0.3%~11.8%不等[5],据不完全统计,在我国HPV感染的流行病学调查中,HPV多重型别感染在HPV感染者中的比例可达17.8%至65.1%[6-8]。在中国云南省,HPV单一型别的感染率为10.6%,多重型别的感染率为 2.3%,占比约为17.8%[6];中国山西省的资料显示单一型感染为77.48%,多重型感染占22.5%,其中两种型别的感染占72.22%[7];在新疆北部人群中HPV多重型感染的比例为65.1%[8]。
中国地域辽阔,不同省份以及同一省份的不同地区HPV的感染率以及单一、多重型别感染的比例也不相同。在云南省的西南部HPV高危型别的感染率18.1%,单一型别感染为16.70%,明显高于西北部(高危型别感染率13.90%,单一型别感染率11.30%、东南部(11.60%, 10.50%),东北部(9.60%,9.10% )以及中部 (10.50%,10.00% ),多重型别感染西北部(4.20%)明显高于西南部(1.30%,3.10%)、东南部(1.70%,2.70%),东北部(1.50%, 2.00%)以及中部 (2.40%,2.90%)[9]。
在我们研究的医院人群中,HPV多重型别感染的比例为24.1%,并以双重型别为主,占76.5%,与山西的资料相近[7]。
由此可见,HPV多重型别的感染非常常见,探讨其致病风险以及管理模式非常必要。
3.2 HPV多重型别感染的致病风险
在我们的研究中发现与HPV单一型别感染者相比,HPV多重型别感染增加了子宫颈细胞学异常的风险,但尚未发现增加了细胞学高级别异常风险。在Adler 等[10]、Chagas等[11]的研究中也发现HPV多重型别感染增加了两倍的细胞学异常可能性,如果同时存在HIV感染以及HPV多重型别的感染,则进一步增加了细胞学异常的风险,二者可能存在相互叠加的作用[10]。Dickson等[12]的研究发现在30岁以上妇女中,HPV多重型别感染尤其是HPV16型别的多重感染,其细胞学HSIL的风险最大,OR为2.98 (95%CI:1.57~5.64)。在我们的研究中也发现HPV多重型别感染增加了细胞学异常的可能性,但尚未增加细胞学高级别及以上几率。细胞学高级别及以上异常与HPV16、33、31型别感染存在相关性,OR分别为HPV16型别3.700(95%CI:3.048~4.492),HPV33 型别2.038(95%CI:1.568~2.467),HPV31型别1.563(95%CI:1.110~2.201)。
由此可见,虽然HPV多重型别感染增加了细胞学异常的风险,但尚未增加细胞学高级别及以上异常的风险;细胞学高级别及以上异常的风险与HPV16、33、31型别的感染具有相关性,所以,在对于HPV感染者的管理中,更应注重可导致细胞学高级别及以上异常的型别的管理。
HPV感染所致的子宫颈高级别及以上病变风险主要与HPV持续感染相关,有研究发现HPV持续感染与多重型别感染无关,主要与HPV16、18型别病毒载量相关,OR分别为1.279 (95%CI:1.074~1.524)、1.256 (95%CI:1.028~1.533)[13]。HPV多重感染型别间是否存在相互作用,如存在相互作用是相互协同抑或是相互竞争,目前的研究结论并不一致。
Wang等[14]的研究发现HPV多重型别感染与子宫颈病变的严重程度无必然联系,来自美国的HPV单一与多重型感染的队列研究发现,HPV多重型别感染非常常见,占38.2%,但HPV所致的高级别病变常见于单一型别感染者,在多重型别感染的患者中未观察到附加的或协同的作用[15]。
Poppe WA等研究认为无论HPV单一型感染还有多重型别的感染均可导致CIN2+病变。但在HPV多重型别感染的妇女中,多基因型别比单一型别感染可能诱导更有效的局部或体液免疫反应。Nie等[16]在以医院人群为基础的研究中发现,多重感染占 23.2%,其血中的中和抗体滴度明显高于单一型别感染者 (P<0.01)。
Schmitt 等[17]研究发现高病毒载量的HPV多重型别感染者存在细胞学异常以及CIN可能性为高病毒载量单一型别感染者的4~6倍。高病毒载量的多重型别感染增加了细胞学异常以及存在CIN病变的可能性,但无法用于区分低级别以及高级别病变。同时也发现随着子宫颈病变级别的增加,HPV多重型别的感染率呈下降趋势(CIN2中为44.2%,CIN3中为36.7%,子宫颈浸润癌中为35.3%),HPV多重型别感染在CIN2病变中更为常见[18]。Chaturvedi等[19]研究发现与单一型别感染相比,多重型别感染尤其是多重α9共同感染者的CIN2+病变风险明显增加(OR=2.2,95%CI:1.1~4.6)。
在我们的研究中发现HPV单一与多重型别感染者的CIN2+风险无增高,但HPV单一型别感染所致的CIN3+病变风险增加,在HPV16型别以及HPV16/18型别的感染者中均观察到CIN3+风险的增加;但在非HPV16/18型别感染者中,单一与多重型别感染者的CIN2+以及CIN3+风险均无增加。由此可见,HPV单一型别感染者、HPV16型别感染者、HPV16/18型别感染者的CIN3+风险增高,相反,HPV多重型别感染者、非16/18型别的单一及多重型别感染者的CIN3+风险均无增高,这一发现也从另一方面验证了HPV多重型别之间的相互作用虽然增加了致病风险,但由于激发了更强地免疫效应及中和抗体水平,导致CIN3及以上病变的减少,这对HPV多重型别感染者而言无疑是一正效应,应用于临床可更好地用于HPV感染者的管理。
总之,HPV多重型别感染在临床上非常常见,但其并未增加子宫颈细胞学以及组织学高级别及以上病变的风险,在临床管理上应更重视HPV的持续感染以及特异型别尤其是HPV16/18型别感染者的管理。
[1]Thomsen L T, Frederiksen K, Munk C,etal. Long-term risk of cervical intraepithelial neoplasia grade 3 or worse according to high-risk human papillomavirus genotype and semi-quantitative viral load among 33,288 women with normal cervical cytology[J].Int J Cancer, 2015,137(1):193-203.
[2]Guan P,Clifford G M,Franceschi S. Human papillomavirus types in glandular lesions of the cervix: a meta-analysis of published studies[J]. Int J Cancer,2013,132(1):248-250.
[3]Wheeler C M, Hunt W C, Cuzick J,etal.The influence of type-specific human papillomavirus infections on the detection of cervical precancer and cancer:a population-based study of opportunistic cervical screening in the United States[J]. Int J Cancer, 2014, 135(3):624-634.
[4]Joste N E, Ronnett B M, Hunt W C,etal. Human papillomavirus genotype-specific prevalence across the continuum of cervical neoplasia and cancer[J]. Cancer Epidemiol Biomarkers Prev,2015, 24(1): 230-240.
[5]Vaccarella S, Franceschi S, Snijders P J,etal.Concurrent infection with multiple human papillomavirus types: pooled analysis of the IARC HPV Prevalence Surveys[J].Cancer Epidemiol Biomarkers Prev,2010,19(2):503-510.
[6]Li Z,Liu F,Cheng S,etal.Prevalence of HPV infection among 28,457 Chinese women in Yunnan Province, southwest China[J]. Sci Rep,2016,6:21039.
[7]Li J,Wang Y Y,Nan Xetal.Prevalence of human papillomavirus genotypes among women with cervical lesions in the Shaanxi Province of China[J].Genet Mol Res,2016,15(1):7181.
[8]Wang L,Wang P,Ren Y,etal.Prevalence of high-risk human papillomavirus (HR-HPV) genotypes and multiple infections in cervical abnormalities from northern Xinjiang, China[J].PLoS One,2016,11(8):e0160698.
[9]Baloch Z, Li Y,Yuan T,etal.Epidemiologic characterization of human papillomavirus (HPV) infection in various regions of Yunnan Province of China[J].BMC Infect Dis,2016,16:228.
[10]Adler D H,Wallace M,Bennie T,etal.Cumulative impact of HIV and multiple concurrent human papillomavirus infections on the risk of cervical dysplasia[J].Adv Virol,2016,2016:7310894.
[11]Chagas B S, Comar M, Gurgel A P,etal.Association study between cervical lesions and single or multiple vaccine-target and non-vaccine target human papillomavirus (HPV) types in women from northeastern Brazil[J].PLoS One,2015,10(7):e0132570.
[12]Dickson E L,Vogel R I,Geller M A,etal.Cervical cytology and multiple type HPV infection: a study of 8182 women ages 31-65[J].Gynecol Oncol,2014,133(3):405-408.
[13]van der Weele P,van Logchem E,Wolffs P,etal.Correlation between viral load, multiplicity of infection, and persistence of HPV16 and HPV18 infection in a Dutch cohort of young women[J].J Clin Virol,2016,83:6-11.
[14]Wang L,Wang P,Ren Y,etal.Prevalence of high-risk human papillomavirus (HR-HPV) genotypes and multiple infections in cervical abnormalities from northern Xinjiang, China[J].PLoS One,2016,11(8):e0160698.
[15]Salazar K L,Zhou H S,Xu J,etal.Multiple human papilloma virus infections and their impact on the development of high-risk cervical lesions[J].Acta Cytol, 2015,59(5):391-398.
[16]Nie J,Liu J,Xie H,etal.Multiple human papillomavirus infections and type-competition in women from a clinic attendee population in China[J].J Med Virol,2016,88(11):1989-1998.
[17]Schmitt M, Depuydt C, Benoy I,etal.Multiple human papillomavirus infections with high viral loads are associated with cervical lesions but do not differentiate grades of cervical abnormalities[J].J Clin Microbiol,2013,51(5):1458-1464.
[18]Xiao M,Xu Q,Li H,etal.Prevalence of human papillomavirus genotypes among women with high-grade cervical lesions in Beijing, China[J].Medicine (Baltimore),2016,95(3):e2555.
[19]Chaturvedi A K,Katki H A,Hildesheim A,etal.Human papillomavirus infection with multiple types: pattern of coinfection and risk of cervical disease[J].J Infect Dis,2011,203(7):910-920.
[专业责任编辑: 张忠明]
Comparison of risk of cervical lesions in HPV single and multiple infections
BI Hui1, LIU Yan1,2, PEI Zhi-fei1,3
(1.DepartmentofGynecologyandObstetrics,PekingUniversityFirstHospital,Beijing100034,China2.DepartmentofGynecology,TheSecondHospitalofBeijingCity,Beijing100031,China;3.DepartmentofGynecology,MaternalandChildHealthCareHospitalofXichengDistrict,Beijing100029,China)
Objective To compare the risk of cervical lesions in patients with single and multiple types of human papilloma virus (HPV) infections and to explore the corresponding management model. Methods Clinical data of 7 192 women accepting cervical cytology and HPV detection with positive in high risk HPV in Peking University First Hospital during 2010-2012 were summarized retrospectively. The correlation between cervical precancerous lesions and invasive carcinoma in HPV high-risk single and multiple severe infections was analyzed. Results Among 7 192 HPV high-risk patients, the rates of single and multiple infections were 75.88% and 24.12%, respectively. Among the single and multiple types of infection, the type detected most frequently was type 16, followed by type 58, type 52 and type 53. Among the patients with single or multiple infections, the rate of high-level abnormalities and worse results in cytology was 7.81% and 8.24%, respectively. There was no statistical difference between two groups (χ2=0.343,P=0.574). Logistic regression analysis showed that type 16, type 31 and type 33 of HPV infection were associated with high-level abnormalities and worse results in cytology [ORvalue was 3.700 (95%CI: 3.048-4.492), 2.038 (95%CI: 1.568-2.647) and 1.563 (95%CI: 1.110-2.201). The detection rate of CIN2+ was 22.29% and 23.04%, respectively among the patients with single and multiple infections, while the detection rate of CIN3+ was 11.72% and 8.73% among them. There was no significant difference in CIN2+ detection between two groups (χ2=0.226,P=0.653), but statistical difference was showed in CIN3+ detection (χ2=0.622,P=0.011). In HPV16 and HPV16/18, there was no statistically significant difference in CIN2+ detection between patients with single and multiple infections (χ2value was 2.215 and 2.680, respectively, bothP>0.05), while statistical difference was showed in CIN3+ detection (χ2value was 0.622 and 11.112, respectively, bothP<0.05). There was no significant difference in CIN2 + and CIN3 + detection between single and multiple infected patients with non-type HPV16/18[1](χ2value was 2.747 and 0.199, respectively, bothP>0.05). Logistic regression analysis showed that HPV type 16, single infection, cytology abnormality and high-level cytology abnormality were correlated with CIN2+ [ORvalue was 2.358 (95%CI:1.934-2.874), 1.264 (95%CI:1.020-1.566), 2.216 (95%CI:1.779-2.761), 9.599 (95%CI:7.728 to 112.575), respectively]. Whereas HPV type 16 and type 33 infection, cytology abnormality and high-level cytology abnormality were associated with CIN3+ [ORvalue was 4.192 (95%CI:3.102-5.665), 1.806 (95%CI:1.183-2.757), 2.919 (95%CI:1.360-2.708), 10.357 (95%CI:7.545-14.215), respectively]. Conclusion Multiple infection of HPV might lead to more cytology abnormality but not led to more high-level cytology abnormality. Patients with single HPV infection, type 16 and type 16/18 HPV infection are at high risk of CIN3+, and the management on them should be paid more attention in clinics.
human papilloma virus (HPV); type; cytology; cervical intraepithelial neoplasia (CIN); cervical neoplasm (cancer)
2017-04-17
毕 蕙(1964-),女,主任医师,主要从事妇科良性疾病诊治、子宫颈癌前病变诊断及治疗研究。
10.3969/j.issn.1673-5293.2017.05.001
R711.7
A
1673-5293(2017)05-0487-05

