帕金森病抑郁患者双侧额叶的磁共振波谱改变及意义
曹冰清, 张 鑫, 何堪生, 康 蓓, 杨 谦, 王 涛
(陕西省人民医院, 1. 神经内二科; 2. 核磁共振室, 陕西 西安, 710068)
帕金森病抑郁患者双侧额叶的磁共振波谱改变及意义
曹冰清1, 张 鑫2, 何堪生1, 康 蓓1, 杨 谦1, 王 涛1
(陕西省人民医院, 1. 神经内二科; 2. 核磁共振室, 陕西 西安, 710068)
目的 研究帕金森病抑郁(DPD)患者额叶磁共振波谱(1H-MRS)的改变及其临床意义。方法 对20例DPD患者、23例PD患者和20名正常对照者的双侧额叶进行1H-MRS检测,分析3组双侧额叶的N-乙酰基天门冬氨酸(NAA)/肌酸复合物(Cr)和含胆碱化合物(Cho)/Cr值的变化。结果 DPD患者症状首发侧额叶的NAA/Cr值显著低于PD患者(P<0.05), Cho/Cr值显著高于PD患者(P<0.05)。DPD患者症状首发侧额叶的NAA/Cr和Cho/Cr值与PD患者比较无显著差异。结论1H-MRS可以检测到DPD患者额叶的代谢改变,有助于DPD的病因诊断及风险预测。
帕金森病; 帕金森病抑郁; 磁共振波谱; 额叶
帕金森病(PD)是中老年人常见的中枢神经系统变性疾病之一,主要特征为震颤、强直和运动减少,并且出现认知障碍的风险较正常中老年人明显增高,严重影响了患者的生活质量[1-3]。目前对PD的研究主要集中于黑质纹状体系统,但研究[4-6]证实PD常伴有大脑皮质功能的改变。抑郁是PD患者最常见的一种非运动性的神经精神症状,帕金森病合并抑郁定义为帕金森病抑郁(DPD), DPD不同于原发性抑郁,是PD患者功能障碍的一个重要原因,严重影响患者生存质量及社会功能[7-9]。磁共振波谱(MRS)是目前唯一无损伤性研究人体器官组织代谢生化改变及化合物定量分析的影像学检测方法,质子磁共振波谱(1H-MRS)是一种无损伤地进行活体脑组织代谢、生化研究及定量分析的方法[10-11]。本研究通过对43例PD患者双侧额叶及进行1H-MRS检测,探讨PD患者额叶1H-MRS的改变及其临床意义,报告如下。
1 资料与方法
1.1 一般资料
选取2015年1月—2016年11月年陕西省人民医院神经科门诊及住院PD患者43例,均符合英国Brain-Bank诊断标准。根据24项汉密尔顿抑郁量表(HAMD-24)评分将PD患者分为DPD组(HAMD-24≥8分)和PD组(HAMD-24<8分)。PD组23例,男10例,女13例,年龄55~75岁,平均(65.5±7.7)岁; 病程1~10年,平均(5.08±0.38)年; H-Y分期: Ⅰ级9例, Ⅱ级6例, Ⅲ级4例, Ⅳ级4例。DPD组20例,男9例,女11例,年龄58~79岁,平均(67.6±7.2)岁; 病程2~10年,平均(5.84±3.5)年; H-Y分级: Ⅰ级7例, Ⅱ级6例, Ⅲ级4例, Ⅳ级3例。43例患者均进行统一PD评定量表,运动检查(UPDRS Ⅲ)。Hoehn-Yahr(H-Y)分期、HAMD量表及MMSE评分。2组患者一般情况及疾病严重程度比较无显著差异。另选择既往无神经、精神疾病史并经临床及磁共振检查证实的中老年健康志愿者20例为对照组,男12例,女8例,年龄42~79岁,平均(62.0±9.5)岁。3组的性别、年龄和受教育程度差异无统计学意义(P>0.05), PD和DPD组的病程差异无统计学意义(P>0.05), 具有可比性。
1.2 方法
采用3T-Ingenia飞利浦磁共振成像系统,常规MRI检查,2组患者均用核磁共振进行检查,均行头颅MRI平扫,包括矢状位T1WI, 冠状位T2WI, 横轴位T1WI, T2WI 及DWI像。MRS应用点分辨选择波谱序列(PRESS)进行多体素采集。测量参数: TR/TE=1 500 ms/135 ms, 一次采集,采集时间为3 min 54 s。接受/发射增益调节、体素内匀场、水抑制扫描均由自动预扫描程序完成,达到半高宽带(FW HM)<13 Hz, 水抑制99%的水平。
额叶兴趣区定位:通过T2WI轴位定位于半卵园中心所在层面,于双侧额叶皮质的对称部位放置兴趣区(ROI), 大小为1 cm×1 cm×1 cm。数据处理和图形分析于Extended MR WorkSpace图形工作站完成。在所获得的二维波形图中,N-乙酰天门冬氨酸(NAA)、胆碱(Cho)、肌酸(Cr)3个主峰,分别位于2.0、3.2、3.0 mg/m3处,其峰下面积为ROI内该物质的相对浓度。由工作站计算机自动给出各ROI的NAA/Cr, Cho/Cr比值。
1.3 统计学分析
应用统计软件SPSS 17.0 进行分析,数据采用均数±标准差表示,两组比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
3组受试者额叶1H-MRS结果显示,症状首发患肢对侧额叶NAA/Cr比值为PD组与DPD组均显著低于对照组(P<0.05), DPD组显著低于PD组(P<0.05); 患肢同侧额叶NAA/Cr比值为3组差异无统计学意义(P>0.05); 双侧额叶的Cho/Cr比值为3组差异无统计学意义(P>0.05)。见表1。
3 讨 论
PD合并抑郁是PD患者最常见的一种非运动性的神经精神症状,严重影响患者生活质量及社会功能。文献[12]报道DPD患者的神经生化递质异常,与多巴胺能解剖区域有关,包括前额叶、眶额叶及纹状体。还有研究[13-14]发现高达40%的PD患者在运动症状发生之前就出现了抑郁,表现为情感淡漠、精神运动迟缓、记忆障碍、悲观、激惹以及无自杀行为的自杀观念。
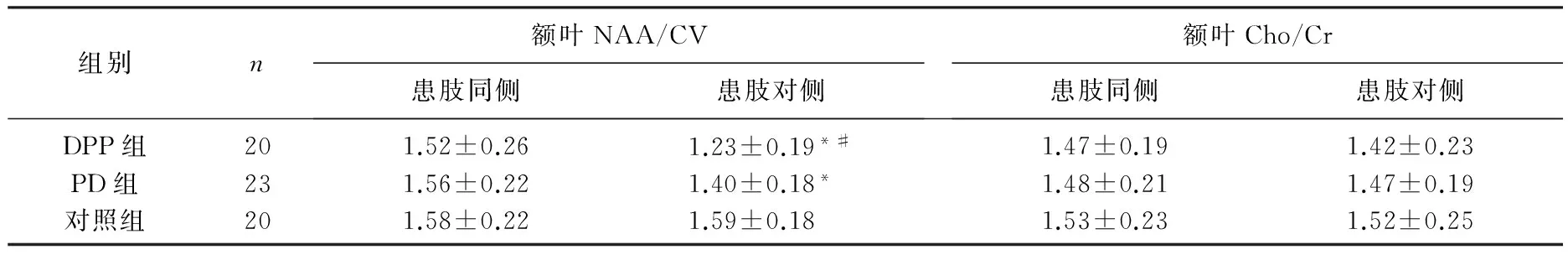
表1 3组受试者额叶的结果
与对照组比较, *P<0.05; 与PD组比较, #P<0.05。
近年来, MRS已广泛运用于活体组织代谢与功能测定,其原理是通过对某组织的目标区域施加经过特殊设计的射频脉冲后采集该区域的MR信号,由于化学移位效应,目标区域多种代谢产物中的原子核运动频率有差异,通过傅立叶转换可得到不同物质的波谱信息,从而可以检测活体组织中的特定代谢物的相对浓度,用以分析组织代谢的变化。NAA是哺乳动物神经系统中普遍存在的化合物之一, NAA在脑组织内几乎全部位于神经元内,是目前公认的反映神经元功能的内标物[15], 其浓度降低反映了神经元或轴突的破坏和缺失以及功能的异常。Cho是细胞膜磷酯代谢的一个组成成分,参与细胞膜的构成并反映膜的更新,其浓度的改变反映细胞膜合成和降解的变化, Cho在星形胶质细胞和少突胶质细胞内含量明显高于神经元内。Cho含量增加提示有神经胶质细胞增生[16]。而检测到的磷酸肌酸(Cr)为能量代谢产物,在各种病理状态下其浓度保持相对稳定,通常作为1H-MRS研究的内参物。目前,通过1H-MRS测定颅内特定部位的NAA/Cr、Cho/Cr比值变化也越来越多地运用于帕金森病的临床诊断、鉴别诊断和病理生理研究中。
本课题组前期进行了多项有关PD患者抑郁、睡眠障碍、认知功能等非运动性症状的影像系列临床研究,发现PD患者双侧额叶及纹状体均有不同程度的萎缩,且胆碱代谢及N-乙酰天门冬氨酸、肌酸存在异常改变[17]。既往研究[18-19]也提示PD患者抑郁症状的产生与脑神经递质改变、额叶及纹状体等解剖结构损伤有关,尤其额叶与运动的发起和调节、情绪的改变、精神活动密切相关,并且对不同程度的PD患者的单侧额叶进行MRS检查,发现中晚期PD患者额叶的NAA/Cr和Cho/Cr明显异常[20]。本研究结果显示, DPD患者症状首发对侧额叶的NAA/Cr值显著低于PD患者(P<0.05), PD组与DPD组均低于对照组(P<0.05), Cho/Cr值显著高于PD患者(P<0.05)。而DPD患者的症状首发侧额叶侧的NAA/Cr和Cho/Cr值与PD患者比较差异无统计学意义。上述结果中, NAA/Cr值显著下降提示PD患者的额叶存在神经元或轴突的破坏和缺失, Cho/Cr增高提示额叶病灶有神经胶质细胞增生,间接反映额叶受损,导致神经递质及代谢产物的改变。
本研究并没有发现3组的Cho/Cr比值差异有统计学意义,分析可能与脑内Cho代谢较快,1H-MRS测量Cho准确性较低,且Cho含量会随时间变化有关,另一方面也提示PD与DPD患者的额叶胶质增生现象并不明显。本研究也发现与前期研究存在不统一的现象,分析可能是由多种因素造成: ① 核磁共振仪器:硬件及技术参数等不同的设备、序列、方法可能导致数据截然不同; ② 前期采样方法是单体素采样,后期改良为多体素法采样,多体素法采样谱线质量较前者稳定,同时可以定义更多感兴趣区,更准确全面地反映代谢物的变化; ③ 取样部位不同造成差异性大,或者同一感兴趣区,不同技术员操作也容易形成误差,因此需统一操作规范; ④ 入组样本量较少,且MRS的改变与运动受损程度有关,也与抑郁症状分级有关。
综上所述, MRS 的异常有可能作为从代谢角度预测DPD患者脑内损伤的重要指标,本课题组将进一步扩大样本量、增加MRS感兴趣区及加用抗抑郁药等进一步论证本研究结果,为临床诊治提供新的依据及理论基础。
[1] 陈蓓, 刘剑立, 王耀山, 等. 震颤麻痹与智能障碍 (附26例分析)[J]. 中国神经精神疾病杂志, 1990, 3: 024-025.
[2] Aarsland D, Zaccai J, Brayyne C. Asystematic review of prevalence studies of dementia in Parkinson′s disease[J]. Mov Disord, 2005, 20(10): 1255-1263.
[3] Fossati P, Amar G, Raoux N, et al. Executive functioning and verbal memory in young patients with unipolar depression and schizophrenia[J]. Psychiarry Res, 1999, 89(3): 171-187.
[4] 金燕, 郑健. 帕金森病合并抑郁的临床研究进展[J]. 临床神经病学杂志, 2005, 18: 233-238.
[5] Sabatini U, Boulanouar K, Fabre N, et al. Cortical motor reorganization in akinetic patients with Parkinson′s disease: a functional MRI study[J]. Brain, 2000, 123: 394-397.
[6] Hu M T, Taylor-Robin S D, Chaudhuri K R, et al. Cortical dysfunction in non. demented Parkinson′s disease, patients: a combined31p-MRS and18FDG-PET study[J]. Brain, 2000, 123: 340-345.
[7] Storch A, Ebersbach G, Fuchs G, et al. Depression in Parkinson′s disease. Partl: epidemiology, signs and symptoms, pathophysiology and diagnosis[J]. Fortschr Neurol Psychiatr, 2008, 76(12): 715-724.
[8] Latoo J, Mistry M, Dunne F J. Depression in Parkinson′s disease: diagnosis and management[J]. Br J Hosp Med(Lond), 2012, 73(6): 331-334.
[9] Reijnders J S, Ehrt U, Weber W E, et al. A systematic review of prevalence studies of depression in Parkinson′s disease[J]. Mov Disord, 2008, 23(2): 183-189.
[10] Gujar S K, Maheshwari S, Bjorkman-Burtscher L, et al. Magneticm, wmance spectroscopy[J]. J Neu Hxphthalmol, 2005, 25: 217-221.
[11] 王大力, 刘吴, 下坚, 等. 质子磁共振波谱对帕金森病的诊断价值[J]. 临床神经病学杂志, 2002, 15: 213-214.
[12] Culang-Reinlieb M E, Johnert L C, Brickman A M, et al. MRI-defined vascular depression: a review of the construct[J]. Int J Geriatr Psychiatry, 2010, 26(11): 1101-1108.
[13] Fang P, Zeng L L, Shen H, et al. Increased Cortical-limbic anatomical network connectivity in major depression revealed by diffusion tensor imaging. increased anatomical connectivity in depression[J]. PLos One, 2012, 7(9): e45972.
[14] Takeda M, Tanaka T, Kudo T. Elderly depression and diffusion tensor imaging[J]. Psychogeriatrics, 2011, 11(1): 1-5.
[15] Massana G, GastóC, JunquéC, et al. Reduced Levels of Creatine in the Right Medial Temporal Lobe Region of Panic Disorder Patients Detected with 1 H Magnetic Resonance Spectroscopy[J]. Neuroimage, 2002, 16(3): 836-842.
[16] Galbán C J, Spencer RGS. Optimized pulse parameters for reducing quantitation errors due to saturation factor changes in magnetic resonance spectroscopy[J]. Journal of Magnetic Resonance, 2002, 156(2): 161-170.
[17] 邱恒峰, 潘小平, 郑浩, 等. 帕金森病抑郁的磁共振波谱初探[J]. 中华神经科杂志, 2012, 45(9): 480-482.
[18] Zheng X N, Zhu X C, Ruan L X, et al. MRS study on lentiform nucleus in idiopathic Parkinson′ s disease with unilateral symptoms [J]. J Zhejiang Univ Sci, 2004, 5(2): 246-250.
[19] 黄海东, 顾建文, 杨春敏, 等. 正常人额叶质子磁共振波谱研究[J]. 实用医学杂志, 2008, 24(10): 1718-1720.
[20] 黄海东, 杨春敏, 顾建文, 等. 帕金森病患者额叶磁共振波谱的改变及其临床意义[J]. 临床神经病学杂志, 2008 (5): 73-74.
Change and significance of bilateral frontal magnetic resonance spectroscopy in patients with Parkinson′s disease and depression
CAO Bingqing1, ZHANG Xin2, HE Kansheng1, KANG Bei1, YANG Qian1, WANG Tao1
(1. The Second Department of Neurology; 2. MRI Room, Shaanxi Provincial People′s Hospital, Xi′an, Shaanxi, 710068)
Objective To study the change and significance of bilateral frontal magnetic resonance spectroscopy (1H-MRS) in patients with Parkinson′s disease depression (DPD). Methods1H-MRS for bilateral frontal lobe was performed in 20 patients with DPD, 23 patients with PD and 20 healthy controls. The metabolite ratios of N-acetylaspartate (NAA)/Creatine(Cr) and Choline (Cho)/Cr in patients with PD and DPD and control group were compared. Results The NAA/Cr values of the first frontal lobe of patients with DPD were significantly lower than those of PD patients (P<0.05), while Cho/Cr values were significantly higher than those of PD patients (P<0.05). There were no significant differences of NAA/Cr and Cho/Cr values between DPD and PD patients. Conclusion1H-MRS can detect the metabolic changes of frontal lobe in patients with DPD, and it can contribute to the diagnosis and risk prediction of DPD.
Parkinson′s disease; Parkinson′s disease depression; magnetic resonance spectroscopy; frontal
2017-02-09
陕西省科学技术研究发展计划项目(2014K11-03-02-07)
王涛
R 749
A
1672-2353(2017)11-021-04
10.7619/jcmp.201711007

