不同超声辐照时间空化作用对降低兔肝血流灌注效应影响的实验研究
皋月娟 董小小 王 菲 向 娟 刘 娅 陈晓琴 刘 政 高文宏
·实验研究·
不同超声辐照时间空化作用对降低兔肝血流灌注效应影响的实验研究
皋月娟 董小小 王 菲 向 娟 刘 娅 陈晓琴 刘 政 高文宏
目的 探讨不同声空化辐照激励时间高声压超声空化作用对兔肝血流灌注降低的影响作用。方法选取健康新西兰大白兔27只,依据不同声空化辐照时间将其随机分为1 min空化组(T1组)、5 min空化组(T5组)及10 min空化组(T10组),每组各9只。所有动物均采用高峰值负压(P=2.0 MPa)超声脉冲联合经静脉脂质微泡注射进行肝脏超声空化辐照处理。于超声辐照前、辐照后即刻、辐照后30 min、辐照后60 min及辐照后24 h对各组均进行肝脏超声造影,比较辐照区域造影曲线下面积(AUC)及达峰时间(Tp)。辐照后24 h造影结束切取辐照区域肝脏组织,观察其病理改变情况。结果T1、T5及T10组正常兔肝脏在高声压超声空化辐照后均出现血流灌注量下降和达峰时间延长,AUC分别由(4868.24±1098.47)%s、(4395.27±1784.42)%s、(5522.43±1444.29)%s降低至(1642.71±914.15)%s、(1825.51±874.96)%s、(1097.38±370.24)%s,Tp由(21.62±7.07)s、(22.67±5.21)s、(24.17±5.50)s增加至(42.23±19.12)s、(50.04±11.33)s、(51.98± 12.06)s。随着时间延长各组AUC逐渐回升,Tp逐渐回落。重复测量结果显示,各造影参数组间效应及交互效应差异均无统计学意义(P组间=0.171、0.432、0.724,P时间*组间=0.905、0.472、0.230);组内效应差异均有统计学意义(均P<0.01),其中T1组辐照后即刻及辐照后30 min AUC与辐照前比较差异均有统计学意义(均P<0.05),T5组仅辐照后即刻AUC与辐照前比较差异有统计学意义(均P<0.05),而T10组辐照后所有时间点AUC与辐照前比较差异均有统计学意义(P<0.05);T1组辐照后即刻及辐照后60 min Tp与辐照前比较差异有统计学意义(P<0.05),T5组辐照后即刻、60 min、24 h Tp与辐照前比较差异均有统计学意义(均P<0.05),而T10组辐照后所有时间点Tp与辐照前比较差异均有统计学意义(均P<0.05)。病理结果显示,三组肝脏组织均出现不同程度的肝脏细胞变性坏死,T10组目测坏死范围大于T5组及T1组。结论高声压超声空化作用可显著降低正常兔肝组织血流灌注量及灌注速率,但不同声空化辐照时间对其影响作用无显著差异。随着声空化时间的延长,组织血流灌注恢复减缓。
超声空化;微泡;肝脏;止血;兔
肝脏损伤是仅次于脾脏损伤的第二常见腹腔实质性脏器损伤,严重的肝脏损伤患者死亡率可达4.0%~11.7%[1-2]。由于肝脏质脆易碎且血管丰富,肝损伤后大出血引起的失血性休克成为其主要危险因素。有效控制损伤部位的出血不仅可以减轻患者失血症状,还可降低严重损伤患者手术治疗的难度,为医师和患者提供更好的治疗条件。Zhao等[3]研究发现,在高声压低平均声强超声脉冲辐照的同时辅以血池内脂质微泡灌注,其剧烈瞬态空化效应的产生可引起肝细胞急性水肿,继发的肝窦闭塞可显著降低甚至暂时性阻断肝脏局部的血流灌注,使出血量及出血速率显著下降。本实验在此基础上,同样采用高声压低声强超声脉冲进行不同时间的声空化辐照,旨在评价不同声空化辐照时间对兔肝血流灌注及组织损伤的影响,为声空化作用的相关影响因素提供更全面的证据,为其临床应用奠定基础。
材料与方法
一、实验动物及分组
健康新西兰大白兔27只,雌性不限,体质量2~3kg,采用随机数字表法分为3组:T1组、T5组、T10组,各组声空化辐照时间分别为1min、5min、10min,余声空化参数相同。
二、仪器与试剂
1.仪器:使用西门子S 2000彩色多普勒超声诊断仪,线阵探头,频率为7~9 MHz;配有次谐波低机械指数超声造影模式及时间-强度曲线定量分析软件,用于肝脏超声造影灌注的动态成像及造影相关参数的定量分析。使用深圳市威尔德医疗电子有限责任公司生产的脉冲式超声空化治疗仪,为定制型脉冲式超声发射仪器,由主机及治疗探头组成,工作波形、超声发射频率、峰值声压、脉冲重复频率、有效脉冲宽度、工作/间歇时间及治疗时间等参数可调节,用于激励脂质微泡产生空化效应。
2.试剂:“脂氟显”脂质包膜微泡,由第三军医大学新桥医院超声科自行研制。核心气体为全氟丙烷,包膜成分由1,2-棕榈酰磷脂酰甘油(DPPG)和二硬脂酰基磷脂酰乙醇胺(DSPE)经冻干法制成;微泡浓度约4~9×109/ml,平均粒径2 μm,作为次谐波低机械指数成像的超声造影剂及超声空化效应的空化核,经静脉注入血液循环。
三、实验方法
1.辐照前准备:健康新西兰大白兔,称重后以复合麻醉方法麻醉。肌注盐酸塞拉嗪注射液(陆眠宁Ⅱ,吉林省华牧动物保健品有限公司)0.3 ml/kg;待动物肌肉松弛后,经耳缘静脉注入2%戊巴比妥钠(Sigma,P3761)溶液约0.4 ml/kg;待动物角膜反射基本消失后,仰卧位固定于动物手术台。腹部备皮,上至胸骨柄水平,下至剑突下10 cm处,两侧至腋前线处。局部皮肤以医用碘伏溶液消毒,铺一次性无菌手术巾。于剑突下沿腹中线逐层切开皮肤及腹壁肌肉约4 cm。将肝叶由腹壁切口轻轻拖出,置于腹壁上。
2.超声造影及超声空化辐照:选取肝叶长轴切面采集二维影像,随后固定探头,经静脉团注“脂氟显”脂质微泡造影剂0.1 ml/kg,同时于次谐波低机械指数造影成像模式下录取造影动态影像90 s。造影结束后,将空化治疗仪治疗头置于肝叶表面,保证充分耦合,按照设定参数及分组分别辐照肝脏1 min、5 min或10 min。脉冲超声参数设置为:工作波形采用正弦波,探头频率为1.07MHz,脉冲重复频率100 Hz,有效脉冲宽度50 μs,峰值负压2000 kPa,采用“工作6 s-间歇6 s”模式进行辐照。治疗头辐照同时经静脉缓慢推注稀释的脂质微泡0.2 ml/kg(微泡以无菌生理盐水稀释至3 ml)。辐照后即刻采用同样方法再次进行超声造影并录取动态影像。以辐照结束时间点为零点,于30 min及60 min时分别行超声造影记录肝叶同一部位造影影像。等待间期以湿润的无菌纱布块覆盖于肝叶表面。60 min造影结束后,将肝叶轻缓置入腹腔,逐层缝合腹壁肌肉及皮肤,腹腔内及切口处局部以40万单位青霉素钠溶液(华北制药股份有限公司)冲淋,同时肌注40万单位青霉素,待动物苏醒后继续饲养。24 h后以同前方法麻醉动物并沿原腹部切口剪断缝合线,拖出肝叶。再次于原部位行超声造影检查。
3.造影图像分析:使用仪器自带的造影分析软件分析各组动物于各造影时间点的时间-强度曲线。勾选辐照区域为感兴趣区,仪器自动生成时间-强度曲线,采用Gamma变量拟合方式生成拟合曲线,获得曲线下面积(AUC)及达峰时间(Tp),见图1。AUC为动态造影各时间点造影强度对造影时间的积分值,反映整个造影时间段内的累积灌注强度;因该仪器自带算法所得造影强度单位为%,故以时间积分后AUC单位为%s;Tp为造影剂进入到达峰时刻所经历时间,单位为s。
图1 超声造影软件图像分析界面
4.病理检查:辐照后24 h造影结束后,切取辐照区域肝脏组织,固定于4%多聚甲醛溶液及2%戊二醛溶液中,常规制备HE染色石蜡切片及电镜组织切片,观察组织病理改变情况。
四、统计学处理
结果
一、各组超声造影表现

图2 各组不同时间点超声造影图
各组二维超声造影图像见图2。空化辐照前,微泡造影剂推注后各组肝脏血流灌注呈现典型“快进慢出”表现,在动脉相肝脏实质快速均匀增强(图2A、F、K),约15~25 s时造影强度达到峰值,随后缓慢减弱。空化辐照后即刻,各组辐照区域均出现不同程度血流灌注受阻现象(图2B、G、L),表现为造影剂灌注缓慢及充盈缺损;辐照区域肝脏典型“快进”现象消失,代之以与呼吸相关的缓慢推进式灌注,无明显达峰现象,至90 s仍可见辐照区域大血管分支内缓慢血流灌注;肝实质内可见大范围、不规则充盈缺损区。至空化辐照后30 min,各组辐照区域仍表现为造影剂灌注缓慢及充盈缺损,但灌注速度较辐照后即刻明显增快,充盈缺损区范围较前减小(图2C、H、M)。空化辐照后60 min,各组超声造影可见辐照区域肝实质不均匀增强,造影剂灌注速度仍较缓慢,辐照区域未见大范围充盈缺损,但其增强不均质,可见肝实质内小片状充盈缺损区域(图2D、I、N)。24 h后再次行超声造影,可见各组肝脏基本恢复正常血流灌注速度,但辐照区域峰值造影强度较周边未辐照区域降低,部分仍可见肝实质内散在分布小片状充盈缺损区域(图2E、J、O)。
二、各组超声造影定量比较
各组超声造影定量参数AUC及Tp见表1。随时间延长各组AUC逐渐回升,Tp逐渐回落。重复测量结果显示,各造影参数组间效应及交互效应差异均无统计学意义(P组间=0.171、0.432、0.724,P时间*组间=0.905、0.472、0.230);组内效应差异均有统计学意义(均P<0.01),其中:①T1、T5、T10组AUC较辐照前分别下降了约66.3%、58.5%、80.1%。各组辐照后30 min、60 min、24 h AUC均较辐照后即刻升高,T1组分别为辐照前的77.0%、88.7%及97.3%,T5组分别为辐照前的77.6%、89.7%及88.7%,T10组分别为辐照前的63.1%、71.0%及56.9%。T1组辐照后即刻及辐照后30 min AUC与辐照前比较差异均有统计学意义(均P<0.05),T5组仅辐照后即刻与辐照前比较差异有统计学意义(P<0.05),而T10组辐照后所有时间点与辐照前比较差异均有统计学意义(均P<0.05)。②空化辐照后即刻T1、T5、T10组Tp分别延长至辐照前的2.12倍、2.27倍及2倍。至辐照后30 min、60 min及24 h,各组Tp均较辐照后即刻有所降低,但较辐照前仍高,与辐照前比较分别为:T1组1.43倍、1.56倍、0.98倍,T5组1.36倍、1.85倍、1.36倍,T10组1.68倍、1.64倍、1.42倍。T1组辐照后即刻及辐照后60 min Tp与辐照前比较差异均有统计学意义(均P<0.05),T5组辐照后即刻、60 min、24 h与辐照前比较差异均有统计学意义(均P<0.05),而T10组辐照后所有时间点与辐照前比较差异均有统计学意义(均P<0.05)。
三、病理检查结果
辐照后24 h各组肝脏组织均出现局部肝细胞不可逆性病理损伤,包括散在片状肝细胞气球样变(图3A)及嗜酸性坏死(图3B、C),坏死部位可见白细胞浸润。电镜检测结果同样显示肝细胞早期坏死性改变,细胞及胞核轮廓尚存,但正常细胞器结构均消失,胞浆呈无结构疏松片状均质,坏死区域可见较多白细胞浸润(图3D~F)。各组坏死区域病理改变情况相同,但T10组目测坏死区域较T5及T1组大。
表1 各组不同时间点AUC及Tp比较(±s)
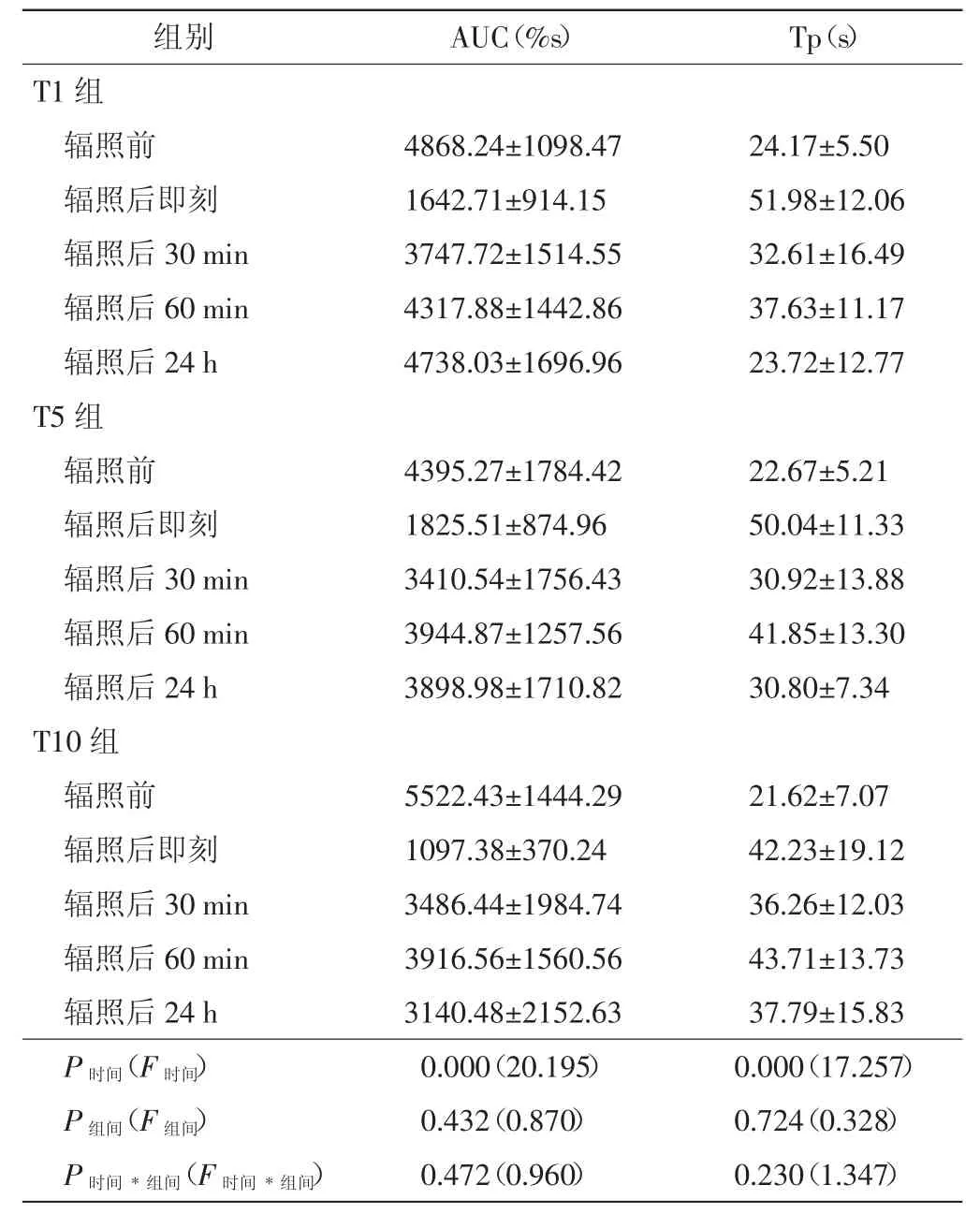
表1 各组不同时间点AUC及Tp比较(±s)
AUC:曲线下面积;Tp:达峰时间。
组别 AUC(%s) Tp(s)T1组辐照前 4868.24±1098.47 24.17±5.50辐照后即刻 1642.71±914.15 51.98±12.06辐照后30 min 3747.72±1514.55 32.61±16.49辐照后60 min 4317.88±1442.86 37.63±11.17辐照后24 h 4738.03±1696.96 23.72±12.77 T5组辐照前 4395.27±1784.42 22.67±5.21辐照后即刻 1825.51±874.96 50.04±11.33辐照后30 min 3410.54±1756.43 30.92±13.88辐照后60 min 3944.87±1257.56 41.85±13.30辐照后24 h 3898.98±1710.82 30.80±7.34 T10组辐照前 5522.43±1444.29 21.62±7.07辐照后即刻 1097.38±370.24 42.23±19.12辐照后30 min 3486.44±1984.74 36.26±12.03辐照后60 min 3916.56±1560.56 43.71±13.73辐照后24 h 3140.48±2152.63 37.79±15.83 P时间(F时间) 0.000(20.195) 0.000(17.257)P组间(F组间) 0.432(0.870) 0.724(0.328)P时间*组间(F时间*组间) 0.472(0.960) 0.230(1.347)
讨论

图3 辐照后24 h各组肝脏组织病理图(HE染色,×100)及电镜图(D示,×15 000;E、F示,×5000)
超声辐照对活体组织生物学行为具有影响作用的观点早已被业界公认。在诊断超声成像领域,为了避免潜在副作用的产生,监管部门严格规定超声辐照能量必须限制在安全阈值之内[4-5]。而在治疗超声领域,超声生物学效应潜在的治疗用途则逐渐引起部分学者[6-7]的重视。随着超声造影技术在临床应用的逐步推广,超声造影剂微泡的应用亦日渐广泛。其结构特性使其不仅可作为声散射微粒用于血池造影成像,同时可作为外源引入的微气腔大大降低空化效应的阈值,使得同样超声辐照条件下血管内较血管外产生更强烈的空化效应,从而引起血管损伤[8]。超声空化引起的血管损伤效应强弱与辐照能量密切相关,随着超声辐照能量的增强可引起不同类型的血管效应,包括血管通透性的增加,轻度血管损伤,甚至血管的损伤性闭塞[9-10]。Liu等[11]和Li等[12]采用峰值负压2.6 MPa的超声辐照联合静脉脂质微泡注射,有效破坏了大鼠及兔的肿瘤微血管,引起肿瘤温度及造影灌注强度的降低。在此基础上采用峰值负压4.3 MPa的超声联合血池内微泡注射辐照兔肝脏后,实现了其血流的暂时性阻断,并进一步增强了肝脏酒精消融的体积[13]。Zhao等[3]采用的辐照超声峰值负压虽然远较诊断超声高,但由于所使用的脉冲超声占空比极低(<1%),时间平均空间声强远低于高强度聚焦超声,故其热效应不显著,血流阻断效应主要依靠超声激励的微泡空化效应所产生。其研究证实,高声压低声强超声辐照联合血管内脂质微泡注射的血流阻断效应效果确切,在对肝脏进行辐照时可引起辐照区域肝细胞急性水肿及继发性肝窦闭塞,该效应用于肝脏的急性止血效果佳。但是,上述研究对超声空化肝脏损伤效应的持续时间及参数影响作用未进行深入研究探讨。肝脏作为人体的“化学工厂”,承担解毒及物质合成等重要任务,如何在实现有效止血效应的前提下尽可能降低损伤效应,对于肝损伤后功能的恢复具有重要意义。
本实验超声造影观察及定量分析结果显示,在血管内脂质微泡存在的条件下,高峰值声压(2 MPa)脉冲超声辐照兔正常肝脏后即刻,辐照区域AUC显著下降,下降率可达58.5%~80.1%,同时Tp显著延长,可达辐照前2倍;至辐照后30 min、60 min及24 h,AUC呈现逐渐回升趋势,Tp则逐渐回落,提示空化辐照后辐照区域组织血流灌注量下降、血流速度减缓,且该效应随时间延长逐渐恢复。两因素重复测量方差分析结果证实,各组内不同时间点AUC及Tp比较差异均有统计学意义(均P<0.05),且辐照后即刻肝脏AUC均显著低于辐照前,Tp均显著高于辐照前,差异均有统计学意义(均P<0.05)。本实验结果再一次证实高声压脉冲超声激励微泡产生的空化效应可引起肝脏血流灌注量的有效下降及血流速度的有效减缓。而组间与时间交互效应比较差异均无统计学意义,提示时间点的作用不随空化辐照时间变化而改变。以上结果证实,高声压低强度脉冲超声的空化效应可造成局部肝脏血流灌注量和灌注速度随时间的显著改变,但声辐照时间的长短对该阻断效应无显著影响。
尽管重复测量分析结果显示各组间无显著差异,但各组内分别进行比较显示,T10组在辐照后各时间点AUC及Tp与辐照前比较差异均有统计学意义(均P<0.05),而T1及T5组仅个别时间点与辐照前比较有差异,可见长时间辐照的影响作用主要体现在血流灌注的恢复过程上,而非即刻的灌注阻断效果上。结合病理检查结果可知,在相同参数的高声压低声强超声脉冲空化辐照下,短时间的空化效应即可导致辐照区域肝组织血流灌注量及灌注速度的显著下降,辐照时间的延长并不会产生更显著的即刻阻断效应,但会减缓辐照后血流恢复的速度,同时会增加组织损伤的程度。其原因与空化损伤的作用机制有关。在体内大量微泡空化核存在的条件下,高达2 MPa峰值负压的脉冲超声可引起强烈的瞬态空化,仅若干脉冲产生的强烈空化效应即可对肝血窦甚至邻近肝细胞造成损伤,而1 min的辐照时间足以引起部分肝细胞的急性水肿。随着辐照时间的延长,肝细胞水肿范围及程度亦逐步增加,此时由于肝窦闭塞所引起的血流灌注受阻同样会导致微泡空化核的进入受阻,因此辐照后期空化效应的效率远低于辐照早期,但长时间高声压脉冲刺激的累积可能引起细胞损伤的进一步加重,导致坏死范围的扩大。本实验结果也证实了尽管T1组及T5组在辐照后24 h血流灌注参数仍不及辐照前水平,但与辐照前比较差异无统计学意义,可以认为已基本恢复,而T10组在辐照后24 h的血流灌注水平与辐照前比较差异仍有统计学意义(P<0.05)。
综上所述,本实验再次证实了高声压低声强脉冲超声空化效应的血流阻断效果,并通过对不同超声辐照时间组的比较,得到了辐照时间的延长对即刻空化效应无显著影响,但会减缓血流灌注恢复的结论,对于指导肝脏的空化止血应用具有重要意义。但是由于对24 h后的空化病理损伤未进行定量比较,因此尚不能明确超声辐照时间的延长是否会增加组织病理损伤的程度,尚有待进一步探索。
[1]Chatoupis K,Papadopoulou G,Kaskarelis I.New technology in the management of liver trauma[J].Ann Gastroenterol,2013,26(1):41-44.
[2]Brown TC.Considerations on the management of liver trauma[J]. Paediatr Anaesth,2013,23(1):94-96.
[3]Zhao X,Li L,Zhao H,et al.Liver haemostasis using microbubbleenhanced ultrasound at a low acoustic intensity[J].Eur Radiol,2012,22(2):379-386.
[4]Fowlkes JB,Abramowicz JS,Church CC,et al.American institute of ultrasound in medicine consensus report on potential bioeffects of diagnostic ultrasound[J].J Ultrasound Med,2008,27(4):503-515.
[5]Dalecki D.Mechanical bioeffects of ultrasound[J].Ann Rev Biomed Eng,2004,6(1):229-248.
[6]David E.Goertz.An overview of the influence of therapeutic ultrasound exposures on the vasculature:high intensity ultrasound and microbubble-mediated bioeffects[J].Int J Hyperthermia,2015,31(2):134-144.
[7]Wood AK,Sehgal CM.A review of low-intensity ultrasound forcancer therapy[J].Ultrasound MedBiol,2015,41(4):905-928.
[8]Skyba DM,Price RJ,Linka AZ,et al.Direct in vivo visualization of intravascular destruction of microbubbles by ultrasound and its local effects on tissue[J].Circulation,1998,98(4):290-293.
[9]Miller DL,Quddus J.Diagnostic ultrasound activation of contrast agent gas bodies induces capillary rupture in mice[J].Proc Natl Acad Sci U S A,2000,97(18):10179-10184.
[10]Hwang JH,Brayman AA,Reidy MA,et al.Vascular effects induced by combined 1-MHz ultrasound and microbubble contrast agent treatments in vivo[J].Ultrasound Med Biol,2005,31(4):553-564.
[11]Liu Z,Gao S,Zhao Y,et al.Disruption of tumor neovasculature by microbubble enhanced ultrasound:a potential new physical therapy of anti-angiogenesis[J].Ultrasound Med Biol,2012,38(2):253-261.
[12]Li P,Zhu M,Xu Y,et al.Impact of microbubble enhanced,pulsed,focused ultrasound on tumor circulation of subcutaneous VX2 cancer[J].Chin Med J(Engl),2014,127(14):2605-2611.
[13]Liu Q,Zhao H,Wu S,et al.Impact of microbubble-enhanced ultrasound on liver ethanol ablation[J].Ultrasound Med Biol,2013,39(6):1039-1046.
Effects of different acoustic irradiation time on cavitation-induced blood flow reduction of rabbit liver
GAO Yuejuan,DONG Xiaoxiao,WANG Fei,XIANG Juan,LIU Ya,CHEN Xiaoqin,LIU Zheng,GAO Wenhong Department of Ultrasound,302 Hospital of PLA,Beijing 100039,China
ObjectiveTo investigate the effects of different acoustical irradiation time on the reduction of rabbits hepatic blood perfusion under high-pressure ultrasonic cavitation.MethodsTwenty-seven healthy New Zealand rabbits were randomly divided into three groups according to the acoustic irradiation duration adopted-1 min(T1 group),5 min(T5 group),and 10 min(T10 group),withninemiceineachgroup.Ultrasoniccavitationprocedurewascarriedoutonallanimalsbyhighnegativepressure(P=2.0 MPa)pulsed ultrasonic irradiation combined with intravenous lipid microbubbles injection.Before,right after,30 min after,60 min after,and 24 h after the cavitation procedure,contrast-enhanced ultrasonography was performed to obtain timeintensity curve from which quantity parameters including area under curve and time to peak could be analyzed.After ultrasonography at 24 h,the treated liver tissues were harvested for pathological observation.ResultsAll three groups showeddecreased blood perfusion and prolonged time to peak right after high-pressure ultrasonic cavitation irradiation.Area under curve of T1,T5,and T10 groups decreased from(4868.24±1098.47)%s,(4395.27±1784.42)%s,(5522.43±1444.29)%s to(1642.71± 914.15)%s,(1825.51±874.96)%s,(1097.38±370.24)%s,respectively,while time to peak value prolonged from(21.62±7.07)s,(22.67±5.21)s,(24.17±5.50)s to(42.23±19.12)s,(50.04±11.33)s,(51.98±12.06)s,respectively.Both parameters showed gradual recovery over a long time.Statistical analysis showed no significant differences in cavitation duration effect(P=0.171,0.432,0.724)and cavitation duration×time interaction effect(P=0.905,0.472,0.230),but time effect showed statistical significant differences among three groups(all P<0.01).Pathological results showed that cell degeneration and necrosis were observed in all three groups,and the area T10 group was larger than that of T5 group and T1 group.Conclusion High negative pressure ultrasound induced microbubble cavitation can significantly reduce the perfusion volume and perfusion rate of liver tissue in normal rabbits,but the effect of different acoustic irradiation time has no significant difference.With the elongation of ultrasonic cavitation time,recovery of tissue blood perfusion slow down.
Cavitation;Microbubble;Liver;Hemostasis;Rabbit
R-332;R445.1
A
2016-11-21)
100039 北京市,解放军第三○二医院超声科(皋月娟);第三军医大学第二附属医院超声科(董小小、向娟、刘娅、陈晓琴、刘政、高文宏);昆明医科大学第一附属医院超声科(王菲)
高文宏,Email:10471048gwh@163.com

