植物甾醇酯对高脂膳食大鼠脂代谢影响及其机制研究
丁程程,李文芳,陈 萌,程 静,荣 爽
(武汉科技大学 公共卫生学院,营养与食品卫生系,武汉 430065)
油脂营养
植物甾醇酯对高脂膳食大鼠脂代谢影响及其机制研究
丁程程,李文芳,陈 萌,程 静,荣 爽
(武汉科技大学 公共卫生学院,营养与食品卫生系,武汉 430065)
为了研究植物甾醇酯(PSE)对高脂膳食大鼠肝脏脂代谢的作用及其机制,将42只雌性SD大鼠随机均分为对照组、模型组和干预组,分别给予基础饲料、高脂饲料和高脂加质量分数2% PSE饲料24周。监测大鼠的体重;检测血清脂蛋白的水平和肝脏脂质水平;检测血清转氨酶(ALT、AST)活性并对肝脏结构进行病理学观察;分别用Real-time PCR和Western Blot的方法评估肝脏LXRα、CYP7A1、ABCA1、HMGCoA、FXR、SREBP-1c、 PPARγ、SIRT1 mRNA的表达水平以及PPARγ和SIRT1蛋白的表达水平。结果表明,PSE降低了血清TC和LDL-C以及肝脏TC的水平,增加了血清HDL-C的水平(P<0.05),改善了由高脂膳食导致的肝脏组织病理学改变,降低了血清ALT和AST的水平(P<0.05)。PSE增加了肝脏SIRT1 mRNA的表达,减少了CYP7A1 mRNA和PPARγmRNA以及PPARγ蛋白的表达(P<0.05),对LXRα、ABCA1、HMGCoA、FXR和SREBP-1c mRNA的表达以及SIRT1蛋白的表达没有显著作用。
植物甾醇酯;高脂膳食大鼠;降脂;CYP7A1;PPARγ;SIRT1
高脂血症是一种以血浆脂质升高、高胆固醇和高甘油三酯为特征的多相异质性疾病[1],是心血管疾病的主要致病因素,促进动脉粥样硬化的形成,增加中风和其他心脏和血管疾病的风险[2]。尽管有一系列降脂药用于管理高脂血症,但并不能使低密度脂蛋白胆固醇(LDL-C)维持在正常水平[3],且有许多副作用,如他汀类药物[4]。因此,探索调节高脂膳食所带来的脂代谢紊乱的非药物策略极具意义。
植物甾醇(PS)是一类存在于植物油及其脱臭馏出物中的天然化合物。植物甾醇酯(PSE)由PS和脂肪酸结合而成,酯化之后的吸收率和生物功能显著提高[5]。植物甾醇/植物甾烷醇对血脂作用的系统性评价显示[6],摄入植物甾醇/植物甾烷醇(1.5~3.0 g/d)能够显著降低人体总胆固醇(TC)、甘油三酯(TG)和LDL-C的水平,而对高密度脂蛋白胆固醇(HDL-C)的水平无影响。Demonty等[7]对84个随机对照实验进行Meta分析,发现平均每天摄入2.15 g的PSE,能使LDL-C减少0.34 mmol/L或8.8%,基础LDL-C浓度较高者,PSE对LDL-C的降低作用更明显。关于PS/PSE降脂机制的研究较多,主要涉及抑制胆固醇合成、促进脂肪酸的合成、促进胆固醇外流以及促进胆汁酸排泄几个方面,但是并未得出一致的结论,故本文对高脂膳食大鼠进行PSE干预,探索其降脂机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
清洁级12月龄雌性SD大鼠80只,体重300~400 g,由湖北省疾病预防控制中心提供。
1.1.2 实验试剂
植物甾醇酯(巴斯夫公司);总胆固醇测试盒、甘油三酯测试盒、高密度脂蛋白胆固醇测试盒(中生北控生物科技股份有限公司);考马斯亮蓝蛋白质定量测试盒、谷丙转氨酶测试盒、谷草转氨酶测试盒(南京建成生物工程研究所);无酶水(日本TaKaRa公司);组织裂解液、cDNA合成试剂盒(美国Thermo Fisher Scientific公司);所有引物(武汉天一辉远);BCA蛋白定量试剂盒(碧云天生物技术研究所);聚乙二烯二氟化物膜(美国Millipore公司);抗PPAR-γ单克隆抗体、抗β-actin单克隆抗体、二抗抗体(美国Santa Cruz公司),抗SIRT1单克隆抗体(英国Abcam公司);Super Signal West Durao发光液、Super Signal West Pico发光液(英国GE公司)。
1.1.3 实验仪器
Epoch酶标仪(美国BioTek公司);Bio-Rad CFX Manager Real-time PCR、凝胶成像分析系统(美国Bio-Lab公司)。
1.2 实验方法
1.2.1 实验动物分组
将80只大鼠在温度(24±1)℃,相对湿度(55±10)%,昼夜交替(08:00~20:00)的环境下,每笼5只,自由进食进水,适应性饲养3 d。筛选实验动物,剔除血脂水平异常及患有慢性呼吸性疾病和肿瘤的动物。将剩余的42只大鼠随机均分为3组,分别为对照组、模型组和干预组,分别给予普通饲料,高脂饲料(5%蛋黄粉、10%猪油、2%胆固醇、0.3%胆盐、0.2%丙基硫氧嘧啶、82.5%基础饲料)和含2%PSE的高脂饲料喂养24周,期间每周称重。实验结束后,禁食12 h,采血并离心取血清,-80℃冷冻保存。每组随机选取4只大鼠用4%多聚甲醛进行心脏灌注,分离肝脏,浸泡于4%多聚甲醛溶液中。剩余大鼠快速分离肝脏,称重并-80℃冷冻保存。肝脏系数= 肝脏湿重/体重×100%。
1.2.2 血清及肝脏脂质水平的检测
严格按照试剂盒的说明书检测血清中TC、TG、LDL-C和HDL-C的水平。制备肝脏组织匀浆,离心取上清,用试剂盒检测其TC、TG含量。
1.2.3 肝脏组织病理学的检测
将浸泡在4%多聚甲醛溶液中的肝脏组织进行石蜡包埋,切片并进行苏木-伊红(H&E)染色,通过显微镜观察肝脏的组织病理学变化。
1.2.4 肝功能的检测
按照说明书的方法检测血清中谷丙转氨酶(ALT)和谷草转氨酶(AST)的活性。
1.2.5 Real-time PCR分析
检测肝脏LXRα、CYP7A1、ABCA1、HMGCoA、FXR、SREBP-1c、PPARγ和SIRT1 mRNA的表达水平,目的基因用β-actin。肝脏组织用Tizol Reagent提取和分离总mRNA,再用高容量cDNA逆转录试剂盒将RNA转化为互补的DNA(cDNA)。加入引物(序列见表1)和Taq聚合酶,放入Bio-Rad CFX Manager Real-time PCR仪进行定量分析。

表1 用于Real-time PCR的引物序列
1.2.6 Western Blot分析
称取约100 mg组织(按组织与裂解液质量体积比为1∶4)加入400 μL裂解液,充分匀浆,直到看不到明显的组织块,冰浴25 min。收集裂解液,4℃下14 000 r/min离心10 min,取上清,测定总蛋白质含量。蛋白质在12%的聚丙烯酰胺凝胶电泳上分离,且用半干转移法将蛋白质转移到聚乙二烯二氟化物膜中。将膜放入有Tween-20的5%脱脂牛奶(TTBS)中封闭1 h,然后放入包含一抗抗体的TTBS 中孵1 h,再放入稀释的二抗中孵1 h。取膜,加入Super Signal West Durao和Super Signal West Pico(体积比1∶1)混合发光液,反应30 s后,用凝胶成像分析系统对条带进行成像和分析。
1.2.7 统计分析
数据用“均值±标准差”表示。各组均值用SPSS17.0 软件ANOVA法进行统计学分析。P<0.05 时认为有统计学意义。
2 结果与分析
2.1 体重及肝脏系数
各组大鼠的体重及肝脏系数的变化分别见表2、表3。由表2可知,在实验中各组大鼠的体重变化均无统计学意义(P>0.05)。由表3可知,与对照组相比,模型组大鼠的肝脏系数明显增加(P<0.05),干预组大鼠与模型组的肝脏系数相比,显著减小(P<0.05),但与对照组相比,差异无显著性(P>0.05)。这表明PSE膳食干预改善了高脂膳食诱导的大鼠肝脏系数的增加,且改善至接近对照组大鼠的水平。
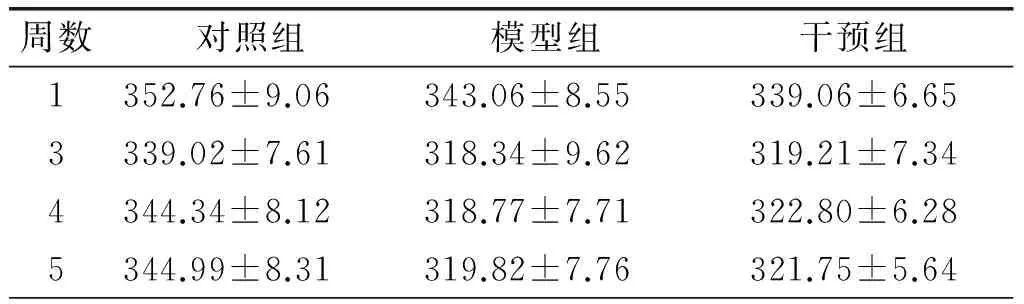
表2 各组大鼠体重变化 g
续表2

g
注:第2周和第24周为采血周,为了排除禁食对大鼠体重的影响,体重不作记录。
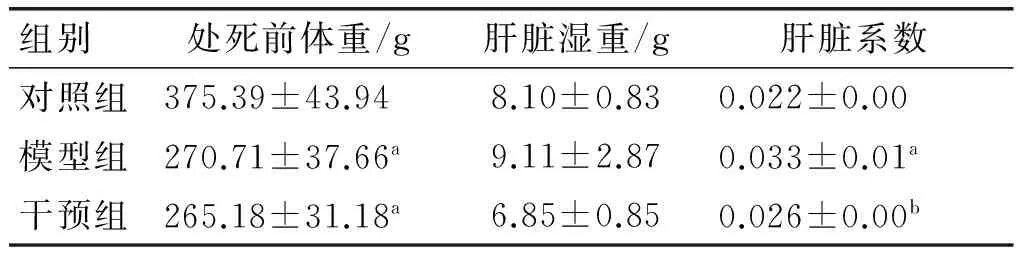
表3 各组大鼠肝脏系数
注:a表示与对照组相比差异有显著性(P<0.05);b表示与模型组相比差异有显著性(P<0.05)。下同。
2.2 PSE改善脂代谢紊乱
2.2.1血清脂质水平
实验前后各组大鼠血清TC、TG、LDL-C和HDL-C的水平变化见表4。由表4可知,0周时,各组大鼠的血脂水平均无显著性差异(P>0.05);24周时,模型组大鼠血清TC和LDL-C的水平显著高于对照组,差异有统计学意义(P<0.05);与模型组相比,PSE干预能够显著降低血清TC和LDL-C的水平,差异有统计学意义(P<0.05);此外,与对照组相比,模型组血清HDL-C水平显著降低(P<0.05),而给予PSE干预后血清HDL-C的水平与模型组相比显著升高(P<0.05),且升高至与对照组的HDL-C水平相近的水平(P>0.05)。
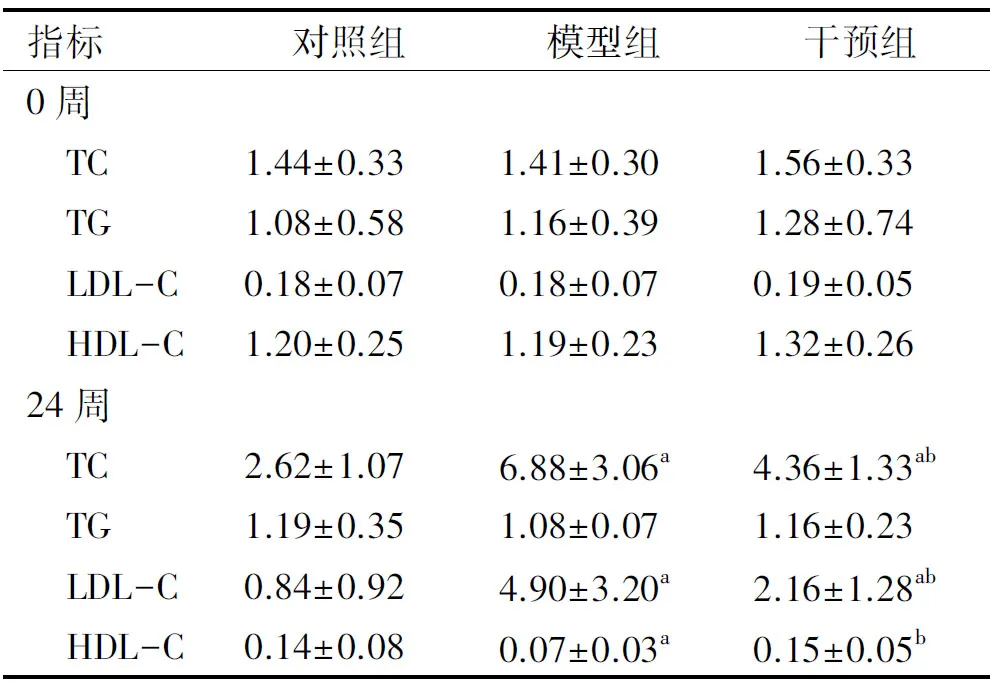
表4 实验前后各组大鼠血清TC、TG、LDL-C和 HDL-C的水平变化 mmol/L
2.2.2 肝脏TC、TG的水平
各组大鼠肝脏TC、TG的水平见表5。由表5可见,与对照组相比,模型组大鼠肝脏的TC含量明显增加,且差异有显著性(P<0.05);干预组大鼠肝脏TC的水平与模型组相比差异有统计学意义(P<0.05),而与对照组相比均无显著差异(P>0.05)。TG的水平各组之间无显著差异(P>0.05)。结果表明,膳食添加PSE可以有效减少高脂膳食导致的肝脏的脂肪积累,使TC水平恢复至接近对照组水平,而对TG水平未产生显著影响。
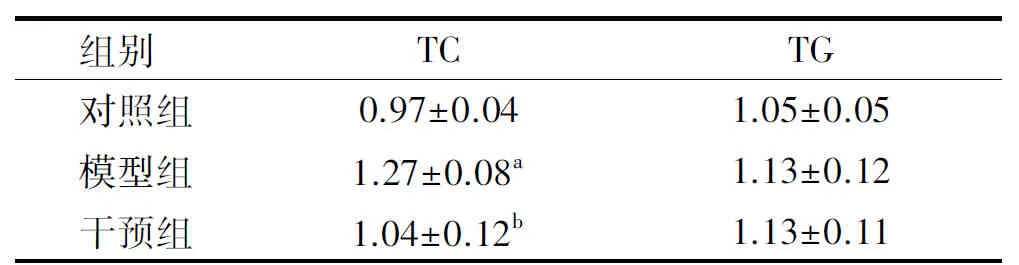
表5 各组大鼠肝脏TC、TG的水平 mmol/L
2.3 PSE对肝脏病理损伤的保护作用
2.3.1 PSE缓解肝脏组织病理学变化(见图1)
由图1可见,对照组大鼠肝细胞结构完整,边界清晰,呈多边形,且无空泡,以中央静脉为轴心呈放射状排列的肝索清晰可见;模型组大鼠肝脏细胞堆积大量的脂滴,可见大量近似圆形的空泡,且中央静脉出现明显的脂肪变性,肝索结构消失;而干预组脂滴小而分散,中央静脉没有明显的病变,且可见放射状肝索。这表示PSE的干预减少了脂肪在肝脏的积累,缓解了中央静脉的脂肪变性并使肝索结构恢复,减少肝脏损伤。
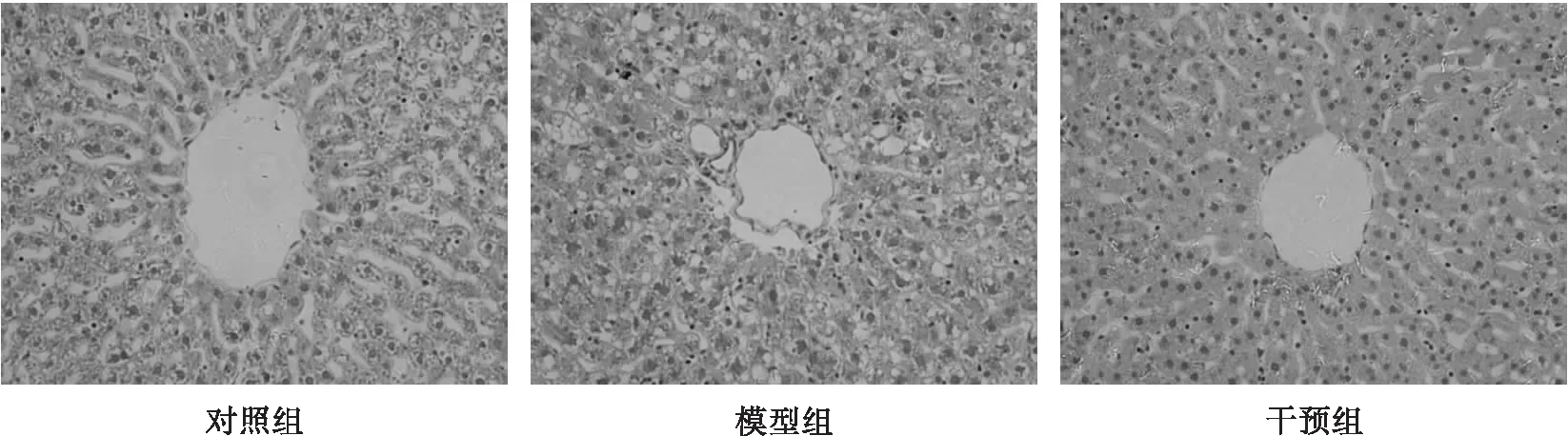
图1 各组大鼠肝脏的病理切片(H&E 400×)
2.3.2 PSE降低血清转氨酶的活性
各组大鼠血清ALT和AST的活性见表6。

表6 各组大鼠血清ALT和AST的活力 U/L
由表6可知,模型组大鼠血清的ALT、AST活性显著高于对照组,而干预组组二者活性均有所下降,与模型组相比差异均有统计学意义(P<0.05),与对照组相比差异无显著性(P>0.05),由此可认为PSE的干预缓解了高脂膳食引起的肝功能损伤。
2.4 PSE对脂代谢相关基因和蛋白质表达的影响
2.4.1 Real-time PCR 分析
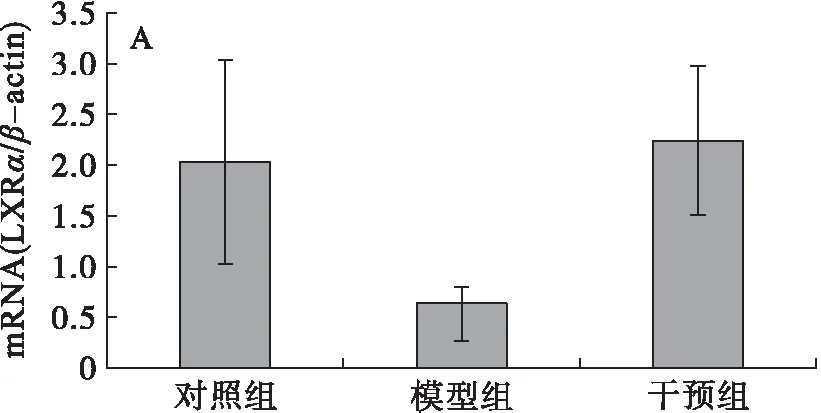
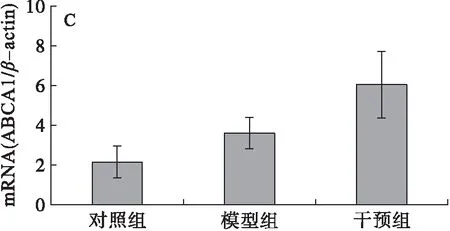
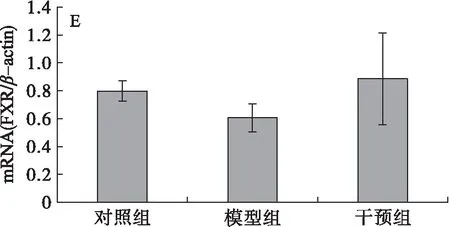
分析肝脏LXRα、CYP7A1、ABCA1、HMGCoA、FXR、SREBP-1c、PPARγ和SIRT1 mRNA的表达,结果见图2。由图2可知,模型组大鼠肝脏的CYP7A1和PPARγmRNA的表达水平与对照组相比显著升高(图2B和图2G),干预组与模型组相比其表达水平显著降低,差异均有统计学意义(P<0.05),干预组与对照组相比无显著性差异,表明PSE的干预能够有效下调高脂膳食诱导的肝脏CYP7A1和PPARγmRNA表达,且下调至接近对照组的水平;另外,高脂膳食(模型组)抑制了大鼠肝脏SIRT1的表达(图2H),与对照组相比差异显著(P<0.05),干预组大鼠肝脏SIRT1 mRNA的表达水平显著高于模型组大鼠的(P<0.05),与对照组相比差异无统计学意义(P>0.05),说明高脂膳食抑制了大鼠肝脏SIRT1 mRNA的表达,而PSE能够逆转这一变化;高脂膳食对LXRα、ABCA1、HMGCoA、FXR、SREBP-1c mRNA的表达没有明显影响(图2A、图2C、图2D、图2E、图2F),PSE的干预对其表达水平也未见显著影响(P>0.05)。
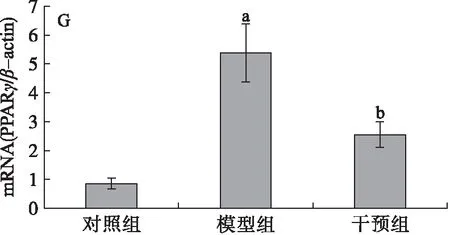
2.4.2 Western Blot分析
采用免疫印迹的方法对大鼠肝脏PPARγ和SIRT1蛋白的表达水平进行评估,结果见图3。模型组与对照组相比,PPARγ的表达增加(见图3A),干预组与模型组相比水平降低,差异均有显著性(P<0.05),干预组与对照组相比,差异无统计学意义(P>0.05),表明摄入PSE能够下调PPARγ蛋白的表达,逆转高脂膳食引起的变化,与基因表达结果一致。在肝脏SIRT1蛋白的表达水平上,各组之间均没有显著的差异,但其表达趋势与基因表达一致(见图3B)。
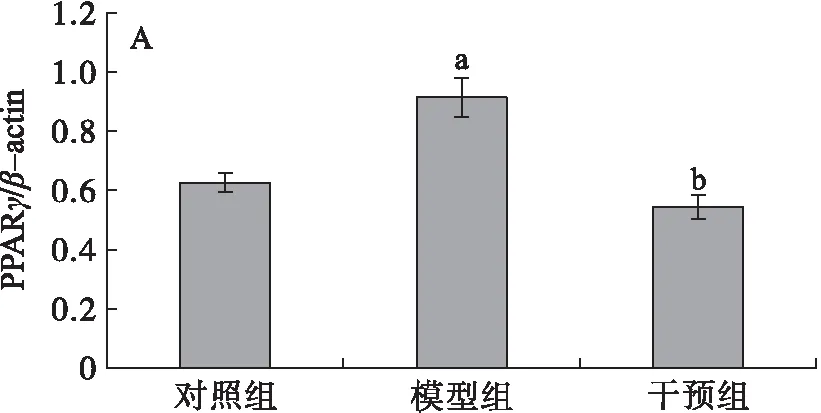
图3 肝脏PPARγ和SIRT1蛋白表达水平
3 讨 论
相关基因和蛋白质的表达结果表明,膳食补充PSE逆转了高脂膳食诱导的CYP7A1 mRNA表达水平的增加,这与Batta等[8]对豆甾醇的研究结果一致,并使其恢复至对照组水平。CYP7A1是胆汁酸经典合成途径中第一步,即胆固醇转化为羟基胆固醇(7α-hydroxycholesterol, 7α-HOC)的催化剂,是胆汁酸合成的限速酶[9]。大鼠肝脏CYP7A1 mRNA的表达下降,可能是PSE干预后体内胆固醇水平下降所致。高脂膳食大鼠肝脏PPARγmRNA和蛋白质的表达水平增加,PSE膳食干预改善了这一变化。PPARγ参与调控脂代谢的多个环节,研究表明PPARγ经配体活化后,能激活促进脂肪酸储存相关基因的表达,如脂肪酸转移蛋白、脂肪酸结合蛋白和脂蛋白脂酶;与此同时,还能抑制促进脂肪酸释放相关基因的表达,如肿瘤坏死因子-α(TNF-α)[10]。故PSE改善脂质水平紊乱的机制可能是调节PPARγ的表达,促进脂肪酸合成,减少胆固醇堆积。另外,摄入PSE改善了高脂膳食引起的大鼠肝脏SIRT1 mRNA表达的减少,在其蛋白质的表达上未见影响。已证实,SIRT1对PPARγ有抑制作用,并因此能够增加脂质分解,减少脂质的生成[11]。表明PSE可能是通过上调SIRT1间接抑制PPARγ的表达来发挥降脂作用的。实验结果可见,高脂膳食和PSE膳食补充均未对LXRα、ABCA1、HMGCoA、FXR和SREBP-1c mRNA的表达产生显著的影响。这与已有的一些研究结果不完全一致,但在基因的表达趋势上结果一致。如麦角甾醇被证实是LXR的激活剂[12],LXRs调节SREBP-1c的表达,SREBP-1c是一种调节脂肪酸生物合成相关基因的转录因子[13];膳食补充PSE有上调ABCA1的表达趋势[14],促进胆固醇外流;豆甾醇喂食大鼠时,抑制了肝脏HMGCR的表达[8],减少胆固醇合成;FXR具有调节胆汁酸和脂质内环境稳态的作用[15],研究表明,豆甾醇是FXR的强拮抗剂[16]。不一致可能是因为干预物、干预剂量、动物种类和干预时长等不一样造成的。
4 结 论
本研究探索了摄入植物甾醇酯(PSE)对高脂膳食诱导的脂质水平紊乱的改善作用及其调节机制。实验过程中各组大鼠的体重变化均没有显著差异,PSE在肝脏系数方面表现出显著的改善作用。与模型组相比,摄入PSE的干预组大鼠血清TC和LDL-C的水平以及肝脏TC的含量显著降低,血清HDL-C水平显著增加。饮食加入PSE减少了肝脏细胞中脂肪的堆积,缓解了中央静脉的脂肪变性并使肝索结构恢复。干预组大鼠血清的ALT和AST活性明显低于模型组大鼠,接近对照组大鼠的水平。膳食补充PSE逆转了高脂膳食诱导的CYP7A1 mRNA表达水平的增加,并使其恢复至对照组水平。高脂膳食大鼠肝脏PPARγmRNA和蛋白质的表达水平增加,PSE膳食干预改善了这一变化。另外,摄入PSE改善了高脂膳食引起的大鼠肝脏SIRT1 mRNA表达的减少,在其蛋白质的表达上未见影响。实验结果可见,高脂膳食和PSE膳食补充均未对LXRα、ABCA1、HMGCoA、FXR、SREBP-1c mRNA的表达产生显著的影响。
综上所述,PSE的降脂效果显著,可能是通过下调PPARγ的表达,进而促进脂肪酸合成,减少胆固醇堆积,同时上调SIRT1的表达,间接抑制PPARγ的表达而起作用的。
[1] O′KEEFE J H, BELL D S. Postprandial hyperglycemia/hyperlipidemia (postprandial dysmetabolism) is a cardiovascular risk factor[J]. Am J Cardiol, 2007, 100(5): 899-904.
[2] LEE H S, LEE Y J, CHUNG Y H, et al. Beneficial effects of red yeast rice on high-fat diet-induced obesity, hyperlipidemia, and fatty liver in mice[J]. J Med Food, 2015, 18(10): 1095-1102.
[3] RIZOS C V, BARKAS F, ELISAF M S. Reaching low density lipoprotein cholesterol targets[J]. Curr Med Res Opin, 2014, 30(10): 1967-1969.
[4] CLARK L T. Treating dyslipidemia with statins: the risk-benefit profile[J]. Am Heart J, 2003, 145(3): 387-396.
[5] WEINGARTNER O, ULRICH C, LUTJOHANN D, et al. Differential effects on inhibition of cholesterol absorption by plant stanol and plant sterol esters in apoE-/-mice[J]. Cardiovasc Res, 2011, 90(3): 484-492.
[6] 付佳, 杨月欣, 张立实, 等. 植物甾醇/甾烷醇对血脂作用的系统评价研究[J]. 营养学报, 2008(2): 181-184.
[7] DEMONTY I, RAS R T, VAN DER KNAAP H C M, et al. Continuous dose-response relationship of the LDL-cholesterol-lowering effect of phytosterol intake[J]. J Nutr, 2008, 139(2): 271-284.
[8] BATTA A K, XU G, HONDA A, et al. Stigmasterol reduces plasma cholesterol levels and inhibits hepatic synthesis and intestinal absorption in the rat[J]. Metabolism, 2006, 55(3): 292-299.
[9] LI T, CHIANG J Y. Bile acids as metabolic regulators[J]. Curr Opin Gastroenterol, 2015, 31(2): 159-165.
[10] ZANDBERGEN F, MANDARD S, ESCHER P, et al. The G0/G1 switch gene 2 is a novel PPAR target gene[J]. Biochem J, 2005, 392(2): 313-324.
[11] PICARD F, KURTEV M, CHUNG N, et al. Sirt1 promotes fat mobilization in white adipocytes by repressing PPAR-γ[J]. Nature, 2004, 429: 771-776.
[12] KANEKO E, MATSUDA M, YAMADA Y, et al. Induction of intestinal ATP-binding cassette transporters by a phytosterol-derived liver X receptor agonist[J]. J Biol Chem, 2003, 278(38): 36091-36098.
[13] REPA J J, LIANG G S, OU J F, et al. Regulation of mouse sterol regulatory element-binding protein-1c gene (SREBP-1c) by oxysterol receptors, LXRαand LXRβ[J]. Gene Dev, 2000, 14(22): 2819-2830.
[14] BOMBO R P A, AFONSO M S, MACHADO R M, et al. Dietary phytosterol does not accumulate in the arterial wall and prevents atherosclerosis of LDLr-KO mice[J]. Atherosclerosis, 2013, 231(2): 442-447.
[15] CARIOU B, STAELS B. FXR: a promising target for the metabolic syndrome?[J]. Trends Pharmacol S, 2007, 28(5): 236-243.
[16] CARTER B A, TAYLOR O A, PRENDERGAST D R, et al. Stigmasterol, a soy lipid-derived phytosterol, is an antagonist of the bile acid nuclear receptor FXR[J]. Pediatr Res, 2007, 62(3): 301-306.
Effect of phytosterol ester on lipid metabolism of rats fed a high fat diet and its mechanism
DING Chengcheng, LI Wenfang, CHEN Meng,CHENG Jing, RONG Shuang
(Department of Nutrition and Food Hygiene, School of Public health, Wuhan University of Science and Technology, Wuhan 430065, China)
The effect of phytosterol ester(PSE) on lipid metabolism of rats fed a high fat diet and its mechanism were investigated. 42 female SD rats were randomly divided into a control group, a model group and an intervening group, fed with basic feed, high fat diet (HFD) and HFD with 2% PSE respectively for 24 weeks. The changes of weight were monitored, the levels of lipoprotein in serum and liver were measured, the activities of ALT and AST in serum were determined and the pathological changes of the liver were observed. The mRNA expressions of LXRα, CYP7A1, ABCA1, HMGCoA, FXR, SREBP-1c, PPARγand SIRT1 were measured by Real-time PCR and Western Blot. The results showed that PSE significantly lowered serum TC, LDL-C and liver TC level,increased serum HDL-C level (P<0.05), attenuated HFD-induced histopathological changes of liver and reduced the serum ALT and AST activity (P<0.05). PSE had no effect on the mRNA level of LXRα, ABCA1, HMGCoA, FXR and SREBP-1c and protein level of SIRT1, but PSE increased SIRT1 mRNA in liver and decreased CYP7A1 mRNA. Most importantly, PSE decreased not only the protein expression of PPARγbut also expression of PPARγmRNA.
phytosterol ester; high fat diet rat; lipid-lowering; CYP7A1; PPARγ; SIRT1
2016-10-11;
2017-01-23
2013年BASF国际健康研究基金项目(亚洲)
丁程程(1992),女,硕士研究生,研究方向为营养与健康、食品安全评价(E-mail)811255158@qq.com。
荣 爽,副教授,博士(E-mail)moment-88@163.com。
TQ645.9; Q591.5
A
1003-7969(2017)06-0071-07

