慢性肾脏病肠道菌群失调的病理机制、治疗策略及中药的干预作用
韩文贝+刘莹露+万毅刚+孙伟+涂玥+杨晶晶+吴薇+何伟明+姚建
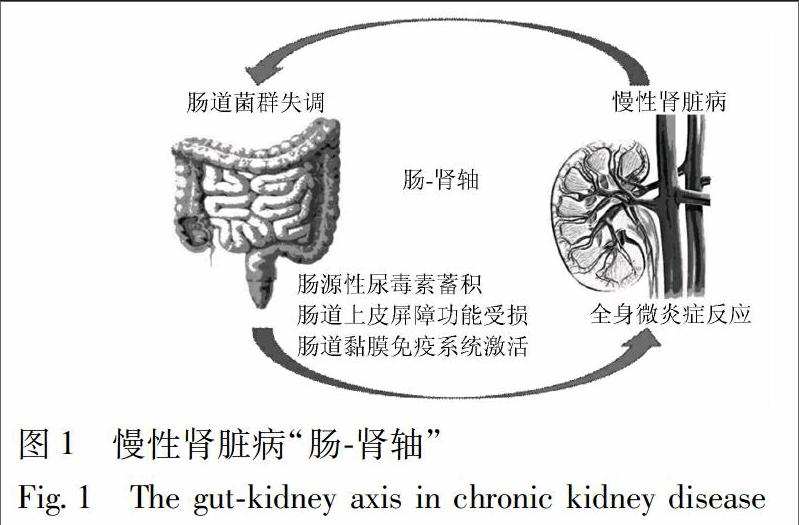

[摘要] 腸道菌群失调是中、晚期慢性肾脏病(chronic kidney disease,CKD)进展至尿毒症的高危因素之一,其特征就是益生菌减少、能产生尿毒素的条件致病菌(产尿素酶菌群、产内毒素菌群以及产代谢毒素菌群)增多。“肠-肾轴(gut-kidney axis)”学说和“慢性肾脏病-结肠轴(chronic kidney disease-colonic axis)”概念的核心观点认为,失调的肠道菌群通过加剧尿毒素蓄积和诱导全身性微炎症反应等途径加重肾脏的损伤。初步的临床试验和动物实验的结果显示,以乳酸菌和双歧杆菌制剂为代表的益生菌和以菊粉、低聚半乳糖为代表的益生元,还有鲁比前列酮、活性炭吸附剂等都可以针对CKD患者体内失调的肠道菌群,通过减轻尿毒素蓄积和抑制全身性微炎症反应等途径而改善肾功能。不仅如此,一些经口服或肠道给药的单味中药、中药复方还有中药提取物(大黄素等)在一定程度上也能调节肠道细菌,保护肠道上皮屏障,减轻尿毒素蓄积,延缓CKD进展。其中,大黄类经方——大黄甘草汤(浓缩颗粒TJ-84)改善肾衰竭动物模型体内尿毒素蓄积的靶点不是肾脏,而可能是“肠道菌群所启动的肠-肾轴”。基于此,针对中、晚期CKD患者肠组织中肠道菌群相关的病理因素(紧密连接蛋白、辅助性和调节性T细胞等)的干预性研究可能是今后的重点发展方向之一。
[关键词] 肠道菌群;中药;慢性肾脏病;肠-肾轴;病理机制
[Abstract] The gut microbiota dysbiosis is one of the risk factors in the progression from the advanced chronic kidney disease(CKD)to uremia, characterized by the reduction of probiotics and the increase of opportunistic pathogens including urease-related microbes, endotoxin-related microbes and toxin-related microbes, which can produce uremic toxins. According to the core point of "the gut-kidney axis" theory and "the chronic kidney disease-colonic axis" concept, the gut microbiota dysbiosis aggravates renal damage by accumulating uremic toxins and inducing the systemic micro-inflammation. The preliminary clinical trials and animal experiments show that the probiotics biologicals from Lactobacillus acidophilus or Bifidobacterium, and the prebiotics including inulin and galactooligosaccharides, as well as lubiprostone and activated carbon adsorbents can be used for improving dysfunction of CKD patients with the gut microbiota dysbiosis via reducing uremic toxins and inhibiting the systemic micro-inflammation. But not only that, it is reported that, to some extent, a number of the single Chinese herbal medicine(CHM), the CHM prescriptions and the CHM extracts(emodin,etc.)with oral or enema administration can also regulate the gut microbiota dysbiosis, protect the intestinal epithelial barrier, reduce uremic toxins accumulation and delay CKD progression. Thereinto, Dahuang Gancao Decoction(the concentrated granule TJ-84), a classical CHM prescription of rhubarb, can ameliorate uremic toxins accumulation in the animal models with renal failure probably through targeting the gut-kidney axis triggered from gut microbiota, but not targeting the kidney. Based on these results, the interventional studies targeting the gut microbiota-related pathological factors such as tight junction proteins, helper T cells and regulatory T cells in the intestinal tract of the advanced CKD patients will become one of the key development directions in the future.
[Key words] gut microbiota;Chinese herbal medicine;chronic kidney disease;gut-kidney axis;pathomechanism
肠道(gut)是人体最大的消化器官和排泄器官,其间,寄生着100万亿以上的细菌,这些肠道菌群(gut microbiota)构成了肠道微生态系统(intestinal micro-ecogical system)[1]。研究表明,健康人群的肠道菌群与机体为共生关系,这些共生菌在肠道内不但能参与物质和能量代谢,调控基因表达,调节免疫功能和营养状态,还能抵抗病原菌,消化碳水化合物,生成短链脂肪酸、维生素B、维生素K以及氨基酸等营养物质[2-3]。因此,肠道还被认为是一个功能活跃的代谢器官。近年来,越来越多的证据显示,肠道微生态系统紊乱与很多常见疾病密切相关,如神经退行性病变[4]、肺病[5]、自闭症[6]、炎症性肠病[7]、肥胖[8]、直肠癌[9]以及心血管疾病等[10]。此外,对于中、晚期慢性肾脏病(chronic kidney disease,CKD)患者,肠道菌群失调(intestinal microbes dysbiosis)也是其进展至尿毒症的高危因素之一[11]。2011年,Meijers等首次提出了肾脏与肠道相互作用的“肠-肾轴(gut-kidney axis)”学说[12];在此基础上,2015年,Pahl等提出“慢性肾脏病-结肠轴(chronic kidney disease-colonic axis)”概念[13]。其核心观点认为,CKD患者在疾病进展过程中会出现肠道微生态系统(内环境)紊乱,造成肠道菌群失调,包括益生菌减少、能产生尿毒素的条件致病菌增多,其结果是加剧肠源性尿毒素在血液中蓄积而不能被受损的肾脏及时清除,肾功能进一步减退,最终,形成肠、肾之间的恶性循环;另一方面,失调的肠道菌群还会破坏肠道上皮屏障功能,使得肠源性尿毒素和条件致病菌移位而进入血液循环,激活肠道黏膜免疫系统,诱导全身性微炎症反应,加重肾脏的损伤(图1)。临床上,以乳酸菌和双歧杆菌制剂为代表的益生菌[14-15]和以菊粉、低聚半乳糖为代表的益生元[16-17],还有鲁比前列酮[18]、活性炭吸附剂[19-20]等都可以针对CKD患者体内失调的肠道菌群,通过减轻尿毒素蓄积和抑制全身性微炎症反应等途径而改善肾功能。此外,一些单味中药、中药复方还有中药提取物在一定程度上也能发挥调节肠道细菌[21],保护肠道上皮屏障,减轻尿毒素蓄积,延缓CKD进展等类似的作用。
1 慢性肾脏病肠道菌群失调的病理机制
1.1 肠道菌群失调的特征 研究表明,健康人群的肠道菌群分类有1 000种以上,99%以上的细菌分类都属于厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)以及放线菌门(Actinobacteria)等4类,其中,最多者是厚壁菌门中的集群梭状芽孢杆菌(Clostridium cluster)XIV型和IV型,占60%,而拟杆菌门只占20%[22]。细菌是以菌落形成单位(colony-forming unit,CFU)计数的。十二指肠和空肠内有胆汁和胰液的分泌,所以,1 g十二指肠和空肠内容物的细菌数量只有1×103~1×104CFU;与此不同的是,在回肠和大肠,其内容物的细菌数量剧增,1 g回肠和大肠内容物的细菌数量可达到1×107~1×1012CFU[23]。因此,大肠(结肠)内的肠道菌群在数量和规模上都占據着重要地位。
据报道[24],在人类成年人的结肠内,肠道菌群通过传统的细菌培养法只能鉴定出其中的20%。近年来,随着聚合酶链反应(polymerase chain reaction,PCR)[25]、实时荧光定量PCR[26]、16S rDNA指纹分析[27]、荧光原位杂交(flurescence in situ hybridization)[28]、基因芯片(gene chip)[29]以及宏基因组学(metagenomics)等分子生物学技术的进步,肠道微生态和肠道菌群的研究得到了飞速的发展。宏基因组学是以样品微生物群体基因组为对象来研究微生物种群结构、进化关系以及与环境间相互作用的先进技术,无需培养就可以直接对肠道菌群总DNA进行全基因组测序,进而,鉴定和分析肠道菌群的分类和功能[30]。基于该技术,国外学者发现CKD患者肠道中的益生菌和条件致病菌在分类、数量上均会产生明显的变化。其特征包括益生菌——双歧杆菌(Bifidobacterium)、嗜酸乳杆菌(Lactobacillus acidophilus)以及普氏菌(Prevotella)等显著减少,而条件致病菌——短状杆菌(Brachybacterium)、伯吉古菌(Catenibaterium)、肠杆菌(Enterobacteriaceae)、盐单胞菌(Halomonadaceae)、莫拉氏菌(Moraxellaceae)、涅斯捷连科氏菌(Nesterenkonia)、多囊粘菌(Polyangiaceae)、假单胞菌(Pseudomonadaceae)以及丝硫菌家族(Thiothrix families)等明显增多[31-32]。这些条件致病菌与肠源性尿毒素的产生直接相关,因此,也被称为产尿素酶菌群、产内毒素菌群以及产代谢毒素菌群等。Vaziri等报道[31],终末期肾病(end-stage renal disease,ESRD)患者与健康人之间,其肠道菌群有190种细菌操作分类单元的丰度差异。王尊松等发现,在120例尿毒症透析和非透析患者的粪便中,长双歧杆菌(Bifidobacterium longum)和嗜酸乳杆菌(Lactobacillus acidophilus)浓度均明显降低,大肠杆菌(Escherichia coli)和粪肠球菌(Enterococcus faecalis)浓度均明显升高[33]。对于5/6肾切除的尿毒症模型鼠,其肠道优势细菌硬壁菌和拟杆菌的数量减少,变形菌数量增加[34]。
研究表明,CKD患者出现肠道菌群失调的原因可能有以下几方面:一则,尿毒症患者血液中氨的高含量会直接导致结肠内条件致病菌数量增多、益生菌数量减少;二则,CKD患者的便秘并发症使得结肠转运时间延长,能降解蛋白质的条件致病菌数量就会在结肠中增多;三则,CKD患者食物结构的改变(高纤维摄入不足,富含钾的蔬菜和水果摄入过多等)会引起肠道内益生菌数量减少。此外,在CKD治疗过程中,抗生素的滥用和磷酸盐结合剂的使用也是肠道菌群失调的原因之一[35]。
1.2 肠道菌群失调与肠源性尿毒素蓄积 对于肾功能减退的CKD患者,本来应该由肾脏排泄的尿毒素(uremic toxins)在体内蓄积必定会进一步加快肾功能减退。尿毒素依据其生化性质可分为3类:一是水溶性尿毒素,也就是不与蛋白质结合的小分子物质,如尿素氮(urea nitrogen)和肌酐(creatinine);二是中分子尿毒素,如甲状旁腺素和β2微球蛋白(β2-microglobulin);三是蛋白结合性尿毒素,如硫酸吲哚酚(indoxyl-sulfate)、对甲酚(p-cresol)以及三甲胺氧化物(trimethylamine-N-oxide,TMAO)等[36-38]。其中,蛋白结合性尿毒素来源于食物,并由肠道菌群合成,称之为“肠源性尿毒素”。研究表明,这类肠源性尿毒素毒性较强,相比于小分子尿毒素,它们不仅会加剧CKD患者肾功能恶化,而且,难于被血液透析所清除,更易诱发心脑血管并发症[37-38]。
Aronov等根据有无结肠切除病史将ESRD患者分成2组,结果显示,对于结肠切除组患者,其血液中的硫酸吲哚酚和对甲酚的含量很低,有些患者血液中甚至没有上述的蛋白结合性尿毒素;作者推测,结肠是肠源性尿毒素的主要来源地[39]。Poesen等认为,在小肠中没有得到完全吸收的食物蛋白进入大肠后成为肠源性尿毒素的物质来源。在CKD患者失调的肠道菌群中,诱导碳水化合物发酵的菌群减少,而诱导蛋白质发酵的菌群增多,这就使得肠源性尿毒素的前体物质——吲哚和对甲酚在肠道中过度产生。其中,吲哚是色氨酸的发酵产物,经肝脏代谢为硫酸吲哚酚而进入血液循环系统;对甲酚是苯丙氨酸和酪氨酸的酵解产物[40]。此外,CKD患者多伴有便秘,其肠道内容物蠕动速度低下,食物蛋白在肠道内的停留时间过长而易于腐烂,这也是肠源性尿毒素的成因之一[35]。
1.3 肠道菌群失调与肠道上皮屏障功能受损 肠道上皮除了摄取营养物质外,还能发挥屏障功能,以防止细菌、细菌毒素、抗原以及消化酶等进入机体内环境。肠道上皮屏障由肠道上皮细胞的“顶端膜”和“顶端连接复合体”构成,顶端连接复合体能填补相邻细胞间隙。这个复合体由紧密连接蛋白(tight junction protein,TJP)、下粘合连接组件构成,其中,TJP是顶端连接复合体管腔的主要组成部分。TJP主要包括闭合蛋白(occludin)家族和封闭蛋白(claudin)家族以及闭锁小带ZO1蛋白家族。简言之,在肠道上皮细胞之间,TJP形成一种有效的屏障来抵挡来源于肠道的各种致病因子的侵入[41]。研究表明,CKD患者肠道上皮屏障功能往往会遭到破坏,出现渗漏性肠道(leaky gut),肠源性尿毒素和条件致病菌经渗漏肠道而进入血液循环,诱导全身性微炎症反应。接受血液透析的晚期CKD患者,其肠道上皮组织会出现慢性结肠炎的病理改变,如绒毛高度降低、隐窝延伸以及炎症细胞浸润肠道固有层。这些病变与患者血液中发现的肠源性细菌DNA高度相关[11]。Vaziri等发现,对于CKD动物模型,其肠道上皮细胞的紧密连接蛋白claudin-1,occludin,ZO1表達水平明显下调;作者推测,模型鼠肠道上皮屏障功能的破坏可能与尿毒素——氨及其代谢产物尿素有关;在CKD进展过程中,肠道内过量的氨会转化为氢氧化铵,氢氧化铵的腐蚀性不但会引起肠道菌群失调,而且,可以直接破坏肠道上皮细胞之间的TJP[42]。此外,尿毒症患者的肠道黏膜会出现水肿、萎缩、溃疡、炎症等病理性改变,这些改变会破坏肠道上皮屏障功能,增加肠壁通透性,减慢肠管蠕动,导致肠道内的致病菌移位而进入血液循坏,引起全身性微炎症反应[11]。同样,借助5/6肾切除的尿毒症大鼠模型,张盼等发现,模型鼠血液、脾脏、肝脏中检测到的细菌DNA片段来源于肠道,其中,肠道条件致病菌(不动杆菌、大肠埃希菌、肠杆菌和变形杆菌)增加,益生菌(乳酸菌和双岐菌)减少;此外,血液中超敏C反应蛋白、白介素(interleukin,IL)-6浓度和肠壁通透性均增高;作者推测,尿毒症模型鼠肠道上皮屏障功能受损,使得失调的肠道菌群移位,最终,诱导微炎症反应而戕害肾脏[34]。
1.4 肠道菌群失调与肠道黏膜免疫系统激活 肠道黏膜的免疫系统包括免疫诱导组织和免疫效应组织。前者的免疫诱导组织由小肠派尔集合淋巴结(Peyer patches)、孤立淋巴结、结肠补丁(colonic patch)以及肠系膜淋巴结构成。这些组织也被称为肠道相关淋巴组织,其中的淋巴滤泡发挥免疫诱导作用。后者的免疫效应组织由上皮层和黏膜固有层构成。黏膜固有层内有大量的T细胞、B细胞、IgA源性浆细胞和抗原提呈细胞(树突细胞)等,这些免疫效应细胞是肠道黏膜免疫系统的主体[43-44]。研究表明,肠道黏膜固有层内存有很多Th17细胞(辅助性T细胞),它分泌的细胞因子能够有效地防御病原菌和真菌的感染。然而,肠道内附着在上皮细胞上的分节丝状菌(segmented filamentous bacteria,SFB)会强烈诱导Th17细胞活化,过度活化的Th17细胞是类风湿性关节炎、多发性硬化以及炎症性肠病等自身免疫性疾病的致病因素之一[45]。在肠道黏膜固有层内同样含有调节性T细胞,它与肠道内肉毒杆菌诱导的免疫逃逸和免疫不应答相关[46-47]。此外,肠道黏膜固有层内还有IgA源性浆细胞产生大量分泌型IgA,它附着在小肠内分节丝状菌上,并与细菌、病毒和毒素等相结合,在肠道黏膜中发挥重要作用[48]。简言之,肠道内失调的致病菌不仅能激活肠道黏膜的免疫系统,还能诱导全身性微炎症反应,最终,加重肾脏的损伤。
2 慢性肾脏病肠道菌群失调的治疗策略
近年来,针对CKD患者体内失调的肠道菌群而改善其尿毒素蓄积和全身性微炎症反应的治疗策略已经成为国际肾脏病治疗学领域的重要进展之一。研究表明,即使是对于接受透析治疗的ESRD患者,减轻体内尿毒素蓄积也能有效地防治其心脑血管并发症[49]。
2.1 益生菌和益生元 益生菌(probiotics)是指来源于食物而对人体有益的肠道菌群,又称为“活性微生物”[50];益生元(prebiotics)是指能促进益生菌增殖的食物纤维成分,包括菊粉、低聚果糖、低聚半乳糖、大豆低聚糖、低聚木糖以及焦糊精等[51]。晚近的研究显示,益生菌和益生元可以用于纠正CKD患者肠道菌群失调。Wang[14]和Taki[15]等用乳酸菌和双歧杆菌制剂(益生菌)经口服给药而干预非透析的CKD患者和透析的尿毒症患者,结果表明,这些益生菌可以减少患者血中肠源性尿毒素硫酸吲哚酚和对甲酚含量,抑制全身性微炎症反应,延缓肾功能恶化。同样,Salmean[16]和Meijers[17]等把益生元——菊粉(inulin)给予非透析的CKD患者和透析的尿毒症患者,结果显示,患者血中尿素氮和对甲酚硫酸含量明显下降。对于肾功能不全的模型鼠,经灌胃给予低聚半乳糖(galacto-oligosaccharides),这种益生元不仅可以纠正肠道菌群失调,还可以减少肠道内吲哚和血中硫酸吲哚酚含量[52]。Vaziri等报道,富含直链抗性淀粉(high amylose resistant starch)的食物(益生元)可以改善CKD患者氧化应激状态和肾脏炎症性损伤[53]。
2.2 缓泻剂 CKD患者往往因肠道蠕动迟缓而伴有便秘,大肠内容物停留时间过长而易于腐烂,这些因素导致肠道内环境紊乱和肠源性尿毒素过度生成。因此,改善CKD患者便秘也是肠道菌群失调的治疗策略之一。鲁比前列酮(lubiprostone)可活化小肠上皮细胞膜上的氯离子通道而使肠液分泌增多,具有促进大肠内容物蠕动而缓泻的效果。Mishima等发现,对于肾功能不全的模型鼠,经典的缓泻药——鲁比前列酮不仅能增加肠液分泌,而且,能改善肠道纤维化和肠道内减少的益生菌(双歧杆菌和普氏菌),此外,还能减少血中硫酸吲哚酚等肠源性尿毒素的含量,减轻肾脏纤维化和炎症性损伤[18]。
2.3 活性炭吸附剂 肠道菌群失调的治疗策略还包括长期使用大剂量的活性炭吸附剂。AST-120是直径在0.2~0.4 mm的球形碳颗粒,它能吸附大肠中的有机化合物,包括硫酸吲哚酚、对甲酚以及食物源性糖基化终末产物[19]。研究显示,AST-120经口服可以有效地在大肠内吸附肠道菌群生成的尿毒素前体物质——吲哚和对甲酚,因此,硫酸吲哚酚和对甲酚硫酸的产生显著减少,患者血液中尿毒素浓度明显下降,CKD进展得到延缓[20]。在2009年实施的小规模临床研究中,Maeda等报道[19],非透析的CKD患者经AST-120干预后,其血清尿素氮浓度下降,CKD进展得到缓解。但是,2015年,针对中、晚期非透析的CKD患者而实施的大规模EPPIC研究中,与对照组相比,AST-120抑制CKD进展的效果并未得到公认。究其原因,一是没有坚持大剂量AST-120内服;二是受到AST-120相关性便秘的不良影响[20]。因此,开发新型的尿毒素吸附剂是今后的发展方向之一。
3 中药对肠道菌群失调的干预作用
无论是单味中药、中药复方还是中药提取物,大多数是经口服或肠道给药的。因此,中药中各种有效成分进入肠道以后就有可能与肠道菌群相互作用,在一定程度上发挥调节肠道细菌,保护肠道上皮屏障,减轻尿毒素蓄积,延缓CKD进展的作用[54]。
3.1 中药调节肠道菌群 2015年,Guo等在体外研究中发现,红参和薏苡仁提取物均能促进乳酸菌、双歧杆菌等益生菌生长,还能抑制大肠埃希氏菌、葡萄球菌和沙门菌等病原菌的生长;作者同时建立三硝基苯磺酸诱导的溃疡性结肠炎动物模型,结果显示,红参和薏苡仁提取物在体内也能改善模型鼠肠道菌群失调和结肠炎症[55]。Chang等报道[56],高脂饲料可诱导肥胖小鼠肠道内厚壁菌/拟杆菌比例升高,还可提高产内毒素的蛋白菌水平,但是,若将灵芝提取物和高脂饲料混合饲养,不但可以调整肥胖小鼠肠道内的硬壁菌、拟杆菌和蛋白菌水平,还可以保持肠道上皮屏障的完整性。孙立群等探讨黄芪纳米制剂对溃疡性结肠炎大鼠肠道菌群的调节作用;作者将60只大鼠随机分为正常组、溃疡性结肠炎模型组、自然恢复组、纳米黄芪组、丽珠肠乐(益生菌制剂)组,各组大鼠经灌胃给药,干预7 d;结果表明,纳米黄芪组和丽珠肠乐组大鼠的肠道内双歧杆菌﹑乳酸菌含量明显上升,而肠球菌和肠杆菌含量显著下降;作者认为,纳米黄芪和丽珠肠乐对溃疡性结肠炎大鼠肠道菌群失调有调节作用,而且,黄芪纳米制剂优于丽珠肠乐[57]。胡新俊等用盐酸林可霉素建立肠道菌群失调的小鼠模型;作者发现,模型鼠肠道菌群数量发生明显改变,其中,双歧杆菌、乳酸菌数量明显下降,而大肠埃希菌、肠球菌数量显著升高;此外,模型鼠肠道黏膜微绒毛稀疏、断裂,肠道上皮屏障功能被破坏;然而,模型鼠经马齿苋多糖灌胃干预后,其失调的肠道菌群和受损的肠道黏膜均得到不同程度的改善[58]。同样,冯兴忠等用加味补中益气丸(黄芪、人参、白术、陈皮、柴胡、升麻、当归、甘草、黄连、薏苡仁)干预相同的小鼠模型,作者发现,加味补中益气丸也有调节小鼠肠道益生菌的作用[59]。此外,健脾益气的代表性中药——黄芪、党参和茯苓有类似益生元的作用,如黄芪能增加大鼠肠道内乳酸菌、双歧杆菌,减少肠球菌、肠杆菌数量;党参能增加乳酸菌数量;茯苓能增加双歧杆菌数量等[54]。
3.2 中药保护肠道上皮屏障 张英谦等观察大黄对脓毒症幼猪肠道屏障的保护作用;作者发现,大黄治疗组幼猪肠道上皮细胞间的紧密连接相对完整,细胞凋亡明显减轻,紧密连接蛋白 ZO-1和occludin核酸(mRNA)表达明显增强,与模型组比较,其差异均有显著性(P<0.05)[60]。卢璐等探讨清肠栓(参三七、马齿苋、五倍子等)對三硝基苯磺酸诱导的溃疡性结肠炎大鼠结肠黏膜通透性的影响;作者采用异硫氰酸荧光素-右旋糖4000作为结肠通透性的特异标记物,观察模型鼠结肠通透性,结果显示,清肠栓能有效地改善溃疡性结肠炎模型鼠结肠通透性,恢复结肠上皮屏障功能[61]。
3.3 中药减轻尿毒素蓄积,延缓CKD进展 研究表明,除外调节肠道菌群,保护肠道上皮屏障的作用,针对中、晚期CKD患者或尿毒症动物模型,中药结肠给药(灌肠)还能在一定程度上减轻尿毒素蓄积,延缓CKD进展[62]。邹川等收集37例非透析治疗的CKD 5期患者,将其分为灌肠组(20例)和对照组(17例),对照组患者只采取基础治疗措施,如优质低蛋白饮食、控制血压、降低高血糖、纠正酸碱平衡和钙磷代谢紊乱等,灌肠组患者在基础治疗的前提下加用中药结肠洗液(大黄、蒲公英、牡蛎等)灌肠治疗2周;结果显示,与治疗前比较,灌肠组患者血液中的水溶性尿毒素——肌酐、尿素氮、尿酸水平明显下降,结肠内大肠杆菌数量明显减少,双歧杆菌和乳杆菌数量显著升高,与治疗前或对照组患者相比,其差异均有显著性(P<0.05或P<0.01);此外,作者还发现,灌肠组患者血液中的D乳酸(肠道通透性的经典指标)水平与治疗前相比也明显改善[63]。Zeng等建立5/6肾切除尿毒症大鼠模型,用0.4%羧甲基纤维素钠水溶液和大黄素水溶液联合给尿毒症模型鼠灌肠(灌肠组),并且,与仅接受0.4%羧甲基纤维素钠水溶液灌肠的尿毒症模型鼠相对照(对照组);结果显示,尿毒症模型鼠的体重、血红蛋白、肌酐清除率均明显下降,而血中蛋白结合性尿毒素硫酸吲哚酚和尿素氮的含量显著升高,肠道内大肠杆菌、产气荚膜梭菌数量显著升高,乳酸菌数量明显降低;经0.4%羧甲基纤维素钠水溶液和大黄素水溶液灌肠干预28 d后,与对照组相比,灌肠组大鼠肠内乳酸菌数量有所增加,大肠杆菌和产气荚膜梭菌数量有所降低,蛋白结合性尿毒素硫酸吲哚酚含量显著降低,同时,其肌酐清除率和血清尿素氮水平明显改善[64]。
程新等发现,中药复方制剂肾衰康(煅牡蛎、枳壳、丹参、大黄、土茯苓)中各组分中药在体外可以不同程度地吸附水溶性尿毒素——尿素氮、肌酐和尿酸。首先,作者采用各组分中药配制成水煎剂(50,100,150 g·L-1),并且,把相应中药焙干研末配制成药粉,然后,在不同时间(30,60,90,120 min)内把不同浓度的2種剂型的中药与尿毒素混合液标准品共同作用,观察这些组分中药对尿毒素的影响;结果显示,对于水煎剂,煅牡蛎水煎剂(50 g·L-1)对尿素氮、肌酐的吸附与对照组比较,差异有显著性(P<0.05);枳壳水煎剂(50 g·L-1)对尿素氮的吸附与对照组比较,差异有显著性(P<0.05)。土茯苓、丹参、大黄水煎剂在100 g·L-1下吸附率才有改变;而各种中药焙剂在50 g·L-1下其吸附率与对照组比较,差异有显著性(P<0.05或P<0.01);枳壳、大黄、茯苓各剂量组的水煎剂和焙剂对尿素氮吸附率的差异无显著性,而对肌酐、尿酸的吸附率的差异均有非常显著性(P<0.01);作者认为,肾衰康中5味组分中药在体外有直接吸附水溶性尿毒素的作用[65]。
综上所述,肠道菌群失调是中、晚期CKD进展至尿毒症的高危因素之一,其特征就是益生菌减少、能产生尿毒素的条件致病菌(产尿素酶菌群、产内毒素菌群以及产代谢毒素菌群)增多;失调的肠道菌群通过加剧尿毒素蓄积和诱导全身性微炎症反应等途径加重肾脏的损伤。这就是“肠-肾轴”学说和“慢性肾脏病-结肠轴”概念的核心观点。基于此,肠道菌群失调的治疗策略和药物的干预作用受到国内外学者的高度关注。初步的临床试验和动物实验的结果显示,益生菌、益生元、鲁比前列酮以及活性炭吸附剂等都可以针对CKD患者体内失调的肠道菌群而改善肾功能。不仅如此,一些经口服或肠道给药的单味中药(黄芪、党参以及茯苓等)、中药复方(肾衰康、清肠栓以及结肠洗液等)还有中药提取物(大黄素、马齿苋多糖以及红参、薏苡仁、灵芝提取物等)在一定程度上也能调节肠道细菌,保护肠道上皮屏障,减轻尿毒素蓄积,延缓CKD进展(图2)。
然而,笔者认为,关于“肠-肾轴”学说和“慢性肾脏病-结肠轴”概念,还有很多关键问题尚未阐明。首先,在CKD进展过程中,肠道菌群失调导致肠道微生态紊乱,但是,它是促进CKD患者肾功能恶化的直接原因吗?显然,决定肠道上皮屏障功能的紧密连接(tight junction)和诱导全身性微炎症反应的肠道黏膜免疫系统的活化才是肠-肾轴的关键病理机制[66],因此,以“肠组织中肠道菌群相关的病理因素(紧密连接蛋白、辅助性和调节性T细胞等)”为靶点的干预措施可能是今后相关研究的重点方向。其次,如何在多如兆计的CKD患者肠道菌群中确定有临床价值的生物标志物以及治疗所需的靶点?也就是说,在产尿素酶菌群、产内毒素菌群以及产代谢毒素菌群[67]之中,哪些条件致病菌与CKD患者肾功能恶化直接相关?第三,除外活性炭吸附剂,益生菌、益生元以及缓泻剂鲁比前列酮的确可以调整肠道内环境,但是,这些生物制剂,还有上述的单味中药、中药复方和中药提取物能够显著地降低中、晚期CKD患者体内的氮质代谢产物(经典的肾功能指标)吗?目前,尚缺乏令人信服的临床证据。众所周知,对于中、晚期CKD(慢性肾衰竭)患者体内尿毒素蓄积,中医药的通用治则是“通腑泄浊”,其代表性药物包括大黄、大黄类经方及其有效成分(大黄酸、大黄素等)[68]。的确,大黄具有“荡涤肠胃,通利水谷,安和五脏,推陈出新”的功效(《中华本草》),但是,它的归经不在肾经,而在脾、胃、大肠、肝、心包经等。为何不归属肾经的中药却有治肾的效果?基于“肠-肾轴”学说,这一古老的中医关键科学问题很可能产生新的答案。因此,笔者推测,大黄改善中、晚期CKD患者体内尿毒素蓄积的靶点不是肾脏!这个假说若能得到证实,将会颠覆中医肾脏病学的传统认识。笔者所属团队的前期研究表明,对于5/6肾切除诱导的肾衰竭大鼠模型,其肠道内双歧杆菌、乳酸菌减少,大肠杆菌、粪肠球菌增多;肠道上皮组织出现溃疡性病变并伴有TJP蛋白表达水平下调;肠道黏膜组织内辅助性和调节性T细胞活化并伴有炎症因子的高表达;此外,模型鼠肠道组织内Toll 样膜受体(Toll-like receptor,TLR)4/髓样分化因子(myeloid differentiation factor88,MyD88)/核因子(nuclear factor,NF)-κB信号通路[69]激活;经一定剂量的日本汉方制剂——大黄甘草汤(浓缩颗粒TJ-84)[70]或鲁比前列酮灌肠干预,不仅使肾衰竭模型鼠的肾功能指标得到明显改善,而且,失调的肠道菌群、受损的肠道屏障和免疫功能有一定程度的好转,其机制可能与干预肠道TLR4/MyD88/NF-κB信号通路活性有关[71]。这一初步研究结果提示,对于肾衰竭模型鼠而言,大黄类经方——“大黄甘草汤”改善其体内尿毒素蓄积的靶点可能是“肠道菌群所启动的肠-肾轴”。
[参考文献]
[1] Glenwright A J,Pothula K R,Bhamidimarri S P,et al. Structural basis for nutrient acquisition by dominant members of the human gut microbiota[J]. Nature,2017,541(7637):407.
[2] Tropini C,Earle K A,Huang K C,et al. The gut microbiome:connecting spatial organization to function [J]. Cell Host Microbe,2017,21(4):433.
[3] 三島英換,福田真嗣,阿部高明. 腸内細菌と慢性腎臓病[J]. 日本抗加齢醫学会雑誌,2016,12(1):18.
[4] Erny D,Prinz M. Microbiology:gut microbes augment neurodegeneration [J]. Nature,2017,544(7650):304.
[5] Chakradhar S. A curious connection:teasing apart the link between gut microbes and lung disease [J]. Nat Med,2017,23(4):402.
[6] Strati F,Cavalieri D,Albanese D,et al. New evidences on the altered gut microbiota in autism spectrum disorders [J]. Microbiome,2017,5(1):24.
[7] Chu H,Khosravi A,Kusumawardhani I P,et al. Gene-microbiota interactions contribute to the pathogenesis of inflammatory bowel disease [J]. Science,2016,352(6289):1116.
[8] Ruan J W,Statt S,Huang C T,et al. Dual-specificity phosphatase 6 deficiency regulates gut microbiome and transcriptome response against diet-induced obesity in mice [J]. Nat Microbiol,2016,2:16220.
[9] Viennois E,Merlin D,Gewirtz A T,et al. Dietary emulsifier-induced low-grade inflammation promotes colon carcinogenesis [J]. Cancer Res,2017,77(1):27.
[10] Kelly T N,Bazzano L A,Ajami N J,et al. Gut microbiome associates with lifetime cardiovascular disease risk profile among bogalusa heart study participants [J]. Circ Res, 2016,119(8):956.
[11] Anders H J,Andersen K,Stecher B. The intestinal microbiota,a leaky gut,and abnormal immunity in kidney disease [J]. Kidney Int,2013,83(6):1010.
[12] Meijers B K,Evenepoel P. The gut-kidney axis:indoxyl sulfate,p-cresyl sulfate and CKD progression [J]. Nephrol Dial Transplant,2011,26(3):759.
[13] Pahl M V,Vaziri N D. The chronic kidney disease-colonic axis [J]. Semin Dial,2015,28(5):459.
[14] Wang I K,Wu Y Y,Yang Y F,et al. The effect of probiotics on serum levels of cytokine and endotoxin in peritoneal dialysis patients:a randomised,double-blind,placebo-controlled trial [J]. Benef Microbes,2015,6(4):423.
[15] Taki K,Takayama F,Niwa T. Beneficial effects of Bifidobacteria in a gastroresistant seamless capsule on hyperhomocysteinemia in hemodialysis patients [J]. J Ren Nutr,2005,15(1):77.
[16] Salmean Y A,Segal M S,Langkamp-Henken B,et al. Foods with added fiber lower serum creatinine levels in patients with chronic kidney disease [J]. J Ren Nutr,2013,23(2):e29.
[17] Meijers B K,De Preter V,Verbeke K,et al. p-Cresyl sulfate serum concentrations in haemodialysis patients are reduced by the prebiotic oligofructose-enriched inulin [J]. Nephrol Dial Transplant,2010,25(1):219.
[18] Mishima E,Fukuda S,Shima H,et al. Alteration of the intestinal environment by lubiprostone is associated with amelioration of adenine-induced CKD [J]. J Am Soc Nephrol,2015,26(8):1787.
[19] Schulman G,Berl T,Beck G J,et al. The effects of AST-120 on chronic kidney disease progression in the United States of America:a post hoc subgroup analysis of randomized controlled trials [J]. BMC Nephrol,2016,17(1):141.
[20] Schulman G,Berl T,Beck G J,et al. Randomized placebo-controlled EPPIC trials of AST-120 in CKD [J]. J Am Soc Nephrol,2015,26(7):1732.
[21] 祖先鹏,林璋,谢海胜,等. 中药有效成分与肠道菌群相互作用的研究进展[J]. 中国中药杂志,2016,41(10):1766.
[22] Sekirov I,Russell S L,Antunes L C,et al. Gut microbiota in health and disease[J]. Physiol Rev,2010,90(3):859.
[23] Sartor R B. Microbial influences in inflammatory bowel diseases [J]. Gastroenterology,2008,134(2):577.
[24] 刘玉婷,郝微微,温红珠,等. 肠道菌群的检测方法及研究进展[J]. 世界华人消化杂志,2016,24(20):3142.
[25] 松木隆広. ヒト腸内フローラ構成菌の定量的PCR検出法の確立および菌属·菌種分布の解析[J].日本細菌学雑誌,2007,62(2):255.
[26] 赵洁,马晨,席晓敏. 实时荧光定量PCR技術在肠道微生物领域中的研究进展[J]. 生物技术通报,2014,12(1):61.
[27] Rintala A,Pietil S,Munukka E,et al. Gut microbiota analysis results are highly dependent on the 16S rRNA gene target region,whereas the impact of DNA extraction is minor [J]. J Biomol Tech,2017,28(1):19.
[28] Fraher M H,O′Toole P W,Quigley E M. Techniques used to characterize the gut microbiota:a guide for the clinician[J]. Nat Rev Gastroenterol Hepatol,2012,9(6):312.
[29] Dobrindt U,Agerer F,Michaelis K,et al. Analysis of genome plasticity in pathogenic and commensal Escherichia coli isolates by use of DNA arrays[J]. J Bacteriol,2003,185(6):1831.
[30] Song C,Wang B,Tan J,et al. Discovery of tauroursodeoxycholic acid biotransformation enzymes from the gut microbiome of black bears using metagenomics[J]. Sci Rep,2017,7:45495.
[31] Vaziri N D,Wong J,Pahl M,et al. Chronic kidney disease alters intestinal microbial flora[J]. Kidney Int,2013,83(2):308.
[32] Wang F,Zhang P,Jiang H,et al. Gut bacterial translocation contributes to microinflammation in experimental uremia[J]. Dig Dis Sci,2012,57(11):2856.
[33] 王尊松,崔美玉,唐利军,等. 尿毒症患者肠道细菌变化的研究[J]. 中华肾病杂志,2014,30(3):172.
[34] 张盼,魏萌,蒋红利,等. 尿毒症大鼠肠道细菌移位诱发微炎性反应[J]. 中华肾病杂志,2013,29(8):611.
[35] Wu M J,Chang C S,Cheng C H,et al. Colonic transit time in long-term dialysis patients[J]. Am J Kidney Dis, 2004,44(2):322.
[36] Evenepoel P,Meijers B K,Bammens B R, et al. Uremic toxins originating from colonic microbial metabolism[J]. Kidney Int,2009(114):S12.
[37] Tang W H,Wang Z,Kennedy D J,et al. Gut microbiota-dependent trimethylamine N-oxide(TMAO)pathway contributes to both development of renal insufficiency and mortality risk in chronic kidney disease[J]. Circ Res,2015,116(3):448.
[38] Lekawanvijit S. Role of gut-derived protein-bound uremic toxins in cardiorenal syndrome and potential treatment modalities[J]. Circ J,2015,79(10):2088.
[39] Aronov P A,Luo F J,Plummer N S,et al. Colonic contribution to uremic solutes[J]. J Am Soc Nephrol,2011,22(9):1769.
[40] Poesen R,Windey K,Neven E,et al. The influence of CKD on colonic microbial metabolism[J]. J Am Soc Nephrol,2016,27(5):1389.
[41] Vaziri N D,Goshtasbi N,Yuan J,et al. Uremic plasma impairs barrier function and depletes the tight junction protein constituents of intestinal epithelium[J]. Am J Nephrol,2012,36(5):438.
[42] Vaziri N D,Yuan J,Norris K. Role of urea in intestinal barrier dysfunction and disruption of epithelial tight junction in chronic kidney disease[J]. Am J Nephrol,2013,37(1):1.
[43] 大島茂,渡辺守. 腸管免疫と腸內細菌の密接な関わり合い[J]. 日本内科学会雑誌,2015,104(1):81.
[44] Wing M R,Patel S S,Ramezani A,et al. Gut microbiome in chronic kidney disease[J]. Exp Physiol,2016,101(4):471.
[45] Ivanov I I,Atarashi K,Manel N,et al. Induction of intestinal Th17 cells by segmented filamentous bacteria[J]. Cell,2009,139(3):485.
[46] Atarashi K,Tanoue T,Oshima K,et al. Treg induction by a rationally selected mixture of clostridia strains from the human microbiota[J]. Nature,2013,500(7461):232.
[47] Atarashi K,Tanoue T,Shima T,et al. Induction of colonic regulatory T cells by indigenous Clostridium species[J]. Science,2011,331(6015):337.
[48] Umesaki Y,Setoyama H,Matsumoto S,et al. Differential roles of segmented filamentous bacteria and clostridia in development of the intestinal immune system[J]. Infect Immun,1999,67(7):3504.
[49] Khoury T,Tzukert K,Abel R,et al. The gut-kidney axis in chronic renal failure:a new potential target for therapy[J]. Hemodial Int,2016,doi:10.1111/hdi.12486.
[50] Homayouni-Rad A,Soroush A R,Khalili L,et al. Diabetes management by probiotics:current knowledge and future perspective[J]. Int J Vitam Nutr Res,2017,24:1.
[51] Koppe L,Fouque D. Microbiota and prebiotics modulation of uremic toxin generation[J]. Panminerva Med,2017,59(2):173.
[52] Furuse S U,Ohse T,Jo-Watanabe A,et al. Galacto-oligosaccharides attenuate renal injury with microbiota modification[J]. Physiol Rep,2014,2(7)pii:e12029.
[53] Vaziri N D,Liu S M,Lau W L,et al. High amylose resistant starch diet ameliorates oxidative stress,inflammation,and progression of chronic kidney disease[J]. PLoS ONE,2014,9(12):e114881.
[54] 姜东京,张丽,曹雨诞,等. 肠道菌群在中药研究中的应用[J]. 中国中药杂志,2016,41(17):3218.
[55] Guo M,Ding S,Zhao C,et al. Red Ginseng and Semen Coicis can improve the structure of gut microbiota and relieve the symptoms of ulcerative colitis[J]. J Ethnopharmacol,2015,162:7.
[56] Chang C J,Lin C S,Lu C C,et al. Ganoderma lucidum reduces obesity in mice by modulating the composition of the gut microbiota[J]. Nat Commun,2015,6:7489.
[57] 孙立群,梁金花,高月娟. 探讨纳米级中药黄芪对溃疡性结肠炎大鼠肠道菌群失调的调整作用[J]. 中国中医急症,2012,21(8):1263.
[58] 胡新俊,李春香,王广,等. 马齿苋多糖对肠道微生态失调小鼠的调整作用研究[J]. 中国微生态学杂志,2010,22(9):781.
[59] 冯兴忠,张娅南,姜欣,等. 加味补中益气丸促进肠道益生菌生长的实验研究[J]. 中国微生态学杂志,2008,20(2):159.
[60] 张英谦,刘建华,李佃贵,等. 大黄对脓毒症幼猪肠屏障保护作用及机制研究[J]. 中华中医药杂志,2007,22(12):843.
[61] 卢璐,谢建群. 中药清肠栓对溃疡性结肠炎大鼠结肠通透性的影响[J]. 中国中西医结合杂志,2010(10):1087.
[62] Zou C,Lu Z Y,Wu Y C,et al. Colon may provide new therapeutic targets for treatment of chronic kidney disease with Chinese medicine[J]. Chin J Integr Med,2013,19(2):86.
[63] 邹川,吴禹池,罗丽,等. 中药大黄复方灌肠对慢性肾脏病5期(非透析)肠道菌群和肠道屏障功能影响的临床研究[J]. 辽宁中医杂志,2012,39(7):1309.
[64] Zeng Y Q,Dai Z,Lu F,et al. Emodin via colonic irrigation modulates gut microbiota and reduces uremic toxins in rats with chronic kidney disease[J]. Oncotarget,2016,7(14):17468.
[65] 程新,蒋云生,陈刚. 肾衰康组成中药对低分子尿毒症毒素的体外吸附作用[J]. 实用中医药杂志,2007,23(8):486.
[66] Ramezani A,Raj D S. The gut microbiome,kidney disease,and targeted interventions[J]. J Am Soc Nephrol,2014,25(4):657.
[67] Mishima E,Fukuda S,Mukawa C,et al. Evaluation of the impact of gut microbiota on uremic solute accumulation by a CE-TOFMS-based metabolomics approach[J]. Kidney Int,2017,doi: 10.1016/j.kint.2017.02.011.
[68] Tu Y,Sun W,Wan Y G,et al.Dahuang Fuzi Decoction ameliorates tubular epithelial apoptosis and renal damage via inhibiting TGF-β1-JNK signaling pathway activation in vivo [J].J Ethnopharmacol,2014,156:115.
[69] Zhang J,Zhang J,Yu P,et al. Remote ischaemic preconditioning and sevoflurane postconditioning synergistically protect rats from myocardial injury induced by ischemia and reperfusion partly via inhibition TLR4/MyD88/NF-κB signaling pathway[J]. Cell Physiol Biochem,2017,41(1):22.
[70] Fournier-Larente J,Azelmat J,Yoshioka M,et al. The Daiokanzoto(TJ-84)kampo formulation reduces virulence factor gene expression in porphyromonas gingivalis and possesses anti-inflammatory and anti-protease activities[J]. PLoS ONE,2016,11(2):e0148860.
[71] Wan Y G,Wu W,Liu Y L,et al. Targeting gut microbiota and intestinal epithelial barrier by Dahuang Gancao Decoction(TJ-84)is associated with amelioration of renal dysfunction in chronic kidney disease [C]. Sendai(Japan):The 60th Annual Meeting of the Japanese Society of Nephrology(JSN2017),2017.
[責任编辑 张宁宁]

