氯化钠处理对原壳小球藻生长及油脂积累的影响
潘洁莉,高丽娜,赵双双,刘巧,郁吉峰,何一君,李美芽
氯化钠处理对原壳小球藻生长及油脂积累的影响
潘洁莉1,高丽娜2,赵双双2,刘巧3,郁吉峰2,何一君2,李美芽1
1 浙江中医药大学分析测试中心,浙江杭州 310053 2 浙江中医药大学生命科学学院,浙江杭州 310053 3 浙江中医药大学医学技术学院,浙江杭州 310053

潘洁莉, 高丽娜, 赵双双, 等. 氯化钠处理对原壳小球藻生长及油脂积累的影响. 生物工程学报, 2017, 33(7): 1101–1108.Pan JL, Gao LN, Zhao SS, et al. Effect of sodium chloride on growth and lipid accumulation of Chlorella protothecoides CS-41. Chin J Biotech, 2017, 33(7): 1101–1108.
采用Basal培养基,通过光学显微镜、电子显微镜、激光共聚焦显微镜以及尼罗红染色定量等方法研究了不同浓度氯化钠 (0、150、300、600 mmol/L) 对小球藻属原壳小球藻的生长状态、脂滴分布、总脂含量的影响。结果表明,添加不同浓度的氯化钠对原壳小球藻的生长有明显的影响,随着氯化钠浓度的增加,小球藻的生长速度受到明显的抑制,600 mmol/L氯化钠处理时生长几乎完全被抑制。在显微镜下观察,可见氯化钠浓度的增加会导致小球藻聚集成团,这种现象在150 mmol/L和300 mmol/L氯化钠培养下比较明显;通过电子显微镜下观察,可以发现培养初期,随着氯化钠浓度的增加,小球藻细胞壁增厚,脂滴增多。通过尼罗红染色对脂含量进行定量,处理初期脂滴的合成量在600 mmol/L时最高,但到后期,随着藻生物量的增加,150 mmol/L和300 mmol/L处理下脂合成量逐渐升高,而对照小球藻脂合成量基本不变。稳定期后,从生物量 (干重) 和脂总量来看,300 mmol/L氯化钠培养处理的小球藻虽然生物量只有对照的73.55%,但是总脂含量却是对照的2.22倍,可见一定浓度的氯化钠处理一定时间可显著提高原壳小球藻的油脂含量。
氯化钠,原壳小球藻,脂滴
微藻生物能源作为新一代生物能源,基于其绿色、环保、可再生的特性,近年来备受关注。小球藻属于绿藻门、绿球藻目卵囊藻科小球藻属,是第一种被人工分离并培养的单细胞微藻[1]。原壳小球藻是小球藻的一种,而且也是目前研究较多的一种小球藻,关于原壳小球藻最早的研究是在1967年,Katayama等研究了其在光照和黑暗条件下的光合作用效率以及油酸含量的变化[2]。原壳小球藻既可以自养也可以异养培养[3-4],异养培养只需要提供葡萄糖以及一些有机化合物作为营养来源,即可以获得较高的生物量和高的油脂含 量[5-6]。Miao等研究发现只提供葡萄糖作为碳源,对原壳小球藻进行异养培养,可以使其油脂含量比光合自养高出4倍[5,7]。目前,原壳小球藻主要用作饲料和医药材料的重要来源,近年来,也是合成生物能源的一个非常好的来源[6,8]。
为了获得高产油脂的藻株,研究者们尝试各种方法,包括从不同地方分离、筛选高产油脂藻株[9];对藻株施行基因改造或外界刺激从而获得高产油脂且生长快速的藻株[10-13]。盐胁迫是最常见的一种环境刺激。在微藻细胞中,盐胁迫可以影响脂类的合成,微藻在一定程度上都可以耐受一定的盐浓度[14-18],但是过量的盐胁迫也会影响光合作用进而影响生物量和脂合成量。对于海洋微藻盐胁迫的影响研究较多,如杜氏盐藻sp.[19]、微拟球藻[20]等,但对于淡水藻的研究则较少。氯化钠是非常廉价的盐类,同时也是营养的组成部分,通过调整培养基中氯化钠的浓度达到不影响生物量同时增加脂含量,可以大大降低生产成本。Xia等[21]研究了不同的钠盐对链带藻油脂积累的影响,结果表明氯化钠是一种有效的脂类积累的诱导剂。经过改变衣藻ArM0029A培养基中的氯化钠浓度,其脂类特别是不饱和脂肪酸的含量有显著的提高[22]。Hounslow等[23]在莱茵衣藻的氯化钠胁迫研究中发现,莱茵衣藻可以耐受100 mmol/L浓度氯化钠,而200 mmol/L以上则会导致衣藻死亡,但是不论是低浓度长时间处理还是高浓度短时间处理,衣藻中的软脂酸和亚麻酸含量均有极显著的提高。前人的研究[5-7]已经表明原壳小球藻能合成较高的脂质,随着盐碱化程度的日益严重和淡水资源的日益匮乏,发掘盐胁迫下小球藻的特色作用必然有重要的理论和经济意义。
本研究以原壳小球藻为研究对象,在基本培养基中添加不同浓度的氯化钠进行盐胁迫的处理,对其生长速度进行测定,采用细胞计数板以及光学显微镜等对其生长状态进行观察,并采用尼罗红染色定量的方法测定其不同生长阶段的生物量以及油脂含量,采用电子显微镜和激光共聚焦显微镜对其脂滴进行观察,总结其在含不同浓度氯化钠的培养基中的生长情况和油脂合成规律。
1 材料与方法
1.1 藻种
实验所用小球藻藻株CS-41由上海交通大学史贤明教授馈赠。
1.2 培养条件
培养基为改良的Basal培养基 (g/L):葡萄糖9.0,KNO31.25,KH2PO41.25,MgSO4·7H2O 1.0,EDTA 0.5,H3BO30.144 2,CaCl2·2H2O 0.088 2,MnCl2·4H2O 0.014 2,MoO30.007 1,CuSO4·5H2O 0.015 7,Co(NO3)2·6H2O 0.004 9,pH 6.1。
培养装置:美国NBS公司摇床 (型号Innova@42)。
培养条件:温度28 ℃,光照4 000 lux,摇床转速为180 r/min。
1.3 方法
1.3.1 原壳小球藻不同盐浓度下的培养
配制含NaCl终浓度分别为0、150、300和600 mmol/L的小球藻低糖培养基。将培养至对数生长期的藻液作为藻种,以5%的接种量接种到含不同盐浓度的液体培养基中,采用混养的培养方式进行培养。从接种的当天开始,每隔24 h取一次样,参考崔妍等[24]的研究方法,分别采用细胞计数以及干重法绘制小球藻生长曲线。每处理样品测定进行3次生物学重复。
1.3.2 光学显微镜观察原壳小球藻生长情况
取在含不同浓度NaCl的培养基中培养的藻细胞,每24 h取样1次,在光学显微镜下观察细胞的生长情况。
1.3.3 电子显微镜观察原壳小球藻细胞的显微结构
将原壳小球藻收集到1.5 mL离心管中, 5 000 r/min离心5 min收集藻体。弃上清后,用无菌水洗涤2次,然后加入2.5%戊二醛固定过夜,琼脂包埋,1%锇酸再固定,脱水、切片后,采用日立H-7650透射电子显微镜观察小球藻的微观结构变化。
1.3.4 激光共聚焦显微镜观察细胞中脂滴
尼罗红染料(N3013,-Aldrich公司) 用50%的DMSO (/) 配成1 µg/mL工作浓度,染色时,在一定体积的藻液中加入等体积的 1 µg/mL尼罗红染料进行染色,使得染料和DMSO终浓度分别为0.5 µg/mL和25% (/),混合均匀黑暗条件下室温放置30 min备用。
采用莱卡SP5激光共聚焦显微镜,用63倍的油镜对尼罗红染色后的小球藻进行观察,在激发光488 nm,发射光560–600 nm处捕获尼罗红荧光信号,在激发光620 nm,发射光620–700 nm处捕获叶绿体荧光信号。获得的图像采用莱卡激光共聚焦图像处理软件进行融合分析。
1.3.5 尼罗红定量小球藻中总脂含量
通过采用尼罗红荧光染料对小球藻细胞进行染色,测定荧光强度从而对单位细胞中的脂含量进行定量。测量前需对小球藻进行计数,然后采用1.3.4相同的方法对小球藻进行尼罗红染色,染色后用SpectraMax M3酶标仪测定发射波长530 nm吸收波长570 nm的荧光值。以Triolein (Supelco,PA,USA) 作为标准品,绘制标准曲线,计算不同培养时期一定数量小球藻中的脂含量,并结合小球藻不同阶段的细胞浓度以及细胞干重分别计算单位体积小球藻中的脂含量以及单位重量小球藻中的脂含量。
1.3.6 数据分析
2 结果
2.1 原壳小球藻生长曲线的绘制
分别采用细胞计数法和干重法绘制小球藻的生长曲线,见图1。可以发现原壳小球藻在接种后第3天开始进入对数生长期,对数生长期可持续3–4 d,然后进入稳定期。氯化钠的添加影响了小球藻的生长,添加氯化钠的培养基中的小球藻细胞浓度明显小于对照组 (图1A),干重同样要小(图1B)。
2.2 显微镜观察添加不同浓度氯化钠培养下的小球藻
采用光学显微镜观察了在添加不同浓度氯化钠培养基培养的小球藻,随着培养时间的延长,在含有氯化钠的培养基中培养的小球藻开始聚集成团,静置时这些细胞也更容易沉降。图2显示了培养6 d的小球藻的状态,在含有氯化钠的培养基中培养的小球藻聚团明显,随着盐浓度的提高,细胞生长减缓,单个细胞的轮廓更清晰,特别是在含600 mmol/L的氯化钠培养基中培养的小球藻,细胞周围有黑色晕圈,形态类似厚壁孢子。
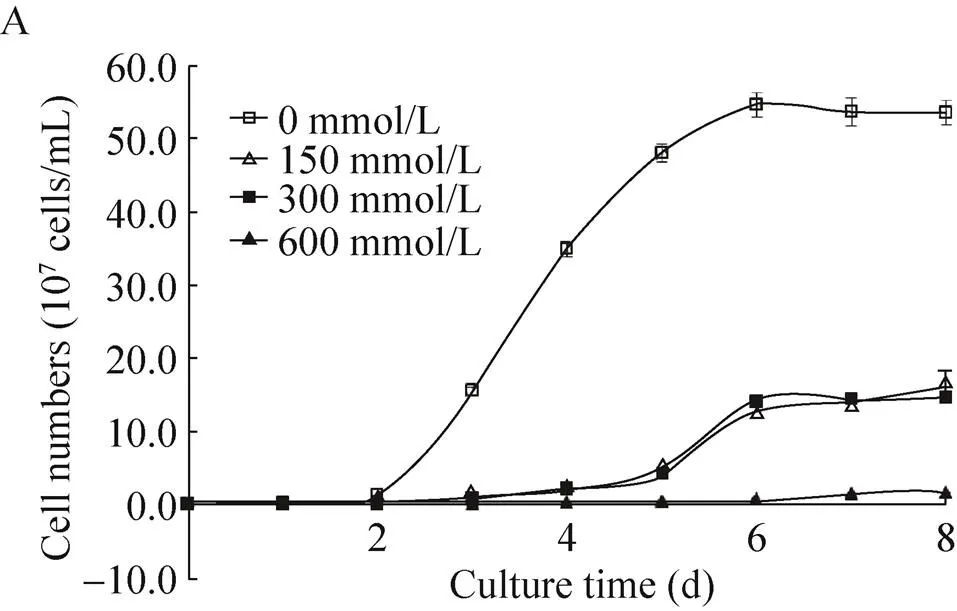

图2 显微镜下培养6 d的小球藻生长状态 (40 ×)
2.3 电镜下观察脂滴在小球藻中的分布情况
采用透射电镜观察分析了不同浓度NaCl处理下小球藻中脂滴分布情况。图3显示的是培养第3天的状态,从图中可以看出,随着盐浓度的提高,小球藻中的脂滴明显增多,并且脂滴出现聚合情况,600 mmol/L氯化钠培养下的小球藻中脂滴含量明显高于其他组,并且随着盐浓度升高,小球藻细胞壁增厚,这与光学显微镜下得到的结果相似。
2.4 激光共聚焦显微镜观察小球藻中的脂滴
通过激光共聚焦显微镜可直观地看到脂滴在小球藻细胞中的状态以及分布情况。图4显示了不同盐浓度处理3 d后藻细胞中的脂滴,高浓度的氯化钠处理下,脂滴较多,呈现较强的黄色荧光,细胞也比对照大。

图3 小球藻不同处理培养3 d的电子显微镜观察结果(CW:细胞壁;LP:脂滴)
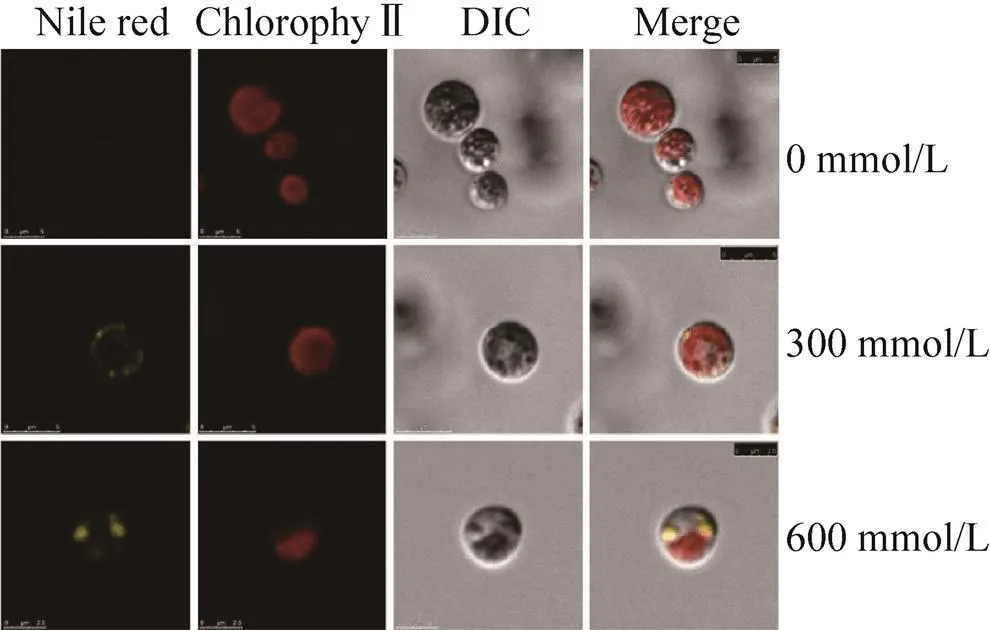
图4 激光共聚焦显微镜观察氯化钠处理3 d后的小球藻(红色为叶绿素荧光,黄色为尼罗红荧光)
2.5 小球藻中总脂含量的变化
采用尼罗红染色的方法对不同生长阶段的小球藻中的脂含量进行了定量和动态监测。结合不同时期的细胞浓度进行分析,从图5A中可以看出,与对照相比,在含氯化钠 (150、300 mmol/L)的培养基中培养的小球藻油脂总量在培养初期明显低于对照组,但进入稳定期后,则呈现持续上升的趋势,到第8天明显高于对照组,高盐浓度 (600 mmol/L) 由于严重限制了藻的生长,所以油脂含量一直偏低。结合不同时期的细胞干重进行分析,如图5B所示,在培养初期,高盐可以刺激小球藻合成脂滴,在600 mmol/L氯化钠培养下的小球藻中总脂含量明显高于其他组,随着时间的延长,总脂含量持续下降。而300 mmol/L氯化钠培养下的小球藻中总脂含量则明显上升,虽然生长速度有所限制,但是脂含量依然有显著的提高。综合两种分析方法可以看出,300 mmol/L氯化钠培养下的小球藻中总脂含量是最高的,而且趋势明显。

3 讨论
微藻的生长受环境因素的影响,其中主要有光照、温度、培养基的成分及pH等。研究发现当培养条件改变时,微藻细胞代谢途径也会受到影响。通过改变微藻培养的环境压力,能刺激细胞代谢向有利于目标的方向变化,从而达到提高目标产物产量的目的。许多生长条件对微藻细胞脂质含量的积累都可以产生影响[17],如pH、氮素的缺乏、光照、温度等培养条件,以及自养、异养和混养等培养方式。微藻种类及菌株的不同也会有很大的差异。微藻的脂质含量可占其干重的1%–7%,通常认为,在一定的环境压力下,微藻细胞分裂减缓或者停止,能导致细胞切换到脂质合成模式,以作为能量储存,从而导致了脂质含量的提高,最高可达到80%–90%,例如氮元素缺乏[18]、磷酸盐限制[14,18]或高盐度[14]等都能提高微藻的脂质含量,但是其生长速度往往受到不良影响,常常导致了细胞生长减缓或者停止,虽然脂质含量相对增加,但是微藻的生物量会大大减少,造成总脂质产量降低。因此摸索这些外界压力和细胞增殖以及脂质合成的一个平衡点,既可以让小球藻生长不受太大影响,同时也能获得较高的脂质含量。
本研究选择高盐处理淡水小球藻,通过对其不同阶段的生长状态和油脂含量的测定,发现氯化钠的处理可以显著提高小球藻中油脂含量,但对其生长也有一定的影响。从生长曲线来看,在第2–3天进入对数生长期,第6–7天进入平台期,在前期 (未进入对数生长期之前) 高浓度 (600 mmol/L) 的氯化钠处理的小球藻油脂含量明显提高,但是严重限制了藻的生长。对数生长期,没有氯化钠的培养基中的小球藻生长旺盛,而含氯化钠培养基中的小球藻生长较缓慢,并且呈现聚集现象,显微镜下可以观察到细胞成团,而且有些处于未分裂的状态,细胞个体比起对照组要大一些。此外,细胞壁明显增厚,如图3所示,含300 mmol/L氯化钠的培养基中培养的小球藻细胞壁明显厚于含150 mmol/L氯化钠的培养基中培养的小球藻。说明高浓度的盐使小球藻启动了应激模式,加固了防御屏障。从脂滴合成来看,除600 mmol/LNaCl处理的小球藻中油脂呈现先升高后降低的趋势外,其他浓度处理的小球藻均持续上升,只是幅度有所不同,对照组中上升幅度较低,将细胞生物量干重与油脂总量与对照进行相对比较分析见图5B,可以发现,进入平台期后150 mmol/L和300 mmol/L氯化钠处理的小球藻中油脂含量持续上升,300 mmol/L氯化钠处理的小球藻中油脂含量上升幅度最大。稳定后期 (大于8 d) 细胞聚集明显,计数困难,因此没有继续进行油脂含量的测定。从培养相同天数的细胞干重和总脂含量来看,稳定期300 mmol/L氯化钠处理的小球藻细胞干重虽然只有对照的73.55%,但是总脂含量却提高了2.22倍。按细胞浓度与总脂含量来分析,每毫升藻液中油脂含量比对照增加了58.78%。综合分析,300 mmol/L氯化钠处理的小球藻中油脂含量有明显的提高。
通过本研究,我们发现一定浓度的氯化钠胁迫虽然减缓了小球藻的生长,但能显著提高小球藻中的油脂积累,培养时间和处理浓度与小球藻中油脂积累呈现一定的规律。Wan等[15]研究了铁盐对中油脂合成的影响,发现油脂合成从12%增加到了33%,并且通过Q-PCR发现铁盐的添加对脂代谢途径相关基因表达有一定的影响。结合我们的研究结果,钠盐的添加是否也是影响原壳小球藻脂合成途径相关基因的表达从而影响小球藻脂质合成的差异,还有待进一步研究。
REFERENCES
[1] Manuel ME. The cultivation ofsp.Plant Physiol, 1944, 19(2): 359–369.
[2] Katayama M, Benson AA. α-linolenate and photosynthetic activity in. Plant Physiol, 1967, 42(3): 308–313.
[3] ShiXM, Zhang XW, Chen F. Heterotrophic production of biomass and lutein byon various nitrogen sources. Enzyme Microb Technol, 2000, 27(3/5): 312–318.
[4] ShiXM, Chen F. High-yield production of lutein by the green microalgain heterotrophic fed-batch culture. Biotechnol Prog, 2002, 18(4): 723–727.
[5] MiaoXL, Wu QY. High yield bio-oil production from fast pyrolysis by metabolic controlling of. J Biotechnol, 2004, 110(1): 85–93.
[6] Heredia-ArroyoT, Wei W, HuB. Oil accumulation via heterotrophic/mixotrophic.Appl Biochem Biotechnol, 2010, 162(7): 1978–1995.
[7] MiaoXL, Wu QY. Biodiesel production from heterotrophic microalgal oil. Bioresour Technol, 2006, 97(6): 841–846.
[8] WeiAL,Zhang XW, Wei D, et al. Effects of cassava starch hydrolysate on cell growth and lipid accumulation of the heterotrophic microalgae. J Ind Microbiol Biotechnol, 2009, 36(11): 1383–1389.
[9] Cui J. Microalgae for oil: strain selection, robustness assessment and induction of lipid synthesis[D]. Qingdao: Insititute of Oceanology, Chinese Academy of Sciences, 2012 (in Chinese).崔静. 产油微藻的筛选评价与诱导油脂积累研 究[D]. 青岛: 中国科学院海洋研究所, 2012.
[10] Irshad A, Anil KS, Henry D, et al. Altered lipid composition and enhanced lipid production in green microalga by introduction of brassica diacylglycerol acyltransferase 2. Plant Biotechnol J, 2015, 13(4): 540–550.
[11] James GO, Hocart CH, Hillier W, et al. Temperature modulation of fatty acid profiles for biofuel production in nitrogen deprived. Bioresour Technol, 2013, 127: 441–447.
[12] Mata TM, Martins AA, Caetano NS. Microalgae for biodiesel production and other applications: a review. Renew Sustain Energy Rev, 2010, 14: 217–232.
[13] Lin H, Wang Q, Shen Q, et al. Genetic engineering of microorganisms for biodiesel production. Bioengineered, 2013, 4(5): 292–304.
[14] Rao AR, Dayananda C, Sarada R, et al. Effect of salinity on growth of green algaand its constituents. Bioresour Technol, 2007, 98(3): 560–564.
[15] Wan MX, Jin XJ, Xia JL, et al. The effect of iron on growth, lipid accumulation, and gene expression profile of the freshwater microalga. Appl Microbiol Biotechnol, 2014, 98(22): 9473–9481.
[16] Concas A, Steriti A, Pisu M, et al. Comprehensive modeling and investigation of the effect of iron on the growth rate and lipid accumulation ofcultured in batch photobioreactors. Bioresour Technol, 2014, 153: 340–350.
[17] Xu YJ, Lin JD. Effect of temperature, salinity, and light intensity on the growth of the green macroalga,. J World Aquac Soc, 2008, 39(6): 847–851.
[18] Xin L, Hu HY, Ke G, et al. Effects of different nitrogen and phosphorus concentrations on the growth, nutrient uptake, and lipid accumulation of a freshwater microalgasp.. Bioresour Technol, 2010, 101(14): 5494–5500.
[19] Azachi M, Sadka A, Fisher M, et al. Salt induction of fatty acid elongase and membrane lipid modifications in the extreme halotolerant alga. Plant Physiol, 2002, 129: 1320–1329.
[20] Bartley MI, Boeing WJ, Corcoran AA, et al. Effects of salinity on growth and lipid accumulation of biofuel microalgaand invading organisms. Biomass Bioenerg, 2013, 54: 83–88.
[21] Xia L, Rong JF, Yang HJ, et al. NaCl as an effective inducer for lipid accumulation in freshwater microalgae. Bioresour Technol, 2014, 161C(11): 402–409.
[22] Ahn JW, Hwangbo K, Yin CJ, et al. Salinity-dependent changes in growth and fatty acid composition of new Arcticsepcies. ArM0029A. Plant Cell Tissue Organ Cult, 2015, 120(3):1015–1021.
[23] Hounslow E, Kapoore RV, Vaidyanathan S, et al. The search for a lipid trigger: the effect of salt stress on the lipid profile of the model microalgal speciesfor biofuels production. Curr Biotechnol, 2016, 5(4): 305–313.
[24] Cui Y, Li MY, Shi CL, et al. A comparative study of rapid determination methods for biomass ofCS-41. Food Sci, 2012,33(2): 253–257 (in Chinese).崔妍, 李美芽, 施春雷, 等. 原壳小球藻生物量快速测定方法的对比研究. 食品科学, 2012, 33(2): 253–257.
(本文责编 郝丽芳)
Effect of sodium chloride on growth and lipid accumulation ofCS-41
Jieli Pan1, Li’na Gao2, Shuangshuang Zhao2, Qiao Liu3, Jifeng Yu2, Yijun He2, and Meiya Li1
1,,310053,,2,,310053,,College of Medical TechnologyZhejiang Chinese Medical UniversityHangzhouZhejiangChina
With basal medium, we studied the growth status, lipid droplet distribution, total lipid content ofCS-41 treated with different concentrations of sodium chloride (0, 150, 300 and 600 mmol/L) by optical microscopy, electron microscopy, confocal laser focusing and Nile red staining. Results show that the addition of NaCl affected the growth ofCS-41. With the increase of NaCl concentration, the growth rate ofwas inhibited.cell wall became thicker, and lipid droplets increased. At the early stage, the amount of lipid droplets in the 600 mmol/L NaCl culture was the highest, but at the late-log stage, the amount of lipid droplets increased with the increase of the biomass of culture in 150 and 300 mmol/L NaCl culture. At the stable stage, biomass (dry weight) in 300 mmol/L NaCl culture was 73.55% of that in the control, but the total lipid content was 2.22 times higher than that in the control. A certain concentration of sodium chloride treatment can significantly increase the lipid content ofCS-41.
sodium chloride,CS-41, lipid droplet
December 13, 2016; Accepted:May 10, 2017
Meiya Li. Tel: +86-571-86613589; Fax: +86-571-86633176; E-mail: lmeiya@126.com
Supported by:Science and Technology Project of Zhejiang Province (No. 2015C32084).
浙江省科技计划项目(No. 2015C32084) 资助。
网络出版时间:2017-05-17
http://kns.cnki.net/kcms/detail/11.1998.Q.20170517.1505.004.html

