2013-2015年山东乳山市人民医院鲍曼不动杆菌耐药性监测
仇祝强, 祝丽晶, 刘 成, 孙 宁, 侯盼飞
2013-2015年山东乳山市人民医院鲍曼不动杆菌耐药性监测
仇祝强, 祝丽晶*, 刘 成, 孙 宁**, 侯盼飞
目的 对山东乳山市人民医院近3年住院患者分离鲍曼不动杆菌的临床分布、耐药性及同源性进行分析,为控制医院感染提供依据。方法 收集2013-2015年住院患者送检临床标本中分离的鲍曼不动杆菌,分析其分布情况和耐药性变化趋势。随机选取60株菌株采用脉冲场凝胶电泳(PFGE)法进行同源性分析。结果 3年间共分离出鲍曼不动杆菌567株,检出数逐年升高,3年分别为85株、156株、326株;标本来源以呼吸科和ICU为主,分别占47.4 %和23.8 %;标本种类以痰液为主,占62.1 %,其次为分泌物15.2 %。药敏结果显示鲍曼不动杆菌对多黏菌素B均敏感,对甲氧苄啶-磺胺甲唑、氨苄西林100 %耐药,3年显示对亚胺培南、美罗培南、头孢曲松、甲氧苄啶-磺胺甲唑耐药率有显著升高,对庆大霉素耐药率显著下降。选取的60株鲍曼不动杆菌根据PFGE 图谱可分为4型,A 型为主要流行株。结论 鲍曼不动杆菌主要分离自呼吸道感染住院患者,其对常用抗菌药物耐药严重,且存在克隆播散。
鲍曼不动杆菌; 临床分布; 耐药性; 同源性
鲍曼不动杆菌广泛分布于自然界、人体皮肤和医院环境中,是临床常见的条件致病菌,也是医院感染最主要的病原菌之一,它能天然抵抗多种抗菌药物,容易变异而形成多重耐药菌,给临床治疗带来了极大的困扰[1]。随着抗菌药物的大量使用,鲍曼不动杆菌的耐药性也越来越严重,多重耐药、广泛耐药甚至全耐药菌株不断出现[2]。为了解鲍曼不动杆菌感染的分布情况及其对抗菌药物的耐药性,现对2013-2015年山东乳山市人民医院住院患者送检的各类临床标本中分离的鲍曼不动杆菌资料进行分析,为临床用药、控制医院感染提供参考,现报道如下。
1 材料与方法
1.1 菌株来源
收集2013年1月1日-2015年12月31日本医院住院患者中分离的鲍曼不动杆菌567株(剔除同一患者同一部位的重复菌株)。来自男性329株(58.0 %),女性238株(42.0 %)。患者年龄36~89岁,平均73岁。
1.2 仪器与试剂
VITEK 2-Compact细菌鉴定分析仪、Heal Force 212UV二氧化碳培养箱(法国生物梅里埃公司);CHEF-MapperXA 型脉冲电泳仪(美国 BioRad 公司),凝胶成像仪(上海天能科技有限公司)。药敏纸片和水解酪蛋白(MH)琼脂平皿为英国OXOID公司产品。
1.3 药敏试验
所有临床标本均按照《全国临床检验操作规程》第3版的要求进行分离培养,挑取可疑单个菌落后采用VITEK 2- Compact细菌鉴定分析仪进行病原菌的鉴定。药敏试验采用纸片扩散(K-B)法,试验的操作步骤及结果判断按照CLSI 2012年标准执行。质控菌株为铜绿假单胞菌ATCC27853。
1.4 脉冲场凝胶电泳(PFGE)行同源性分析
对567株鲍曼不动杆菌按检出时间排序编号,采用等距随机抽样方法选取60株细菌进行同源性分析。制备1 %低熔点胶,54 ℃蛋白酶K消化3 h,水、Tris-EDTA缓冲液各洗涤3次,40 U限制性内切酶ApaI于37 ℃酶切3 h,置于2 200 mL 0.5×TBE缓冲液电泳,条件:温度14 ℃, 电压6 V/cm,夹角120°,脉冲时间5~20 s,电泳20 h。电泳后溴化乙啶( EB) 染色,紫外灯观察结果。分型标准参照文献[3]。
1.5 统计处理
采用SAS 8.0统计软件进行统计学分析。
2 结果
2.1 菌株分布
3年共收集鲍曼不动杆菌567株,其中2013年85株,2014年156株,2015年326株,检出数量逐年增多。标本来源:痰液标本352株(62.1 %),分泌物标本86株(15.2 %),尿液标本59株(10.4 %),血液标本29株(5.1 %),其他标本41株(7.2 %)。科室分布:呼吸科269株(47.4 %),ICU 135株(23.8 %),神经外科 68株(12.0 %),胸外科43株(7.6 %),消化科26株(4.6 %),其他科室共26株(4.6 %)。
2.2 药敏结果
鲍曼不动杆菌对多黏菌素B均敏感,对甲氧苄啶-磺胺甲唑、哌拉西林、氨苄西林、环丙沙星、头孢曲松耐药率均较高,甚至达100 %,3年来对亚胺培南、美罗培南、头孢曲松、左氧氟沙星、甲氧苄啶-磺胺甲唑耐药率显著升高,增幅超过20 %;对庆大霉素耐药率显著下降(15.8 %),对阿米卡星、哌拉西林也有小幅下降。见表1。
2.3 同源性分析
60株鲍曼不动杆菌主要分为4型,分别用A、B、C、D表示,其中A型41株、B型11株、C型4株、D型4株,A型又被细分为A1、A2、A3共3种亚型,部分菌株PFGE图谱见图1。
3 讨论
鲍曼不动杆菌为医院感染常见病原菌,在检出的革兰阴性菌中仅次于铜绿假单胞菌和大肠埃希菌,居第3位[4]。2015年CHINET细菌耐药性监测从全国20所医院中检出鲍曼不动杆菌8 876株,仅次于大肠埃希菌和克雷伯菌属[5]。从2013年至2015年本院住院患者鲍曼不动杆菌检出数量逐年上升,检出的567株鲍曼不动杆菌中,从标本来源来看,痰液标本占62.1 %,分泌物标本占15.2 %,尿液标本占10.4 %,与之前国内文献报道基本一致[6-7]。从科室分布来看,呼吸科、ICU分别占47.4 %、23.8 %,这与患者基础疾病较多、免疫力低下及常进行侵袭性操作有关。这也提示临床医务人员应加强手卫生、严格遵守无菌操作规程,阻断鲍曼不动杆菌的传播途径,从而有效地降低感染率。
鲍曼不动杆菌耐药机制非常复杂,主要包括青霉素结合蛋白改变、产生灭活酶(如苯唑西林酶、金属β内酰胺酶等)、外排泵过表达、外膜通透性降低等。在多重耐药菌株中,这几种因素可能同时存在[8]。碳青霉烯类药物一直被认为是治疗鲍曼不动杆菌感染的首选药物,随着耐药率逐年上升,耐碳青霉烯类鲍曼不动杆菌成为临床抗感染治疗的一大难题。本院2015年鲍曼不动杆菌对亚胺培南、美罗培南耐药率均达50 %以上,与国内监测数据基本一致[2,6,9];含酶抑制剂复合制剂也是治疗鲍曼不动杆菌的重要药物,本研究结果也显示哌拉西林-他唑巴坦体外抑菌效果明显优于单独哌拉西林,与CHINET数据相吻合[6]。3年间鲍曼不动杆菌对头孢曲松、左氧氟沙星耐药率增幅也超过20 %,应引起临床重视。与CHINET监测数据不同,对甲氧苄啶-磺胺甲唑耐药率较高且呈上升趋势;所有菌株对多黏菌素B均敏感,提示多黏菌素在我国上市后,可能成为治疗多重耐药鲍曼不动杆菌感染的重要药物。2015年所检测细菌除对多黏菌素B均敏感外,对氨基糖苷类庆大霉素(43.6 %)、阿米卡星(50.6 %)耐药率相对较低,可能与我院较少使用此类药物有关。朱军东等[10]通过临床试验证实雾化吸入阿米卡星在治疗鲍曼不动杆菌呼吸机相关性肺炎临床效果较好,并且对肾功能无明显影响,是一种安全有效的治疗方法。这或许为多重耐药鲍曼不动杆菌的治疗提供新的方法和思路。
目前,国内外常用的病原菌分子生物学水平的分型方法主要有核糖体分型、质粒分型、随机引物PCR(AP-PCR)、PFGE分型、扩增限制性片段长度多态性分析(RFLP)和ERIC-PCR分型等[11-12]。PFGE分型指纹图谱图像分辨力强,结果辨识度和重复性好,操作标准化,并且有成熟分型结果数据库,PFGE被国内外分子流行病学者广泛认同,被认为是病原菌分子生物分型的“金标准”[13]。本研究对选取的60株鲍曼不动杆菌采用PFGE分型发现,共可分为4个型,其中A型占68.3 %,为主要流行型别,广泛分布于全院各个科室,B型主要存在于呼吸科中,4株C型全部来自骨科。同型菌株可能通过被感染患者本身或与其相关的物品为媒介,在本病区甚至不同病区之间播散流行。
本研究显示我院鲍曼不动杆菌检出率、耐药率逐年升高,且存在播散流行。这要求医务工作者在临床诊疗过程要注意严格执行消毒隔离制度,对定植患者及环境要早期检测、及时处理等,预防鲍曼不动杆菌的播散流行,对感染患者尽可能根据药敏结果合理应用抗生素,以减少耐药菌的产生。
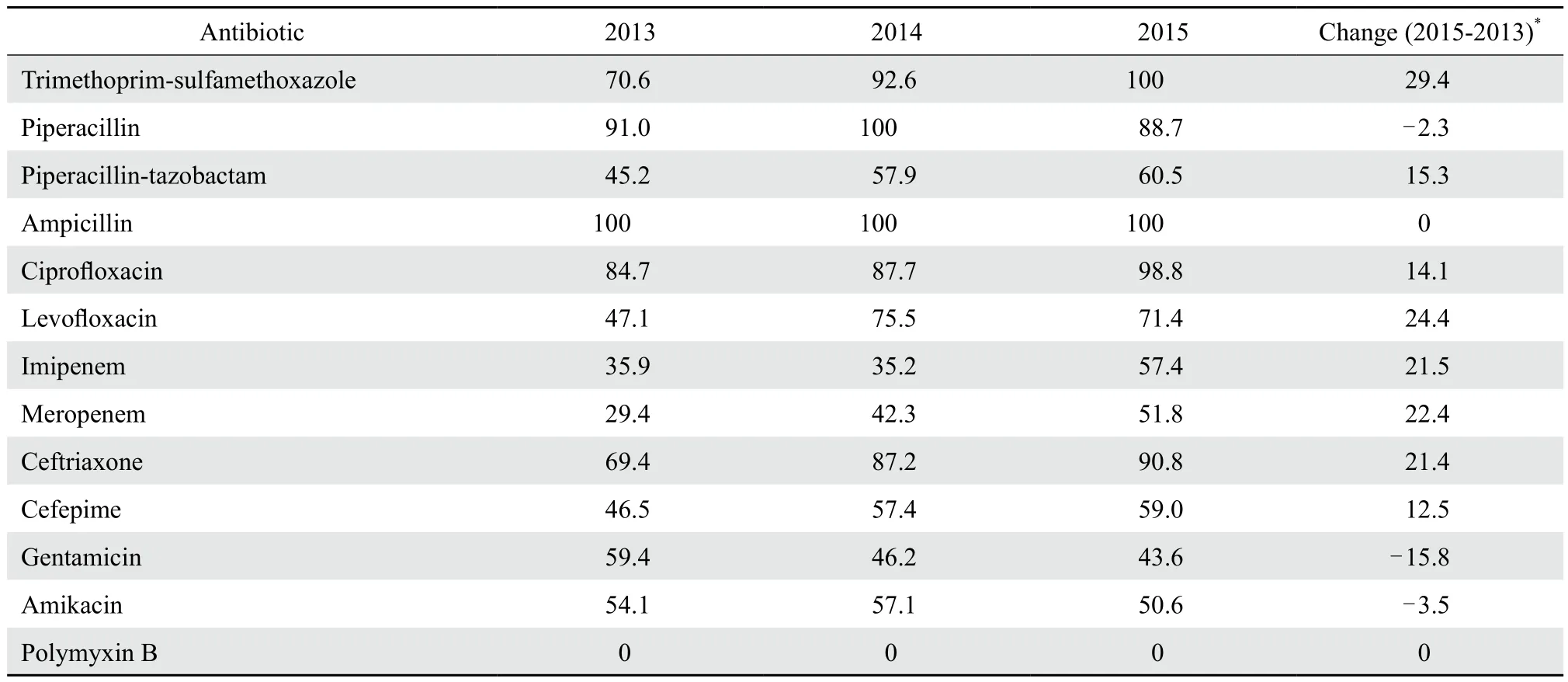
表1 2013-2015年鲍曼不动杆菌耐药率变迁Table 1 Changing resistance rates of Acinetobacter baumannii from 2013 to 2015( %)
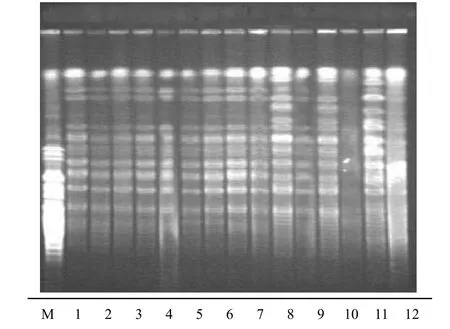
图1 部分菌株脉冲场凝胶电泳图谱Figure 1 Pulsed-f i eld gel electrophoresis patterns of some Acinetobacter baumannii isolates
[1] 陈佰义,何礼贤,胡必杰,等. 中国鲍曼不动杆菌感染诊治与防控专家共识[J]. 中国医药科学, 2012,92(8):3-8.
[2] 喻华, 刘华, 黄文芳, 等. 四川省细菌耐药监测网2012年细菌耐药性监测[J]. 中国抗生素杂志,2014,39(5):332-337.
[3] TENOVER FC,ARBEIT RD,GOERING RV,et al. Interpreting chromosomal DNA restriction patterns produced by pulsed-f i eld gel electrophoresis: criteria for bacterial strain typing[J]. J Clin Microbiol, 1995, 33( 9): 2233-2239.
[4] VAN DUIN DV, KAYERS,NEUNER EA,et al. Carbapenem-resistant Enterobaeteriaceae, a review of treatment and outcomes[J]. Diagn Microbiol Infect Dis, 2013,75(2):115-120.
[5] 胡付品,朱德妹,汪复,等. 2015年中国CH INET细菌耐药性监测[J]. 中国感染与化疗杂志, 2016,16(6):685-694.
[6] 胡付品,朱德妹,汪复,等. 2013年中国CH INET细菌耐药性监测[J]. 中国感染与化疗杂志,2014,14(5):365-374.
[7] 马冬梅,齐宏伟. 2010-2012年临床分离鲍曼不动杆菌的耐药监测[J]. 检验医学与临床,2013,10(20):2715-2716.
[8] 侯盼飞,祝丽晶,宫凌娟,等. 多重耐药鲍曼不动杆菌耐药性及AdeABC外排泵作用研究[J/CD]. 中华临床医师杂志(电子版), 2012,6(19):6060-6062.
[9] 刘薇,李禄俊,龙云,等. 2012年某院鲍曼不动杆菌感染分布及耐药性分析[J]. 国际检验医学杂志,2014,35(5):576-577.
[10] 朱军东,蒋海涛,骆建国,等. 阿米卡星在治疗鲍曼不动杆菌呼吸机相关性肺炎的价值分析[J]. 中国微生态学杂志,2015,11(27):1319-1323.
[11] ABDALHAMID B,HASSAN H,ITBAILEH A,et al. Characterization of carbapenem- resistant Acinetobacter baumannii clinical isolates in a tertiary care hospital in Saudi Arabia[J]. New Microbiol,2014,37( 1) : 65-73.
[12] 王丽丽,徐建国. 脉冲场凝胶电泳技术( PFGE) 在分子分型中的应用现状[J]. 疾病监测杂志,2006,21( 5) : 276-279.
[13] SOUZA V,MOREIRAC R,PASTERNAK J,et al. Characterizing uncommon Burkholderia cepacia complex isolates from an outbreak in a haemodialysis unit[J]. J Med Microb,2004,53( 10) : 999-1005.
Changing antimicrobial resistance prof i le of Acinetobacter baumannii in Rushan People’s Hospital from 2013 to 2015
QIU Zhuqiang, ZHU Lijing, LIU Cheng, SUN Ning, Hou Panfei. (Department of Laboratory Medicine, Rushan People's Hospital, Rushan Shandong 264500, China)
Objective To analyze the antimicrobial resistance profile and homology of the Acinetobacter baumannii strains isolated from Rushan People’s Hospital in a three-year period for better control of hospital infections. Methods A. baumannii strains were isolated from clinical specimens during the period from 2013 to 2015. Homology analysis were conducted by pulsedfi eld gel electrophoresis (PFGE) for 60 randomly selected isolates. Results A total of 567 A. baumannii isolates were isolated, 85 isolates in 2013, 156 in 2014, and 326 in 2015. These isolates were mainly from Department of Respiratory Diseases (47.4 %) and ICU (23.8 %). Overall, 62.1 % of the isolates were from sputum specimens followed by secretions (15.2%). All isolates were sensitive to polymyxin B, but all resistant to sulfamethoxazole and ampicillin. The A. baumannii isolates showed increasing resistance rate to imipenem, meropenem, ceftriaxone, and trimethoprim-sulfamethoxazole over the 3-year period, but decreasing resistance rate to gentamicin. The 60 selected isolates were grouped into 4 types by PFGE. A-type was the main pattern. Conclusions A. baumannii strains were mainly isolated from inpatients with respiratory tract infections. The A. baumannii strains showed serious antimicrobial resistance associated with possible clonal spread in this hospital.
Acinetobacter baumannii; clinical distribution; antimicrobial resistance; homology
R378
A
1009-7708 ( 2017 ) 04-0439-04
10.16718/j.1009-7708.2017.04.016
2016-12-05
2017-01-20
山东省自然科学基金项目(ZR2014HP061),山东省医药卫生科技发展项目(2013WS0066)。
乳山市人民医院检验科 ,山东乳山 264500;*呼吸科;**手术室。
仇祝强(1966—),男,本科,副主任技师,主要从事细菌耐药性监测及耐药机制研究。
侯盼飞,E-mail:panfeihou@163.com。

