12个油茶良种的SCAR分子标记鉴别
李海波,刘 勇,赵 佳,王燕飞,徐 梁,杨 明
(1. 浙江省林业科学研究院,浙江 杭州 310023;2. 浙江省安吉县林业局,浙江 安吉 313300;3. 浙江省龙泉市林场,浙江 龙泉 323700;4. 浙江省安吉县梅溪镇林业站,浙江 安吉 313300)
12个油茶良种的SCAR分子标记鉴别
李海波1,刘 勇2,赵 佳1,王燕飞3,徐 梁1,杨 明4
(1. 浙江省林业科学研究院,浙江 杭州 310023;2. 浙江省安吉县林业局,浙江 安吉 313300;3. 浙江省龙泉市林场,浙江 龙泉 323700;4. 浙江省安吉县梅溪镇林业站,浙江 安吉 313300)
以12个长林系列油茶Camellia oleifera良种为试材,基于特异性SCAR分子标记的开发来鉴别油茶品种。结果表明:基于4条SAPD引物、24对SRAP引物和15个ISSR引物分别对12个油茶品种进行扩增,得到了21条多态性片段,包括7条nSAPD,10条SRAP和4条ISSR片段。2条nSAPD,7条SRAP和2条ISSR多态性片段被成功转化为了11个稳定可靠的SCAR标记。长林油茶23号、长林26号、长林53号、长林56号和长林166号有1个SCAR标记,长林3号和长林55号各有2个SCAR标记,长林21号有4个SCAR标记,长林18号有6个SCAR标记,长林4号、长林27号和长林40号没有SCAR标记。这些SCAR标记可作为品种特异性的DNA指纹,辅助用于12个长林系列油茶良种的鉴别。
油茶;良种;品种鉴别;分子标记;SCAR;DNA指纹
油茶Camellia oleifera是我国南方重要的木本油料树种,栽培历史悠久,具有分布区域广、栽培面积大、用途多等特点,并集经济价值于一身[1],在生态经济建设中占有重要地位。早在上个世纪60年代,我国林业工作者就开展了油茶良种的选育工作,并取得了重大突破。先后选育出了一批优良的单株、无性系和家系[2],其中,具有早实、丰产和稳产特点的油茶优良无性系已作为最重要的良种资源推广应用[3]。每公顷产油量达到750 kg以上的新品系,成为油茶主栽品种[4]。近年来,油茶产业迅速发展,油茶良种苗木市场供不应求,出现了品系混杂、以假乱真、以次充好的现象。油茶无性系品种的真实性问题一直困扰油茶产业化的发展。
油茶各无性系的识别主要依赖其表观特征,但是许多形态性状的鉴定周期长、受环境影响大,而且随着无性系数量的不断增多,鉴别也愈加困难。况且,用于大面积推广的油茶芽砧苗尚不具备可用于识别的形态、生物学特征以及经济性状[2]。二十一世纪以来,分子标记技术包括随机扩增多态性DNA(Random Amplified Polymorphic DNA, RAPD)[5]、简单重复序列间区扩增多态性(Inter Simple Sequence Repeat, ISSR)[6]、相关序列扩增多态性(Sequence-Related Amplified Polymorphism, SRAP)[7]和简单序列重复(Simple Sequence Repeats,SSR)或微卫星(Microsatellite)标记[8]陆续应用于油茶的生产技术研究,为油茶优良无性系的品种鉴别与优良品系的分子选育提供一种新的技术手段[2,4,9-12]。这些分子标记中,RAPD的稳定性和可重复性较低。SSR具有多态性丰富、操作简单、结果可靠、重复性好等优点,但SSR标记的开发需要构建cDNA文库、利用转录组测序技术,还需要对SSR标记的有效性做大量筛选工作,工作量很大、成本高。而且SSR标记用于油茶品种鉴定,不仅要筛选出一组多态性良好、扩增稳定且均匀分布于染色体上的核心引物组合,并采用一个标准化的等位基因检测方法[13],还需要建立油茶已知品种的DNA数据库。
SCAR(特征性片段扩增区域,Sequence Characterized Amplified Region)标记是RAPD标记的进一步发展,它是基于对特异RAPD片段的测序,根据两端序列设计一对18 ~ 24碱基的引物,在较高的退火温度下进行特异扩增实现的[14]。随着分子标记技术的不断发展,SCAR标记的开发已不仅仅限于从RAPD发展而来。几种分子标记SRAP、ISSR)、特异扩增多态性DNA(Specifically Amplified Polymorphic DNA, SAPD)也被相继用于转化为SCAR标记。无论RAPD,还是SRAP,ISSR,SAPD都是基于通用性引物的PCR扩增,而转化为SCAR标记是特异性引物的扩增,具有稳定、简便、快速的优点,因而被广泛用于众多物种在种间或种内的高效鉴别[15-23]。
长林系列油茶品种具有早实丰产、稳产、出籽率高、含油量高、抗性强、适应性广等特性的优良无性系。选用长林系列的12个良种作为材料,首先基于SAPD,SRAP和ISSR三种引物通用型的DNA分子标记技术对12个油茶品种的基因组DNA进行大规模筛选,并进一步通过分子克隆技术开发获得油茶品种特异性的SCAR分子标记,进而达到对12个油茶品种快速鉴别的目的。该研究旨在为油茶优良无性系的准确鉴别开发一种新的分子识别方法,为油茶优良品种资源的保护提供技术支持。
1 材料与方法
1.1 实验材料
1.1.1 植物材料 12个长林系列油茶优良无性系来自浙江省林业科学研究院在浙江省武义县俞源镇钟蓬村建立的百灵谷油茶幼林基地,分别为:长林3号(CL3)、长林4号(CL4)、长林18号(CL18)、长林21号(CL21)、长林23号(CL23)、长林26号(CL26)、长林27号(CL27)、长林40号(CL40)、长林53号(CL53)、长林55号(CL55)、长林56号(CL56)、长林166号(CL166)。主要经济性状参见林萍等[4]的报道。2015年4 ~ 5月进行采样,每个油茶品种均采集3株,每株取3 ~ 5个幼嫩叶片,置于装有硅胶的密封袋干燥保存,至完全失水后作为提取基因组DNA的供试材料。
1.1.2 主要试剂及引物 研究所用主要分子生物学试剂包括新型快速植物基因组DNA提取试剂(BioTeke,北京)、普通琼脂糖凝胶DNA回收试剂盒(TIANGEN,北京)、PCR扩增试剂2´Power Taq PCR MasterMix(BioTeke,北京),基因克隆所用载体pGEM-Teasy、感受态细胞DH5a(TaKaRa,大连)。ISSR引物选用加拿大哥伦比亚大学(UBC)开发的通用引物。ISSR,SRAP,SAPD,nSAPD和SCAR引物由北京擎科新业生物技术有限公司(TSINGKE,北京)合成。
1.2 实验方法
1.2.1 基因组DNA的提取及浓度测定 将每个油茶品种3株经干燥后的幼嫩叶片粉碎,取等量混合后作为基因组DNA的提取样品。DNA提取方法参照新型快速植物基因组DNA提取试剂盒的操作说明,提取后的DNA测定浓度,并经1.5%琼脂糖凝胶电泳检测,于-20℃保存备用。
1.2.2 nSAPD,SRAP和ISSR多态性扩增 SAPD-PCR的扩增体系为:2×Power Taq PCR Master Mix 10 ml,SAPD(A-NotT-NotG-NotC-Not)引物(10 uM)1 ml,DNA模板(20 ng/ml)3 ml,加ddH2O补齐到20 ml。nSAPD-PCR的扩增体系为:2×Power Taq PCR Master Mix 10 ml,nSAPD(A-Not-A,A-Not-T,A-Not-G,A-Not-C;T-Not-A、T-Not-T,T-Not-G,T-Not-C;G-Not-A,G-Not-T G-Not-G,G-Not-C;C-Not-A,C-Not-T,C-Not-G,C-Not-C)引物(10 uM)1 ml,DNA模板(SAPD-PCR的产物)1 ml,加ddH2O补齐到20 ml。SRAP和ISSR-PCR的扩增体系为:2×Power Taq PCR Master Mix 10 ml,SRAP上下游引物(10 uM)各1 ml(或ISSR引物2 ml),DNA模板(20 ng/ml)3 ml,加ddH2O补齐到20 ml。
nSAPD、SRAP和ISSR的扩增反应均在Life ECO型PCR仪(Bioer,杭州)上进行。nSAPD的反应条件为95℃预变性5 min后,94℃变性1 min、39℃退火1 min (A-Not-A,A-Not-T,A-Not-G,A-Not-C;T-Not-A,T-Not-T,T-Not-G,T-Not-C)或41℃退火1 min(G-Not-A,G-Not-T,G-Not-G,G-Not-C;C-Not-A,C-Not-T,C-Not-G,C-Not-C),72℃延伸5 min,共30个循环;最后于72℃补平10 min,终止温度为4℃。SRAP的反应条件为94℃预变性5 min后,94℃变性1 min、35℃退火1 min、共5个循环;之后72℃延伸1 min;继续94℃变性1 min、52℃退火1 min、72℃延伸1 min,共30个循环;最后于72℃补平10 min,终止温度为4℃。ISSR的反应条件为94℃预变性5 min后;94℃变性45 s,退火时间45 s(不同ISSR引物的最佳退火温度不同),72℃延伸2 min,共30个循环;最后于72℃补平7 min,终止温度为4℃。
PCR扩增后的产物用1.5%的琼脂糖凝胶(EB染色)电泳,扩增图谱的摄取采用美国伯乐自动凝胶图像分析仪(Chemi Doc XRS imaging system,Bio-Rad,Hercules, CA, USA)。
1.2.3 nSAPD,SRAP和ISSR特异片段回收、克隆及测序 采用普通琼脂糖凝胶DNA回收试剂盒从1.5%的琼脂糖凝胶中回收nSAPD、SRAP和ISSR的特异片段。特异片段与pGEM-Teasy载体连接,4℃过夜。连接产物转化于E. coli 感受态细胞DH5a中,经蓝白斑筛选后,每个样品均随机挑选5个阳性克隆交付杭州擎科生物技术公司完成测序。
1.2.4 SCAR引物设计 根据nSAPD,SRAP和ISSR特异片段的测序数据,利用Oligo 6.54(MBI,USA)软件设计SCAR引物。引物设计的主要参数标准为:Stringency:moderate;Prime Tm Range:60.0±5.0;其余参数选择Defaults。用软件的“Analyse”菜单对设计出的SCAR引物进行分析评价,包括引物二聚体(3’端不形成二聚体)、发夹结构(DG<4.5 kcal/mol)、GC含量(45% ~ 55%)、Tm值(上下游引物接近)等,最终设计出一对18~24 bp的特异PCR引物,交由北京擎科合成。
1.2.5 SCAR-PCR扩增 20 ml SCAR-PCR的扩增体系为:2×Power Taq PCR Master Mix 10 ml,SCAR上下游引物(10 mM)各1 ml,DNA模板(20 ng/ml)3 ml,加ddH2O补齐到20 ml。扩增反应在TC-XP型(Bioer,杭州)扩增仪上进行。反应条件为94℃预变性6 min后;94℃变性40 s,退火时间40 s(不同SCAR引物的最佳退火温度不同),72℃延伸2 min,共30个循环;最后于72℃补平7 min,终止温度为4℃。最适退火温度的取得是通过在SCAR-PCR扩增中逐步提高退火温度。
2 结果与分析
2.1 nSAPD,SRAP和ISSR多态性分析、特异片段的克隆及测序
利用nSAPD、SRAP和ISSR分子标记对12个油茶品种的基因组DNA进行PCR扩增,检测品种间的多态性差异(图1)。利用4条SAPD(A-Not,T-Not,G-Not,C-Not)引物分别对12个油茶品种的基因组DNA进行PCR扩增之后,继续用16条nSAPD (A-Not-A,A-Not-T,A-Not-G,A-Not-C;T-Not-A,A-Not-T,A-Not-G,A-Not-C;G-Not-A,G-Not-T,G-Not-G,G-Not-C;C-Not-A,C-Not-T,C-Not-G,C-Not-C)引物分别对SAPD-PCR产物进一步进行巢式PCR扩增。nSAPD的扩增图谱显示,A-Not-A,A-Not-C,G-Not-T,C-Not-G,C-Not-C这5条引物在12个油茶品种间共检测到了7条清晰、稳定的多态性片段;选用24个Me/em系列的SRAP引物对对12个油茶品种的基因组DNA进行PCR扩增,SRAP扩增图谱显示,7个SRAP引物(Me1/em9,Me1/em12,Me2/em7,Me6/em4,Me7/em12,Me7/em4,Me8/em8)在12个油茶品种间扩增出了10条带清晰、稳定的多态性片段;选用15个UBC系列的ISSR引物对12个油茶品种进行PCR扩增,其中3个ISSR引物共检测到了4条清晰、稳定的多态性片段。这7条nSAPD,10条SRAP和4条ISSR多态性片段被进一步回收、克隆测序,待转化为SCAR标记。
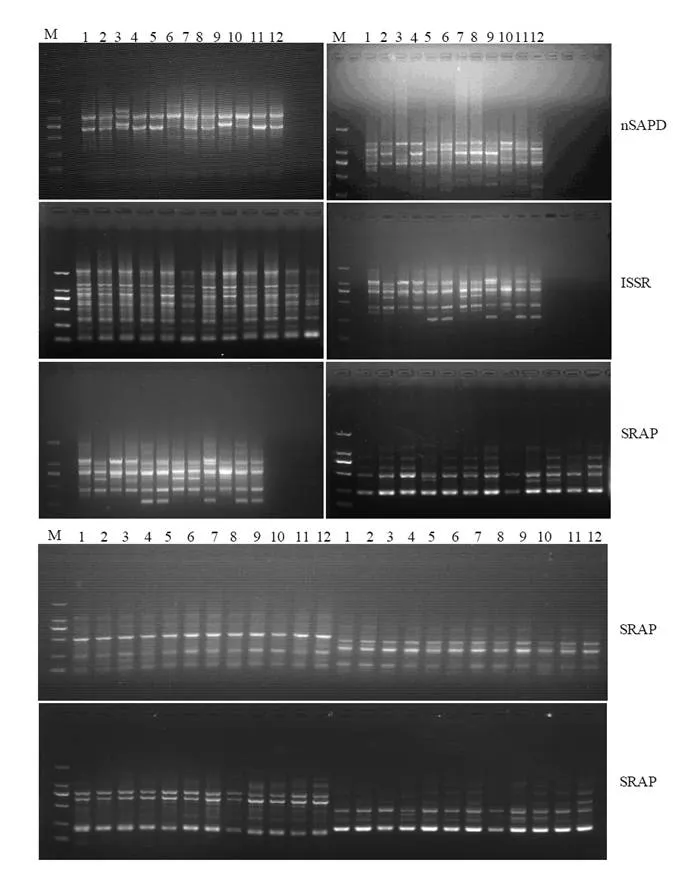
图1 12个油茶品种的nSAPD,SRAP和ISSR-PCR扩增图谱Figure 1 Electrophoretic prof i le of 12 cultivars of C. oleifera amplified with nSAPD, SRAP and ISSR primers
2.2 SCAR标记的建立及可鉴别的油茶品种
对21条多态性片段的测序数据设计出21对SCAR特异引物,分别对12个油茶品种的基因组DNA进行扩增,结果显示,21对SCAR引物中的10对引物并没有再现起初nSAPD,SRAP和ISSR标记的多态性,表明这些多态性的分子标记未能转化为特异性的SCAR标记;其余的11对引物(从Co_1R/Co_1F到Co_11R/Co_11F)在各自最适的退火温度下,从1个或几个油茶品种中扩增出了预期的特异性条带(图2),这表明基于三种分子标记对12个油茶品种的多态性筛选,2个nSAPD,7个SRAP和2个ISSR多态性标记已成功转化为了11个稳定特异的SCAR标记CoSC1 ~ CoSC11。表1所示为11对油茶SCAR标记特异引物的名称、核苷酸序列、最适退火温度、bp数,以及这些SCAR标记可用于鉴别的油茶品种。11个SCAR标记对油茶品种的鉴别能力显著不同,CoSC1可鉴别5个油茶品种,CoSC10可鉴别3个油茶品种,CoSC6和CoSC7均可鉴别2个油茶品种,其余7个SCAR标记可各自鉴别1个油茶品种。从表2所示的11个SCAR标记在12个油茶品种间的分布来看,12个油茶品种所拥有的SCAR标记数量亦明显不同,长林23号、长林26号、长林53号、长林56号和长林166号只有1个SCAR标记,长林3号和长林55号各有2个SCAR标记,长林21号有4个SCAR标记,长林18号有6个SCAR标记,而长林4号、长林27号和长林40号则没有SCAR标记。从SCAR标记的品种特异性来看,11个SCAR标记中的CoSC2,CoSC3,CoSC8为长林18号所特有,CoSC4,CoSC5,CoSC9为长林21号所特有,CoSC11为长林55号所特有,其余的CoSC1,CoSC6,CoSC7和CoSC10均为几个品种所共有。因此,这11个SCAR标记尚不能鉴别长林4号、长林27号和长林40号,另外9个油茶品种的鉴别则需要11个SCAR标记的联合使用。
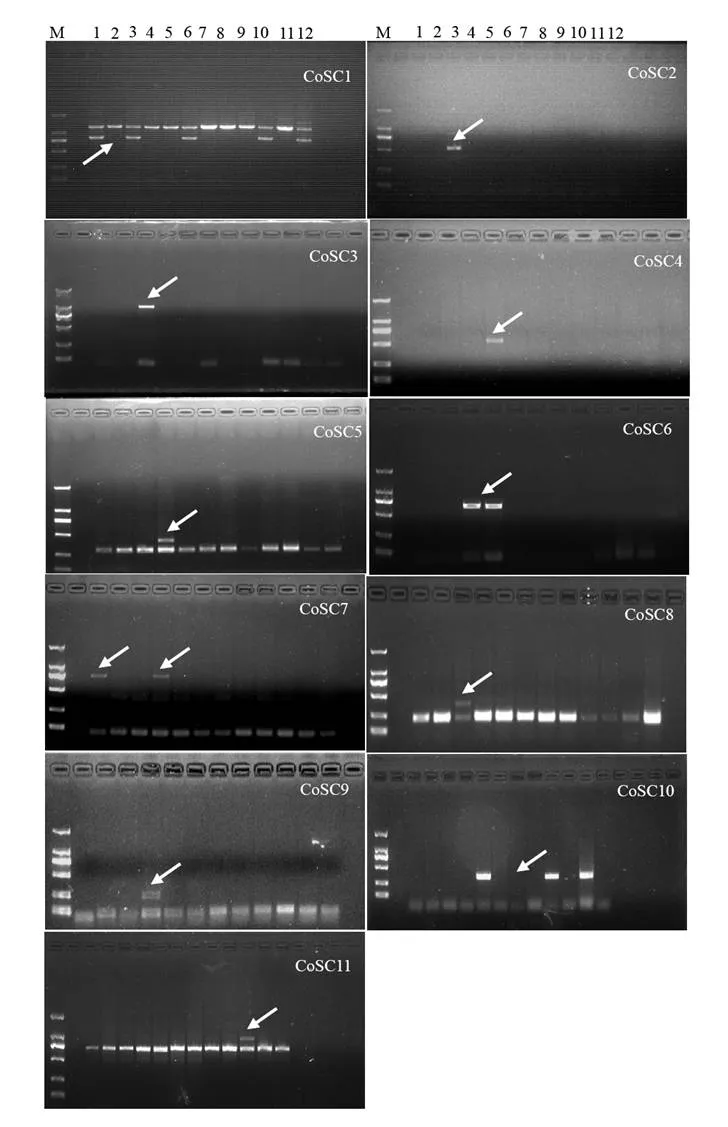
图 2 12个油茶品种的SCAR-PCR扩增图谱Figure 2 Electrophoretic prof i le of 12 cultivars of C. oleifera amplified with SCAR primers

表1 用于12个油茶品种鉴别的特异SCAR标记Table 1 SCAR markers for identification of 12 cultivars of C. oleifera

表212个油茶品种的SCAR标记分布Table 2 Distribution of SCAR markers among 12 cultivars of C. oleifera
3 讨论与结论
根据21条多态性片段的测序数据设计的21对SCAR引物中,11对成功转化为了SCAR标记CoSC1 ~ CoSC11,可用于9个油茶品种的鉴别。剩下的10对中,5对nSAPD引物和3对SRAP引物在12个油茶品种间的SCAR-PCR扩增出现完全一致的结果,没有再现起初nSAPD和SRAP的多态性;2对ISSR引物虽出现多态性,但重复性很差。这可能是由于起初nSAPD和SRAP检测到的多态性来自于引物错配位点。或者由于设计的SCAR引物不在变异位点,而导致原有的多态性消失。因此从引物通用性标记转化为品种特异性的SCAR标记需要做大量的筛选工作和重复性测试,才能最终确定SCAR标记的稳定可靠性。1对SCAR引物的扩增产生了2个SCAR条带的情况,但由于其中1个条带的扩增效率很低且重复性差,在逐步提高退火温度后,只有1个SCAR标记稳定存在。
针对12个长林系列的油茶优良品种,开发出了11个SCAR标记,可作为品种特异性的DNA指纹,从分子水平上辅助油茶良种的有效鉴别。为了提高品种间分子鉴别的可靠性与便捷性,挖掘品种的多个SCAR标记(多位点SCAR表型)具有重要价值[19]。本研究中,长林3号和长林55号各有2个SCAR标记,长林21号有4个SCAR标记,长林18号有6个SCAR标记。因此在后续研究中,进一步扩大SRAP,ISSR等通用性引物的多态性筛选,不仅开发出可用于鉴别长林4号、长林27号和长林40号品种的SCAR标记,特别是开发出单个品种的多位点SCAR表型对于这些油茶良种的准确鉴别更有意义。
多重PCR是一种可以在一个PCR反应里同时检测多位点表型的分子技术手段。利用多重PCR技术将特异性的SCAR标记整合已成功用于了香菇菌株和乳酸菌种间等物种的高效鉴别[19-20,22-24]。因此在后续研究中,技术层面上进一步优化建立油茶品种的多重PCR体系,即将某些品种,例如长林3号和长林55号的2个SCAR标记、长林21号品种的4个SCAR标记、长林18号的6个SCAR标记的引物进行整合,实现在一个PCR反应里同时检测一个品种的多个SCAR指纹条带,这样不仅可以实现油茶品种的高效鉴别,也更有利于油茶品种鉴别的准确性。
SAPD分子标记揭示基因组DNA在限制性内切酶Not I识别位点序列(GCGGCCGC)上的多态性,其开发初衷是为了增强原RAPD标记的分辨率并克服其不稳定性[25-26]。高分辨率的SAPD标记已成功用于了细菌、酵母、真菌、植物、水稻以及人类的基因组研究[22],还有最近报道的用于樱花品种鉴别的研究[27],但由SAPD转化为特异性的SCAR标记用于优良经济林品种的鉴别迄今尚未有报道。本研究基于4个SAPD引物和15个ISSR引物的筛选,从12个油茶品种中各获得了2个稳定的SCAR标记,而基于24对SRAP引物的筛选则获得了7个稳定的SCAR标记,显然SRAP显示了比SAPD和ISSR标记更高的分辨率、更低的工作量。因此,对于油茶品种的鉴别,SAPD和ISSR不是最佳的分子标记,基于SRAP标记筛选并进一步转化为特异性SCAR标记更适合于油茶品种高效鉴别。
SCAR分子标记的一个显著特点是可以由显性标记发展为更加有用的共显性标记[13]。因而本研究中获得的油茶显性SCAR分子标记可进一步发展为共显性的SCAR标记,用于今后油茶分子标记辅助育种(Marker Assisted Selection)中杂合子的高效鉴定,对于提高油茶育种目的性、精确性及其遗传改良效率具有重要意义。
[1] 江南,谭晓风,张琳,等.基于RNA-Seq的油茶种子a-亚麻酸代谢途径及相关基因分析[J].林业科学,2014,50(8):68-75.
[2] 温强,雷小林,叶金山,等.油茶高产无性系的ISSR分子鉴别[J].中南林业科技大学学报,2008,28(1):39-43.
[3] 陈永忠,王湘南.油茶生物技术育种研究前景展望[J].湖南林业科技,2005,32(4):5-7.
[4] 林萍,姚小华,王开良,等.油茶长林系列优良无性系的SRAP分子鉴别及遗传分析[J].农业生物技术学报,2010,18(2):272-279.
[5] Williams J G K,Kubelik A R,Livak K J,et al. DNA polymorphisms amplified by arbitrary primers are useful as genetic markers [J]. Nucl Acids Res,1990,18:6531-6535.
[6] Fisher P J,Gardner R C,Richardson T E. Single locus microsatellites isolated using 5′ anchored PCR [J]. Nuc Acids Res,1996,24:4369-4371.
[7] LI G,QUIROS C F. Sequence-related amplified polymorphism (SRAP),a new marker system based on a simple PCR reaction: its application to mapping and gene tagging in Brassica [J]. Theor Appl Genet,2001,103:455-461.
[8] Kalia R,Rai M,Kalia S,et al. Microsatellite markers:an overview of the recent progress in plants [J]. Euphytica,2011,177(3):309-334.
[9] 黄永芳,陈锡沐,庄雪影,等.油茶种质资源遗传多样性分析[J]. 林业科学,2006,42(4):38-43.
[10] 张国武,钟文斌,乌云塔娜,等.油茶优良无性系ISSR分子鉴别[J]. 林业科学研究,2007,20(2):278-282.
[11] 孙佩光,奚如春,李俊成,等.25个油茶优良无性系的遗传分析与分子鉴别[J]. 华南农业大学学报,2014,35(6):83-88.
[12] 刘扬,彭赟,贺瑞,等.基于ISSR标记的海南油茶种质资源遗传多样性分析[J]. 分子植物育种,2016,(2):517-523.
[13] 张琼. 樱属观赏品种资源调查及部分种与品种SSR分析[D]. 南京:南京林业大学,2013.
[14] Paran I,Michelmore R W. Development of reliable PCR based markers linked to downy mildew resistance genes in lettuce. Theor Appl Genet,1993,85:985-993.
[15] Vidal J R,Delavault P,Coarer M,et al. Design of grapevine (Vitas vinifera L.) cultivar-specific SCAR primers for PCR fingerprinting [J]. Theor Appl Genet,2000,101:1194-1201.
[16] Das M,Bhattacharya S,Pal A. Generation and characterization of SCARs by cloning and sequencing of RAPD products: A strategy for species-specific marker development in Bamboo [J]. Ann Bot,2005,95:835-841.
[17] Dnyaneshwar W,Preeti C,Kalpana J,et al. Development and application of RAPD-SCAR marker for identification of Phyllanthus emblica LINN [J]. Biol Pharm Bull,2006,29:2313-2316.
[18] Choi Y E,Ahn C H,Kim B B,et al. Development of species specific AFLP-derived SCAR marker for authentication of Panax japonicus C. A. MEYER [J]. Biol Pharm Bull,2008,31:135-138.
[19] Li H B,Wu X Q,Peng H Z,et al. New available SCAR markers: potentially useful in distinguishing a commercial strain of the superior type from other strains of Lentinula edodes in China [J]. Appl Microbiol Biotechnol,2008,81:303-309.
[20] Wu X Q,Li H B,Zhao W W,et al. SCAR makers and multiplex PCR-based rapid molecular typing of Lentinula edodes strains [J]. Curr Microbiol,2010,61:381-389.
[21] Shen A H,Li H B,Wang K, et al. Sequence characterized amplified region (SCAR) markers-based rapid molecular typing and identification of Cunninghamia lanceolata [J]. Afr J Biotechnol,2011,10(82):19066-19074.
[22] Pfannebecker J,Fröhlich J. Use of a species-specific multiplex PCR for the identification of pediococci [J]. Int J Food Microbiol,2008,128:288-296.
[23] Petri A,Pfannebecker J,Fröhlich J,et al. Fast identif i cation of wine related lactic acid bacteria by multiplex PCR [J]. Food Microbiol,2013,33:48-54.
[24] Ke L Q,Wang L L,Li H B, et al. Molecular identification of lactic acid bacteria in Chinese rice wine using species-specific multiplex PCR [J]. Eur Food Res Technol,2014,239(1):59-65.
[25] Fröhlich J,Pfannebecker J. Species-independent DNA fingerprint analysis with primers derived from the Notl identification sequence. [P]. Patent number: EP 2027285(A1),2007.
[26] Fröhlich J,Pfannebecker J. Spezies-unabhängiges nachweisverfahren für biologisches Material [P]. Pat Appl,DE 102 06 022 569.4,2006.
[27] 赵庆杰,李海波,屈燕,等.基于SCAR标记的20个樱花品种的分子鉴别[J].南京林业大学学报(自然科学版),2016,40(5):34-40.
Identification of 12 Superior Cultivars of Camellia oleifera by Sequence Characterized Amplified Region Markers
LI Hai-bo1,LIU Yong2,ZHAO Jia1,WANG Yan-fei3,XU Liang1,YANG Ming4
(1. Zhejiang Academy of Forestry, Hangzhou 310023, China; 2. Anji Forestry Bureau of Zhejiang, Anji 313300, China; 3. Longquan Forest Farm of Zhejiang, Longquan 323700, China; 4. Anji Meixi Forestry Station of Zhejiang, Anji 313300, China)
Experiments were conducted on sequence characterized amplified region markers (SCAR) from amplified polymorphic DNA (SAPD), sequence-related amplified polymorphism and inter simple sequence repeat (ISSR) molecular techniques for identification of 12 cultivars (Changlin series)of Camellia oleifera. The result demonstrated that twenty-one polymorphic bands (7 from nSAPD, 10 from SRAP and 4 from ISSR) were obtained from the tested cultivars by using 43 primers (4 SAPD, 24 SRAP and 15 ISSR). Eleven (2 from nSAPD, 7 from SRAP and 2 from ISSR) of 21 polymorphic bands were converted into 11 stable and reproducible SCAR markers by designing specific SCAR primers from the 11 sequenced polymorphic bands and by verifying PCR amplification with SCAR primers. Changlin 23, 26, 53, 56 and 166 had only one SCAR marker, Changlin 3 and 55 had two ones, Changlin 21 had four ones, Changlin 18 had six ones, and Changlin 4, 27 and 40 have no SCAR markers. These SCAR markers can be used as cultivar-specific DNA fingerprints for better identification of cultivars.
Camellia oleifera; superior cultivars; identification; molecular markers; SCAR; DNA fingerprints
S794.4
A
1001-3776(2017)02-0017-07
10.3969/j.issn.1001-3776.2017.02.003
2016-12-25;
2017-02-12
浙江省科研院所扶持专项(No. 2014F30002;2013F50012);浙江省重大科技专项(No. 2010C02005-1)
李海波,研究员,从事林木遗传育种研究;E-mail:1178646251@qq.com。通信作者:杨明,助理工程师,从事森林培育研究;E-mail:1178646251@qq.com。

