资木瓜中莽草酸对大鼠腹腔肥大细胞脱颗粒及抗炎作用研究①
郑倩倩 董甜甜 李世刚 柳 蔚 喻玲玲 陈先勇 王金龄
(三峡大学医学院,宜昌 443002)
资木瓜中莽草酸对大鼠腹腔肥大细胞脱颗粒及抗炎作用研究①
郑倩倩 董甜甜 李世刚 柳 蔚 喻玲玲 陈先勇 王金龄
(三峡大学医学院,宜昌 443002)
目的:探讨资木瓜总提物中莽草酸(Shikimic acid,SA)对C48/80(Compound 48/80)刺激大鼠腹腔肥大细胞(Rat peritoneal mast cells,RPMC)脱颗粒的影响及抗炎作用。方法:HPLC法进行资木瓜总提物中莽草酸成分的定性分析;采用甲苯胺蓝(Toluidine blue,TB)、免疫组化及电镜法进行RPMC鉴定;CCK-8法检测各浓度组RPMC细胞的增殖情况;底物法检测β-己糖苷酶的释放率;ELISA法检测细胞上清中组胺的含量。结果:SA在0~90 μg/ml时,对RPMC生长无显著影响;与阳性对照组比较,SA能有效抑制β-己糖苷酶的释放和抑制组胺的分泌。结论:SA通过抑制C48/80刺激的RPMC脱颗粒而抑制炎症介质组胺的释放,进而发挥抗炎作用。
资木瓜;莽草酸;RPMC;β-己糖苷酶;组胺
木瓜为蔷薇科木瓜属多年生落叶灌木或小乔木,药食兼用,以药用为主[1]。常以果实入药,果实中富含许多丰富的有机酸成分,其含量和种类与舒筋活络、祛风除湿之功效密切相关,主要用于预防和治疗关节疼痛、风湿以及吐泻腹痛等[2]。资木瓜与川木瓜、宣木瓜、沂木瓜齐名,皆为邹皮木瓜,同属于道地药材。
本课题结合木瓜药材的药用价值,对资木瓜药材进行提取纯化。药理实验研究显示[3-6],莽草酸(Shikimic acid,SA)在抗炎、抗血栓、抗肿瘤以及在防治心血管疾病等多个方面具有较强的生理功效。Rabelo等[7]研究SA的抗炎作用,通过对巨噬细胞存活率、NO、TNF-α以及IL-1β等指标进行检测,结果显示,SA显著抑制脂多糖(Lipopolysaccharide,LPS)诱导的巨噬细胞存活率的降低以及NO的产生,且明显抑制炎症介质TNF-α和IL-1β的上调,以此证实,SA具有一定抗炎作用。有研究报道,SA主要存在于天然植物中,其中木瓜中同样含有SA成分,SA对肥大细胞(Mast cell,MC)的促炎功能有抑制作用。本文通过对资木瓜提取物中SA成分的定性分析,并利用体外大鼠腹腔肥大细胞(Rat peritoneal mast cells,RPMC)为模型进行SA抗炎活性的初步研究,为资木瓜的临床应用提供实验依据。
1 材料与方法
1.1 材料 DMEM培养基购自吉诺生物医药技术有限公司;PBS购自吉诺生物医药技术有限公司;胎牛血清购自杭州四季青生物有限公司;细胞计数试剂盒(Cell counting kit-8,CCK-8)购自Dojindo Laboratories公司;C4880(Compound 48/80)购自Sigma公司;甲苯胺蓝购自武汉科瑞生物技术有限公司;Pereoll(1.130 g/ml,进口分装)购自Pharmaeia公司;大鼠组胺ELISA试剂盒购自Elabscience公司;莽草酸对照品购自上海阿拉丁生化科技公司;SPF级SD大鼠,雌雄均可,体重200±20 g,由湖北省实验动物中心提供。
1.2 方法
1.2.1 资木瓜总提物供试品及SA对照品储备液的制备 称取干燥资木瓜果实粉末1.5 kg,按料液比1∶10的比例加入70% 乙醇,加热回流提取3次,每次3 h,合并提取液,减压浓缩至无醇味,干燥,得到资木瓜总提物,储存备用。临用前精密称取资木瓜总提物10.0 mg置于5 ml容量瓶中,甲醇溶解并定容至刻度,超声处理,摇匀,用0.45 μm微孔滤膜过滤,取过滤后的液体作为供试品溶液。
精密称定SA对照品1.8 mg,加入1 ml甲醇溶解,超声处理,摇匀,过0.45 μm微孔滤膜,即得对照品储备液。
1.2.2 SA的HPLC分析 色谱条件优化:Waters symmetry C18 色谱柱(5 μm,4.6×250 mm),流动相:0.1%磷酸二氢钾水溶液-乙腈(95∶5),等度洗脱,柱温:30℃,检测波长:220 nm,流速:1.0 ml/min,进样量:10 μl。
1.2.3 RPMC的分离及鉴定 正常SD大鼠断颈处死后,将其浸泡于75% 乙醇中5 min,在洁净工作台上进行操作,向腹腔注射12 ml无钙台氏液(0.8 g NaCl,0.02 g KCl,0.005 g NaH2PO4·H2O,0.11 g D-Glucose双蒸水定容至100 ml,0.45 μm微孔滤膜过滤后使用),轻揉腹部3 min,打开腹腔,巴斯德管吸取腹腔冲洗液至15 ml离心管,1 500 r/min,离心15 min,弃上清,加入0.75 ml无钙台氏液重悬细胞,并加入3.5 ml 1.110 g/ml的Percoll液再次重悬细胞,然后缓缓向细胞悬液液面加入0.5 ml无钙台氏液,1 500 r/min,离心15 min,弃上层离心液3 ml,加入无钙台氏液洗涤3次,4℃,1 000 r/min,离心5 min。采用台盼蓝染色法检测细胞活性;利用电镜观察细胞内部结构;采用甲苯胺蓝(Toluidine blue,TB)染色法检测其形态功能;免疫组化法观察肥大细胞类胰蛋白酶的表达。倒置显微镜下计数,调整细胞密度进行以下相关试验。
1.2.4 CCK-8法检测SA对RPMC增殖实验 以5×104个/ml细胞密度向各孔中加入100 μl细胞悬液,37℃培养箱中孵育,设正常对照组、SA剂量处理组(终浓度3、10、30 μg/ml),空白组,分别向各孔中加入各浓度的待测溶液10 μl,每组设3个复孔。作用20 h后,向各孔加入10 μl CCK-8,37℃下孵育1~4 h,选择450 nm波长测定各孔吸光度(A)值,记录结果,细胞存活率(%)=A加药组-空白组/A正常对照组-空白组×100%。以质量浓度为横坐标,细胞存活率为纵坐标绘制细胞生长曲线。
1.2.5 底物法检测SA对C48/80刺激的RPMC活化脱颗粒的影响 调整细胞密度以4×105个/ml接种于24孔培养板中,每孔1 ml,37℃培养箱内孵育1 h,离心,弃上清。阳性对照组加入250 μl刺激剂C48/80(终浓度为20 μg/ml)、SA剂量阳性处理组分别加入200 μl C48/80(终浓度为20 μg/ml)和50 μl各浓度药物(终浓度3、10、30 μg/ml)、阴性对照组加入250 μl台式液、SA剂量阴性处理组分别加入250 μl各浓度药物(终浓度3、10、30 μg/ml),孵育1 h。收集细胞于1.5 ml离心管中,4℃ 1 000 r/min离心10 min,分别取50 μl至新的96孔板中,剩余上清液转移至新EP管中-80℃储存备用,每管细胞沉淀中分别加入100 μl 0.5% TritonX-100裂解细胞,将裂解细胞液转移至新96孔板中,向另一新孔加入50 μl台式液作为空白对照组,最后再分别向所有孔板中加入50 μl底物,37℃孵育1 h,之后加入50 μl终止液终止反应,405 nm波长处检测各孔吸光度,计算β-己糖苷酶(β-hexosaminidase)释放率。β-hexosaminidase释放率=A上清液吸光度值-空白对照组吸光度值/A上清液吸光度值+对应细胞裂解液吸光度值-空白对照组吸光度值×100%。
1.2.6 ELISA法检测上清液中组胺的含量 取出上述实验中-80℃储存的细胞培养上清液,冰上融化,根据ELISA试剂盒说明书进行严格操作,检测OD值,软件进行数据统计和分析。
2 结果
2.1 SA及资木瓜总提物的HPLC色谱图 图1A~C HPLC谱图所示,在优化后的色谱条件下,SA经HPLC色谱柱等度梯度洗脱后,色谱峰达到基线分离;与对照品SA保留时间比较,资木瓜总提物的样品溶液也在保留时间为2.50 min左右时出现色谱峰;向资木瓜总提物样品溶液中滴加SA对照品后,在相同保留时间下的色谱峰峰高由0.9 AU增高至1.1 AU以上,以此证实,资木瓜总提物中含有SA成分。
2.2 RPMC的分离及鉴定 图2A~D所示,采用原代RPMC分离方法分离的细胞存活率为99%左右,纯度为90%左右。肥大细胞具有胞膜完整,胞质富含分布均匀的颗粒性物质,颗粒表面光滑,颗粒内电子密度较为适中等特征,通过电镜观察细胞的内部结构,经观察具有肥大细胞以上特征。MC胞质中富含易染颗粒性物质,遇到甲苯胺蓝则染成紫红色,倒置显微镜下观察甲苯胺蓝染色的分离细胞发现具有异染颗粒存在;类胰蛋白酶是鉴定MC的特异性标志,类胰蛋白酶免疫组化染色,细胞胞浆染成棕黄色,通过对类胰蛋白酶存在的可能性进行检测,同样可以证实MC的纯度,倒置显微镜下观察类胰蛋白酶免疫组化染色的分离细胞发现类胰蛋白酶存在。采用三种不同的方法鉴定分离的细胞后,认为已成功建立原代RPMC分离体系,分离的细胞可用于相关实验。
2.3 SA对RPMC增殖的影响 图3 CCK8法实验结果显示,与正常对照组比较,SA剂量处理组的质量浓度范围对RPMC增殖无显著影响(P>0.05),故可选择SA质量浓度在30 μg/ml以内的安全质量浓度进行下一步实验研究。
2.4 SA对C48/80刺激的RPMC活化脱颗粒的影响 图4实验结果显示,SA剂量阳性处理组与阳性对照组比较,β-己糖苷酶的释放率明显受抑制且具有统计学差异(*.P<0.05,**.P<0.01),SA的质量浓度在30 μg/ml时可显著性抑制C48/80诱导的RPMC脱颗粒。

图1 对照品和样品的HPLC色谱图Fig.1 HPLC chromatogram of reference substance and samplesNote: A.SA Reference substance;B.Chaenomeles speciosa samples;C.A and B mixed samples.
2.5 RPMC细胞上清液中组胺的含量 如图5所示,C48/80刺激后可显著升高RPMC内组胺的释放,不同质量浓度的SA可显著抑制C48/80诱发的组胺异常释放的释放率,且具有浓度依赖性(P<0.01)。

图2 原代RPMC分离和鉴定Fig.2 Primary RPMC isolation and identifyNote: A.Light microscope(× 200);B.Electron microscope(× 20k);C.TB staining(× 400);D.Tryptase immunohistochemical staining(× 400).
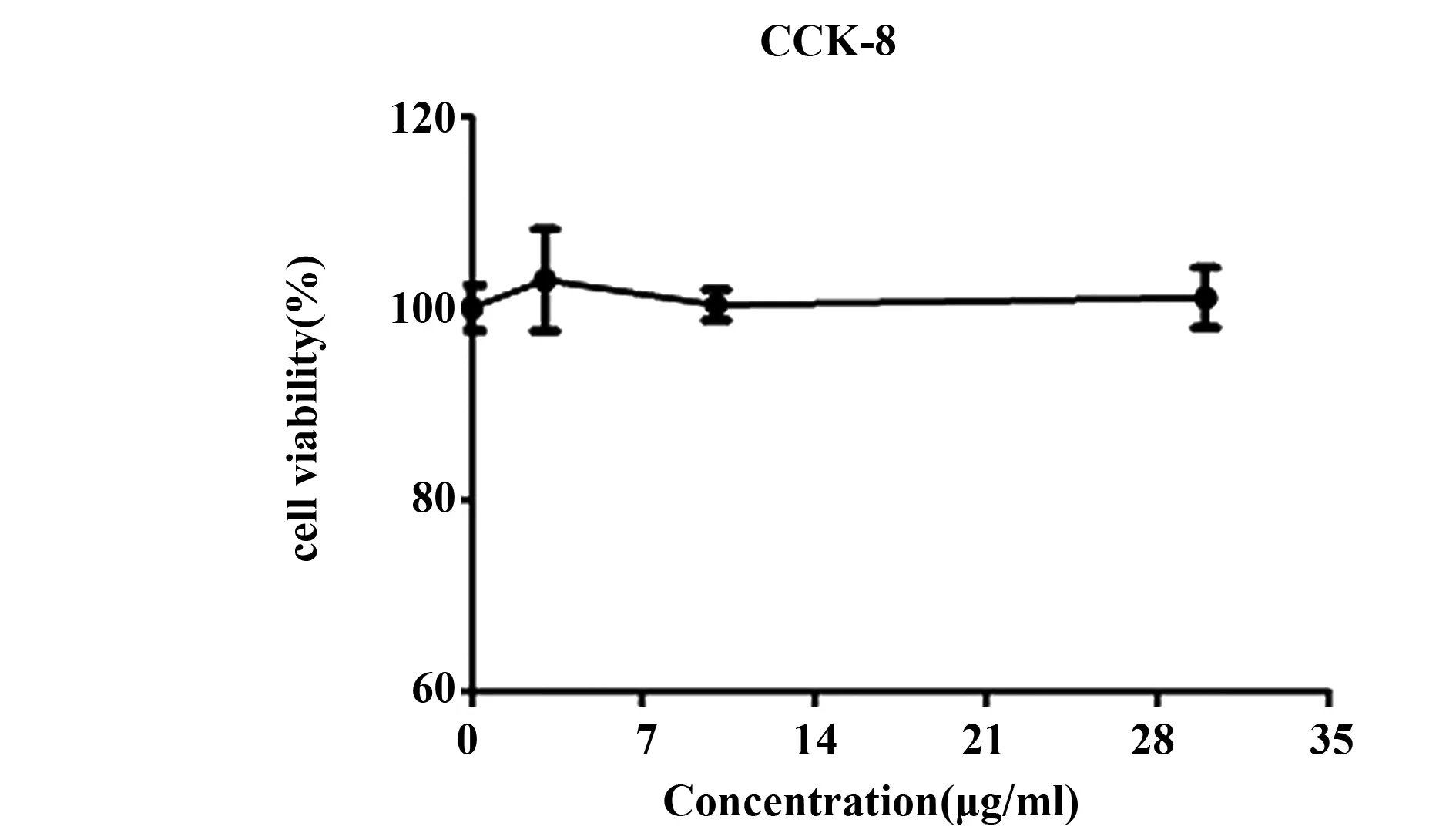
图3 不同浓度SA对RPMC活力的影响Fig.3 Effects of cell viability at different concentrations of SA pretreated RPMC cells

图4 底物法检测不同浓度SA对RPMC释放β-己糖苷酶的影响Fig.4 Effects of different concentrations of SA on β-hexosaminidase release was detected by substr-ate method Note: *.P<0.05,**.P<0.01,compared with control group.
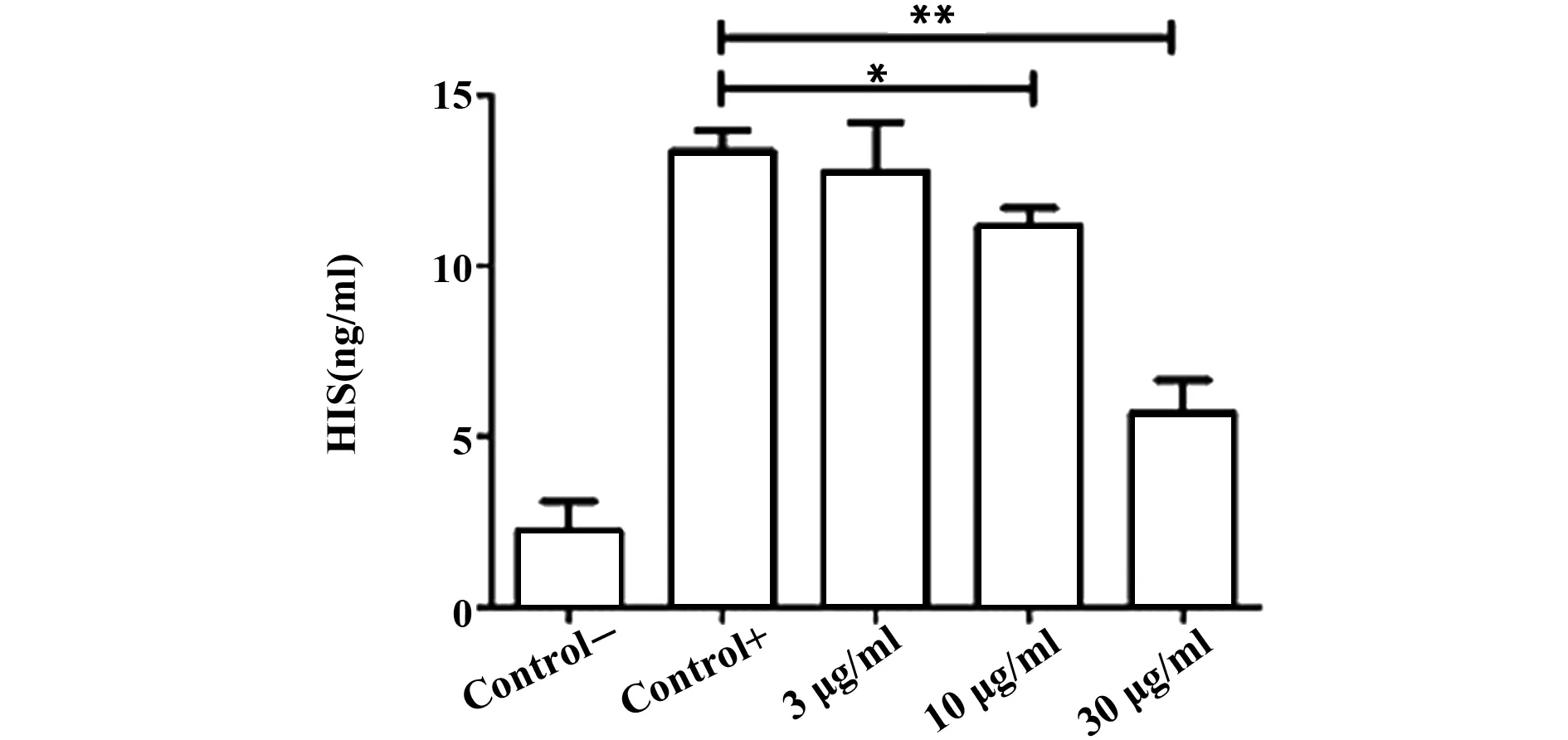
图5 ELISA检测不同浓度SA对RPMC释放组胺的影响Fig.5 Effects of different concentrations of SA on histamine release was detected by ELISA assayNote: *.P<0.05,**.P<0.01,compared with control group.
3 讨论
越来越多的现代医学研究表明,MC在治疗自身免疫性疾病过程中可作为一种新的治疗靶点。MC能够通过增加活性介质的分泌和抵消T细胞的正常生理功能进而加剧一些疾病的发生[8,9]。MC释放的一系列炎症介质如组胺、类胰蛋白酶等活性物质会促进炎症疾病的发生与发展[10]。
研究证实,组胺是一种促炎介质在变应性疾病中扮演重要角色。组胺及其受体调节并影响许多细胞类型的趋化,包括重要的免疫细胞,如抗原递呈细胞、上皮细胞、自然杀伤细胞、T和B淋巴细胞等。O′Mahony等[11]报道,组胺的增加直接导致血管通透性增加,平滑肌收缩,引起神经病理性疼痛和瘙痒等病理反应,其效果依赖于组胺受体亚型的表达,因此,抑制组胺含量可能有效抑制病理反应的发生。
木瓜在多种条件下作为一种传统中药材使用,如关节炎、关节疼痛、肠炎等。目前,从木瓜中分离出较多天然单体化合物,这些单体化合物和粗提物首先在体内、体外进行活性筛选,然后将活性物质进行相关药理作用及作用机制的研究[12,13]。将资木瓜的传统应用与资木瓜的药理作用机制研究相结合,更好地解释了资木瓜传统应用与现代药理之间的关系,并为资木瓜提供更广的药用价值。
莽草酸是中药单体成分中非常常见的有机酸类化合物,如八角茴香、木瓜、松针等,其在抗炎作用方面的研究报道较为少见[14-16]。本研究采用CCK8法对SA作用于RPMC 24 h后的细胞增殖情况进行检测。结果显示SA对RPMC增殖无显著影响,进而选用适当浓度的SA进行脱颗粒实验以及SA处理后对细胞上清液细胞炎性因子进行检测,检测结果发现SA对MC脱颗粒及炎症介质组胺的分泌有显著抑制作用,说明SA对C48/80致炎反应有一定的保护作用。本研究仅仅从细胞水平证实了SA对MC具有稳定作用,其具体抗炎机制还需要进一步广泛深入的研究。
[1] 谢海伟,文 冰.木瓜药理成分及产品开发研究进展[J].生命科学研究,2012,16(1):79-84.
[2] 肖 硕,丁卓伶.木瓜活性成分提取工艺研究进展[J].湖北农业科学,2012,51(5):877-878.
[3] 李 娜,金敬红,姜洪芳,等.宣木瓜总有机酸的纯化及镇痛抗炎作用[J].中国实验方剂学杂志,2011,17(1):113-116.
[4] Park J,Lee B,Choi H,etal.Antithrombosis activity of protocatechuic and shikimic acids from functional plant Pinus densiflora Sieb.et Zucc needles[J].J Nat Med,2016,70(3):492-501.
[5] 葛章文,吴 利,张望明.莽草酸抑制BLM解旋酶活性及肝癌细胞的研究[J].中外医疗,2016,35(16):9-11.
[6] Veach D,Hosking H,Thompson K,etal.Anti-platelet and anti-thrombogenic effects of shikimic acid in sedentary population[J].Food Funct,2016,7(8):3609-3616.
[7] Rabelo TK,Guimaraes AG,Oliveira MA,etal.Shikimic acid inhibits LPS-induced cellular pro-inflammatory cytokines and attenuates mechanical hyperalgesia in mice[J].Int Immunopharmacol,2016,39:97-105.
[8] Salamon P,Shefler I,Hershko AY,etal.The involvement of protein kinase D in T cell-induced mast cell activation[J].Int Arch Allergy Immunol,2016,171(3-4):203-208.
[9] Shefler I,Pasmanik-Chor M,Kidron D,etal.T cell-derived microvesicles induce mast cell production of IL-24:relevance to inflammatory skin diseases[J].J Allergy Clin Immunol,2014,133(1):217-224.
[10] Amin K.The role of mast cells in allergic inflammation[J].Respir Med,2012,106(1):9-14.
[11] O′Mahony L,Akdis M,Akdis CA.Regulation of the immune response and inflammation by hista mine and hista mine receptors[J].J Allergy Clin Immunol,2012,128(6):1153-1162.
[12] 陈 壮,肖刚,覃洪含,等.木瓜提取物对实验性肝损伤小鼠的保护作用[J].医药导报,2013,32(5):596-599.
[13] 梁红艳,戎 谞,陈丕庭,等.木瓜抗烟草花叶病毒活性及其有效成分分离[J].中国农业科学,2013,46(17):3571-3579.
[14] 朱开梅,顾生玖,顾小文,等.八角中莽草酸对人肝癌HepG-2细胞增殖及NF-κB蛋白表达的影响[J].中国实验方剂学杂志,2014,20(1):126-129.
[15] 于 生,张 丽,单鸣秋,等.UFLC-MS法同时测定木瓜饮片中8种有机酸[J].中草药,2016,47(14):2465-2469.
[16] 张志琴,刘光明,杨永寿,等.云南松松针中莽草酸的含量测定[J].云南民族大学学报自然科学版,2012,21(1):10-11.
[收稿2017-02-21 修回2017-03-29]
(编辑 倪 鹏)
Degranulation and anti-inflammatory effects of shikimic acid in Chaenomeles speciosa on peritoneal mast cells in rats
ZHENGQian-Qian,DONGTian-Tian,LIShi-Gang,LIUWei,YULing-Ling,CHENXian-Yong,WANGJin-Ling.
MedicalCollegeofChinaThreeGorgesUniversity,Yichang443002,China
Objective:To investigate the effect of Chaenomeles speciosa total extract shikimic acid(SA) on the degranulation of compound 48/80(C48/80) stimulated rat peritoneal mast cells and the anti-inflammatory.Methods: Qualitative analysis of shikimic acid in the total extract of Chaenomeles speciosa by high performance liquid phase;RPMC were identified by toluidine blue,immunohistochemistry and electron microscopy;CCK-8 method was used to detect the proliferation of RPMC in each concentration group.The release rate of β-hexosidase was determined by substrate method.The content of histamine in supernatant was detected by ELISA.Results: SA had no significant effect on the growth of RPMC at the concentration of 0-90 μg/ml.Compared with the positive control group,SA could effectively inhibit the release of β-hexosidase and inhibit the secretion of histamine.Conclusion: SA inhibits the release of histamine in inflammatory mediators by inhibiting the degranulation of RPMC stimulated by C48/80,and then exerts anti-inflammatory effects.
Chaenomeles speciosa;Shikimic acid;RPMC;β-hexos1 minidase;Histamine
10.3969/j.issn.1000-484X.2017.07.016
①本文为三峡大学医学院国家自然科学基金资助项目(No.81673665,81274116)。
郑倩倩(1989年-),女,硕士,主要从事中药药效评价与新药研究,E-mail:1101741610@qq.com。
及指导教师:李世刚(1971年-),男,博士,副教授,主要从事中药药效评价与新药研究,E-mail:fox201@163.com。
R285.5
A
1000-484X(2017)07-1035-04

