红景天对血管性痴呆大鼠认知功能的影响
刘 娜,徐 明,王华龙,王文婷,王彦永,3,王铭维,3*
(1.河北医科大学第一医院神经内一科,河北 石家庄 050031;2.河北医科大学口腔医院病理科,河北省口腔医学重点实验室,河北 石家庄 050017;3.河北省脑老化与认知神经科学实验室,河北 石家庄 050031)
·论 著·
红景天对血管性痴呆大鼠认知功能的影响
刘 娜1,徐 明2,王华龙1,王文婷1,王彦永1,3,王铭维1,3*
(1.河北医科大学第一医院神经内一科,河北 石家庄 050031;2.河北医科大学口腔医院病理科,河北省口腔医学重点实验室,河北 石家庄 050017;3.河北省脑老化与认知神经科学实验室,河北 石家庄 050031)
目的观察红景天对血管性痴呆(vascular dementia,VD)大鼠认知功能的影响并探讨其神经保护的机制。方法采用双侧颈总动脉结扎的方法制作VD大鼠模型,红景天治疗4周后利用Morris水迷宫检测VD大鼠认知能力;试剂盒检测氧化应激指标超氧化物歧化酶(orgotein superoxide dismutase,SOD)和丙二醛(malondialdehyde,MDA )的表达,免疫印迹法检测p38、p-p38及 caspase-3的表达。结果VD大鼠认知能力下降,SOD表达减少,MDA表达增多, p-p38、caspase-3蛋白表达增多。红景天组大鼠认知功能明显改善,红景天治疗逆转了SOD、MDA、p-p38和caspase-3相应变化。结论红景天治疗可明显改善VD大鼠空间学习记忆能力,其治疗作用机制可能是一方面发挥了其抗氧化应激特性,另一方面通过抑制p38 MAPK 信号通路抑制caspase-3介导的凋亡实现的。
痴呆,血管性;红景天;氧化性应激
血管性痴呆(vascular dementia,VD)是由脑出血、脑梗死或其他对大脑造成损伤的疾病导致的认知功能障碍性疾病,主要病因包括各种心血管或脑血管疾病,是常见的临床综合征[1]。目前已经成为全世界老年群体中第二常见的痴呆类型,仅次于阿尔茨海默病[2]。VD占全世界痴呆总数的15%~20%,VD影响的人群将逐渐增多,对老年人群造成的严重影响也在逐渐上升。然而无论是手术还是药物方面都没有治愈VD的有效方法。因此,对于VD有效治疗方法或药物的研究就显得至关重要。红景天是一种传统的中药,被广泛用于各种心脑血管疾病。其拥有抗肿瘤、抗衰老的特性,同时其具有强大的神经保护作用。红景天可激活PI3K/Akt信号通路,通过抗氧化应激、抗凋亡等特性发挥神经保护作用[3-5]。对大鼠采用双侧颈总动脉结扎的方法可以减少大脑的血供,导致大鼠学习和记忆能力的下降,可成功诱导VD的动物模型。本研究应用该模型观察红景天对于VD大鼠认知功能的治疗效果,并探讨其相关的神经保护机制,旨在为VD的临床治疗提供相应的理论依据。
1 材料与方法
1.1 实验动物及试剂 健康的无特定病原体级雄性SD大鼠30只,体质量为(260±20) g,由河北省实验动物中心提供,合格证号SCXK(冀)2013-1-003。所有动物2~3只/笼饲养,自由获得食物和水。动物房温度控制在(23±2) ℃,给予动物12 h白天/黑夜循环周期的光照。所有的实验流程及操作规程符合河北医科大学关于实验动物的操作规范。主要试剂:红景天干燥粉末(河北省中医研究所),超氧化物歧化酶(orgotein superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)活性检测试剂盒(美国abcam公司),p38 MAPK抗体及p-p38 MAPK 单克隆抗体(美国Cell Signaling公司),caspase-3抗体(美国abcam公司),β-actin 单克隆抗体(美国 abcam公司)。
1.2 模型制作及分组 VD模型制作使用双侧颈总动脉结扎的方法[6]。分为空白对照组10只、VD模型组10只、红景天组10只。术前12 h动物禁食,可自由进水。VD模型组和红景天组大鼠用10%的水合氯醛腹腔注射麻醉,待麻药起效后局部消毒,沿大鼠颈部正中剪开皮肤暴露双侧颈总动脉(注意不能损伤周围的神经),仔细分离周围的组织,VD模型组和红景天组采用双侧颈总动脉结扎的方法制作痴呆模型,对照组大鼠给予相同的操作但不结扎相应的动脉。缝合皮肤切口并消毒,将大鼠放回笼中待其苏醒。造模后2周水迷宫检测各组大鼠认知功能,与对照组相比,模型鼠逃避潜伏期明显延长,目标象限停留时间明显缩短,表明大鼠认知功能障碍,视为模型制作成功。水迷宫后第2天红景天组SD大鼠给予红景天15 mg·kg-1·d-1灌胃,连续4周,对照组和VD模型组给予同等剂量的生理盐水灌胃处理,4周后利用Morris水迷宫观察大鼠空间学习和记忆能力的变化。
1.3 实验方法
1.3.1 Morris水迷宫测试大鼠空间学习和记忆能力 造模后2周及灌胃4周后进行Morris水迷宫检测。水迷宫直径150 cm,池壁高50 cm,水深40 cm,水温(22±1) ℃。目标象限中央放置一直径10 cm平台,位于水面下1 cm。大鼠经过适应训练后,进行定位航行试验,大鼠面朝池壁下水,记录大鼠找到平台的时间,如果在120 s内找到平台,记录时间(逃避潜伏期),如果120 s未找到平台将其引导到平台并让大鼠停留20 s,逃避潜伏期记录为120 s。空间搜索试验:定位航行试验后,移除平台,记录大鼠在目标象限停留时间。
1.3.2 试剂盒检测SOD和MDA含量 水迷宫测试后大鼠断头取脑(每组5只大鼠),分离脑组织样本,利用比色检测试剂盒进行SOD和MDA含量的测定。具体实验方法见产品说明书。
1.3.3 免疫印迹法检测p38、p-p38及 caspase-3的表达 每组5只大鼠麻醉后快速断头取脑,分离海马提取蛋白。蛋白使用裂解液进行裂解,匀浆使用离心机4 ℃ 条件下12 000 r/min离心5 min,取上清液进行蛋白浓度的测定。取样本加入每个泳道,10%SDS聚丙烯酰胺凝胶电泳,室温下电泳3 h,转移到聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)上(4 ℃、电压100 V)。含5%脱脂牛奶的TTBS处理1 h。随后与以下一抗相结合:抗p-p38 MAPK抗体(浓度1∶1 000)、抗p38 MAPK抗体(浓度1∶1 000)、抗caspase-3抗体(浓度1∶1 000)、β-actin抗体 (浓度1∶2 000),4 ℃ 过夜。洗膜后与二抗结合,室温下孵育结合。最后进行曝光显影。各目的蛋白与β-actin的IOD值比值作为其相对蛋白表达量。
1.4 统计学方法 应用SPSS 16.0统计软件分析数据,计量资料比较分别采用单因素方差分析和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 Morris水迷宫测试大鼠空间学习和记忆能力 造模后VD模型组、红景天组大鼠逃避潜伏期明显长于对照组,目标象限停留时间明显少于对照组,差异均有统计学意义(P<0.05);而VD模型组和红景天组之间差异无统计学意义(P>0.05)。治疗后,VD模型组大鼠逃避潜伏期较对照组延长,差异有统计学意义(P<0.05);红景天组大鼠逃避潜伏期与VD模型组相比缩短,但仍长于对照组,差异有统计学意义(P<0.05)。VD模型组大鼠在目标象限停留时间短于对照组,差异有统计学意义(P<0.05);红景天组大鼠在目标象限停留时间与VD模型组相比延长,但仍短于对照组,差异有统计学意义(P<0.05)。水迷宫结果表明VD模型组VD大鼠空间认知功能较正常组大鼠下降,红景天治疗后改善了VD大鼠的空间学习和记忆能力,但尚未恢复到正常组大鼠的认知水平。见表1。

表1 造模后及治疗后各组大鼠逃避潜伏期与目标象限停留时间比较Table 1 The escape latency and retention time of the target quadrant in different groups after modeling and treatment
*P<0.05与对照组比较 #P<0.05 与VD模型组比较(SNK-q检验)
2.2 氧化应激的测定 VD模型组大鼠海马MDA含量明显高于对照组,差异有统计学意义(P<0.05);红景天组大鼠海马MDA含量较模型组降低,但仍高于对照组,差异有统计学意义(P<0.05)。VD模型组大鼠海马SOD活性明显低于对照组,差异有统计学意义(P<0.05);红景天组大鼠海马SOD活性较模型组升高,但仍低于对照组,差异有统计学意义(P<0.05)。见表2。
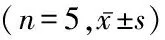
表2 各组大鼠海马MDA和SOD表达比较Table 2 The production of MDA and SOD in different groups
*P<0.05与对照组比较 #P<0.05与VD模型组比较(SNK-q检验)
2.3 Western blot检测大鼠海马p38、p-p38及caspase-3的表达 各组大鼠海马p38表达差异无统计学意义(P>0.05)。VD模型组大鼠海马p-p38含量明显高于对照组(P<0.05);红景天组大鼠海马p-p38含量较VD模型组降低,但仍高于对照组,差异有统计学意义(P<0.05)。VD模型组大鼠海马caspase-3蛋白表达明显高于对照组,差异有统计学意义(P<0.05);红景天组大鼠海马caspase-3蛋白表达低于VD模型组,但仍高于对照组,差异有统计学意义(P<0.05)。见表3。
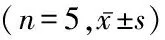
表3 各组大鼠海马p38、p-p38及caspase-3蛋白表达比较Table 3 Expression of p38,p-p38 and caspase-3 proteins in hippocampus of rats in each group
*P<0.05与对照组比较 #P<与VD模型组比较(SNK-q检验)
3 讨 论
VD表现为逐渐进展的认知功能下降,目前对于VD的治疗措施收效甚微。在中枢神经系统,神经元特别容易受到缺血、出血、癫痫以及神经毒素的损伤,氧化应激是导致这些损伤常见的发病机制[7-8]。很多中药具有抗氧化的能力如红景天[9],能否利用其抗氧化特性治疗VD具有重要的现实意义。本研究结果显示VD大鼠的空间学习记忆能力下降,而应用红景天治疗改善了其认知功能,提示红景天具有改善VD认知功能的作用。
氧化应激是指体内氧化与抗氧化作用的平衡失调,导致炎性细胞浸润,相关的蛋白酶分泌增加,从而产生大量氧化相关的中间代谢产物。氧化应激是由自由基在体内产生的一种不良反应,并被认为是导致衰老和疾病的一个重要因素[10]。MDA、SOD在许多研究中都被用作氧化应激的相关指标。MDA作为氧化应激损伤常用的标志物,是氧化应激状态下脂质过氧化反应的产物,与氧化应激和脂质过氧化程度正相关[11]。MDA的升高被认为是氧化损伤中脂质过氧化的结果。另外,氧化应激损伤同时会造成抗氧化的防御系统的损害,损伤抗氧化物酶如SOD[12]。已经证实氧化应激是VD认知功能障碍的重要机制之一,在动物实验中也有报道氧化应激在VD大鼠学习记忆下降中起关键作用[13-14]。本研究结果显示VD大鼠海马MDA表达增多、SOD活性降低,提示结扎双侧颈总动脉引起慢性缺血造成了VD大鼠模型出现氧化应激损伤;4周的红景天治疗则减轻了氧化应激作用,证实了红景天可通过发挥其抗氧化应激的作用改善VD大鼠的认知功能。
红景天不仅具有抗氧化应激的特性,还有大量研究证实其具有抗肿瘤、抗凋亡等作用。笔者前期研究证实红景天通过PI3K/Akt通路抑制凋亡的作用,从而改善AD大鼠的认知功能[15]。亦有研究证实凋亡途径在VD大鼠认知障碍中的作用[16]。Caspase-3是一种促凋亡蛋白[17],在线粒体依赖性凋亡过程中起到了关键作用,它使DNA片段化,从而激活内切酶分裂核DNA,最终导致细胞死亡。所以,抑制caspase-3的表达可有效抑制凋亡途径。本研究观察到VD大鼠海马caspase-3蛋白表达增多,说明慢性缺血启动了凋亡途径;而应用红景天治疗后,caspase-3的表达减弱,证实红景天在VD大鼠模型中具有抗凋亡的特性。
缺氧导致的p38 MAPK 信号通路的激活可启动神经元的凋亡,导致VD出现功能障碍[18-19]。 p38 MAPK 可通过调节caspase-3的表达影响凋亡,阻断p38 MAPK信号通路可通过抑制caspase-3依赖型的凋亡通路保护慢性缺血大鼠的海马神经元,从而改善相应的空间学习记忆能力的损伤[18,20]。本研究VD大鼠p-p38的表达增多,说明慢性缺血后海马p38 MAPK磷酸化增多,最终引起caspase-3介导的凋亡发生;应用红景天治疗后海马p-p38表达较VD模型组大鼠明显下降,提示红景天明显抑制了p38 MAPK的磷酸化,从而进一步抑制了caspase-3介导的凋亡。
总之,红景天治疗可明显改善VD大鼠空间学习记忆能力,其治疗作用的机制可能是一方面发挥了其抗氧化应激特性,另一方面通过抑制p38 MAPK 信号通路抑制caspase-3介导的凋亡实现的。本研究结果证实了红景天的神经保护作用及其在VD动物模型中的治疗作用,为VD的临床治疗提供了理论依据。但本研究中红景天治疗未完全改善VD大鼠的认知功能,与正常SD大鼠的认知水平尚有差距,同时氧化应激指标以及p-p38和caspase-3的表达均未恢复正常,亦显示了治疗的局限性,在今后的研究中将会进一步深入探讨。
[1] Ikram MA,Bersano A,Manso-Caldern R,et al. Genetics of vascular dementia-review from the ICVD working group[J]. BMC Med,2017,15(1):48.
[2] Singh M,Prakash A. Possible role of endothelin receptor against hyperhomocysteinemia and β-amyloid induced AD type of vascular dementia in rats[J]. Brain Res Bull,2017[Epub ahead of print].
[3] Kim M,Shin MS,Lee JM,et al. Inhibitory effects of isoquinoline alkaloid berberine on ischemia-induced apoptosis via activation of phosphoinositide 3-kinase/protein kinase B signaling pathway[J]. Int Neurourol J,2014,18(3):115-125.
[4] Wang S,He H,Chen L,et al. Protective Effects of Salidroside in the MPTP/MPP(+) -induced model of Parkinson′s disease through ROS-NO-Related mitochondrion pathway[J]. Mol Neurobiol,2015,51(2):718-728.
[5] 赵敏,边芳,田卓华,等.甘草、红景天及黄芪粗提取物对UVB诱导小鼠皮肤慢性光损伤的保护作用[J].世纪科技研究与发展,2015,34(5):295-299.
[6] Zhu Y,Zeng Y,Wang X,et al. Effect of electroacupuncture on the expression of mTOR and eIF4E in hippocampus of rats with vascular dementia[J]. Neurol Sci,2013,34(7):1093-1097.
[7] Xu X,Lv H,Xia Z,et al. Rhein exhibits antioxidative effects similar to Rhubarb in a rat model of traumatic brain injury[J]. BMC Complement Altern Med,2017,17(1):140.
[8] Sanchez AB,Kaul M. Neuronal Stress and injury caused by HIV-1,cART and drug abuse:converging contributions to HAND[J]. Brain Sci,2017,7(3).pii:E25.
[9] Si PP,Zhen JL,Cai YL,et al. Salidroside protects against kainic acid-induced status epilepticus via suppressing oxidative stress[J]. Neurosci Lett,2016,618:19-24.
[10] Bhatti JS,Kumar S,Vijayan M,et al. Therapeutic strategies for mitochondrial dysfunction and oxidative stress in age-related metabolic disorders[J]. Prog Mol Biol Transl Sci,2017,146:13-46.
[11] Liu H,Zhao M,Yang S,et al. (2R,3S)-Pinobanksin-3-cinnamate improves cognition and reduces oxidative stress in rats with vascular dementia[J]. J Nat Med,2015,69(3):358-365.
[12] Ghorbanzadeh V,Mohammadi M,Mohaddes G,et al. Protective effect of crocin and voluntary exercise against oxidative stress in the heart of high-fat diet-induced type 2 diabetic rats[J]. Physiol Int,2016,103(4):459-468.
[13] Vijayan M,Reddy PH. Stroke,Vascular Dementia,and Alzheimer′s Disease:Molecular Links[J]. J Alzheimers Dis,2016,54(2):427-443.
[14] El-Dessouki AM,Galal MA,Awad AS,et al. Neuroprotective effects of simvastatin and cilostazol in L-methionine-induced vascular dementia in rats[J]. Mol Neurobiol,2016[Epub ahead of print].
[15] 刘娜,王金华,王华龙,等.红景天对老年痴呆大鼠认知功能的治疗作用[J].河北医科大学学报,2017,38(2):133-137.
[16] Zhang Y,Wang LL,Wu Y,et al. Paeoniflorin attenuates hippocampal damage in a rat model of vascular dementia[J]. Exp Ther Med,2016,12(6):3729-3734.
[17] Chang CT,Korivi M,Huang HC,et al. Inhibition of ROS production,autophagy or apoptosis signaling reversed the anticancer properties of Antrodia salmonea in triple-negative breast cancer(MDA-MB-231) cells[J]. Food Chem Toxicol,2017,103:1-17.
[18] Yang S,Zhou G,Liu H,et al. Protective effects of p38 MAPK inhibitor SB202190 against hippocampal apoptosis and spatial learning and memory deficits in a rat model of vascular dementia[J]. Biomed Res Int,2013,2013:215798.
[19] Wu XD,Zhang ZY,Sun S,et al. Hypoxic preconditioning protects microvascular endothelial cells against hypoxia/reoxygenation injury by attenuating endoplasmic reticulum stress[J]. Apoptosis,2013,18(1):85-98.
[20] Ashabi G,Alamdary SZ,Ramin M,et al. Reduction of hippocampal apoptosis by intracerebroventricular administration of extracellular signal-regulated protein kinase and/or p38 inhibitors in amyloid beta rat model of Alzheimer′s disease:involvement of nuclear-related factor-2 and nuclear factor-kappaB[J]. Basic Clin Pharmacol Toxicol,2013,112(3):145-155.
(本文编辑:许卓文)
The effects of Rhodosin on cognition in rats with vascular demedtia
LIU Na1, XU Ming3, WANG Hua-long1, WANG Wen-ting1, WANG Yan-yong1,2, WANG Ming-wei1,3*
(1.FirstDepartmentofNeurology,theFirstHospitalofHebeiMedicalUniversity,Shijiazhuang050031,China; 2.DepartmentofOralPathology,CollegeandHospitalofStomatology,HebeiMedicalUniversity,KeyLaboratoryofStomatology,HebeiProvince,Shijiazhuang050017,China; 3.BrainAgingandCognitiveNeuroscienceLaboratoryofHebeiProvince,Shijiazhuang050031,China)
Objective To study the effects of Rhodosin on cognition in rats with vascular demedtia(VD), and to explore the mechanisms of its neuprotective effects. Methods The VD group rats were established by bilateral common carotid artery occlusion. Cognitive function was tested by the Morris water maze experiment after Rhodosin treatment for 4 weeks. The expression of orgotein superoxide dismutase(SOD) and malondialdehyde(MDA) (oxidative stress indicators) was detected by the kit. The protein expression of p38, p-p38 and caspase-3 were detected by western blot. Results In VD group, the cognitive ability was declined accompanied by decreased SOD and increased MDA, p-p38, caspase-3 expression. The cognitive ability in Rhodosin group was significantly enchanced, and Rhodosin administration reversed the changes of SOD, MDA, p-p38 and caspase-3 expression accordingly. Conclusion Rhodosin could improve the spatial learning and memory ability of VD rats significantly. Its therapeutic mechanisms may be through its anti-oxidative stress effect and inhibiting caspase-3-dependent apoptosis via suppressing the p38 MAPK signaling pathway.
dementia, vascular; Rhodosin; oxidative stress
2017-03-17;
2017-04-22
河北省医学科学研究重点课题(20110301);河北省医学适用技术跟踪项目(GL2014015)
刘娜(1981-),女,河北赵县人,河北医科大学第一医院主治医师,医学硕士,从事神经内科疾病诊治研究。
*通讯作者。E-mail:mingweiwangtutor@sina.com
R749.16
A
1007-3205(2017)06-0621-05
10.3969/j.issn.1007-3205.2017.06.001

