中性粒细胞与淋巴细胞比值对肝癌预后影响的Meta分析
刘 健, 高驰丹, 张立鑫, 权 刚, 张雨顺, 李敬东
(四川省南充市川北医学院 a.肝胆一科; b.病理科, 四川 南充 637000)
中性粒细胞与淋巴细胞比值对肝癌预后影响的Meta分析
刘 健a, 高驰丹b, 张立鑫a, 权 刚a, 张雨顺a, 李敬东a
(四川省南充市川北医学院 a.肝胆一科; b.病理科, 四川 南充 637000)
目的 探讨中性粒细胞与淋巴细胞比值(NLR)与肝癌患者预后的关系。方法 检索PubMed、Embase、Cochrane Library、中国生物医学文献数据库、维普、万方等数据库建库至2016年10月公开发表的关于NLR与肝癌预后关系研究的中英文文献,筛选后的文献数据用Review Manager 5.3软件进行统计分析,发表性偏倚采用漏斗图进行分析评价。结果 纳入12项符合标准的研究,共计3325例肝癌患者。Meta分析结果显示,NLR升高的肝癌患者,其总体生存期[风险比(HR)=1.56,95%可信区间(95%CI):1.46~1.66,P<0.001]、无病生存期(HR=1.57,95%CI:1.23~2.00,P<0.001)和无复发生存期(HR=1.54,95%CI:1.36~1.74,P<0.001)明显缩矩。结论 NLR升高的肝癌患者预后较差,临床上应重视NLR指标,使肝癌患者及时得到预后评估和合理治疗。
肝肿瘤; 中性白细胞; 淋巴细胞; 预后; Meta分析
肝癌在致死性肿瘤中排名第三位[1],与发达国家相比,发展中国家对肝癌的早期筛查及预后评估方法相对不足,导致发展中国家肿瘤患者整体生存率更低[2],因此肝癌的早期发现、早期治疗仍然是一个艰巨的任务。一些研究[3]认为炎症环境在肿瘤的发生、发展及转归中起着相当重要的作用,包括肿瘤的生长方式、转移途径等。肝癌患者术后5年复发率达70%[4-5],降低肝癌的复发率、延长总体生存期是改善患者预后的重要途径。由于大部分的肝癌患者常伴有慢性肝病,同时炎症又是肝癌进展的主要危险因素,因此,一些研究者对肝癌患者外周血中的中性粒细胞与淋巴细胞比值(NLR)与肝癌预后的关系进行了研究,认为NLR可以作为评估肝癌患者预后的一项新的生物学指标,同时也可能成为未来治疗肝癌的新靶点[6]。然而,部分研究者并不支持这一观点[7]。本文的目的在于通过对近年来有关NLR与肝癌预后的研究进行Meta分析,探讨二者的关系。
1 资料与方法
1.1 文献检索 以liver cancer、liver neoplasm、hepatocellular cancer、cancer, hepatocellular、hepatic cancers、LE cell、neutrophil band cells、neutrophil*、lymphocyte*、prognosis、肝细胞癌、肝癌、肝细胞肿瘤、中性粒细胞、淋巴细胞为检索词,检索建库至2016年10月在PubMed、Embase和Cochrane Library、中国生物医学文献数据库、维普、万方数据库公开发表的有关NLR与肝癌预后关系的中英文文献。
1.2 文献的纳入及排除标准 纳入标准:(1)患者均经肝穿刺活组织检查或相关病理学检查证实为肝癌;(2)报道了NLR与肝癌患者总体生存期(overall survival,OS)、无病生存期(disease free survival,DFS)或无复发生存期(recurrence free survival,RFS)等相关预后指标的关系;(3)报道了风险比(HR)和95%可信区间(95%CI),或可以根据给出的数据、相关生存曲线计算得来。排除标准:(1)综述、病例报告及非临床研究文献;(2)未明确报道NLR的临界值;(3)无法获取HR和95%CI;(4)根据所给生存曲线提取相关数据与原文差别较大者。
1.3 文献质量评估与数据提取 按照Newcastle-Ottawa量表(NOS)对研究文献进行质量评估,NOS包括3个评估参数:研究人群的选择(0~4分),可比性(0~2分),结果测量及评价(0~3分),最高分为9分,NOS评分≥6分则为高质量的文献,才纳入此次研究。数据提取由两名研究者独立进行,如有分歧时通过讨论解决或咨询第三方共同解决。提取的数据包括:(1)作者、发表时间、国家;(2)研究对象的总人数、性别比例、平均年龄、病理分型、治疗方式、随访时间;(3)不同NLR水平患者OS、DFS和RFS的HR、95%CI及其相关生存曲线;(4)NLR的临界值。
1.4 统计学方法 用Review Manager 5.3软件进行统计分析。将各研究中的HR与95%CI进行合并,对纳入的研究进行异质性检验,若P>0.10,I2<50%为各研究无显著异质性,选用固定效应模型进行分析;若P≤0.10,I2≥50%为各研究存在明显的异质性,选用随机效应模型进行分析。发表性偏倚采用漏斗图进行分析评价。
2 结果
2.1 文献筛选 根据上述检索策略检索到387篇文献,按照上述文献纳入及排除标准,通过文献质量评估,最终12篇文献纳入本研究(图1),均为回顾性分析,共收集肝癌病例3325例(男性2601例)。合并数据后,得出的HR均大于1,其中1篇文章接近中性结果,其余为明显阳性结果,在严格按照筛选标准筛选文献的情况下,尽可能降低相关选择偏移,得出的Meta分析结果更接近一次文献的结果。其中10篇研究NLR与OS的关系,2篇研究NLR与DFS的关系,4篇研究NLR与RFS的关系,纳入此Meta分析的文献信息见表1。
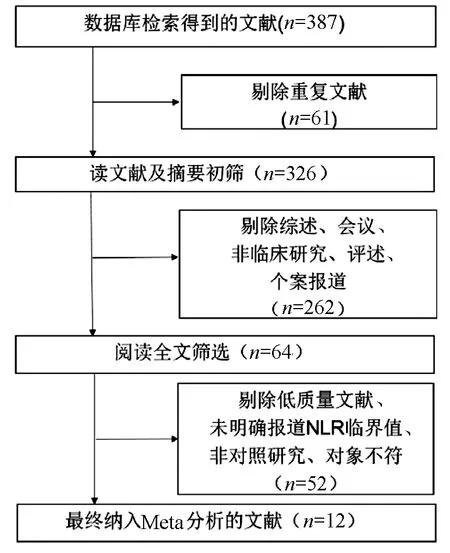
图1 文献筛选流程表1 纳入Meta分析文章的基本信息
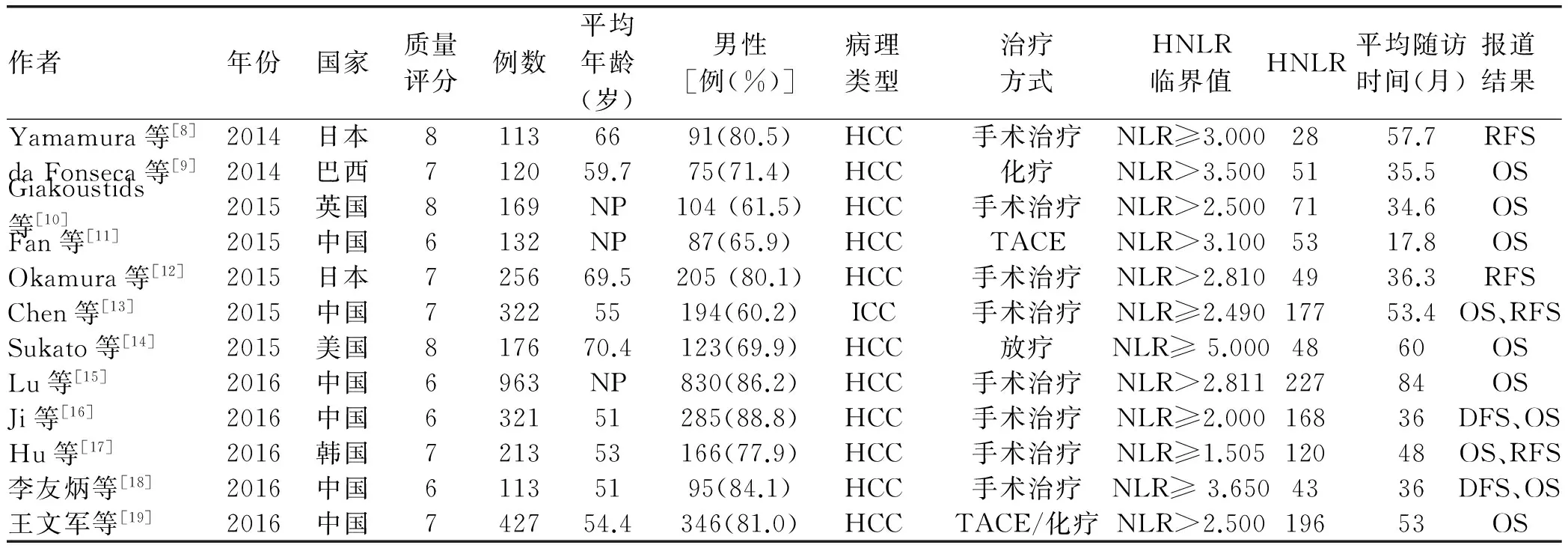
作者年份国家质量评分例数平均年龄(岁)男性[例(%)]病理类型治疗方式HNLR临界值HNLR平均随访时间(月)报道结果Yamamura等[8]2014日本81136691(80.5)HCC手术治疗NLR≥3.0002857.7RFSdaFonseca等[9]2014巴西712059.775(71.4)HCC化疗NLR>3.5005135.5OSGiakoustids等[10]2015英国8169NP104(61.5)HCC手术治疗NLR>2.5007134.6OSFan等[11]2015中国6132NP87(65.9)HCCTACENLR>3.1005317.8OSOkamura等[12]2015日本725669.5205(80.1)HCC手术治疗NLR>2.8104936.3RFSChen等[13]2015中国732255194(60.2)ICC手术治疗NLR≥2.49017753.4OS、RFSSukato等[14]2015美国817670.4123(69.9)HCC放疗NLR≥5.0004860OSLu等[15]2016中国6963NP830(86.2)HCC手术治疗NLR>2.81122784OSJi等[16]2016中国632151285(88.8)HCC手术治疗NLR≥2.00016836DFS、OSHu等[17]2016韩国721353166(77.9)HCC手术治疗NLR≥1.50512048OS、RFS李友炳等[18]2016中国61135195(84.1)HCC手术治疗NLR≥3.6504336DFS、OS王文军等[19]2016中国742754.4346(81.0)HCCTACE/化疗NLR>2.50019653OS
注:HCC,肝细胞癌;ICC,肝内胆管细胞癌;NP,未报道;HNLR,高NLR值;TACE,经肝动脉化疗栓塞术
2.2 NLR与OS的关系 10项研究分析NLR水平与肝癌患者OS的关系,异质性检验显示各研究间无明显异质性(P>0.10,I2=0),故采用固定效应模型分析。结果显示,合并HR=1.56,95%CI:1.46~1.66,P<0.001,表明NLR升高的肝癌患者OS缩短(图2);将肝癌患者按照治疗方式(图3)以及地区分布(图4)进行亚组分析,结果显示无明显异质性。
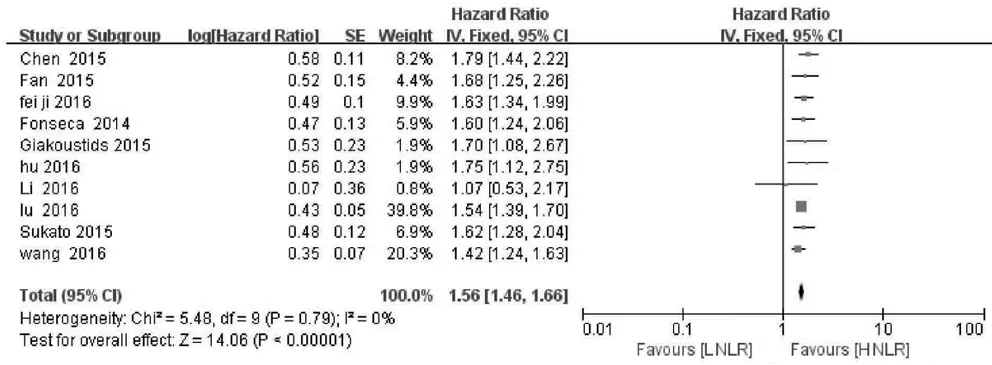
图2 NLR与肝癌患者OS关系的森林图 LNLR:低NLR值

图3 NLR与不同治疗方式的肝癌患者OS的关系
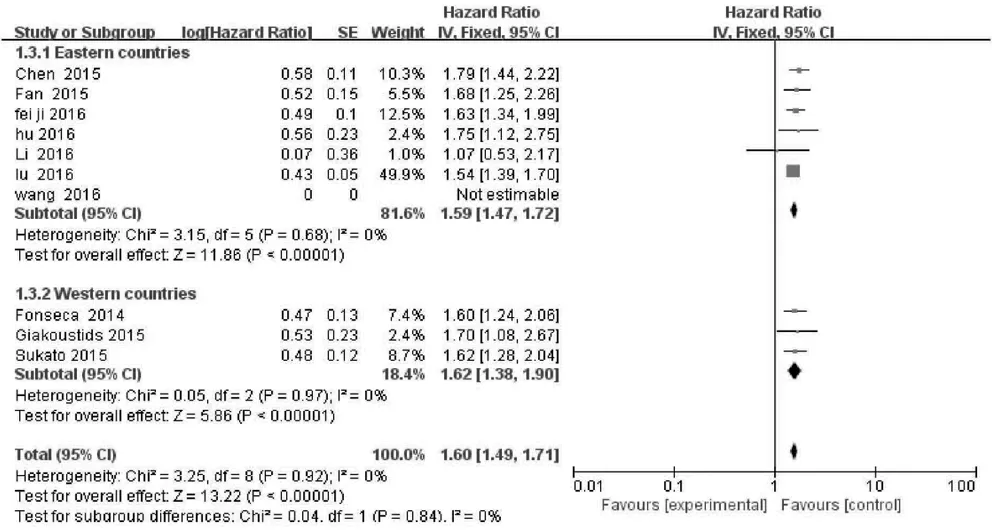
图4 NLR与不同地区的肝癌患者OS的关系
2.3 NLR与RFS的关系 4项研究分析NLR水平与肝癌患者RFS的关系,异质性检验显示各研究间无明显异质性(P>0.10,I2=28%),故采用固定效应模型分析。结果显示,合并的HR=1.54,95%CI:1.36~1.74,P<0.001,表明NLR升高的肝癌患者RFS缩短(图5)。为了探讨各组间的潜在异质性,考虑到纳入研究NLR与RFS关系的文献的国家均为亚洲国家、病例数差别小、NLR临界值差别小等因素,通过文章中患者平均年龄进行亚组分析,结果表明平均年龄亚组间存在异质性(图6)。
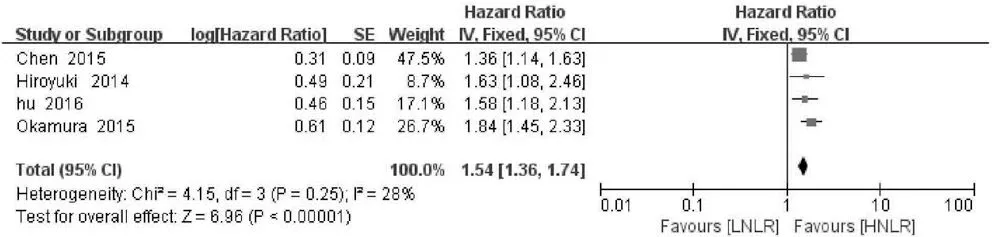
图5 NLR与肝癌患者RFS关系的森林图
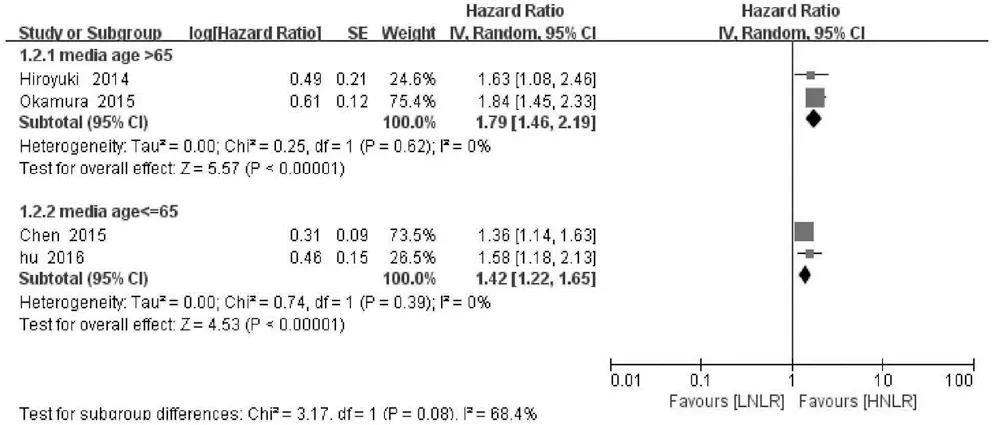
图6 NLR与不同年龄段的肝癌患者RFS的关系
2.4 NLR与DFS的关系 2项研究分析NLR水平与肝癌患者DFS的关系,异质性检验显示各研究间存在轻度异质性(P>0.10,I2=42%),故采用随机效应模型分析。结果显示,合并的HR=1.57,95%CI:1.23~2.00,P<0.001,表明NLR升高的患者DFS缩短(图7)。
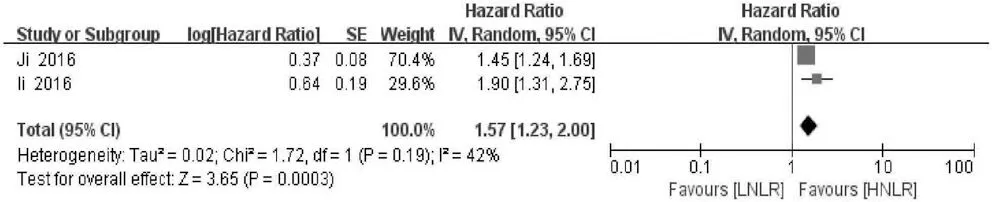
图7 NLR对DFS影响的森林图
2.5 发表偏移 不同NLR水平与肝癌患者预后指标中OS的HR、95%CI合并后的漏斗图如下(图8),RFS和DFS相关的HR、95%CI合并后的各漏斗图基本对称。
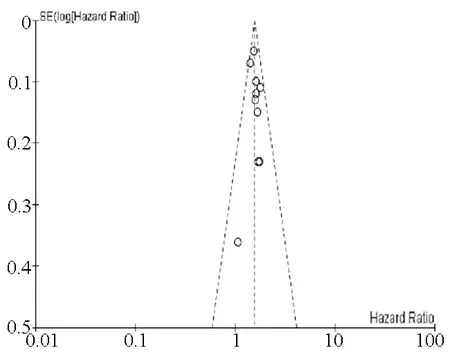
图8 NLR对OS影响的漏斗图
3 讨论
中性粒细胞在感染、肿瘤等原因所导致的机体炎症环境中扮演着重要角色,是机体正常反应、防御的重要炎症细胞,对肿瘤细胞有杀伤、破坏的作用。很早就有研究者发现在肿瘤的坏死组织以及肿瘤增生活跃的组织中可见中性粒细胞的明显浸润,说明中性粒细胞对肿瘤的生长有促进、抑制的双重作用[20-21]。进一步研究表明,中性粒细胞在肿瘤发生中的作用主要是分泌大量血管内皮生长因子、IL-1和IL-6等,进而促进生成肿瘤血管,导致肿瘤生长、发展和转移[22]。
淋巴细胞对肿瘤主要起免疫作用,其释放的细胞因子及其介导的细胞毒反应可抑制肿瘤细胞的增殖和转移。然而肿瘤细胞产生的相关细胞因子及炎性介质可导致淋巴细胞减少,降低淋巴细胞的抗肿瘤作用,从而增加患者复发、转移的风险,导致患者预后差[23]。可见,NLR对于肿瘤的发展过程是一个促进和抑制的动态平衡[24],NLR升高表明中性粒细胞的相对升高或者淋巴细胞的相对降低,导致患者机体的炎症动态平衡向着促进肿瘤发展的方向移动,提示NLR升高的肿瘤患者预后较NLR降低者差。
本研究结果表明,NLR升高的肝癌患者OS、RFS、DFS均缩短,表明预后较差。NLR是廉价、方便、易获取的检验指标,在临床工作中应得到重视,使肝癌高危人群能及时得到控制和预防,以及肝癌患者能够得到合理的评估与治疗。
本文也存在一些局限性:(1)本Meta分析纳入研究均为回顾性分析,论证强度低于临床随机对照试验,且纳入的文献仅是公开发表的中英文文献,纳入的文献可能不够全面,可能存在潜在的发表偏倚;(2)所纳入研究的文献资料中,合并数据可见仅1篇文献接近中性结果,其余文献数据为明显的阳性结果,回顾文献筛选过程,严格审查文献的纳入、排除标准,一次文献中90%(58/64)所报道结果为阳性结果,一方面说明,在研究NLR与肝癌预后相关性的相关临床试验中,炎症环境对肿瘤的发生、发展及转归确实存在一定的影响;另一方面,本文也存在一定的潜在选择偏移;(3)在分析NLR与肝癌患者OS的关系时,虽然评价NLR与肝癌患者OS偏移的漏斗图基本对称,但是由于纳入文献数量的局限性,可能存在潜在的发表偏移性,以及在研究NLR与肝癌患者RFS、DFS时,也可能存在同样的潜在偏移性;(4)在对肝癌患者RFS进行亚组分析时发现不同年龄亚组间存在异质性,由于纳入的文献只有4篇,有待于纳入更多的文献进一步研究;同时性别差异、随访时间、NLR临界值、国家也有可能产生异质性,但因缺乏足够文献及相关数据而无法进行分析;(5)缺乏相关数据而无法进一步分析NLR与肝癌分化程度、浸润深度、TNM分期等相关临床参数的关系。将来有待多中心、更全面的随机对照试验结果进行综合评判。
[1] SUN DN, HUANG X. Roles and mechanism of NF-κB in hepatocellular carcinoma development[J]. China Med Herald, 2016,13(18): 42-45.(in Cninese) 孙丹妮, 黄洵. NF-κB 在肝细胞癌发生发展中的作用及其机制研究进展[J]. 中国医药导报, 2016, 13(18): 42-45.
[2] JEMAL A, BRAY F, CENTER MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 60-90.
[3] GRIVENNIKOV SI, GRETEN FR, KARIN M. Immunity, inflammation, and cancer[J]. Cell, 2010, 140(6): 883-899.[4] Poon RT. Prevention of recurrence after resection of hepatocellular carcinoma: a daunting challenge[J]. Hepatology, 2011, 54(3): 757-759.
[6] OH BS, JANG JW, KWON JH, et al. Prognostic value of C-reactive protein and neutrophil-to-lymphocyte ratio in patients with hepatocellular carcinoma[J]. BMC Cancer, 2013, 13(1): 1-9.
[7] SULLIVAN KM, GROESCHL RT, TURAGA KK, et al. Neutrophil-to-lymphocyte ratio as a predictor of outcomes for patients with hepatocellular carcinoma: a Western perspective[J]. J Surg Oncol, 2014, 109(2): 95-97.
[8] YAMAMURA K, SUGIMOTO H, KANDA M, et al. Comparison of inflammation-based prognostic scores as predictors of tumor recurrence in patients with hepatocellular carcinoma after curative resection[J].J Hepatobiliary Pancreat Sci, 2014, 21(9): 682-688.
[9] da FONSECA LG, BARROSO-SOUSA R, BENTO ADA S, et al. Pre-treatment neutrophil-to-lymphocyte ratio affects survival in patients with advanced hepatocellular carcinoma treated with sorafenib[J]. Med Oncol, 2014, 31(11): 264.
[10] GIAKOUSTIDIS A, NEOFYTOU K, KHAN AZ, et al. Neutrophil to lymphocyte ratio predicts pattern of recurrence in patients undergoing liver resection for colorectal liver Metastasis and thus the overall survival[J]. J Surg Oncol, 2015, 111(4): 445-450.
[11] FAN W, ZHANG Y, WANG Y, et al. Neutrophil-to-lymphocyte and platelet-to-lymphocyte ratios as predictors of survival and metastasis for recurrent hepatocellular carcinoma after transarterial chemoembolization[J]. PLoS One, 2015, 10(3): e0119312.
[12] OKAMURA Y, ASHIDA R, ITO T, et al. Preoperative neutrophil to lymphocyte ratio and prognostic nutritional index predict overall survival after hepatectomy for hepatocellular carcinoma[J]. World J Surg, 2015, 39(6): 1501-1509.
[13] CHEN Q, YANG LX, LI XD, et al. The elevated preoperative neutrophil-to-lymphocyte ratio predicts poor prognosis in intrahepatic cholangiocarcinoma patients undergoing hepatectomy[J]. Tumour Biol, 2015, 36(7): 5283-5289.
[14] SUKATO DC, TOHME S, CHALHOUB D, et al. The prognostic role of neutrophil-to-lymphocyte ratio in patients with unresectable hepatocellular carcinoma treated with radioembolization[J]. J Vasc Interv Radiol, 2015, 26(6): 816-824.e1.[15] LU SD, WANG YY, PENG NF, et al. Preoperative ratio of neutrophils to lymphocytes predicts postresection survival in selected patients with early or intermediate stage hepatocellular carcinoma[J]. Medicine (Baltimore), 2016, 95(5): e2722.[16] JI F, LIANG Y, FU SJ, et al. A novel and accurate predictor of survival for patients with hepatocellular carcinoma after surgical resection: the neutrophil to lymphocyte ratio (NLR) combined with the aspartate aminotransferase/platelet count ratio index (APRI)[J]. BMC Cancer, 2016, 16: 137.
[17] HU XG, MAO W, PARK YK, et al. Blood neutrophil-to-lymphocyte ratio predicts tumor recurrence in patients with hepatocellular carcinoma within milan criteria after hepatectomy[J]. Yonsei Med J, 2016, 57(5): 1115-1123.
[18] LI YB, ZHANG J, LI GP, et al. Correlation of neutrophil-to-lymphocyte ratio with the clinicopathological characteristics and prognosis of early primary hepatocellular carcinoma[J]. Tumor, 2016, 36(7): 784-790.(in Chinese) 李友炳, 张军, 李国平, 等. 中性粒细胞/淋巴细胞比值与早期原发性肝细胞癌临床病理特征及预后的相关性[J]. 肿瘤, 2016, 36(7): 784-790.
[19] WANG WJ, ZHAO Y, XIA DD, et al. Predictive value of neutrophil-lymphocyte ratio and its dynamic change in patients with hepatocellular carcinoma undergoing transarterial chemoembolization[J]. J Clin Hepatol, 2016, 32(6): 1139-1144.(in Chinese) 王文军, 赵艳, 夏冬东, 等. 中性粒细胞与淋巴细胞比值及其动态变化对经肝动脉化疗栓塞术治疗的肝细胞癌患者预后的预测价值[J]. 临床肝胆病杂志, 2016, 32(6): 1139-1144.
[20] EIR N, VIZOSO FJ. Imflammation and cancer[J]. World J Gastrointest Surg, 2012, 4(3): 62-72.
[21] HOFMAN PM. Pathobiology of the neutrophil-intestinal epithelial cell interaction: role in carcinogenesis[J].World J Gastroenterol, 2010, 16(46): 5790-5800.
[22] ROXBURGH CS, MCMILLAN DC. Role of systemic inflammatory response in predicting survival in patients with primary operable cancer[J]. Future Oncology, 2010, 6(1): 149-163.[23] SCONOCCHIA G, EPPENBERGER S, SPAGNOLI GC, et al. NK cells and T cells cooperate during the clinical course of colorectal cancer[J]. Oncoimmunology, 2014, 3(8): e952197.[24] ZHOU WY, ZHANG JP. The association of pre-treatment neutrophil-to-lymphocyte ratios with response of neoadjuvant theropy, clinical outcome in patients with IB2-IIB cervical cancer[J]. Clin J Med Offic, 2016, 44(2): 119-123. (in Chinese) 周文毓, 张建平. IB2-IIB期宫颈癌新辅助化疗治疗前中性粒细胞与淋巴细胞比值对疗效及预后预测意义[J]. 临床军医杂志, 2016, 44(2): 119-123.
引证本文:LIU J, GAO CD, ZHANG LX, et al. Influence of neutrophil-lymphocyte ratio on prognosis of liver cancer: a meta-analysis[J]. J Clin Hepatol, 2017, 33(7): 1305-1309. (in Chinese) 刘健, 高驰丹, 张立鑫, 等. 中性粒细胞与淋巴细胞比值对肝癌预后影响的Meta分析[J]. 临床肝胆病杂志, 2017, 33(7): 1305-1309.
(本文编辑:朱 晶)
Influence of neutrophil-lymphocyte ratio on prognosis of liver cancer: a meta-analysis
LIUJian,GAOChidan,ZHANGLixin,etal.
(FirstDepartmentofHepatobiliarySurgery,TheAffiliatedHospitalofNorthSichuanMedicalCollege,Nanchong,Sichuan637000,China)
Objective To investigate the association between neutrophil-lymphocyte ratio (NLR) and prognosis of liver cancer. Methods
PubMed, Embase and Cochrane Library, CBM, VIP, Wanfang Data were searched for Chinese and English articles on the association between NLR and prognosis of liver cancer published up to October 2016. Review Manager 5.3 was used for statistical analysis of data in these articles, and funnel plots were used to evaluate publication bias. Results A total of 12 studies which met the inclusion criteria were included, with 3325 liver cancer patients in total. The meta-analysis showed that liver cancer patients with an increased NLR had significant reductions in overall survival time (hazard ratio [HR]=1.56, 95% confidence interval [95%CI]: 1.46-1.66,P<0.001), disease-free survival (HR=1.57, 95%CI: 1.23-2.00,P<0.001), and recurrence-free survival (HR=1.54, 95%CI: 1.36-1.74,P<0.001). Conclusion Liver cancer patients with an increased NLR tend to have poor prognosis, and NLR should be taken seriously in clinical practice to provide timely prognostic evaluation and rational treatment for liver cancer patients.
liver neoplasms; neutrophils; lymphocytes; prognosis; Meta-analysis
10.3969/j.issn.1001-5256.2017.07.020
2017-02-04;
2017-03-15。
刘健(1990-),男,主要从事肝胆胰疾病方面的研究。
李敬东,电子信箱::lijingdong358@126.com。
R735.7
A
1001-5256(2017)07-1305-05

