停用核苷和核苷酸类药物抗HBV后诱发慢加急性肝衰竭的临床特征
胡高飞, 李小鹏, 吴振平, 梅 清, 李 丹, 张文苑, 余婷婷, 程 娜, 张伦理
(南昌大学第一附属医院 感染病科, 江西省肝脏再生医学重点实验室, 南昌 330006)
论著/其他
停用核苷和核苷酸类药物抗HBV后诱发慢加急性肝衰竭的临床特征
胡高飞, 李小鹏, 吴振平, 梅 清, 李 丹, 张文苑, 余婷婷, 程 娜, 张伦理
(南昌大学第一附属医院 感染病科, 江西省肝脏再生医学重点实验室, 南昌 330006)
目的 探讨患者停用核苷和核苷酸类药物(NAs)抗HBV后诱发慢加急性肝衰竭(ACLF)的临床特征。方法 回顾性分析2014年6月-2016年10月南昌大学第一附属医院收治的确诊为ACLF的患者865例,其中因停药诱发ACLF的患者137例(停药组),非停用NAs诱发ACLF的患者728例(非停药组),详细记录患者抗病毒药物种类、规范抗病毒持续时间、停药方式、停药至发生肝衰竭时间、停药后监测情况、肝脏基础疾病、进展为ACLF后30 d病死率等。计量资料组间比较采用t检验;计数资料组间比较采用χ2检验。结果 非停药组728例患者中治愈或好转、死亡或无效分别为389例和339例。137例停药组患者中慢性病毒性肝炎基础69例,其中治愈或好转、死亡或无效分别为40例和29例;肝硬化基础68例,其中治愈或好转、死亡或无效分别为16例和52例,差异有统计学意(χ2=16.81,P<0.001)。137例停药患者中停药前服用拉米夫定占24.09%(33/137),阿德福韦酯占34.31%(47/137),拉米夫定联合阿德福韦酯占11.68%(16/137),恩替卡韦占27.01%(37/137)。停药组诱发ACLF时的持续时间≤6个月占57.66%(79/137),6~12个月占18.25%(25/137),>12个月占23.36%(32/137)。结论 本研究提示NAs不当停药后易诱发ACLF。一旦停药,要在停药的前6个月内密切观察乙型肝炎病毒学、肝功能、肝脏影像学等变化。肝脏基础疾病决定停药后ACLF的发生及预后,长期规范抗病毒治疗对肝硬化患者尤为重要。
肝功能衰竭; 肝炎病毒, 乙型; 核苷类; 核苷酸类
在我国引起肝衰竭的主要病因是病毒感染,尤其是HBV,HBV相关肝衰竭占肝衰竭患者的80%以上。核苷和核苷酸类药物(NAs)的长期稳定治疗,可持续抑制病毒复制,控制疾病进展,改善患者生活质量和延长生存时间[1-3]。由于患者对疾病认知、经济压力、医疗资源等的不足,自行停药或停药后未正规监测,疾病复发可进展为慢加急性肝衰竭(ACLF),预后极差。本研究旨在通过对应用NAs治疗的慢性乙型肝炎和肝硬化患者进行性别、年龄、HBV血清学、肝脏基础及停药等因素分析,探索停用NAs导致ACLF的临床特征,为正确处理NAs抗-HBV治疗中停药提供临床依据,以期使更多患者受益。
1 资料与方法
1.1 研究对象 选择2014年6月-2016年10月本院收治的HBV相关ACLF患者865例,分为停药组(因停止口服NAs抗病毒治疗诱发的ACLF,n=137)和非停药组(n=728)。所有患者ACLF临床诊断均符合《肝衰竭诊治指南(2012年版)》[4],慢性乙型肝炎、肝硬化诊断标准符合《慢性乙型肝炎防治指南(2015年更新版)》[1]。排除标准:(1)未成年人;(2)合并药物、毒物、酒精、遗传代谢性疾病等所致肝损伤;(3)合并其他急性嗜肝病毒、非嗜肝病毒感染;(4)合并肝脏或其他系统恶性肿瘤;(5)妊娠或哺乳期妇女。
1.2 仪器设备 血生化采用日立7600 型全自动生化分析仪及其配套试剂检测;凝血功能采用日本Sys-mex CA1500 型全自动血凝仪测定。凝血试剂盒和质控品均为希森美康医用电子有限公司提供的原装配套试剂;乙型肝炎五项定量采用化学发光免疫分析法,仪器为雅培Axsym 全自动化学发光免疫分析仪,试剂盒购自美国雅培公司。HBV DNA 检测采用荧光定量聚合酶链反应(FQ-PCR)技术,仪器为厦门安普利生物工程有限公司GeneLight9810荧光定量PCR仪,试剂盒为该公司配套试剂,HBV DNA载量≥500 IU/ml为阳性,<500 IU/ml为阴性。各项检测均严格按试剂盒说明书进行。
1.3 研究方法 收集停药组因停药导致ACLF的NAs种类、持续抗病毒时间、停药方式、停止抗病毒持续时间、肝脏基础疾病、乙型肝炎血清标志物、预后等资料。
1.4 疗效评价及观察 病情转归以患者入住本院至出院当天为截止点,判定标准:(1)临床治愈:①乏力、纳差、腹胀、尿少、出血倾向和肝性脑病等临床症状消失;②黄疸消退,肝脏恢复正常大小;③肝功能指标基本恢复正常,PTA恢复正常。(2)临床好转标准:①乏力、纳差、腹胀、出血倾向等临床症状明显好转,肝性脑病消失;②黄疽、腹水等体征明显好转[1];③肝功能指标明显好转(TBil降至正常值的8倍以下)。其余判定为无效、死亡。
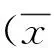
2 结果
2.1 一般资料 非停药组728例患者中治愈或好转、死亡或无效分别为389例(53.43%)和339例(46.57%),16例(2.20%)进展为ACLF后生存时间<30 d。
停药组137例患者中只有1例在达到停药标准[2]后正规停药,后未规律至专科随诊监测乙型肝炎病毒学、肝功能等变化;129例在随诊过程中出现HBV DNA阴转、肝功能正常时,自行终止治疗,且停药后未至专科随诊;5例为抗病毒疗程<1个月,自行停药;2例为抗病毒效果欠佳(有NAs耐药可能),自行终止治疗。停药组患者中男122例,女15例,年龄23~70岁,平均(43.54±9.61)岁,病程5~90 d,平均(23.39±17.41)d,住院天数为1~113 d,平均(34.67±26.00)d,治愈或好转、死亡或无效分别为56例(40.88%)和81例(59.12%),53例(38.69%)进展为ACLF后生存时间<30 d。HBeAg阳性75例,其中治愈或好转、死亡或无效分别为29例和46例;HBeAg阴性62例,其中治愈或好转、死亡或无效分别为27例和35例,二者差异无统计学意义(P>0.05)。停药组患者一般资料比较详见表1。
2.2 停用的NAs种类及诱发ACLF的时间 137例停药患者中,拉米夫定占24.09%,阿德福韦酯占34.31%,拉米夫定联合阿德福韦酯占11.68%,恩替卡韦占27.01%,阿德福韦酯联合恩替卡韦占1.46%,替诺福韦占0.73%,阿德福韦酯联合替比夫定占0.73%。持续抗病毒的时间1~192个月,平均18(8~34)个月,其中≤12个月占37.96%(52/137),12~24个月占21.17%(29/137),>24个月占40.88%(56/137)。停止抗病毒持续的时间1~96个月,平均(12.91± 0.24)个月,其中≤6个月占57.66%(79/137), 6~12个月占18.25%(26/137), >12个月占23.36%(32/137)。137例患者持续抗病毒及停止抗病毒的临床分布特征详见表2。
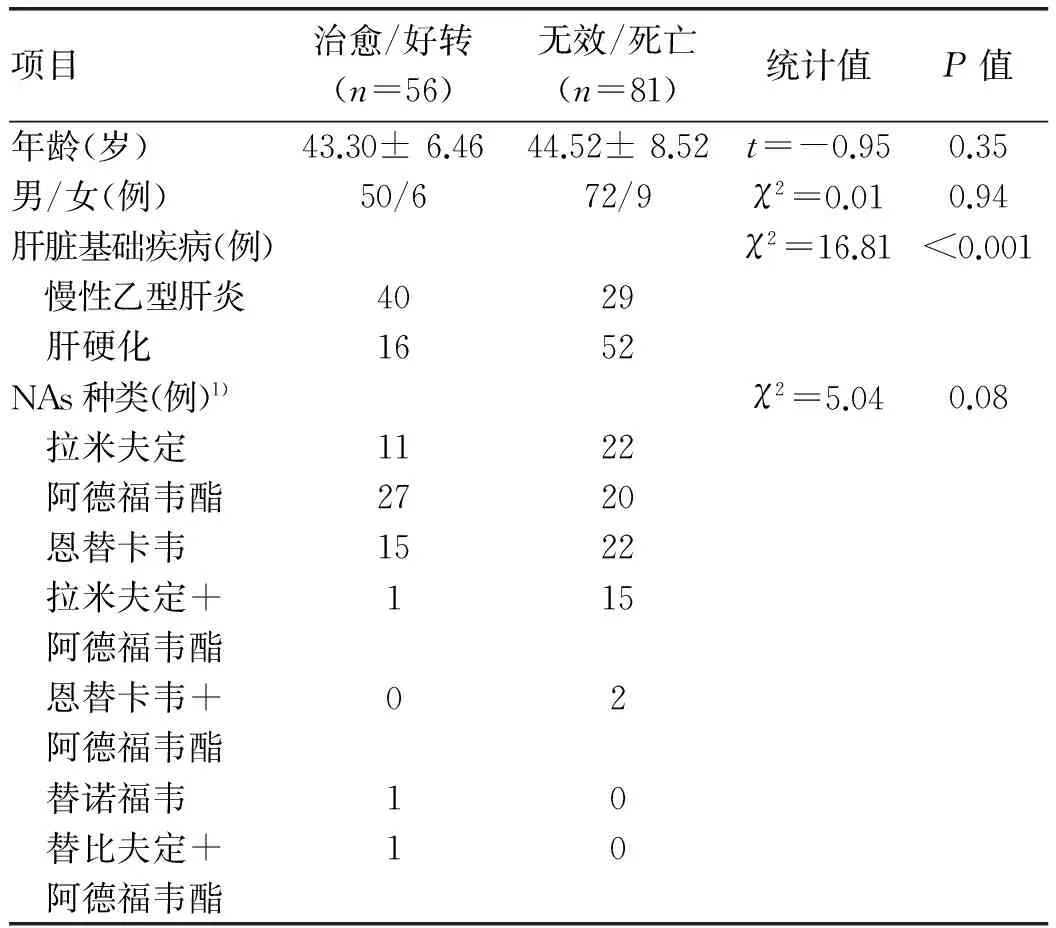
表1 停药组患者的一般特征及临床特点
注:1)仅对前3种药物进行了统计分析
3 讨论
目前NAs是我国大多数慢性乙型肝炎患者抗-HBV治疗的优先选择,由于就诊医院、乙型肝炎知识水平、健康信念及社会支持等[5]影响而出现停药现象,本研究中只有1例患者按照指南标准停止抗病毒治疗,其余均为治疗期间自行非正规停药。Shouval等[6]及Hadziyannis等[7]发现未达到停药标准而停用NAs的肝炎复发率高达80%以上,甚至进展为HBV相关ACLF,且比例逐年升高[8-9]。究其原因:(1)NAs可有效抑制体内HBV复制,Phillips等[10]发现体内HBV的清除主要取决于HBV特异性CD8+T淋巴细胞的数量及功能状态,长期有效的抗病毒治疗能够恢复HBV特异性CD8+T淋巴细胞的功能[11],但不足以清除病毒并建立持久的T淋巴细胞免疫反应,提示恢复程度不够[12],即不能清除HBV cccDNA,而cccDNA是病毒持续复制的来源[13];(2)抗-HBV治疗患者停用抗病毒药物后,反弹的HBV迅速增殖,大量效应T淋巴细胞及强烈的免疫反应对受感染肝细胞产生强烈的免疫损伤,导致大量肝细胞坏死,造成严重肝炎[13]。
本研究发现停药诱发的ACLF的病死/自动出院率(59.12%)高于非停药组(46.57%),提示停药诱发ACLF后预后欠佳。停止NAs治疗的患者6个月内进展为ACLF概率最高,提示停药的6个月内需密切监测乙型肝炎病毒学、肝功能等,及时中断疾病进展,这与刘碧霞等[14]的报道一致。提示临床医生在向患者提供抗-HBV治疗时,须交代患者长期规律口服NAs治疗的依从性,告知其不得擅自停药,并建立严密的随访制度。 本研究提示肝硬化基础的患者与慢性病毒性肝炎患者的预后比较有统计学意义(P<0.05),提示肝硬化基础诱发ACLF的病死率或无效率更高,这与肝硬化假小叶结构导致血流动力学障碍有关[15]。对拉米夫定、阿德福韦酯、恩替卡韦停药后患者的预后比较差异无统计学意义,提示任一种NAs停药后均可诱发ACLF,且预后欠佳。由于本研究收集的阿德福韦酯联合恩替卡韦、替诺福韦、阿德福韦酯联合替比夫定病例数不足,未行统计学分析比较。本研究统计分析停药前患者的血清学HBeAg阳性和阴性病例的预后结局,提示无统计学差异(P>0.05),这与巫贵成等[16]的报道一致。
目前尚无实现停药后持续病毒学应答的标准治疗方案[17]。本研究提示肝硬化基础患者长期规范抗病毒治疗较慢性病毒性肝炎患者尤为重要,抗HBV治疗须在专科医师指导下进行,不得擅自停药。若已自行停药须严密监测乙型肝炎病毒学、肝功能等,尤其在停药的6个月内。拉米夫定、阿德福韦酯及恩替卡韦停药后均诱发ACLF,且预后欠佳,提示上述任一种NAs均不得擅自停用。另外,本研究入组病例数量有限,今后有待进行多中心、大样本研究。
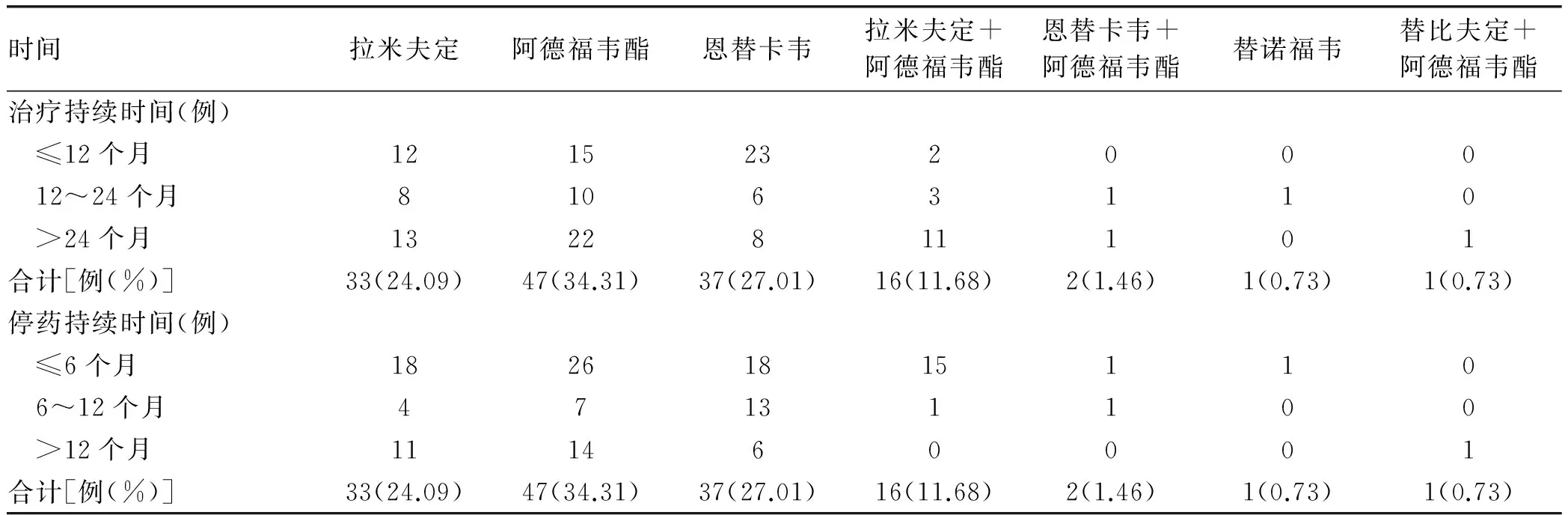
表2 停药组患者NAs治疗持续时间和停药持续时间分布情况
[1] Chinese Society of Hepatology and Chinese Society of Infectious Diseases, Chinese Medical Association. The guideline of prevention and treatment for chronic hepatitis B: a 2015 update[J]. J Clin Hepatol, 2015, 31(12): 1941-1960. (in Chinese) 中华医学会肝病学分会, 中华医学会感染病学分会. 慢性乙型肝炎防治指南(2015年更新版)[J]. 临床肝胆病杂志, 2015, 31(12): 1941-1960.
[2] ZHAN DA, LIU H, CHEN XJ, et al. The clinical efficacy of telbivudine and adefovir ester combination therapy of hepatitis B patients with high viral loads[J]. Int J Virol, 2016, 23(1): 17-19. (in Chinese) 詹东昂, 刘华, 陈秀记, 等. 替比夫定联用阿德福韦酯在高病毒载量乙肝患者中的应用效果[J]. 国际病毒学杂志, 2016, 23(1): 17-19.
[3] ZHANG Y, YU YS, TANG ZH, et al. Clinical study of entecavir combined with kushenin improving the Th1/Th2 imbalance in patients with HBeAg-positive chronic hepatitis B[J]. Chin J Clin Pharmacol Ther, 2016, 21(10): 1168-1172. (in Chinese) 张毅, 余永胜, 汤正好, 等. 恩替卡韦联合苦参素改善HBeAg阳性慢性乙型肝炎患者Th1/Th2失平衡临床研究[J]. 中国临床药理学与治疗学, 2016, 21(10): 1168-1172.
[4] Liver Failure and Artificial Liver Group, Chinese Society of Infectious Diseases, CMA; Severe Liver Disease and Artificial Liver Group, Chinese Society of Hepatology, CMA. Guideline for diagnosis and treatment of liver failure (2012 version)[J]. Chin J Clin Infect Dis, 2012, 5(6): 321-327. (in Chinese) 中华医学会感染病学分会肝衰竭与人工肝治疗组, 中华医学会肝病学分会重型肝病与人工肝学组. 肝衰竭诊治指南(2012年版)[J]. 中华临床感染病杂志, 2012, 5(6): 321-327.
[5] FENG H, HE GP. The study of the compliance of patients with chronic hepatitis B and influence factors[J]. Chin J Nurs, 2005, 40(12): 891-894. (in Chinese) 冯辉, 何国平. 慢性乙型病毒性肝炎患者治疗依从性及其影响因素分析[J]. 中华护理杂志, 2005, 40(12): 891-894.
[6] SHOUVAL D, LAI CL, CHANG TT, et al. Relapse of hepatitis B in HBeAg-negative chronic hepatitis B patients who discontinued successful entecavir treatment: the case for continuous antiviral therapy[J]. J Hepatol, 2008, 50(2): 289-295. [7] HADZIYANNIS SJ, TASSOPOULOS NC, HEATHCOTE EJ, et al. Long-term therapy with adefovirdipivoxil for HBeAg-negative chronic hepatitis B[J]. N Eng J Med, 2005, 352(26): 2673-2681.
[8] LIU XY, CHEN J, XIAO L, et al. Clinical features of HBV-associated acute-on-chronic liver failure induced by discontinuation of nucleoside analogues[J]. J Clin Hepatol, 2016, 32(9): 1766-1769. (in Chinese) 刘晓燕, 陈婧, 肖珑, 等. 停用核苷和核苷酸类药物诱发HBV相关慢加急性肝衰竭患者的临床特点分析[J]. 临床肝胆病杂志, 2016, 32(9): 1766-1769.
[9] LI XP, LEI W, ZHANG LL, et al. The clinical significance of stop using nucleotide (acid) antiviral drugs ininduced factors of severe hepatitis[C]. The 16th national congress of viral hepatitis and liver disease in China, 2013. (in Chinese) 李小鹏, 雷湾, 张伦理, 等. 停用核苷(酸)类抗病毒药物在重型肝炎诱发因素中的临床意义[C]. 中华医学会第十六次全国病毒性肝炎及肝病学术会议论文汇编, 2013.
[10] PHILLIPS S, CHOKSHI S, RIVA A, et al. CD8(+) T cell control of hepatitis B virus replication: direct comparison between cytolytic and noncytolyticfunctions[J]. J Immunol, 2010, 184(1): 287-295.
[11] BONI C, LACCABUE D, LAMPERTICO P, et al. Restored function of HBV-specific T cells afterlong-term effective therapy with nucleos(t)ide analogues[J]. Gastroenterology, 2012, 143(4): 963-973, e969.
[12] LIU BX, ZHANG LL, ZHANG WF. Changes of hepatitis B core antigen-specific cytotoxic T lymphocytes in chronic hepatitis B patients during antiviral treatment and relapse after withdrawal of treatment[J]. Chin J Infect Dis, 2016, 34(8): 480-484. (in Chinese) 刘碧霞, 张伦理, 张文峰. 慢性乙型肝炎患者抗病毒治疗与停药复发后体内乙型肝炎核心抗原特异性T淋巴细胞变化[J]. 中华传染病杂志, 2016, 34(8): 480-484. [13] SEEGER C, MASON WS. Molecular biology of hepatitis B virus infection[J]. Virology, 2015, 479-480: 672-686.
[14] LIU BX, ZHANG LL, LI XP, et al. Curative effect of chronic hepatitis B second treatment with entecavir when non-standarded stopantiviral therapy[J]. Guangdong Med J, 2015, 36(8): 1263-1265. (in Chinese) 刘碧霞, 张伦理, 李小鹏, 等. 慢性乙型肝炎不规范停用恩替卡韦复发后再次恩替卡韦治疗的效果[J]. 广东医学, 2015, 36(8): 1263-1265.
[15] TSOCHATZIS EA, BOSCH J, BURRROUGHS AK. Liver cirrhosis[J]. Lancet, 2014, 383(9930): 1749-1761.
[16] WU GC, ZHOU WP, ZHAO YR, et al. A study on the long-term outcome of hepatitis B e antigen-negative chronic hepatitis B compared with that of hepatitis B e antigen-positive chronic hepatitis B[J]. Chin J Infect Dis, 2007, 25(3): 166-168. (in Chinese) 巫贵成, 周卫平, 赵有蓉, 等. 乙型肝炎e抗原阴性和阳性慢性乙型肝炎患者临床转归的回顾性分析[J]. 中华传染病杂志, 2007, 25(3): 166-168.
[17] KANG W, PARK JY. When to stop nucleos(t)ide analogues treatment for chronic hepatitis B? Durability of antiviral response[J]. World J Gastroenterol, 2014, 20(23): 7207-7212.
引证本文:HU GF, LI XP, WU ZP, et al. Clinical features of acute-on-chronic liver failure induced by withdrawal of nucleos(t)ide analogues[J]. J Clin Hepatol, 2017, 33(7): 1320-1323. (in Chinese) 胡高飞, 李小鹏, 吴振平, 等. 停用核苷和核苷酸类药物抗HBV后诱发慢加急性肝衰竭的临床特征[J]. 临床肝胆病杂志, 2017, 33(7): 1320-1323.
(本文编辑:林 姣)
Clinical features of acute-on-chronic liver failure induced by withdrawal of nucleos(t)ide analogues
HUGaofei,LIXiaopeng,WUZhenping,etal.
(DepartmentofInfectiousDiseases,TheFirstAffiliatedHospitalofNanchangUniversity&JiangxiKeyLaboratoryofLiverRegenerativeMedicine,Nanchang330006,China)
Objective To investigate the clinical features of patients with hepatitis B virus-related acute-on-chronic liver failure (ACLF) induced by the withdrawal of nucleos(t)ide analogues (NAs). Methods A retrospective analysis was performed for the clinical data of 865 patients who were admitted to The First Affiliated Hospital of Nanchang University from June 2014 to October 2016 and diagnosed with ACLF. Among these patients, 137 experienced ACLF induced by drug withdrawal (withdrawal group) and 728 experienced ACLF not induced by drug withdrawal (non-withdrawal group). The type of antiviral drugs, duration of standard antiviral therapy, withdrawal way, time from withdrawal to the development of liver failure, monitoring after withdrawal, underlying liver diseases, and 30-day mortality after progression to ACLF were recorded in detail. Thet-test was used for comparison of continuous data between groups, and the chi-square test was used for comparison of categorical data between groups. Results Of all the 728 patients in the non-withdrawal group, 389 were cured or improved and 339 died or had no response. Of all the 137 patients in the withdrawal group, 69 had chronic viral hepatitis, among whom 40 were cured or improved and 29 died or had no response; 68 had liver cirrhosis, among whom 16 were cured or improved and 52 died or had no response; there was a significant difference (χ2=16.81,P<0.001). Of all the 137 patients in the withdrawal group, before withdrawal, 33 (24.09%) used lamivudine, 47 (34.31%) used adefovir dipivoxil, 16 (11.68%) used lamivudine combined with adefovir dipivoxil, and 37 (27.01%) used entecavir. Of all patients in the withdrawal group, when they developed ACLF, 79 (57.66%) had a duration of drug withdrawal of ≤6 months, 25 (18.25%) had a duration of 6-12 months, and 32 (23.36%) had a duration of >12 months. Conclusion Improper withdrawal of NAs can easily induce ACLF. The changes in virologic parameters, liver function parameters, and liver imaging findings should be closely monitored for patients with hepatitis B within 6 months after withdrawal. Underlying liver diseases determine the development and prognosis of ACLF after withdrawal, and long-term standard antiviral therapy is of great importance in patients with liver cirrhosis.
liver failure; hepatitis B virus; nucleosides; nucleotides
10.3969/j.issn.1001-5256.2017.07.023
2017-01-16;
2017-01-27。
江西省科技支撑计划社发项目(20151BBG70221)
胡高飞(1990-),女,主要从事感染病学的研究。
张伦理,电子信箱:lunliz@126.com。
R575.3
A
1001-5256(2017)07-1320-04

