羟基酪醇对LPS引起的小鼠急性肺损伤的保护作用
魏静元
(辽宁省分析科学研究院,辽宁 沈阳 110015)
羟基酪醇对LPS引起的小鼠急性肺损伤的保护作用
魏静元
(辽宁省分析科学研究院,辽宁 沈阳 110015)
探索了羟基酪醇通过调控自噬在小鼠ALI模型中发挥其抗炎作用的潜在分子机制。通过Western印迹和染色方法检测LPS诱导的ALI小鼠细胞因子活性、炎症因子水平、sirtuin(SIRT1/3/6)表达、丝裂原活化蛋白激酶(MAPK)激活和自噬标志物表达,用Sybyl/Surflex模块研究了HT与SIRT和MAPK之间的分子对接。结果显示,LPS刺激的SIRT抑制、MAPK磷酸化和自噬抑制均被HT给药显著消除。伴随着BAL液中肺W/D比值、蛋白质浓度和炎症细胞水平的降低,HT治疗显著减弱肺水肿和炎症细胞浸润到肺组织中。包括TNF-α、IL-1β、IL-6、IL-10和MCP-1等炎症介质的LPS驱动释放,被HT强烈调控。
羟基酪醇;脂多糖;自噬;急性肺损伤;sirtuin蛋白
羟基酪醇(hydroxytyrosol,HT),又名 3,4-二羟基苯乙醇,是一种天然抗氧化剂,广泛存在于橄榄科橄榄属植物的枝叶及果实中,是橄榄油的有效成分,其对急性肺损伤(ALI)自噬作用引起越来越多的关注。自噬是细胞蛋白质和细胞器自我降解的过程,已被发现参与不同的生理过程,包括炎症反应和组织损伤[1]。已经证明,自噬缺陷的小鼠,腹膜腔内注射脂多糖(LPS)导致相对于对照小鼠更高水平的促炎细胞因子和高死亡率[2]。此外,某些研究[3-4]涉及一些sirtuin家族成员在炎症过程中发生的保护机制,最近已经开发了药理学方法通过靶向其活动来调节炎症。然而,确切的作用机制尚未得到充分阐述。
急性肺损伤(ALI)和急性呼吸窘迫综合征(ARDS)与肺对感染性、炎性或化学损伤的一致反应有关,因此通常与全身性疾病如败血症或重大创伤相关[5]。具体来说,肺是多发性传染病的常见目标,包括严重急性呼吸综合征(SARS)病毒或禽流感AH5N1病毒,两者都会导致因ARDS并发症而致无法接受的高死亡率[6]。因此,ALI/ARDS成了全球公共卫生的主要负担,导致医疗支出巨大,死亡率高达30%~50%[7]。在过去几十年中,尽管在支持性护理治疗方面有所改善,但尚未开发出具体针对ALI/ARDS的药物治疗方案[5,8]。
含有大量橄榄油的地中海饮食与心血管疾病和某些癌症的较低发病率相关[9]。在这些橄榄油酚中,具有生物活性的酚类化合物,如羟基酪醇(HT)被认为是最丰富和最有代表性的多酚[10-11]。最近的几项研究表明,HT具有抗氧化[12]、抗炎[13]和抗菌[14]活性。同时,研究表明,HT没有毒性[15],是商业上可用的食品和营养补充剂[10,15]。此外,HT的抗炎功效也已在体外和体内广泛研究和阐明[14]。然而,HT对感染性肺损伤和炎症反应(如ALI/ARDS中所见)的影响尚未完全了解。
本研究的目的是评估HT对减少炎症、促进自噬和激活SIRT的作用,并将这些作用与地塞米松(DXM)进行比较。
1 材料与方法
1.1 试剂
HT:纯度>98%,西安应化生物科技公司;
脂多糖(LPS,大肠杆菌O111:B4):美国Sigma-Aldrich公司;
地塞米松(DXM):纯度>99.6%,美国Sigma-Aldrich公司;
小鼠白介素(IL)-1β、IL-6、IL-10和肿瘤坏死因子-α(TNF-α)ELISA试剂盒:美国Biolegend公司;
丝裂原活化蛋白激酶(MAPKs)家族抗体(包括ERK、JNK和p38)、小鼠β-肌动蛋白单克隆抗体和辣根过氧化物酶(HRP)标记的抗小鼠和兔IgG(磷酸化和非磷酸化)(H+L)二抗:美国ABclonal Biotech 有限公司;
LC3、Beclin-1和SIRT3一抗:美国Cell Signaling Technology 公司;
SIRT1一抗、SIRT6一抗:英国Abcam公司;
单核细胞趋化蛋白1(MCP-1)一抗:美国NOVUS Biologicals 公司;
其他化学试剂:分析纯,碧云天生物科技有限公司。
1.2 试验设计
BALB/c小鼠:雄性,6周龄,体重约20 g,中国医科大学实验动物中心。实验室温度(24±1) ℃,相对湿度60%。将小鼠饲养在具有过滤空气、高压灭菌木床、食物和水的灭菌微型隔离器笼中。所有的试验程序按照实验室动物福利指南操作。在试验期间没有小鼠死亡,没有明显的疲惫迹象。
1.2.1 LPS 刺激方案 小鼠随机分为4组。在LPS攻击前1 h给予相应的药物或生理盐水处理。 在LPS滴注后24 h处死小鼠。
(1) 对照组:生理盐水,每只小鼠0.2 mL,灌胃。
(2) LPS组:每只小鼠10 μg,鼻内[16]。
(3) HT + LPS组:HT,100 mg/kg,灌胃;LPS,每只小鼠10 μg,鼻内[17]。
(4) DXM + LPS组:DXM,5 mg/kg,灌胃;LPS,每只小鼠10 μg,鼻内[17]。
1.2.2 药品管理 每次在相应的LPS攻击前1 h,灌胃小鼠生理盐水(每只小鼠0.2 mL)或HT(100 mg/kg,溶于生理盐水)。DXM是一种合成的肾上腺皮质激素,用于治疗各种炎性疾病。 因此,在本研究中,DXM(5 mg/kg,溶于生理盐水,灌胃)作为阳性对照。
1.3 方法
1.3.1 支气管肺泡灌洗(BAL)液收集和肺组织分离 最后一次攻击24 h后,将小鼠麻醉并进行气管切开术。通过具有0.5 mL高压灭菌的PBS(pH=7.2)的气管插管进行BAL液的3次收集,总体积约1.3 mL,流体的回收率约为87%。将收集的BAL液体样品在4 ℃下以700×g离心10 min,并将上清液在-80 ℃下冷冻以进一步做 ELISA,然后将细胞沉淀物处理并用作炎性细胞分析的样品。 从未进行BAL液收集的小鼠中同时收获肺组织,然后用优化切割温度(O.C.T.)化合物或-80 ℃保存做进一步试验,包括western印迹分析、形态学研究和免疫组织化学染色。
1.3.2 支气管肺泡灌洗(BAL)液分析
(1) BAL液的细胞分类计数:将细胞沉淀再次悬浮于1 mL红细胞裂解缓冲液中,以除去红细胞。 随后,4 ℃,700×g离心10 min将白细胞分离。 然后,将这些白细胞沉淀再次悬浮于1.0 mL PBS(pH=7.2)中,并使用KWIK-DIFFTM染色试剂盒(Thermo Fisher Scientific Inc)进行染色。每个样品总共200个细胞用于细胞分类计数,包括用血细胞计数器手工计算的淋巴细胞和嗜中性粒细胞。
(2) 细胞因子和趋化因子的测量:每个样品的浓度一式两份测定。 根据制造商的说明书,使用ELISA试剂盒测量BAL液样品中细胞因子的含量,包括IL-1β、IL-6、IL-10和TNF-α。
1.3.3 肺免疫组织化学和组织学染色 对于组织病理学评估,分离未经BAL的小鼠的肺组织,4 ℃下固定于4%多聚甲醛中24 h,PBS中洗涤后,4 ℃下在30%蔗糖中温育过夜,然后嵌入O.C.T. 化合物并在-20 ℃冷冻。
7 μm厚的连续冰冻切片和一抗MCP-1(PBS 1∶2 000稀释)进行免疫组化孵育。二抗是用于MCP-1染色的抗鼠IgG。此外,组织切片用苏木精和伊红(H&E)染色用于炎症细胞浸润。显微照片被裁剪并校正了亮度和对比度,但没有进行其他操作。进行肺切片炎症细胞浸润和黏液产生的半定量分析时[18],为了确定炎性细胞浸润的严重程度,以盲法评估支气管细胞计数,并在5分评分系统上评分:0,无细胞;1,几个细胞;2,细胞环1个细胞层深;3,细胞环2~4个细胞深;4,细胞环超过4个细胞深。为了确定黏液生成的大小,使用5点分级系统以盲法定量气道上皮中的杯状细胞增生:0,无杯状细胞;1,25%;2,25%~50%;3,50%~75%;4,75%。每个肺段至少在3个不同的区域进行炎症细胞和杯状细胞的评分。
1.3.4 分子对接 进行对接研究以探索HT与SIRT和MAPK的潜在结合模式。 它们使用Sybyl程序包(X版)构建,使用鲍威尔方法(Powell’s method)优化,具有几个收敛标准(kJ/mol/nm)的三重力场,并使用Gasteiger-Hückel方法[16]。 对接研究使用Sybyl / Surflex模块进行;SIRT1周围不同半径内残留物(PDB ID:4I5I在0.250 nm处分解)、SIRT3(用PDB ID:3GLS在0.270 nm处分解)、ERK(用PDB ID:4QYY解析为0.165 nm)、JNK(0.179 nm与PDB ID:5AWM)和p38(在0.230 nm,PDB ID:2YIX解析)定义为活性位点。Surflex-Dock程序用于具有默认参数的对接计算,产生的莫尔卡德表面(Molcad surfaces)以观察对接的蛋白质-配体复合物的结合模式。
1.3.5 蛋白质印迹(Western blotting) 将肺组织加入到Western和IP的细胞裂解缓冲液中,分别按照制造商的说明书在蛋白酶和磷酸酶抑制剂的冰上均质化。 将匀浆在4 ℃下以14 000×g离心10 min,除去小部分的蛋白质定量外,上清液分装储存在-80 ℃。 根据制造商的方案,使用BCA蛋白测定试剂盒测定蛋白质浓度。 在免疫印迹的每个泳道中加载等量的80 μg蛋白质,通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,然后转移到聚偏二氟乙烯膜(PVDF)上。
当前社会发展得非常快,数字媒体技术专业核心能力构建和发展工作应该根据的社会的发展而与时俱进,要灵活运用互联网工具来强化数字媒体技术专业核心能力构建和发展工作的开展。数字媒体技术专业核心能力构建和发展应该随着社会的变革而变革,在当今社会教师活动可以通过新媒体或者互联网来做到宣传推广,还可以通过校园内部的广播、校报等方式进行宣传。利用微信、微博等交流工具,将开展数字媒体技术专业核心能力构建和发展的方式运用到互联网上,加快各个之间的交流,分享自身进行,讨论工作上的不足之处,对的数字媒体技术专业核心能力构建和发展工作有着非常好的作用。
用含0.1% Tween-20(TBST)的Tris缓冲盐水洗涤后,用一抗检测免疫印迹。 通过使用过氧化物酶缀合的二级抗小鼠或抗兔抗体再次洗涤3次后,使用增强型化学发光试剂盒开发结合的抗体。 使用预定分子量标准作为标记。
1.4 统计分析
使用SPSS软件(版本13.0)进行数据分析,并以平均值±SEM表示。组间比较采用单因素方差分析或t检验。 生存日期由Kaplan-Meier文本呈现,并通过对数秩和检验进行比较。#P<0.05或##P<0.01,相对于对照组;*P<0.05 或 **P<0.01,相对于LPS组;方差分析,使用Tukey-Kramer HSD比较所有组对。
2 结果与分析
2.1 羟基酪醇对促炎细胞因子和趋化因子水平的影响
由图1可知,HT(100 mg/kg)和DXM(5 mg/kg)的治疗有效地影响BAL液中TNF-α、IL-1β、IL-6和IL-10的分泌(P<0.01)。 进一步观察HT对MCP-1在小鼠肺组织中的表达的影响见图2。与模型小鼠相比,HT处理降低了MCP-1在肺组织中的表达。此外,HT在100 mg/kg的调节作用与5 mg/kg DXM的相当。 说明HT对肺部炎症的调节作用可能与Th1/Th2细胞因子平衡有关。

图1 HT对BAL液评估的影响
2.2 羟基酪醇对BAL液中肺炎症细胞积累的影响
越来越多的证据[2,19-20]表明,LPS刺激白细胞聚集到炎症部位并导致随后的全身炎症。 由图3可知,与生理盐水处理组相比,暴露于LPS的BAL液中的白细胞水平显著升高(P<0.01)。与LPS组相比,用HT预处理显著抑制LPS诱导的总炎症细胞、嗜中性粒细胞和淋巴细胞增加(P<0.05或P<0.01)。 此外,100 mg/kg的HT抑制与5 mg/kg的DXM(与DXM+LPS组相比,P>0.05)相当。
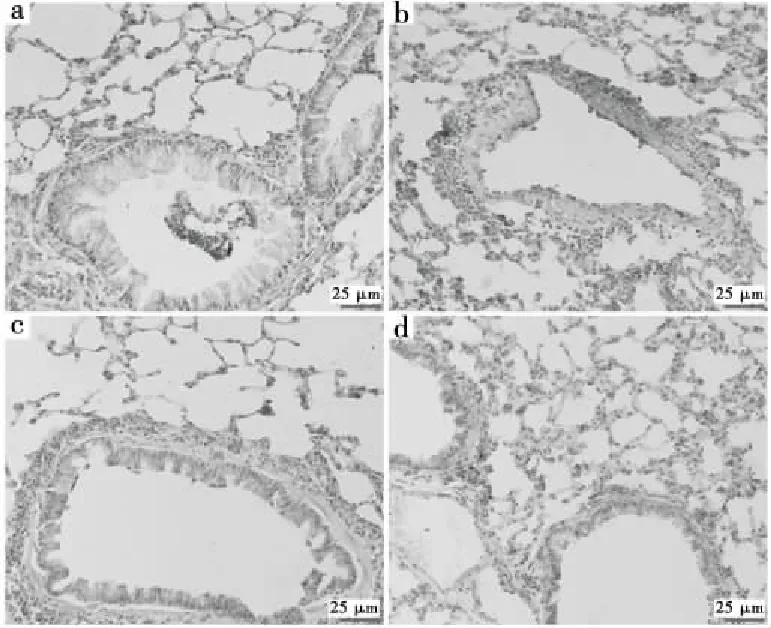
(a) 对照组 (b) LPS组 (c) HT+LPS组 (d) DXM+LPS组
在LPS攻击后24 h,取出肺组织并包埋在最佳切割温度(O.C.T.)化合物中。对于MCP-1,一抗稀释度为1/2 000,对7 μm厚度连续冷冻切片进行免疫染色。重复试验3次,得到类似的结果
图2 HT对肺内MCP-1表达的影响
Figure 2 Effect of HT on MCP-1 expression in lungs
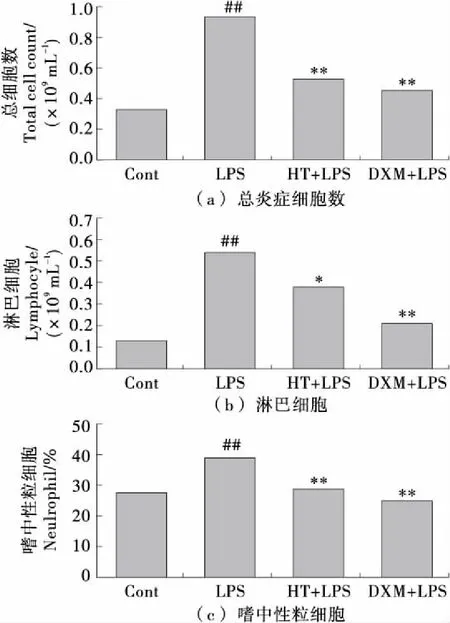
图3 通过Kwik-Diff染色,HT对BAL液中炎症细胞募集的影响
由图4可知,苏木精-伊红染色显示,在没有HT预处理的情况下,LPS施用24 h后对肺部造成广泛的形态学损伤,其表现为充血、水肿、白细胞聚集、增加肺泡间隔厚度,甚至肺泡塌陷。试验表明,在HT+LPS组中,LPS攻击引起的病理症状得到改善。此外,在HT和DXM治疗组之间没有观察到组织病理学染色的显著差异。全肺炎症被定义为支气管炎炎症评分的平均值见图5(a)。这些染色特征表明HT对LPS诱导的肺组织损伤具有保护作用。
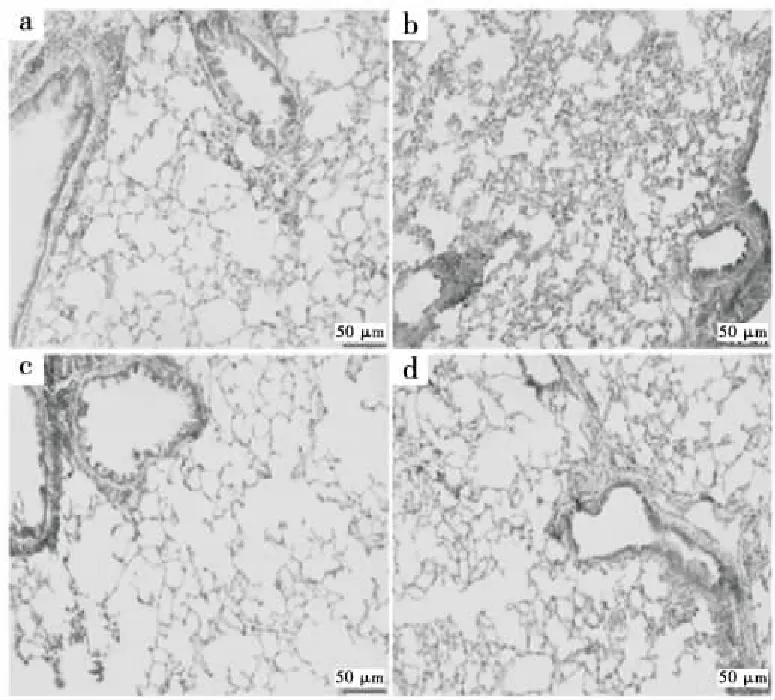
(a) 对照组 (b) LPS组 (c) HT+LPS组 (d) DXM+LPS组
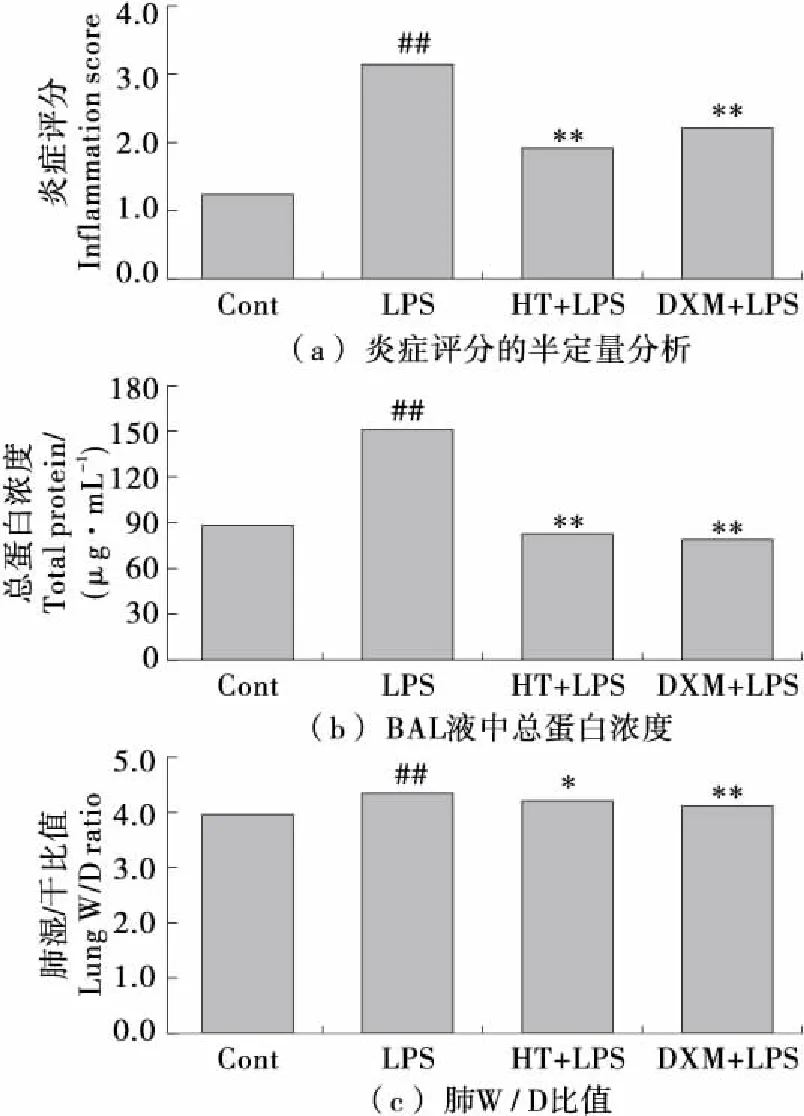
图5 HT对肺组织生理学变化的影响
2.4 羟基酪醇对LPS诱导的肺水肿和血管通透性变化的影响
BAL液中的总蛋白含量作为肺血管通透性的体内测量。由图5(b)可知,与生理盐水组相比,LPS单独处理显著增加BAL液中总蛋白浓度(P<0.01),而用HT治疗可显著抑制肺部蛋白渗漏(P<0.01)。此外,由图5(c)可知,LPS刺激后肺湿/干比率与对照组相比大幅增加(P<0.01)。然而,在LPS攻击前1 h施用HT(100 mg/kg)其增幅显著降低(P<0.05)。
2.5 羟基酪醇对对接研究的影响
HT在SIRT1、SIRT3、ERK、JNK和p38的活性位点的对接显示了HT与这些受体的氨基酸残基之间的许多H键相互作用,见图6。与HT复合物中的SIRT和MAPKs的虚拟对接还显示HT与这些受体的活性位点紧密结合。结果表明,HT的活性成分可以通过SIRT和/或MAPK的信号传导途径发挥作用。
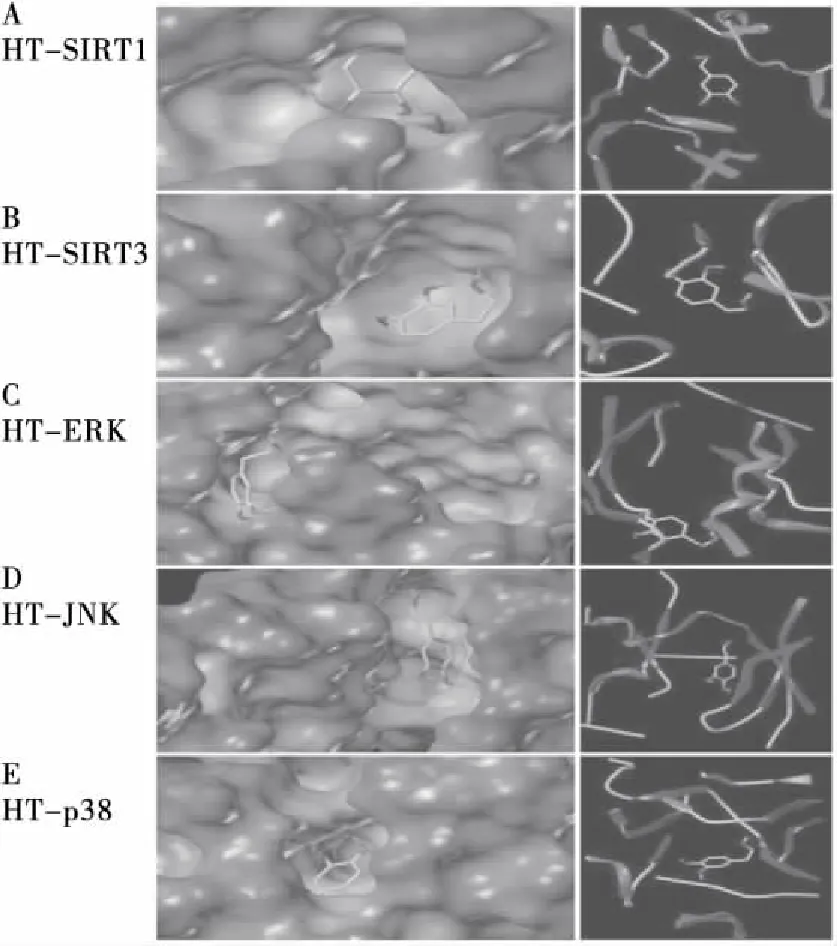
右侧为SIRT和MAPK中HT的最佳对接姿态;左侧为带状结构描绘的相互结合作用
图6 各个活动位点的HT的FlexX对接构象
Figure 6 FlexX docked conformation of HT in the active sites
2.6 羟基酪醇对SIRT表达和MAPK激活的影响
为了确定HT对自噬的阳性效应是否与SIRT和/或MAPK信号通路相关,进一步检查了sirtuin家族成员的蛋白质表达(见图7)。结果表明,与LPS组相比,HT治疗显著上调了所有这些SIRT的蛋白水平。 另外,通过施用HT,LPS处理组中磷酸化MAPKs(ERK,JNK和p38)水平的升高被显著破坏(见图8)。5 mg/kg的DXM导致具有ALI的小鼠中SIRT和MAPK活性的可比变化。结果表明,HT对自噬的有益作用可能部分由SIRT和/或MAPK途径介导。

图7 HT对LPS诱导的SIRT表达的影响
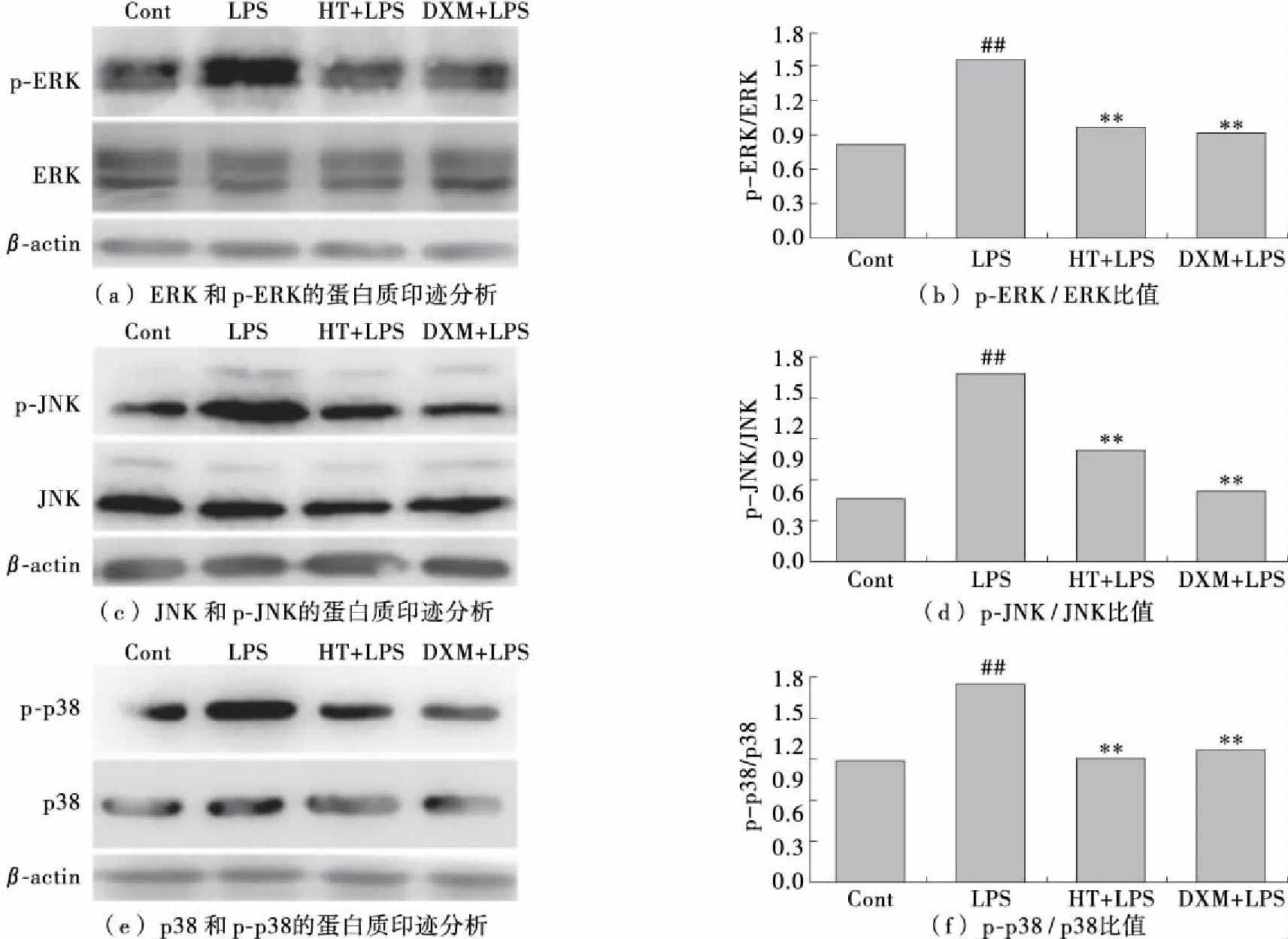
图8 HT对LPS诱导的MAPK激活的影响
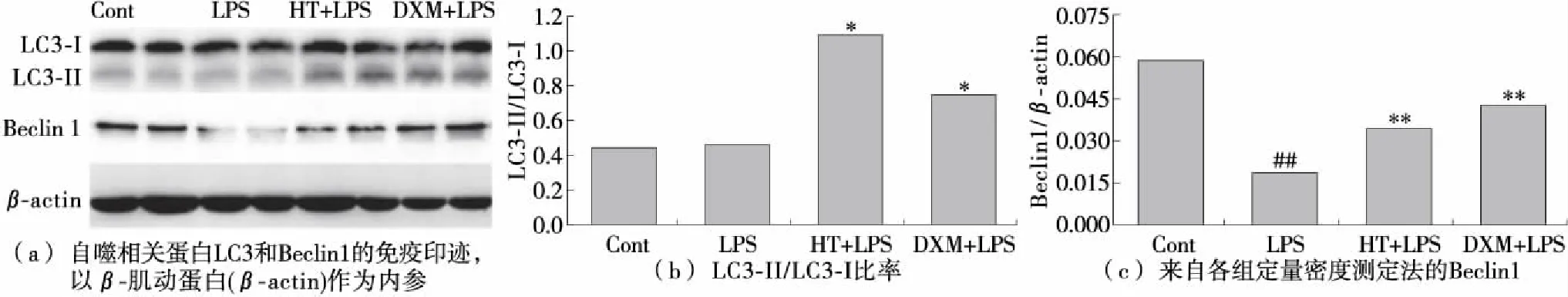
图9 HT对LPS诱导自噬的促进作用
2.7 羟基酪醇对肺组织自噬的影响
为了确定在LPS暴露的小鼠中是否可以通过HT处理诱导自噬,研究了LC3-II与LC3-I的比例(被认为是自噬的准确指标)。由图9可知,与LPS组相比,HT给药增加了LC3-II与LC3-I的比例。 此外,LPS攻击显著抑制了ALI的肺中Beclin1蛋白表达的基础水平,而HT和DXM治疗基本上逆转了这种抑制。 表明HT促进ALI小鼠肺部自噬。
3 结论
近年对HT潜在机制的研究侧重于其抗炎活性[21-23],本研究探索了其通过调控自噬在小鼠ALI模型中发挥抗炎作用的潜在分子机制。HT给药后显著消除了LPS刺激所致的SIRT抑制、MAPK磷酸化和自噬抑制,增加了肺组织的自噬水平,并且伴随着MAPK的信号失活。而且,HT给药后显著减弱了肺水肿和炎症细胞浸润到肺组织中,明显表现即BAL液中肺W/D比值、蛋白质浓度和炎症细胞水平的降低。此外,HT治疗强烈调控了包括TNF-α、IL-1β、IL-6、IL-10和MCP-1等炎症介质的释放,表明HT可能是治疗ALI/ARDS的有希望的候选者。
[1] UNUMA K, AKI T, FUNAKOSHI T, et al. Extrusion of mitochondrial contents from lipopolysaccharide-stimulated cells: Involvement of autophagy[J]. Autophagy, 2015, 11(9): 1 520-1 536.
[2] ABDEL F E, BHATTACHARYA A, HERRON A, et al. Critical role for IL-18 in spontaneous lung inflammation caused by autophagy deficiency[J]. J. Immunol, 2015, 194(11): 5 407-5 416.
[3] STORKA A, FÜHRLINGER G, SEPER M, et al. E. coli endotoxin modulates the expression of Sirtuin proteins in PBMC in humans[J]. Mediators Inflamm, 2013, 2 013: 876943.
[5] MANIATIS N A, KOTANIDOU A, CATRAVAS J D, et al. Endothelial pathomechanisms in acute lung injury[J]. Vascul Pharmacol,2008, 49(4/5/6): 119-133.
[6]LEE N, HUI D, WU A , et al. A major outbreak of severe acute respiratory syndrome in Hong Kong[J]. N Engl J Med, 2003, 348(20): 1 986-1 994.
[7] MATTHAY MA, GOOLAERTS A, HOWARD JP, et al. Mesenchymal stem cells for acute lung injury: preclinical evidence[J]. Crit Care Med, 2010, 38(10 Suppl): S569-573.
[8] CRIBBS S K, MATTHAY M A, MARTIN G S. Stem cells in sepsis and acute lung injury[J]. Crit Care Med, 2010, 38(12): 2 379-2 385.
[9] FENG Zhi-hui, BAI Li-yuan, YAN Jiong, et al. Mitochondrial dynamic remodeling in strenuous exercise-induced muscle and mitochondrial dysfunction: regulatory effects of hydroxytyrosol[J]. Free Radic Biol Med, 2011, 50(10): 1 437-1 446.
[10] SERGIO Granados-Principal, QUILES José L, RAMIREZ-TORTOSA Cesar L, et al. Hydroxytyrosol: from laboratory investigations to future clinical trials[J]. Nutr Rev, 2010, 68(4): 191-206.
[12] WARLETA Fernando, QUESADA Cristina, CAMPOS María, et al. Hydroxytyrosol protects against oxidative DNA damage in human breast cells[J]. Nutrients, 2011, 3(10): 839-857.
[13] BITLER C M, VIALE T M, DAMAJ B, et al. Hydrolyzed olive vegetation water in mice has anti-inflammatory activity[J]. J Nutr, 2005, 135(6): 1 475-1 479.
[14] TUCK K L, HAYBALL P J. Major phenolic compounds in olive oil: metabolism and health effects[J]. J Nutr Biochem, 2002, 13(11): 636-644.
[15] TAKEDA Y, BUI V N, IWASAKI K, et al. Influence of olive-derived hydroxytyrosol on the toll-like receptor 4-dependent inflammatory response of mouse peritoneal macrophages[J]. Biochem Biophys Res Commun, 2014, 446(4): 1 225-1 230.
[16] MOU Jia-jia, FANG Hao, JING Fan-bo, et al. Design, synthesis and primary activity evaluation of L-arginine derivatives as amino-peptidase N/CD13 inhibitors[J]. Bioorg Med Chem, 2009, 17(13): 4 666-4 673.
[17] HAO Jie-jie, SHEN Wei-li, YU Guang-li, et al. Hydroxyty-rosol promotes mitochondrial biogenesis and mitochondrial function in 3T3-L1 adipocytes[J]. J Nutr Biochem, 2010, 21(7): 634-644.
[18] ORTEGA R. Importance of functional foods in the Mediterranean diet[J]. Public Health Nutr, 2006, 9(8A): 1 136-1 140.
[19] HUBER M, KALIS C, KECK S, et al. R-form LPS, the master key to the activation of TLR4/MD-2-positive cells[J]. Eur J Immunol, 2006, 36(3): 701-711.
[20] YIN H, LI X Y, YUAN B H, et al. Adenovirus-mediated overexpression of soluble ST2 provides a protective effect on lipopolysaccharide-induced acute lung injury in mice[J]. Clin Exp Immunol, 2011, 164(2): 248-255.
[21] LAMY S, BEN S A, ZGHEIB A, et al. Olive oil compounds inhibit the paracrine regulation of TNF-alpha-induced endothelial cell migration through reduced glioblastoma cell cyclooxygenase-2 expression[J]. J Nutr Biochem, 2016, 27: 136-145.
[22] CABRERIZO S, CRUZ Jpdl, LPEZ-VILLODRES J A, et al. Role of the inhibition of oxidative stress and inflammatory mediators in the neuroprotective effects of hydroxytyrosol in rat brain slices subjected to hypoxia reoxygenation[J]. J Nutr Biochem, 2013, 24(12): 2 152-2 157.
[23] SCODITTI E, NESTOLA A, MASSARO M, et al. Hydroxytyrosol suppresses MMP-9 and COX-2 activity and expression in activated human monocytes via PKCalpha and PKCbeta1 inhibition[J]. Atherosclerosis, 2014, 232(1): 17-24.
Protective effect of hydroxytyrosol on LPS-induced acute lung injury in mice
WEI Jing-yuan
(Liaoning Province Academy of Analytic Sciences, Shenyang, Liaoning 110015, China)
This paper explored the underlying molecular mechanisms by which hydroxytyrosol exerts its anti-inflammatory effects in a murine model of acute lung injury (ALI) by up-regulating autophagy. LPS-induced cytokine activity, inflammatory factor levels, sirtuin (SIRT1/3/6) expression, mitogen-activated protein kinase (MAPK) activation, and autophagy marker expression in ALI-mice were examined by western blotting and staining methods. Molecular docking between HT and SIRT and MAPK was studied with a Sybyl/Surflex module. The results showed that LPS-stimulated SIRT inhibition, MAPK phosphorylation, and autophagy suppression were all notably abolished by HT administration. HT treatment significantly attenuated pulmonary edema and inflammatory cell infiltration into lung tissues, accompanied by decreased lung W/D ratios, protein concentrations, and inflammatory cell levels in BAL fluid. LPS driven release of inflammatory mediators, including TNF-α, IL-1β, IL-6, IL-10, and MCP-1, was strongly regulated by HT.
Hydroxytyrosol; Lipopolysaccharide; Autophagy; acute lung injury; Sirtuin
辽宁省自然科学基金(编号:20170540480)
魏静元(1971—),男,辽宁省分析科学研究院副研究员,博士。E-mail:906017405@qq.com
2017—04—31
10.13652/j.issn.1003-5788.2017.06.002

