橡胶树HbFCA启动子在转基因烟草中的功能缺失分析
李季++戴雪梅++孙芳++黄天带++华玉伟++黄华孙


摘 要 利用5′缺失设计一系列引物,扩增HbFCA启动子质粒,获得5个启动子缺失片段,用这些片段分别替换PBI121载体中的CaMV35S启动子,得到5个HbFCA的5′缺失表达载体,即pA、pB、pC、pD和pE。利用农杆菌介导叶盘法进行烟草遗传转化,对组培瓶内生根较好的烟草叶片GUS染色,结果发现,长度为最小片段的276 bp的pE可以较好地实现HbFCA启动子的功能。对橡胶树体细胞胚瞬时表达检测发现,pE片段也能启动表达,有较好的GUS活性,可以实现HbFCA启动子的功能。
关键词 橡胶树 ;HbFCA ;启动子 ;5′端缺失分析法 ;核心结构域
中图分类号 S794.1 文献标识码 A Doi:10.12008/j.issn.1009-2196.2017.07.013
5' Deletion Analysis of HbFCA Promoter from Hevea brasiliensis
in Transgenic Tobacco
LI Ji DAI Xuemei SUN Fang HUANG Tiandai HUA Yuwei HUANG Huasun
(Rubber Research Institute, CATAS & Ministry of Agriculture Key Laboratory
of Rubber Biology, Danzhou, Hainan 571737)
Abstract Using the 5' end serial deletion analysis method, five HbFCA promoter deletion fragments which had different distances from transcription start site were amplified by PCR, and they were used to replace the CaMV35S promoter of PBI121 carrier to obtain 5 HbFCA 5'deletion expression vectors, i.e. pA, pB, pC, pD and pE. The expression vectors were transformed into tobacco by using agrobacterium-meditated leaf disc method, and the well-rooted transformed tobacco plants in tissue culture vessels were directly detected with GUS staining. The results showed that the pE 267 bp, the shortest among the fragments, had promoter activity. The transient expression analysis of somatic embryo of rubber tree showed that the fragment pE also had better GUS staining, and could function as a HbFCA promoter.
Keywords rubber tree ; HbFCA ; promoter ; 5' deletion analysis method ; functional domain
橡胶树转基因体系已相对完善[1-2],载体构建时多使用外源组成型启动子(如CaMV35S[3-5])。但外源性启动子存在着表达效率低下,多呈瞬时表达,稳定表达较少[6-9],容易引起外源基因的多拷贝整合[10]或转基因沉默[11],以及影响外源基因的表达水平和表达模式[12]等问题。因此,选择一个橡胶树内源的,高效的组成型表达启动子已成为橡胶树遗传转化系统中的关键环节。
FCA基因的功能具有多样性,除与开花调控外,还与种子休眠、种子千粒重和纤维产量的相关[13]。拟南芥FCA启动子在多个组织中均能启动FCA基因的表达[14]。橡胶树HbFCA启动子具有典型的真核生物核心启动子区域,共有28种顺式调控元件,在橡胶树叶片、茎段、树根和胚状体等组织均能启动报告基因的表达,具有组成型启动子的特点[15]。
启动子缺失分析是研究启动子及其调控元件功能的一种重要、有效的方法。本研究在已获得的橡胶树HbFCA启动子全长的基础上,通过5′端缺失等实验技术对其核心序列结构区域进行相关分析鉴定,为通过系统改造获得启动活性更强、序列长度更短、具有更广泛应用价值的橡胶树內源组成型表达启动子奠定基础。
1 材料与方法
1.1 材料和主要试剂
烟草本生烟,大肠杆菌菌株DH5α,PBI121载体(含CaMV35S启动子和GUS报告基因),根癌农杆菌EHA105均为本实验室保存。
prime STAR Max酶、PUC18载体和T4 DNA连接酶购于Takara公司,胶回收试剂盒、PCR产物回收试剂盒购于OMEGA公司。Taq DNA聚合酶、dNTPs、FastDigestr HindⅢ和FastDigest XbaⅠ购于Fermentas公司。DNA提取试剂盒购于TIANGEN公司(DP320)。DL 2 000 Marker購于Takara公司。
1.2 方法
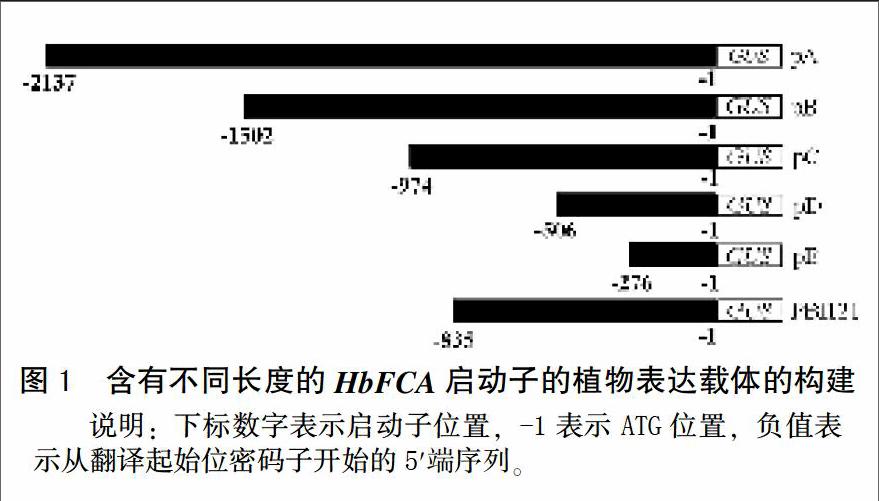
1.2.1 含有不同长度的HbFCA启动子表达载体的构建
以HbFCA启动子预测结果为依据,根据常见的CAAT-box、TATA-box以及甲基茉莉酸顺式作用元件及光效应元件等位置,将其5′依次截短,设计引物FCA-L1-2、FCA-L2-2、FCA-L3-2、FCA-L4-2、FCA-L5-2和FCA-R,其中FCA-L1-2/FCA-R为启动子全长扩增引物。前5个引物的5′端引入Hind Ⅲ酶切位点,FCA-R的5′端引入XbaⅠ酶切位点,以PHbFCA为模板,引物FCA-L1-2/FCA-R、FCA-L2-2/FCA-R、FCA-L3-2/FCA-R、FCA-L4-2/FCA-R、FCA-L5-2/FCA-R,prime STAR Max酶扩增,PCR 反应体系为15 μL,其中2×primeSTAR Max Premix 7.5 μL,左右引物(10 μmol/L)各0.5 μL,ddH2O 4.5 μL,模板(50 ng/μL)2 μL。PCR反应程序为98℃预变性4 min,98℃变性10 s,62℃退火15 s,72℃延伸5 s/Kb,72℃终延伸10 min。长度分别为2 137、1 502、974、506和276 bp。Hind Ⅲ/XbaⅠ酶切上述PCR产物,回收备用,PUC18载体同样利用Hind Ⅲ/XbaⅠ双切,T4 DNA连接酶连接,挑取单克隆,测序,选择正确的菌液保菌,提取质粒后Hind Ⅲ/XbaⅠ双切,溶液回收产物备用,PBI121利用Hind Ⅲ/XbaⅠ双切,切除CaMV 35s启动子,回收大片段分别与上述5个质粒酶切产物进行T4 DNA连接酶连接,PCR检测阳性菌株,完成构建植物表达载体pA、pB、pC、pD和pE(图1)。将重组载体通过冻融法导入农杆菌GV3101菌株备用。
1.2.2 烟草遗传转化与阳性植株筛选
本生烟的遗传转化采用农杆菌介导的叶盘侵染法,筛选培养基中添加激素为2.25 mg/L的BAP和0.3 mg/L的NAA,抗生素为500 mg/L的Carb和100 mg/L的Kan,生根培养基中添加1 mg/L的IBA、500 mg/L的Cef和50 mg/L的Kan,经培养获得每个载体的转化植株。阳性植株筛选不进行传统的PCR检测,而是在获得的再生植株中,选择生根较好的植株直接在组培瓶内进行取样GUS染色,染色结果阳性的植株炼苗,移栽至花盆内继续生长,收获种子备用。
1.2.3 GUS染色阳性植株PCR检测
待花盆内的烟草稳定后,选择相应叶片进行DNA提取,PCR检测,抗生素基因检测反应体系为15 μL,各成分组成详见[16]。基因检测用PrimeSTAR Max DNA 聚合酶,反应体系和程序详见1.2.1。ddH2O作为空白对照,本生烟基因组DNA为阴性对照,含有启动子片段的载体为阳性对照(表1)。
1.2.4 橡胶树瞬时表达检测
挑选新鲜次生胚状体至体胚诱导培养基预培养3 d。测量过夜培养的农杆菌OD600值,用未添加铁盐、CaCl2,蔗糖浓度30 g/L,去除Phytagel,添加100 μmol/L As的愈伤诱导液体培养基调至OD600=0.5作为侵染菌液,置三角瓶待用。将预培养3 d的胚状体放入农杆菌悬浮液,扎好封口膜,然后放至真空干燥器,用2XZ-4型旋片式真空泵(浙江临海)抽真空5 min,倒掉菌液,放入加了过滤布的离心管800 r/min离心30 s,取出后置无菌滤纸放工作台吹干,期间用无菌三角滤纸吸干胚状体弯曲处多余菌液,20℃共培养5 d。每个菌液检测6个胚状体,GUS染色,重复2次。
2 结果与分析
2.1 HbFCA启动子缺失载体构建及鉴定
利用5对不同引物,分别对HbFCA启动子质粒PCR扩增,分别获得与预期一致的片段大小见图2。经测序验证,该序列完全正确。通过酶切连接的方式,将5个质粒导入切掉GUS基因的CaMV35s启动子的PBI121载体中,其中PCR检测结果如图3所示,经验证与预期片段大小一致,因此表明启动子缺失片段载体构建成功,分别命名为pA、pB、pC、pD和pE。
2.2 转基因烟草植株的获得及阳性植株鉴定
将5个构建好的缺失表达载体及对照载体PBI121分别导入农杆菌GV3101菌株中,转化烟草,选择生根较好的植株组培瓶内取样GUS染色,结果如图4。5个缺失载体和对照PBI121均能很好地染色,且均较蓝,初步判断最小的缺失片段pE具有启动子活性,叶片表面具有大面积蓝色。
2.3 转基因阳性植株PCR检测
以烟草叶片基因组DNA为模板,卡那霉素(Npt-f/r)和GUS基因引物(Gus-f/r)对其进行PCR扩增,启动子扩增引物进行高保真酶扩增,电泳检测,部分检测结果如图5、6。结果表明,PCR检测结果与GUS染色结果一致。
2.4 橡胶树瞬时表达检测
按照1.2.4的方法对橡胶树体细胞胚进行5个缺失载体与对照PBI121载体瞬时表达验证(图7),结果表明,最小片段pE具有启动子活性,胚状体呈蓝色。5个缺失载体较PBI121均较弱,表现在染色程度较浅,但5个载体间差异不大。
3 讨论
启动子5′缺失分析是研究启动子表达特性和调控元件功能最常用的方法之一[17]。本研究中以HbFCA启动子预测结果为依据,根据常见的顺式作用元件及光效应元件等位置,构建了5个缺失载体,与对照载体同时转化烟草,对转化的烟草叶片GUS组织化学染色,发现5个缺失载体均能激活GUS基因的表达,但表达强度有差异,其中PBI121表达最强,HbFCA全长启动子片段表达与PBI121较为一致,但其他片段GUS染色均较PBI121载体弱,而对T1代植株GUS蛋白组织染色及系统的定量分析将会更好的与组成型表达35s启动子进行比较[18-20],因此本研究下一阶段准备对烟草T1代转基因植株进行GUS定性的分析。瞬时表达是快速研究基因表达等的重要手段[21],本研究中橡胶树次生体胚瞬时表达结果显示,PBI121中的CaMV35s启动子作为双子叶植物常用的组成型表达启动子具有较强的GUS染色结果,但HbFCA启动子一系列缺失载体表达均较弱,且各片段之间表达差别不大,考虑可能是因为HbFCA基因在橡胶树体细胞胚中的表达活性本来就不高(见图7中pA在橡胶树胚状体中瞬时表达检测结果和孙芳[22]HbFCA基因在愈傷胚、根、叶片、树皮、花及胶乳中的表达结果)。预测发现,最小片段pE启动子区域含有的均为光效应元件、甲基茉莉酸应答顺式调控元件、热应答顺式作用元件、水杨酸应答顺式作用元件、昼夜调控顺式元件以及-79和-107 bp的TATA-box和-26 bp的CAAT-box。丛明等[23]利用橡胶树组培苗叶片瞬时表达比较306和378 bp的REF启动子发现,二者均具有明显的乳管表达活性,分析发现,REF启动子的重要功能元件都集中在启动子第73位点之后。
常规的转基因烟草检测是将获得的转化植株移栽到穴盆内,取叶片进行分子检测,选择阳性植株进行GUS染色[24]。而本研究中利用在组培瓶内选取生根较好的植株进行GUS染色来判断阳性植株,这样一方面直观的获得具有GUS基因表达的转基因阳性植株,另一方面减轻转基因植株鉴定的工作量。不过该方法可能会漏掉一些分子检测为阳性,但是不表达的转基因植株,但这些植株对后期的启动子功能分析起不到相应的作用。
内源型启动子由于其内源的调控序列能更好更充分地发挥其调控能力,在驱动外源基因的高效稳定表达中比外源启动子更有优势。与此同时,使用植物自身基因的启动子可以降低外源基因在该植物转基因个体中的拷贝数[10],且可有效避免基因沉默现象[25]。本研究中获得这个HbFCA启动子在橡胶树叶片、根、茎和胚状体中具有组成型启动子的特点,但在胶乳和树皮中表达相对较低。因此为获得橡胶树内源组成型高表达载体,笔者认为可以将这个启动子的核心结构域与胶乳和树皮中表达较高的启动子进行人工串联,获得人工合成的橡胶树內源组成型表达启动子,为橡胶树遗传转化的应用提供基础。
参考文献
[1] Blanc G, Baptiste C, Oliver G, et al. Efficient Agrobacterium tumefaciens-mediated transformation of embryogenic calli and regeneration of Hevea brasiliensis Mull Arg. Plants [J]. Plant Cell Rep,2006, 24(12): 724-733.
[2] 黄天带,李 哲,孙爱花,等. 根癌农杆菌介导的巴西橡胶树花药遗传转化体系的建立 [J]. 作物学报,2010,36(9):1-7.
[3] Odell J T, Nagy F, Chua N H. Identification of DNA sequences required for activity of the caulifiower mosaic virus 35S promoter[J]. Nature, 1985, 313:810-812
[4] Mehrotra R, Gupta G, Sethi R, et al. Designer promoter:an artwork of cis engineering[J]. Plant Molecular Biology, 2011, 75(6): 527-536.
[5] 魏 晶,毛伟华,林拥军,等. 1个新水稻组成型启动子的克隆与功能鉴定[J]. 华中农业大学学报,2012,31(2):139-146.
[6] Shirasawa-Seo N, Mitsuhara I, Nakamura S, et al. Constitutive promoters available for transgene expression instead of CaMV35S RNA promoter:Arabidopsis promoters of tryptophan synthase protein β subunit and phytochrome B[J]. Plant Biotechnotogy, 2002, 19 (1): 19-26
[7] 李 杰,曲东京,刘玲玲,等. 不同启动子驱动下转基因盐藻外源基因的稳定表达[J]. 中国生物工程杂志,2007,27(3):47-53
[8] Hirata R, Jeong Won-Joong, Saga N, et al. Heterologous activation of the Porphyra tenera HSP70 promoter in Bangiophycean algal cells[J]. Bioengineered, 2011, 2(5): 271-274.
[9] 石 晶,陈 彬,崔雪琼,等. 不同启动子驱动glgC在马铃薯体内的表达研究[J]. 西北植物学报,2012,32(11):2 190-2 194.
[10] 徐子勤,龚莉桂,黄 萱,等. 采用玉米Ubi-1启动子获得低拷贝转基因玉米植株[J]. 生物工程学报,2004,20(1):120-125.
[11] Lardet L, Leclercq J, Bénistan, et al. Variation in GUS activity in vegetatively propagated Hevea brasiliensis transgenic plants[J]. Plant Cell Rep, 2011, 30: 1 847-1 856.
[12] Yoo S Y, Bomblies K, Ahn J H. The 35S promoter used in a selectable marker gene of a plant transformation vector affects the expression of the transgene [J]. Planta, 2005, 221(4): 523-530.
[13] Sun F, Liu C L, Zhang C J, et al. A conserved RNA recognition motif (RRM) domain of Brassica napus FCA improves cotton fiber quality and yield by regulating cell size [J]. Mol Breed, 2012, 30(1): 93-101.
[14] Macknight R, Duroux M, laurie R, et al. Functional significance of the alternative transcript processing of the Arabidopsis floral promoter FCA[J]. Plant Cell, 2002, 14(4): 877-888.
[15] 華玉伟,孙 芳,黄天带,等. 橡胶树HbFCA启动子的克隆及其在橡胶树中的表达分析[J]. 热带作物学报,2013,34(5):800-806.
[16] 李 季,黄天带,蔡海滨,等. 橡胶树体胚遗传转化中早代转化胚状体的PCR鉴定[J]. 热带作物学报,2013,(5):866-869.
[17] Iwamoto M, Higo H, Higo K. Strong expression of the rice catalase gene CatB promoter in protoplasts and roots of both a monocot and dicots[J]. Plant physiology and Biochemistry, 2004, 42(3): 241-249.
[18] 崔喜艳,陈众峰,范 贝,等. 大豆rbcS基因启动子的克隆及在转基因烟草中的功能缺失分析[J]. 西北农林科技大学学报(自然科学版),2015,43(5):114-128.
[19] 关志辉,陈 新,王海燕,等. 木薯可溶性淀粉合成酶(MeSSⅡb)启动子克隆及梯度缺失分析 [J]. 基因组学与应用生物学,2015,34(8):1753-1760.
[20] 王旭静,李为民,唐巧玲,等. 中棉(Gossypium arboreum)光诱导基因Gacab启动子在转基因烟草中的功能缺失分析 [J]. 作物学报,2009,35(6):1 006-1 012.
[21] 赵金风,李 杰,张 爽,等. 杨树木质部特异启动子5′端侧翼序列缺失表达载体构建及转化烟草的研究 [J]. 蚕业科学,2013,39(5):858-861.
[22] 孙 芳. 巴西橡胶树开花相关基因HbFCA的克隆及表达分析[M]. 海口:海南大学,2012.
[23] 丛 明,凌 华,黄惠琴,等. 利用REF启动子构建橡胶树乳管特异表达载体及GUS基因的瞬时表达 [J]. 热带作物学报,2005,26(2):29-33.
[24] 杨江涛,庞伟民,王旭静,等. 陆地棉GhRACK1启动子的克隆与缺失分析[J]. 作物学报,2016,42(3):368-375.
[25] Matzke M A, Matzke A J M. How and why do plants inactivate homologous (trans) genes?[J] Plant Physiol, 1995, 107(3): 679-685.

