利用染色体片段置换系定位水稻苗期耐盐QTLs
林 静,张所兵,张云辉,汪迎节,方先文
(江苏省农业科学院种质资源与生物技术研究所/江苏省种质资源保护与利用研究中心,江苏 南京 210014)
利用染色体片段置换系定位水稻苗期耐盐QTLs
林 静,张所兵,张云辉,汪迎节,方先文
(江苏省农业科学院种质资源与生物技术研究所/江苏省种质资源保护与利用研究中心,江苏 南京 210014)
【目的】挖掘水稻耐盐新基因,为水稻耐盐性遗传改良奠定基础。【方法】本研究以籼稻品种9311和粳稻品种日本晴为亲本培育的高代回交置换系为材料,在0.5 %NaCl盐胁迫条件下,以存活率为耐盐指标,对水稻苗期耐盐性QTL进行定位。采用QTL IciMapping v3.1软件对存活率进行QTL分析。【结果】在第3染色体相邻标记RM1350附近检测到1个苗期耐盐相关QTL(QSst3),所在遗传区间为113.2~132.8 cM,贡献率17.75 %,加性效应10.9。【结论】来自供体亲本日本晴相应QTL使苗期耐盐性变强。
水稻;苗期耐盐;染色体片段置换系(CSSLs);数量性状基因(QTL)定位
【研究意义】世界人口的高速增长以及可耕地面积的持续下降,作为作物育种首要目标的高产一直很受重视。但随着地球环境恶化以及不合理灌溉、施肥等因素,全球盐渍化土地面积日趋增加,且分布广泛,遍及六大洲的30多个国家,总面积约9.56亿hm2。我国大约有9913.3万hm2盐碱地,占世界面积的10 %左右。水稻作为我国的主要粮食作物,其产量和品质受土壤盐浓度的影响巨大。盐碱地种植的水稻一般都会减产,严重时甚至绝收。因此,通过遗传改良等方法,培育耐盐水稻新品种,是解决盐碱化土地水稻生产的根本途径,从而有效缓解粮食供求矛盾,保障我国粮食安全。【前人研究进展】早在20世纪60年代就有研究者报道水稻的耐盐性是受多基因控制的数量性状,遗传基础复杂,存在加性效应和上位性效应[1-4]。研究还发现水稻不同生育期对盐害的耐受性也不同,其中2叶1心期最为敏感[5]。同时有研究表明苗期和成熟期的耐盐性具有一定的相关性[6],Zang等认为苗期和分蘖期的遗传基础有部分重叠[7]。因此,目前水稻耐盐性的遗传研究主要集中在苗期[2, 8-14]。评价水稻苗期耐盐性的指标有很多,主要包括盐胁迫处理后幼苗的存活天数、幼苗地上部Na+含量和K+含量、根部Na+含量和K+含量、幼苗高度、地上部和根的干物质、Na+/K+比率、幼苗叶片叶绿素荧光参数等[6-7,15-16]。水稻苗期耐盐性的遗传和QTL定位研究多使用F2、BC1、BC2F8自交系、RIL等群体。【本研究切入点】为了更好的剖析水稻耐盐性遗传机理,本研究利用水稻染色体片段置换系(CSSSLs),在0.5 % NaCl处理下对水稻幼苗期耐盐性的QTL进行了初步分析。【拟解决的关键问题】以期挖掘到新的水稻耐盐基因,为水稻耐盐性分子机理的研究和育种利用提供资源和利用依据。
1 材料与方法
1.1 试验材料
以籼稻品种9311为轮回亲本,粳稻品种日本晴为供体亲本,通过杂交和连续回交构建该CSSSLs,具体构建过程见Zhu等[17],由于部分置换系中交换片段长度较大以及部分区段未被覆盖等原因,在Zhu等的基础上,从原有BC4F1保存的材料中选出检测背景一致而覆盖区段不同的系自交选取纯系、选取BC4F2纯合系中片段长度过大的材料与轮回亲本杂交获得F1从中挑选片段小的系自交选取纯系,同时原置换系中片段长度过大的材料与轮回亲本回交,从后代中挑选片段较小的系自交,共获得24个新增纯系,组成119个水稻染色体片段置换系用于本试验。置换系总长度(去除重叠片段)为1202 cM,占染色体总长度的比例约为78.6 %。
1.2 水稻幼苗期盐胁迫处理
利用0.5 %NaCl盐浓度对119个染色体片段置换系及其亲本9311、日本晴进行苗期耐盐性鉴定。水稻种子置于9 cm直径培养皿中,各培养皿添加12 mL dH2O,28 ℃暗培养3 d。取出芽长基本一致的种子置于96孔班上,8粒/行,每材料3行,3次重复。将96孔板置于加水周转箱中,并置于光照培养箱内。培养箱的设置为:光照13 h/d,白天28 ℃,夜间24 ℃。待幼苗长至2叶1心期,使用含0.5 % NaCl的水稻营养液进行盐胁迫处理,盐胁迫处理时间为21 d,每3 d更换1次含盐营养液。处理结束后,用营养液恢复生长7 d,调查各系及亲本的幼苗存活情况。
1.3 苗期耐盐性调查
苗期处理21 d后,调查各置换系及亲本存活率,并进行耐盐性评价。
存活率=存活株数/总株数×100 %
1.4 数据分析与QTL定位
采用Wang等[18]的RSTEP-LRT方法,利用其开发软件QTL IciMapping v3.1(LOD值为2.0),将分子标记检测的结果和苗期存活率比值相结合,对置换系群体各株系进行全基因组范围内上苗期耐盐性QTL分析研究,QTL的命名遵循McCouch等[19]的原则。
2 结果与分析
2.1 亲本及119个CSSLs的苗期耐盐性
如图1所示,该性状属于较为复杂且明显受多基因控制的数量性状。2个亲本苗期耐盐性存在显著差异,受体亲本9311的苗期存活率较高,为32 %;供体亲本日本晴的苗期存活率较低,为12.35 %。119个置换系苗期存活率最低为1.7 %,最高55.7 %,并呈连续分布,主要集中在20 %~40 %,低于20 %以及高于40 %的均较少,共有21个置换系。
2.2 水稻苗期耐盐性QTL分析
利用IciMapping v3.1软件,将分子标记检测结果与苗期耐盐性相结合,在第3染色体检测到1个苗期耐盐性相关QTL。QTL在第3染色体上的定位区域如图2 显示,QSst3位于相邻标记RM1350附近,所在遗传区间为113.2~132.8 cM,贡献率17.75 %。加性效应10.9,说明来自供体亲本日本晴相应QTL使苗期耐盐性变强。
3 讨 论
本研究利用苗期耐盐性存在差异的籼稻品种9311与粳稻品种日本晴构建的119个CSSSLs群体为材料,在水稻幼苗期采用0.5 %的NaCl进行胁迫处理,对水稻苗期耐盐性相关QTL进行了分析。染色体片段代换系(Chromosome Segment Substitution Lines,CSSSLs)是在相同的遗传背景中导入供体亲本的染色体片段。其可以降低效应较大QTL对效应较小QTL的遮盖作用,减少了QTL之间的互作,从而使微效QTL被检测出来。并且在初级定位基础上,可快速构建次级分离群体,并将QTL定位分析限定在较小的置换片段区域内,能大大加快精细定位的进程。同时,本试验用于苗期耐盐性鉴定的染色体片段置换系选择芽长基本一致的种子进行盐胁迫处理,有效减少了因生长势不同而导致的试验偏差,提高了表型鉴定的准确性。
图1 CSSLs苗期盐胁迫处理后存活率分布Fig.1 Distribution of survival rate after salt stress treatment at seedling stage of CSSLs
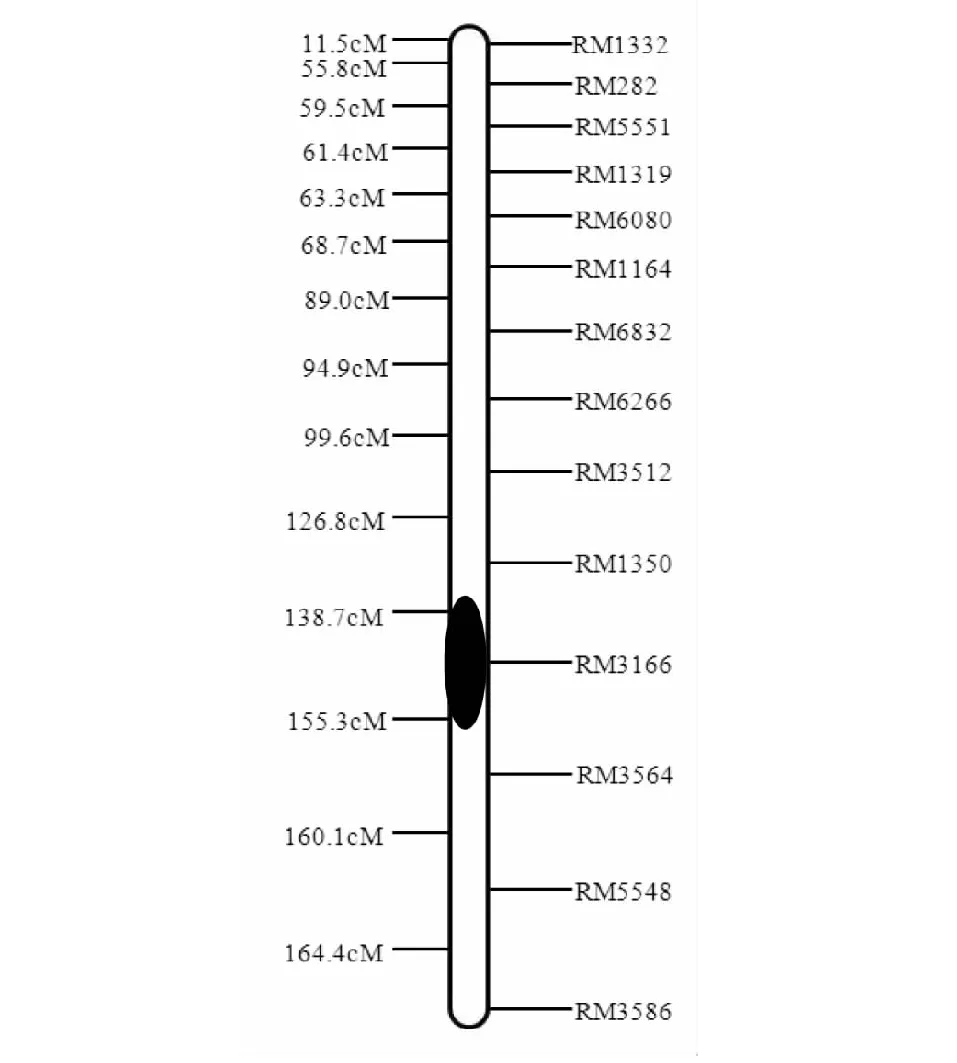
图2 苗期耐盐性QTL在第3染色体上的定位Fig.2 Location of QTL for salt tolerance on chromosome 3 at seedling stage
本研究在第3染色体检测到1个苗期耐盐性相关QTL,借助SSR分子标记和比较图谱,将本研究结果与国内外研究者利用不同作图群体定位到的一些QTL进行了比较。发现本研究定位到的QSst3所在的染色体区域与杨静等利用特青背景倒入系所检测到的幼苗叶片盐害级别、幼苗盐胁迫后存活天数以及地上部Na+浓度相关QTL在染色体的位置重合[20]。
本研究检测到QTL来自苗期耐盐性较差的亲本日本晴。为解释此结果,笔者查阅文献发现,遗传背景对QTL尤其微效QTL的检测存在干扰。Mei等利用Lemont/特青双向导入系对一次枝梗数、二次枝梗数和每穗粒数等穗部性状的QTL进行定位,发现相同亲本的双向导入系,在亲本背景的导入系中同时表达的QTL仅占QTL总数的21 %[21]。谢文学等也利用Lemont/特青该套双向导入系群体定位纹枯病抗性QTL,2007年在2个背景中共检测到11个抗纹枯病QTL,其中仅2个(占18.2 %)是相同的,绝大多数在特青背景下检测到的主效QTL在Lemont背景下不表达[22]。杨静等利用双向导入系群体检测遗传背景对耐盐QTL定位的影响发现,在2个亲本背景导入系中未能检测到任何相同表达的QTL[20]。以上这些研究结果表明QTL表达可能具有很强的遗传背景效应,同时也说明这些耐盐QTL的效应可能较小,因而其表达受遗传背景的影响较大。
4 结 论
本研究在第3染色体相邻标记RM1350附近检测到1个苗期耐盐相关QTL(QSst3),所在遗传区间为113.2~132.8 cM,贡献率17.75 %,加性效应10.9。该QTL来自供体亲本日本晴。不同研究者以及不同环境中均在该区域检测到相关QTL,说明该区域可能是影响水稻苗期耐盐性的重要基因组区域,对分子标记辅助选育耐盐水稻新品系具有一定的应用价值,有待进一步的深入研究。
[1]Pearson G A, Ayers A D, Eberhard D L. Relative salt tolerance of rice during germination and early seeding development[J]. Soil Sci, 1966, 102: 151-156.
[2]郭 岩,陈少麟,张耕耘,等.应用细胞工程获得受主效基因控制的水稻耐盐突变系[J].遗传学报,1997,24(2):122-126.
[3]龚继明,何 平,钱 前,等. 水稻耐盐性QTL的定位[J]. 科学通报,1998,43(17):1847-1850.
[4]Flower T J. Improving crop salt tolerance[J]. Experi Bot, 2004, 55(396): 307-319.
[5]方先文,汤凌华,王艳平. 耐盐水稻种质资源的筛选[J]. 植物遗传资源学报,2004,5(3):295-298.
[6]Wang Z F, Cheng J P, Chen Z W, et al. Identification of QTLs with main, epistatic and QTL × environment interaction effects for salt tolerance in rice seedlings under different salinity conditions[J]. Theor Appl Genet, 2012, 125(4): 807-815.
[7]Zang J P, Sun Y, Wang Y Yang J, et al. Dissection of genetic overlap of salt tolerance QTLs at the seeding and tillering stages using backcross introgression lines in rice[J]. Sci China Life Sci, 2008, 51(7): 583-591.
[8]顾兴友,梅曼彤,严小龙,等. 水稻耐盐性数量性状位点的初步检测[J]. 中国水稻科学,2009,14(2):65-70.
[9]Prasad S R, Bagali P G, Hittalmani S, et al. Molecular mapping of quantitative trait loci associated with seeding tolerance to salt stress in rice (OryzasativaL.)[J]. Curr Sci, 2000, 78: 162-164.
[10]Lin H X, Zhu M Z,Yano M, et al. QTLs for Na+and K+uptake of the shoots and roots controlling rice salt tolerance[J]. Theor Appl Genet, 2004, 108: 253-260.
[11]Koyama M L, Levesley A, Koebner R M D, et al. Quantitative trait loci for component phydiological traits determining salt tolerance in rice[J]. Plant Physiol, 2001, 125: 406-422.
[12]Zhang G Y, Guo Y, Chen S L, et al. RFLP tagging of a salt tolerance gene[J]. Plant Sci, 1995, 110: 227-234.
[13]Lee S Y, Ahn J H, Cha Y S, et al. Mapping of quantitative trait loci for salt tolerance at the seeding stage in rice[J]. Mol Cell, 2006, 21: 192-196.
[14]孙 勇,臧金萍,王 韵,等. 利用回交导入系群体发掘水稻种质资源中的有利耐盐QTL[J]. 作物学报,2007,33(10):1611-1617.
[15]Lin H X, Zhu M Z, Yano M, et al. QTLs for Na+and K+uptake of the shoots and roots controlling rice salt tolerance[J]. Theor Appl Genet, 2004, 108(2): 253-260.
[16]沈 波,蒋 靓,於卫东,等. 水稻苗期盐胁迫下叶绿素荧光参数的QTL分析[J]. 中国水稻科学,2009,23(3):319-322.
[17]Zhu W Y, Lin J, Yang D W, et al. Development of chromosome segment substitution lines derived from backcross between two sequenced rice cultivarsindicarecipient’93-11’ andjaponicadonar ‘Nipponbare’[J]. Plant Mol Biol Pep, 2009,27(2):126-131.
[18]Wang J K, Wan X Y, Li H H, et al. Application of identified QTL-marker associations in rice quality improvement through a design-breeding approach[J]. Theor Appl Genet, 2007, 115: 87-100.
[19]McCouch S R , Cho Y G, Panl E, et al. Report on QTL nomenclature[J]. Rice Genet Newsl, 1997, 14: 11-13.
[20]杨 静,孙 勇,程立锐,等. 利用双向导入系群体检测遗传背景对耐盐QTL定位的影响[J]. 作物学报,2009,35(6):974-982.
[21]Mei H W, Xu J L, Li Z K, et al. QTLs influencing panicle size detected in two reciprocal introgressive line (IL) populations in rice (OryzasativaL.)[J]. Theor Appl Genet, 2006, 112: 648-656.
[22]谢学文,许美容,臧金萍,等.水稻抗纹枯病QTL表达的遗传背景及环境效应[J]. 作物学报,2008,34(11):1885-1893.
(责任编辑 陈 虹)
Mapping of QTLs for Salt Tolerance at Seedling Stage UsingChromosome Segment Substitution Lines of Rice (OryzasativaL.)
LIN Jing, ZHANG Suo-bing, ZHANG Yun-hui, WANG Ying-jie, FANG Xian-wen
(Institute of Germplasm Resources and Biotechnology,Jiangsu Academy of Agricultural Sciences,Research Center for Protection and Utilization of Agricultural Germplasm Resource in Jiangsu Province, Jiangsu High Quality Rice R&D Center, Nanjing Branch of China National Center for Rice Improvement, Jiangsu Nanjing 210014, China)
【Objective】The locations of new rice salt-tolerant genes were found to lay foundation for the genetic improvement of salt tolerance rice. 【Method】Chromosome segment substitution lines (CSSLs) fromindica9311 and japonica Nipponbare were employed to map quantitative trait loci (QTL) of rice salt-tolerant genes. Salt tolerance levels of CSSLs under 0.5 % NaCl stress were evaluated by the survival rates. QTLs for salt tolerance at seedling stage by the survival rates were analyzed with IciMapping v3.1 software. 【Result】A rice seedling salt-tolerant QTL(QSst3) near the marker RM1350 of chromosome3 was identified.Its genetic interval was 113.2-132.8 cM, the contribution of total variance was 17.75 %,and the additive effect of QSst3 was 10.9. 【Conclusion】The QTL from Nipponbare enhanced the salt tolerance at rice seedling stage.
Rice; Salt tolerance; Chromosome segment substitution lines (CSSLs); Quantitative trait loci (QTL) mapping
1001-4829(2017)7-1479-04
10.16213/j.cnki.scjas.2017.7.002
2016-07-10
国家科技支撑计划(2015BAD01B01)
林 静(1981-),女,江苏海安人,硕士,副研究员,研究方向:水稻品种资源,E-mail:534663739@qq.com。
S511
A

