碱性盐胁迫对宁夏枸杞生长、结构及光合参数的影响
毛桂莲,梁文裕,王 盛,2,许 兴,郑 蕊,朱志明
(1.宁夏大学生命科学学院, 宁夏 银川 750021; 2.西部特色生物资源保护与利用教育部重点实验室, 宁夏 银川 750021;3.宁夏大学农学院, 宁夏 银川 750021)
碱性盐胁迫对宁夏枸杞生长、结构及光合参数的影响
毛桂莲1,梁文裕1,王 盛1,2,许 兴3,郑 蕊1,朱志明3
(1.宁夏大学生命科学学院, 宁夏 银川 750021; 2.西部特色生物资源保护与利用教育部重点实验室, 宁夏 银川 750021;3.宁夏大学农学院, 宁夏 银川 750021)
采用盆栽试验,对碱性盐(NaHCO3)胁迫下枸杞生长、叶片解剖结构、超微结构以及光合参数进行了研究。结果显示:随着NaHCO3胁迫浓度的增加,净生长量呈先增加后降低的趋势,地上部干重、地下部干重和整株干重总体呈下降趋势,根冠比呈上升趋势;叶肉栅栏组织在低浓度NaHCO3处理(150 mmol·L-1)时排列比较紧密,随着胁迫浓度增加,栅栏组织的细胞层数逐级减少,细胞结构紧密度逐渐降低,叶片厚度、上下表皮厚度及晶体数呈现先增后降的趋势;超微结构显示,随着胁迫浓度的升高,叶肉细胞形状变的不规则,叶绿体结构变形,基粒片层排列紊乱,淀粉粒增多;净光合速率(Pn)、蒸腾速率(Tr)、气孔限制值(Ls)和气孔导度(Gs)随NaHCO3浓度的升高呈下降趋势,胞间CO2浓度(Ci)呈升高趋势,水分利用效率(WUE)呈先升后降的趋势;相关分析显示,盐胁迫强度与净生长量、生物量、净光合速率、蒸腾速率、气孔导度和气孔限制值呈负相关关系,与净光合速率、蒸腾速率和气孔导度呈显著负相关关系(P<0.05)。由此说明,碱性盐胁迫改变了叶片的功能性状,促使枸杞光合作用下降,直接影响干物质积累及株高的生长。
碱性盐胁迫;宁夏枸杞;生长;结构;光合参数
土壤盐渍化是困扰农业和林业生产的一大难题,也是减少农业和林业产量的主要非生物胁迫因素之一[1]。随着工业现代化、灌溉地和塑料大棚面积的不断扩大,土壤次生盐渍化日趋加剧,加之世界淡水资源的匮乏因而利用盐生植物改良土壤成为诸多植物学工作者关注的热点研究问题[2]。而盐胁迫是影响作物生长的一个重要因子,关于不同作物或同种作物不同栽培品种耐盐的结构机理和生理响应有不少研究。在盐胁迫的研究中,由于叶片的组织结构对生境条件的反应较为敏感,所以在耐盐性研究中,研究最多的器官是叶片,重点是叶肉细胞中的叶绿体、线粒体以及其它细胞器等[3]。大量研究表明[4-5],盐胁迫会抑制植物的光合作用,而光合作用代谢能力的强弱可以从植株的光合色素、光合性能参数和叶片结构等多方面反映。
作为盐生植物的宁夏枸杞(LyciumbarbarumL.),具有耐干旱、耐盐碱、繁殖能力强的特性。目前,有关枸杞抗盐生理的研究主要以NaCl为主要对象,并且对枸杞在NaCl胁迫下的渗透调节、光合作用、抗氧化保护等方面的生理机制的研究都取得了一定的进展,但在碱胁迫方面的研究很少涉及,尤其是碱性盐胁迫下宁夏枸杞生长、叶片结构与光合参数的关系研究鲜有报道,为此,本文以宁夏枸杞为研究材料,研究碱性盐胁迫下枸杞生长、叶片结构与光合参数的变化,以期为枸杞作为盐生植物在盐碱地生物改良中的规模化推广与应用提供理论基础和科学依据。
1 材料与方法
1.1 材料培养及处理
以一年生宁夏枸杞材料宁杞1号硬枝扦插苗为材料,采用盆栽土培,沙子与壤土以1∶1混合,混合后装盆,每盆装土10 kg;土壤的全盐含量为1 g·kg-1,pH值为7.12。底肥每盆施磷酸二铵1.00 g,尿素1.50 g。每盆栽植幼苗1株,在整个实验处理期间,按土培常规管理方法进行管理。整个实验于5-6月份在自然光照条件下进行。选取长势一致的幼苗进行处理,处理分别为CK,150 mmol·L-1NaHCO3,300 mmol·L-1NaHCO3和450 mmol·L-1NaHCO3。实验开始时每天递增50 mmol·L-1NaHCO3溶液,至基质中达到最高预定含盐量为止,花盆底部用托盘承接,渗透水分及时返还花盆中,以确保盆中盐碱总量。每个处理重复5盆,处理后定期浇灌少量水,以平衡蒸发,对照浇自来水,分别于处理后第21天取样测定。
1.2 测定项目
1.2.1 生长指标测定 处理前和处理结束测定各处理苗高,并计算净生长量=处理后株高-处理前株高。同时取样经杀青、烘干测得干重,计算各处理植物的根冠比=根干重/冠干重。
1.2.2 石蜡切片的制备 胁迫21 d时分别取不同处理下植株中部叶片,切成约5 mm×5 mm大小,立即投入FAA固定液固定,固定时间超过48 h。取固定后的材料用70%~100%的乙醇逐级脱水,用二甲苯透明,然后将材料置于38℃恒温箱内的石蜡液与二甲苯的混合液中低温浸蜡24 h直至混合液达饱和状态,再转入60℃恒温干燥箱内融化的纯石蜡液中高温渗蜡5 h,石蜡包埋。用莱卡切片机切片,切片厚度8~12 μm,采用番红与固绿染色。中性树胶封片。在OLYMPUS显微镜下观察、照相。用Motic Images Plus 2.0软件测定表皮细胞厚度。
1.2.3 超微结构观察 用K2HPO4的缓冲溶液(pH 7.6)溶解的2.5%的戊二醛预固定5 h;用缓冲溶液洗涤三次,每次30 min;1%锇酸固定15 h,缓冲溶液洗涤后,系列丙酮脱水,Epon812树脂渗透和包埋。莱卡UC6i超薄切片机切片,在日本电子JEM-1230型透射电子显微镜下观察和拍照。
1.2.4 光合参数的测定 采用CIRAS-1型光合测定仪测定大洋洲滨藜、四翅滨藜和枸杞叶片净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间CO2浓度(Ci)。每处理测定3个重复,每个重复待稳定后读取10个数据,参照Penuelas等[6]的方法.气孔限制值(Ls)按照公式Ls=1-(Ci/Ca)计算,其中Ca=380 μmol·mol-1。
1.3 数据分析
采用Excel和DPS软件进行数据统计分析、作图,采用Duncan新复极差法在a=0.05水平上进行方差分析。
2 结果与分析
2.1 NaHCO3胁迫下枸杞生长指标的变化
宁夏枸杞在低浓度即150 mmol·L-1胁迫时,净生长量与对照CK相比有所增加,增加的幅度不大;随着胁迫浓度的增加,净生长量呈下降趋势;从生物量变化看,地上部干重在150 mmol·L-1胁迫时与对照相比下降,地下部干重和整株干重随着浓度的增加总体呈下降趋势(表1)。枸杞根冠比随着浓度的升高呈上升趋势。净生长量、地上部干重和整株干重各个处理间差异显著(P<0.05);地下部干重和根冠比各个浓度处理间差异不显著(P<0.05)。
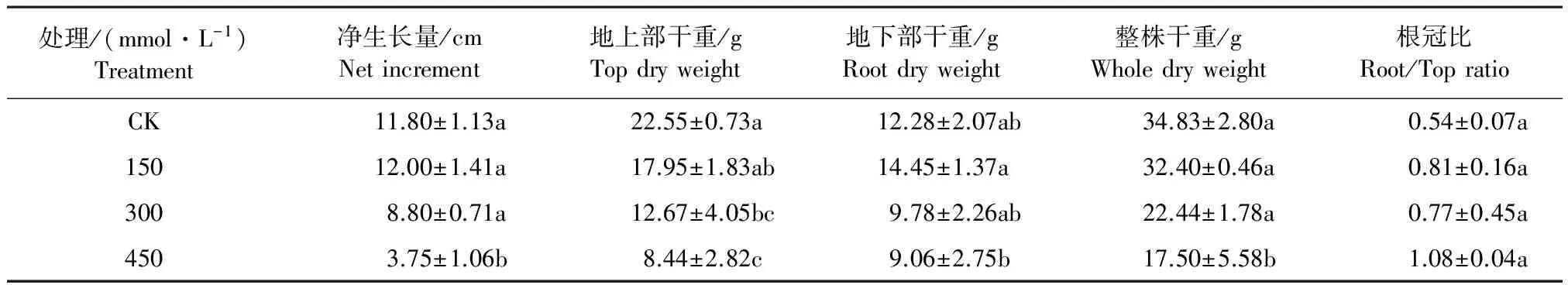
表1 NaHCO3胁迫下枸杞净生长量、干重及根冠比的变化
注:不同字母表示该指标在不同碱处理条件下的差异显著(P<0.05),下同。
Note: different letter indicate the results of variance analysis, where alkali treatment effect is significant(P<0.05), the same below.
2.2 NaHCO3胁迫下枸杞叶解剖结构的变化
枸杞叶的结构由表皮、叶肉、叶脉(维管束)组成。从图1及表2可以看出,随着NaHCO3胁迫浓度的增加,叶片厚度、上下表皮厚度及晶体数呈现先增后降的趋势,即150 mmol·L-1时上下表皮最厚,晶体数目最多。各个处理与对照之间差异显著(P<0.05);枸杞的叶肉主要由栅栏组织和海绵组织构成,叶肉栅栏组织在低浓度NaHCO3处理(150 mmol·L-1)时排列比较紧密,随着胁迫浓度增加,栅栏组织的细胞层数逐级减少,细胞结构紧密度逐渐降低,维管束不发达,没有花环结构。
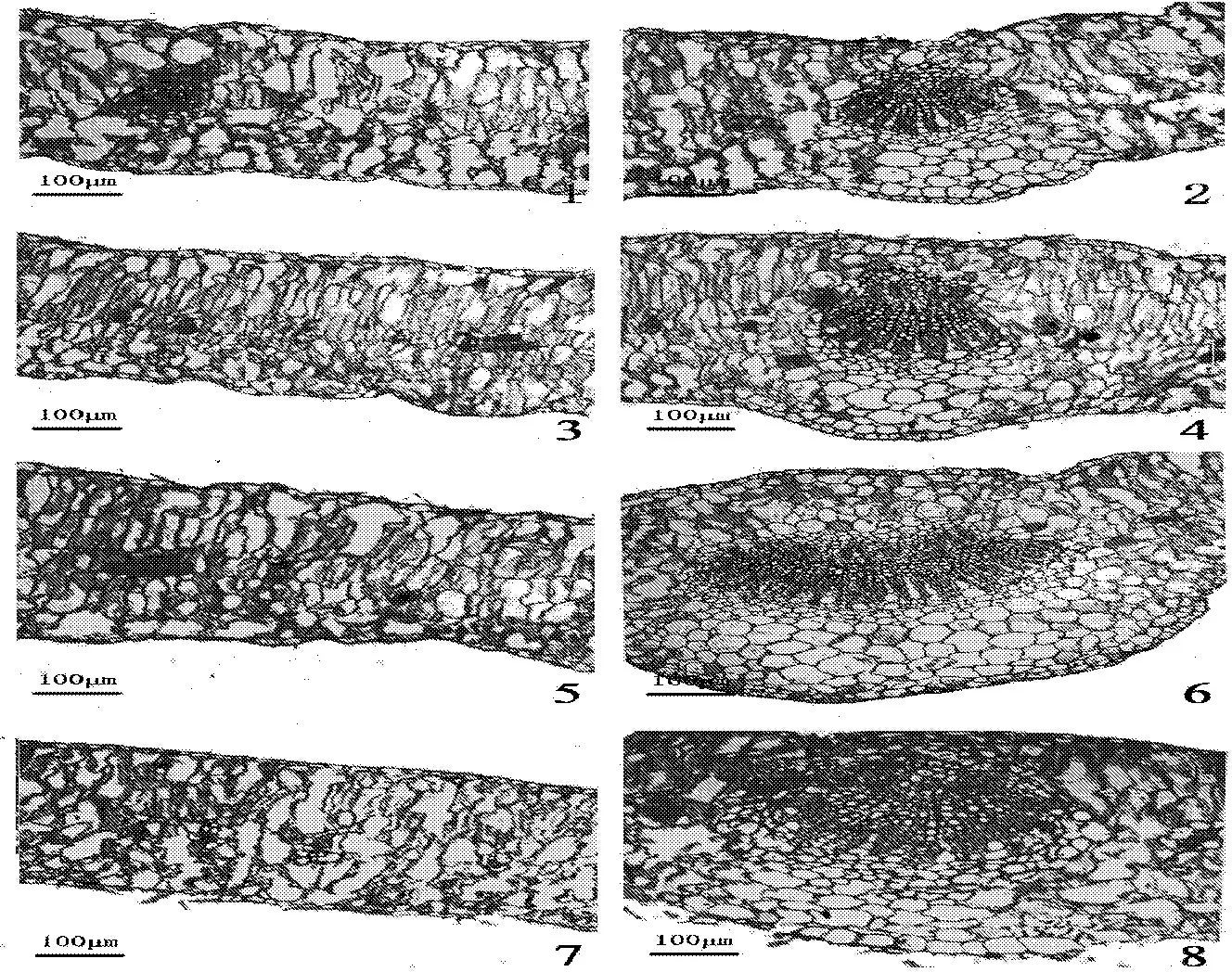
图1 NaHCO3胁迫下宁夏枸杞叶解剖结构的变化(×100)
Fig.1 Anatomical structure ofLyciumbarbarumL.
注:1和2为CK; 3和4为150 mmol·L-1的NaHCO3处理; 5和6为300 mmol·L-1的NaHCO3处理; 7和8为450 mmol·L-1的NaHCO3处理。
Note: 1 and 2 — control; 3 and 4 — 150 mmol·L-1NaHCO3; 5 and 6 — 300 mmol·L-1NaHCO3; 7 and 8 — 450 mmol·L-1NaHCO3.
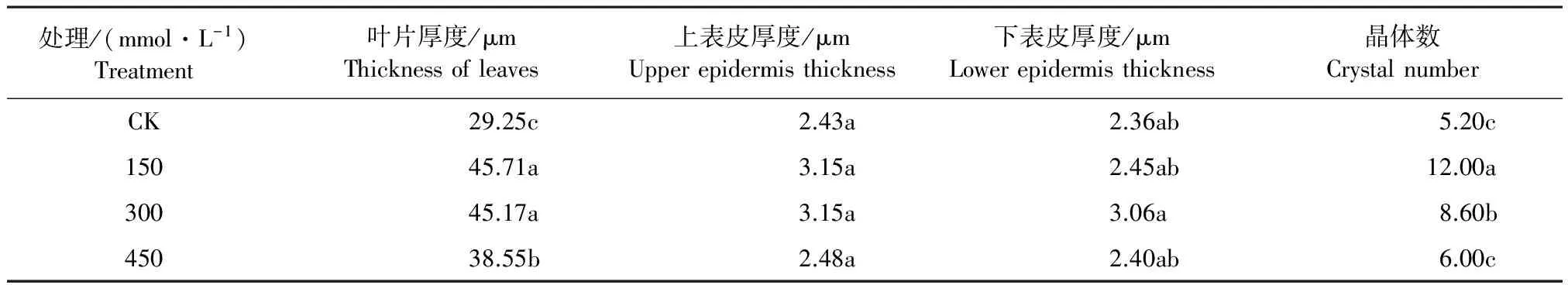
表2 NaHCO3胁迫下枸杞叶片结构参数变化
2.3 NaHCO3胁迫下宁夏枸杞叶超微结构的变化
从图2可以看出,对照枸杞叶肉细胞结构正常(图2中1,2和3),细胞形状较规则,叶绿体在细胞内沿质膜边缘排列。叶绿体呈梭形结构,外膜完整,基粒片层排列整齐;在300 mmol·L-1NaHCO3胁迫下,细胞形状变的较不规则,叶绿体结构变形,有的甚至变成球型,基粒片层排列紊乱,轻微弯曲,淀粉粒增多,叶绿体膜受到破环,同时质膜受到损伤(图2中4,5和6);450 mmol·L-1处理下,叶绿体远离细胞壁,叶绿体结构开始皱缩,变短,基粒片层解体,淀粉粒明显增多,同时,细胞质中产生许多膜状结构,观察到有些叶肉细胞被泡状结构所充满(图2中7,8和9)。

图2 NaHCO3胁迫下枸杞叶肉细胞的超微结构
Fig.2 Ultrastructure of mesophyll cells ofLyciumbarbarumL.
注:1. CK, ×25000; 2. CK叶绿体, ×30000; 3. CK细胞壁, ×20000; 4. 300 mmol·L-1NaHCO3, ×25000; 5. 300 mmol·L-1NaHCO3叶绿体, ×30000; 6. 300 mmol·L-1NaHCO3细胞壁, ×20000; 7. 450 mmol·L-1NaHCO3, ×25000; 8. 450 mmol·L-1NaHCO3叶绿体, ×30000; 9. 450 mmol·L-1NaHCO3细胞壁, ×20000; Ch—叶绿体 chloroplast;CW—细胞壁 cell wall;G—叶绿体基粒 chloroplast grana;IS—细胞间隙 intercellular space;PI—胞间连丝 plasmodesma;L—脂质球 lipid ball;S—淀粉粒 starch grain;PM—质膜 plasm membrane;P—质膜突起 cell membranes protrusion.
2.4 NaHCO3胁迫下宁夏枸杞光合参数的变化
随NaHCO3浓度的升高,宁夏枸杞Pn、Tr、Ls和Gs呈下降趋势(图3),Ci呈升高趋势;WUE随着胁迫浓度的增加呈先升后降的趋势。Pn、Ci、Tr、Gs、Ls和WUE各处理间差异达显著水平(P<0.05)。
2.5 宁夏枸杞生长、叶片结构与光合参数的相关性分析
从表3可知,NaHCO3胁迫强度与净生长量、地上部干重、地下部干重、整株干重、Pn、Tr、Gs和Ls呈负相关关系,其中与Pn、Tr、Gs呈显著负相关 (P<0.05);与叶片厚度、上下表皮厚度相关关系小;净生长量、地上部干重和整株干重与Pn、Tr、Gs呈显著正相关,与叶片晶体数呈正相关(P<0.05) ,其中地上部干重和整株干重与Pn呈极显著正相关(P<0.01);Pn与Tr和Gs呈显著正相关(P<0.05)。
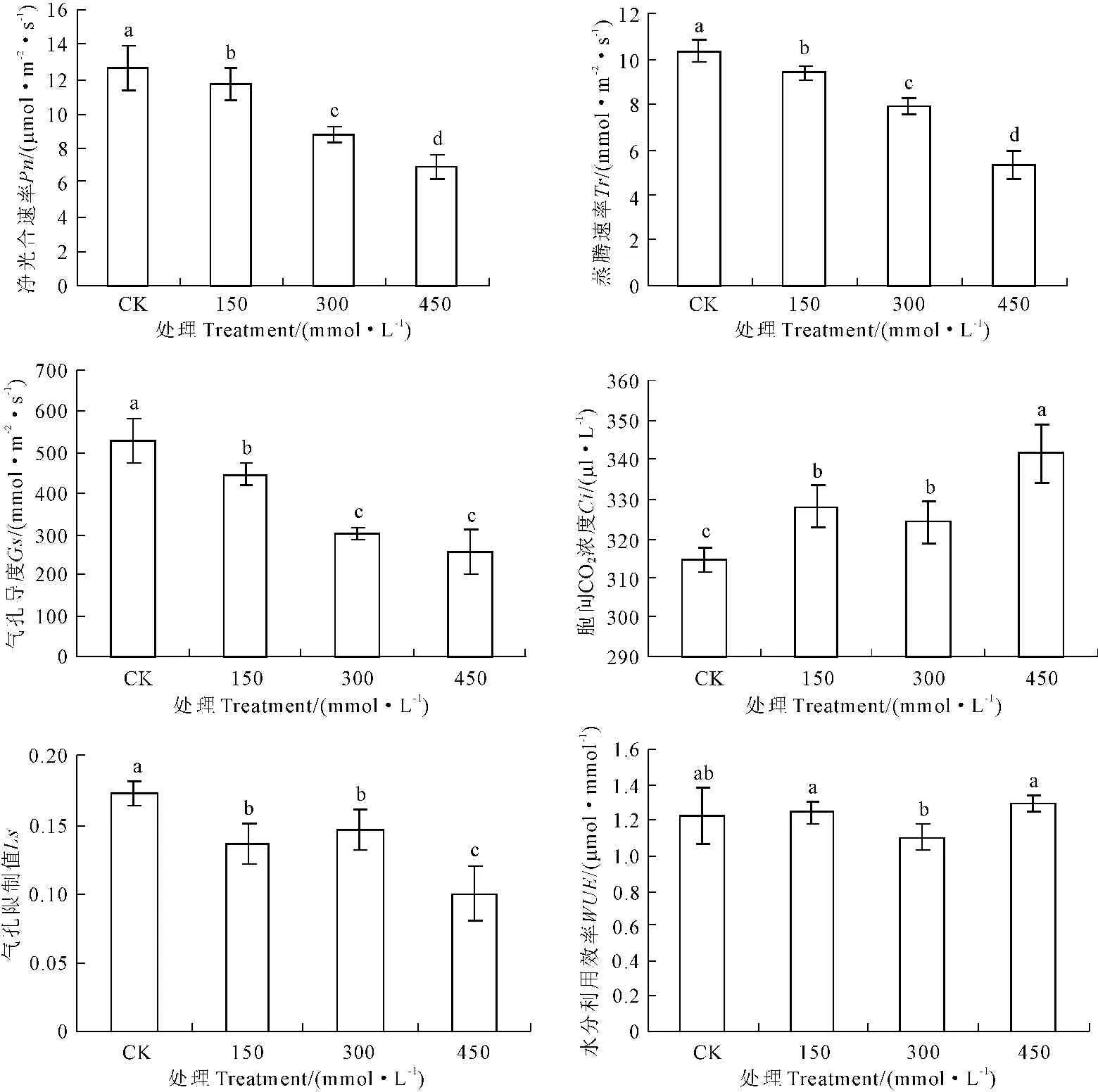
图3 NaHCO3胁迫下宁夏枸杞Pn、Tr、Gs、Ci、Ls和WUE的变化
Fig.3 Effects of NaHCO3stress onPn、Tr、Gs、Ci、LsandWUEof seedlings ofLyciumbarbarumL.
3 讨 论
植物耐盐碱胁迫研究中的相关形态指标是评价其耐盐碱能力最为直接的判断依据,生长是代谢过程在形态上的综合表现[7]。生长抑制是植物在盐渍逆境下的综合体现,一方面,植物通过减缓生长、改变形态特征、重新构建生物量分配格局来维持逆境下的存活;另一方面,植物应对盐渍逆境消耗更多的能量,使其用于生长的能量相应减少[8]。生长量和生物量是植物对盐碱胁迫响应的综合体现及对盐胁迫的综合反映[7]。本研究结果显示,宁夏枸杞在低浓度(150 mmol·L-1)时,净生长量与对照相比增加,随着浓度的升高,生长受到了抑制(表1);生物量随着胁迫浓度的增加呈下降趋势。低浓度胁迫促进枸杞生长,主要是由于长期对盐碱胁迫环境的适应,己经具有了稳定的可遗传的各种适应特性,使之在一定程度上表现出对盐碱胁迫环境的适应能力[9]。
叶片的叶肉细胞是植物进行光合作用的基本单位,其光合能力的大小主要是由叶肉细胞的结构所决定的。植物利用叶器官结构适应所生存环境的“对策”,也是多种多样的。从本研究结果看出,栅栏组织在植物适应逆境环境过程中起着重要作用,随着胁迫浓度的增加,宁夏枸杞栅栏组织结构紧密度下降,层数减少,维管束不发达,没有花环结构。此外,枸杞栅栏组织细胞内含有大量的晶体细胞,随着胁迫程度的增加,晶体个数呈先增后降的趋势(图1,表2),一般认为这些结晶与干旱胁迫相关,因盐碱胁迫也会产生生理干旱[10]。在低浓度盐胁迫下晶体(草酸钙)数目的增加,使叶片可以积累大量渗透调节物质降低叶片渗透势,来维持叶片的保水和吸水能力。国内外大量研究发现盐碱胁迫对植物细胞的膜脂过氧化有促进作用,主要表现在电解质渗漏率增大,叶绿体、线粒体等细胞器的超微结构破坏[11-12],其中叶绿体是感受盐碱胁迫最敏感的细胞器,其结构会随着胁迫浓度的不同而改变。从本试验结果可以看出,枸杞随着胁迫浓度的升高,结构受到不同程度的伤害。其中枸杞淀粉粒明显增多,主要是由于光合作用的下降,光合产物以淀粉的形式沉积,也可能与高浓度盐碱阻碍了淀粉的水解和向外运输有关[13]。

表3 NaHCO3胁迫下枸杞生长、结构和光合参数的相关性
注 Note:NHI:净生长量 net height increment;TDW:地上部干重 top dry weight;RDW:地下部干重 root dry weight;WDW:整株干重 whole dry weight;RT:根冠比 root/top ratio;TL:叶片厚度 thickness of leaves;UET:上表皮厚度 upper epidermis thickness;LET:下表皮厚度 lower epidermis thickness;CN:晶体数 crystal number;SSI: 盐胁迫强度 salt stress intensity. * 表示在0.05水平上显著相关 correlation is significant at 0.05 level; ** 表示在0.01水平上极显著相关 correlation is significant at 0.01 level.
盐碱胁迫能够导致植物光合作用下降,是盐碱胁迫下作物大量减产的主要原因之一。一般认为耐盐碱性越强的植物受盐胁迫后其光合的下降越少[14-15]。本研究结果显示,Pn、Tr和Gs随NaHCO3浓度的升高呈下降趋势,胞间Ci呈升高趋势(图2)。盐碱胁迫对光合作用造成伤害的具体途径至今尚未达到统一的认识,通常认为主要是气孔因素和非气孔因素[16-17]。一般认为Ci与Pn变化方向相同,两者都减小且Ls值增大时,光合速率的下降主要是由气孔限制因素引起的;如果Pn下降,Ci升高,Ls减少,那么光合速率下降的决定因素是非气孔限制因素[18]。宁夏枸杞在300 mmol·L-1NaHCO3处理下Pn和Ci降低、Ls增加,说明是气孔因素占主导;450 mmol·L-1NaHCO3处理下Pn和Ls降低、Ci增加,说明非气孔因素限制光合作用。
叶肉细胞的形态和排列与叶片光合速率密切相关[18]。表3的相关性显示,碱性盐胁迫强度与叶片光合参数相关关系大,其次与净生长量和生物量有一定的相关关系,与叶片的形态结构相关关系较小,主要由于NaHCO3胁迫下,叶片厚度均高于对照,说明NaHCO3胁迫下,叶片厚度的增加促使水分传导距离的增加,提高了水分利用效率;同时,叶片厚度增加也阻碍了CO2从气孔扩散到羧化位点的路径,从而阻碍了气孔与叶肉组织间的联系(降低了Gs)[19],由此说明NaHCO3胁迫改变了叶片的功能性状,影响到叶片的光合作用,促使枸杞光合作用下降,光合作用的下降又直接影响干物质积累,乃至株高的生长。
[1] Boyer J S. Plant productivity and environment[J]. Science, 1982,218(4571):443-448.
[2] 刘玉萍,苏 旭,李建民,等.青海湖畔种典型盐生植物叶片超微结构研究[J].华东师范大学学报(自然科学版),2014,48(1):91-96.
[3] 孟凡娟,庞洪影,王建中,等.NaCl和Na2SO4胁迫下两种刺槐叶肉细胞叶绿体超微结构[J].生态学报,2011,31(3):0734-0741.
[4] Sudhir P, Murthy S D S. Effects of salt stress on basic processes of photosynthesis[J]. Photosynthetica, 2004,42(4):481-486.
[5] 刘永康,郑和平,徐艳霞,等.冬小麦品种更替过程中旗叶结构与光合作用的关系研究[J].河南农业科学,2013,42(3):10-14.
[6] Penuelas J, Filella I, Llusià J, et al. Comparative field study of spring and summer leaf gas exchange and photobiology of the mediterranean trees quercus ilex and Phillyrea latifolia[J]. Journal of Experiment Botany, 1998,49(319):229-238.
[7] 李 峰,谢永宏,覃盈盈.盐胁迫条件下湿地植物的适应策略[J].生态学杂志,2009,28(2):314-321.
[8] Grundmann O, Nakajima J, Seo S, et al. Anti-anxiety effects of Apocynum venetum L. in the elevated plus maze test[J]. Journal of Ethnopharmacology, 2007,110(3):406-411.
[9] 赵可夫,李法曾,樊守金,等.中国盐生植物[J].植物学通报,1999,16:201-207.
[10] 李建东,草地学,郑慧莹,等.松嫩平原盐碱化草地治理及其生物生态机理[M].北京:科学出版社,1997.
[11] 华 春,王仁雷.盐胁迫对水稻叶片光合效率和叶绿体超显微结构的影响[J].山东农业大学学报(自然科学版),2004,35(1):27-31.
[12] 孔令安,郭洪海.盐胁迫下杂交酸模超微结构的研究[J].草业学报,2000,9(2):53-57.
[13] Chatterton N J, Carlson G E, Hungerford W E. Effect of tillering and cool nights on photosynthesis and chloroplast starch in pangola[J]. Crop Science, 1972,12(2):206-208.
[14] Yang Y, Jiang D A, Xu H X, et al. Cyclic electron flow around photosystem I is required for adaptation to salt stress in wild soybean speciesGlycinecyrtolobaACC547[J]. Biologia plantarum, 2006,50(4):586-590.
[15] Yang Y, Yan C Q, Cao B H, et al. Some photosynthetic responses to salinity resistance are transferred into the somatic hybrid descendants from the wild soybean Glycine cyrtoloba ACC547[J]. Physiologia Plantarum, 2007,129(3):658-669.
[16] Lu C, Vonshak A. Effects of salinity stress on photosystem II function in cyanobacterial Spirulina platensis cells[J]. Physiologia plantarum, 2002,114(3):405-413.
[17] Yang X, Lu C. Photosynthesis is improved by exogenous glycinebetaine in salt-stressed maize plants[J]. Physiologia plantarum, 2005,124(3):343-352.
[18] 寇伟锋,刘兆普,陈铭达,等.不同浓度海水对油葵幼苗光合作用和叶绿素荧光特性的影响[J].西北植物学报,2006,26(1):73-77.
[19] 蔡海霞,吴福忠,杨万勤.干旱胁迫对高山柳和沙棘幼苗光合生理特性的影响[J].生态学报,2011,31(9):2430-2436.
Effects of alkali stress on growth, structure and photosynthetic parameters ofLyciumbarbarumL.
MAO Gui-lian1, LIANG Wen-yu1, WANG Sheng1,2, XU Xing3, ZHENG Rui1, ZHU Zhi-ming3
(1.CollegeofLifeScience,NingxiaUniversity,Yinchuan,Ningxia750021,China;2.KeyLaboratoryofMinistryofEducationforProtectionandUtilizationofSpecialBiologicalResourcesinWesternChina,Yinchuan,Ningxia750021,China; 3.CollegeofAgriculture,NingxiaUniversity,Yinchuan,Ningxia750021,China)
To reveal the relationship between the growth, structure, photosynthesis, and the potential mechanism of salt-alkali resistance ofLyciumbarbarumL., the growth, anatomical structure, ultrastructure and photosynthetic parameters were investigated under alkali stress in pot experiments. The results showed that with the increase in concentration of NaHCO3, the net height first increased and then decreased, the top dry weight, the root dry weight, and the whole dry weight decreased, and the root to top ratio increased. With the increase in concentration of NaHCO3, the number of cell layer of palisade tissue and the cell structure compactness decreased, and thickness of leaves, upper Epidermis thickness, lower Epidermis thickness and crystal number first increased and then decreased. With the increase in concentration of NaHCO3, irregular form of mesophyll cell, deformation of chloroplast, disrupted granum lamellae and increased starch number were observed. The net photosynthetic rate (Pn), stomatal conductance(Gs), transpiration rate(Tr), and stomatal limitation(Ls) decreased, and intercellular CO2concentration and water use efficiency(WUE) first increased and then decreased when the concentration of NaHCO3increased. Plant net growth increment, whole plant-biomass accumulation,Pn,Tr,LsandGswere negatively correlated to alkali stress intensity, and significantly negative correlations was found betweenPn,Tr,Gsand alkaline stress intensity ofLyciumbarbarumL. The results suggested the functional traits ofLyciumbarbarumL. were inhibited by higher NaHCO3stress, which reduced the photosynthesis, and thus ultimately a decrease in biomass accumulation and the growth was brought about.
alkali stress;LyciumbarbarumL.; growth; structure; photosynthetic parameter
1000-7601(2017)04-0236-07
10.7606/j.issn.1000-7601.2017.04.36
2016-04-20
国家自然科学基金项目(31360168, 31360361); 宁夏自然科学基金项目(NZ13033)
毛桂莲(1974—),女,宁夏中宁人,副教授,主要从事植物抗逆生理研究。E-mail: fransis-0327@163.com。
许 兴(1959—),男,教授,主要从事植物生理生态研究。E-mail: xuxingscience@126.com。
S567.1+9
A

