外源亚精胺对渗透胁迫下南瓜幼苗抗氧化酶活性等生理特性的影响
吴旭红,冯晶
(1.齐齐哈尔大学生命科学与农林学院, 黑龙江 齐齐哈尔 161006; 2.齐齐哈尔市卫生监督所, 黑龙江 齐齐哈尔 161005)
外源亚精胺对渗透胁迫下南瓜幼苗抗氧化酶活性等生理特性的影响

(1.齐齐哈尔大学生命科学与农林学院, 黑龙江 齐齐哈尔 161006; 2.齐齐哈尔市卫生监督所, 黑龙江 齐齐哈尔 161005)
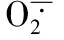
南瓜幼苗;亚精胺;渗透胁迫;渗透调节物质;抗氧化酶
亚精胺(Spd)作为多胺(PA)中的一种具强烈生理活性的小分子脂肪族含氮碱,对植物生长发育具有多方面的调节作用[1-2]。植物在逆境下,细胞内常会积累大量多胺,能够对多种生物和非生物逆境作出应答[3-4]。尤其亚精胺(Spd),除参与植物性别分化、果实成熟与衰老等过程外,还作为逆境下的直接胁迫保护物质,以其独特的分子结构,在胁迫信号转导中直接参与胁迫抗性机制的构建[5]。亚精胺(Spd)和精胺(spm)在DNA复制中,因能与拓补异构酶之间发生交互作用,稳定酶-模板复合物;在转录后修饰、蛋白质合成的后加工过程中参与其磷酸化等,从而影响DNA复制、RNA转录和蛋白质的生物合成[6]。在植物的生长发育中介导了胞内离子平衡、酶活调控、细胞分化等多种生理过程。目前,施用外源多胺已成功应用于提高植物的抗逆性[7-9]。
我国有大量的可耕地处于干旱、半干旱地区,加之大部地区处于亚洲季风气候区,更加重了旱灾的普遍性和持续性。土壤水分是影响植物生长发育的主要因子[10],在干旱逆境下,通过应用外源调节物质如多胺类,探索植物自身的生化响应机制和生理变化规律,对植物避旱和耐旱能力的研究具有重要意义。刘怀攀等[11]发现,Spd能通过抑制NADPH氧化酶活性提高抗氧化酶活力,从而降低叶片内ROS,达到提高玉米苗期抗旱性;段辉国等[12]报道了Spd处理能缓解渗透胁迫对小麦幼苗造成的伤害,提高小麦抗渗透胁迫能力;闫刚等[13]研究表明,Spd能促进干旱处理下番茄幼苗内糖类的转换和利用,通过参与番茄生育早期碳水化合物的代谢,促进番茄的生长发育。以往Spd对植物逆境生理生化的影响多以玉米、小麦、大豆、水稻和蔬菜番茄、黄瓜为试材,在南瓜上的研究鲜见报道。南瓜是重要的粮食、饲料、油料及观赏作物,早期干旱尤其是东北、西北地区频发的春旱,严重制约了南瓜种植面积的扩大和产量的提高。本研究以南瓜为材料,通过外施不同浓度Spd,探讨南瓜苗期生长、ROS的产生和清除、抗氧化体系的生理响应及有机渗透调节物质的变化,揭示Spd提高南瓜幼苗耐旱性的生理机制,以期为外源Spd缓解胁迫伤害及南瓜的抗逆栽培提供依据。
1 材料与方法
1.1 材 料
供试南瓜(CucurbitamoschataDuch)品种为银辉2号,由齐齐哈尔市种子经销处提供。
1.2 方 法
1.2.1 试材培育 试验于2013年3-7月在齐齐哈尔大学生化实验室进行。精选饱满均匀一致的南瓜种子,先经0.1% HgCl2浸泡消毒10 min,再用去离子水反复冲洗干净后放入55℃温水中浸泡10 min,并不断搅拌使水温降至30℃恒温浸泡6 h,之后置于铺有三层纱布的培养皿中,每皿20粒,于25℃恒温培养箱中进行催芽。将培养基细砂经清水浸泡1 h,高温灭菌3 h(130℃),等量称重装盒,之后将露白后的种子播入花盆中,每盆播11粒,于人工气候培养箱中(25℃/20℃±1℃,光照/黑暗:14 h/10 h,相对湿度60%~70%),每3天用1/4 Hongland营养液浇灌。待幼苗第三片真叶展开时,拔除长势差和太密集的幼苗,从人工气候箱中取出转为自然培养,自然培养2周后,每盆定苗8株。
1.2.2 Spd溶液配制 亚精胺(Spd)为Sigma公司产品,先用去离子水配成100 mmol·L-1母液,4℃保存,稀释成相应浓度待用。
1.2.3 试验处理 当幼苗长至4~5片真叶时,将其随机分为三组。分别为:对照CK1:1/4 Hoagland营养液+叶喷蒸馏水;对照CK2:1/4 Hoagland营养液+PEG-6000 200 g·L-1+叶喷蒸馏水;1/4 Hoagland营养液+PEG-6000 200 g·L-1+叶喷 Spd(T1:0.3 mmol·L-1;T2:0.6 mmol·L-1;T3:0.9 mmol·L-1;T4:1.2 mmol·L-1),分别用不同浓度Spd于每天8∶30和14∶30叶面喷施二次,每次喷施量为10 ml·盆-1。以叶片正反面都无溶液滴下为宜,共处理7 d。每处理32株苗,每次取样8株,3次重复。
1.3 测定项目和方法
1.3.1 幼苗生长及鲜重、干重的测定 取幼苗并将地上、地下部分分开,迅速用蒸馏水洗净并吸干表面水分,称取鲜重后,110℃烘箱杀青10 min,之后转至75℃烘干至衡重,称干重。地上部鲜重和干重以8株幼苗的平均值表示,单位为g·株-1,按干重/鲜重计算干物率(%);根系活力用TTC法测定[14];耐性指数%=(处理总生物量/对照总生物量)%-100%。
1.3.3 抗氧化酶活性及抗氧化物质含量的测定 超氧化物歧化酶(SOD)活性用氮蓝四唑(NBT)光化还原法测定,以抑制氮蓝四唑(NBT)光化还原50%为一个酶活单位(U)表示[18];过氧化物酶(POD)、过氧化氢酶(CAT)活性按张志良等[14]的方法测定;抗坏血酸过氧化物酶(APX)活性按照Nakano和Asada[19]的方法,测定1 min内290 nm紫外吸收值的变化,酶活以μmol ASA·h-1·g-1FW表示;抗坏血酸(ASA)和谷胱甘肽(GSH)参照李晓云等[20]的方法定量。1.3.4 渗透调节物质含量的测定[17]脯氨酸含量的测定采用酸性茚三酮比色法;蒽酮比色法测可溶性糖含量;可溶性蛋白用考马斯亮蓝法;氨基酸总量用茚三酮显色法测定。
1.4 统计分析
实验数据用Microsoft Excel软件绘图,用SAS统计软件对平均数进行数据统计分析,采用最小差异法(LSD)进行多重比较和差异显著性分析(α=0.05)。
2 结果与分析
2.1 外源Spd对渗透胁迫下南瓜幼苗生长的影响
植物生长受到抑制是干旱的表观生理效应。由表1可见,渗透胁迫处理7 d,南瓜幼苗地上、地下部干重和根系活力均显著低于正常生长条件,降幅分别达到34.41%、47.73%、56.06%,说明南瓜幼苗干物质增长受阻,且对根系影响大于地上部分。不同浓度Spd处理,均使胁迫下幼苗的生物量增加,但不同浓度Spd对幼苗生物积累的影响效应有较大差异。T3处理(0.9 mmol·L-1Spd),地上、地下部干物质积累分别较CK2提高了39.22%、66.29%,根系活力提高了1.81倍(P<0.05),耐性指数降至最低,调控幼苗生长的效果最显著。T4处理(1.2 mmol·L-1Spd),干物质增长和根系活力开始呈下降趋势,耐性指数升高。Spd处理对南瓜幼苗表现出明显的适宜浓度促进而高浓度抑制的双重效应,且根系对Spd的响应比地上部更敏感。
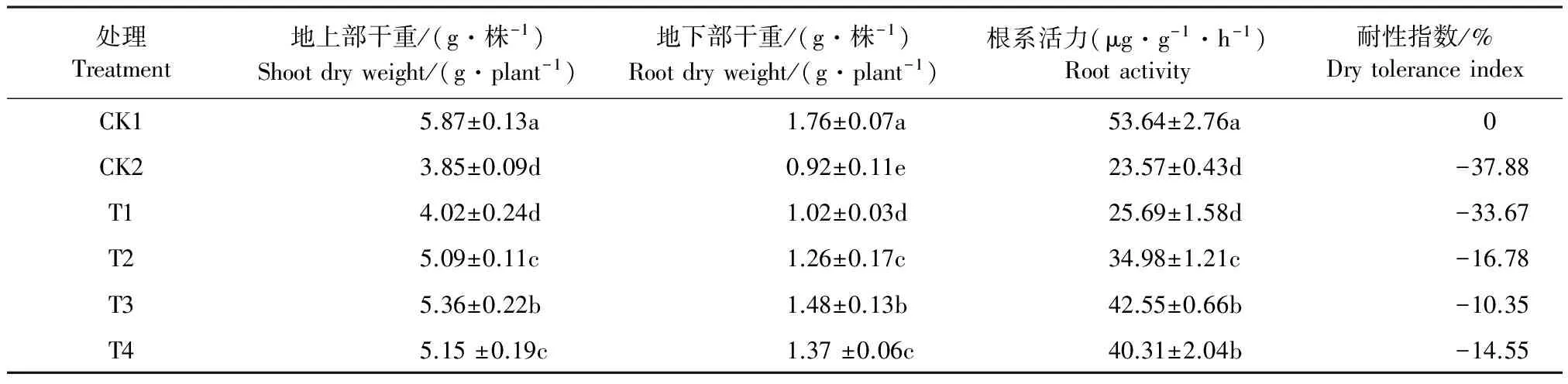
表1 外源亚精胺对渗透胁迫下南瓜幼苗生长的影响
注:同一列数据后不同小写字母表示差异显著(P<0.05),下同。
Note: values with different lowercase in same column are significantly different(P<0.05), the same below.
表2 外源Spd对渗透胁迫下南瓜幼苗产生速率和H2O2、MDA含量及相对电解质渗透率的影响
2.3 外源Spd对渗透胁迫下南瓜幼苗根叶保护酶活性的影响
如表3所示,渗透胁迫使南瓜幼苗叶片和根系的SOD活性均显著增加,分别比对照升高了56.04%、63.94%(P<0.05),SOD活性变化是ROS的诱导而使南瓜幼苗为抵抗和适应渗透胁迫逆境产生的应激响应;POD活性在根系和叶片中的变化不同,渗透胁迫显著降低了叶片POD活性,降幅达59.19%(P<0.05),但根系酶活仅减少6.52%,并未受到显著影响(P>0.05);CAT和APX活性呈现出不同的变化趋势,渗透胁迫处理,根、叶CAT活性分别下降了28.20%、31.87%,而APX活性分别提高了102.33%、72.55%,说明在南瓜内生性的保护机制中,SOD、APX发挥了清除ROS,以抵御和适应渗透胁迫的重要作用。
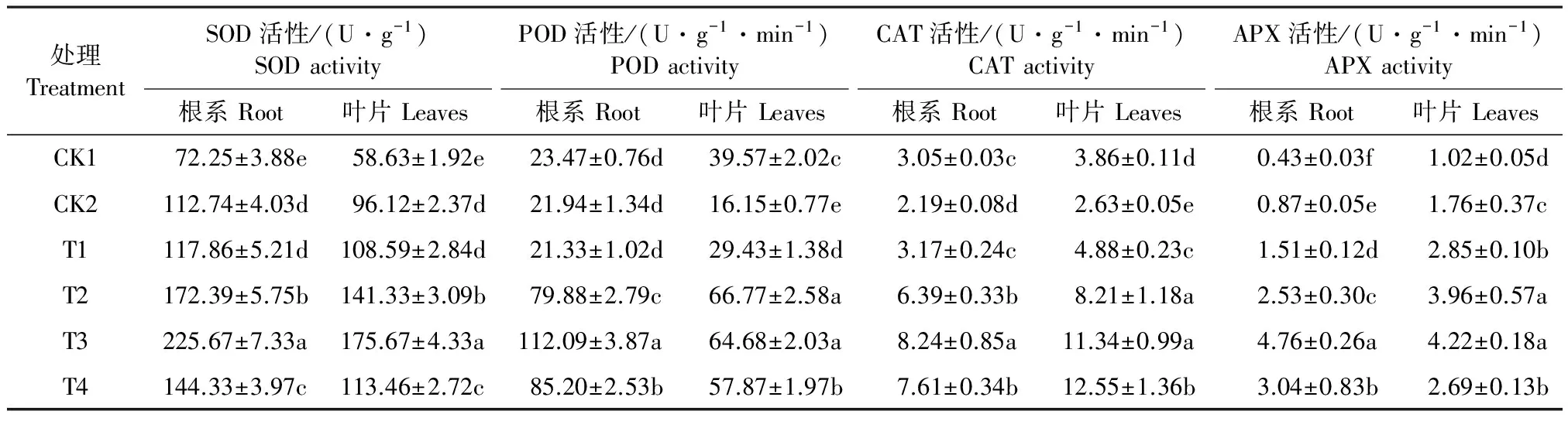
表3 外源Spd对渗透胁迫下南瓜幼苗根、叶保护酶活性的影响
外源不同浓度Spd处理后,对南瓜幼苗根系和叶片4种酶活性的影响有所不同。随Spd浓度升高,根、叶SOD活性在0.9 mmol·L-1Spd处理时达到最大值,显著高于对照,达到渗透胁迫的2.00、1.83倍; POD活性峰值分别出现在0.9和0.6 mmol·L-1Spd处理,叶片酶活随Spd浓度加大升幅较小,而根系从Spd浓度为0.6 mmol·L-1开始升幅显著高于叶片; CAT活性根、叶相差较大且变化趋势有所不同,叶片酶活性明显高于根系;根、叶APX活性都表现为随Spd浓度逐渐增大而先升后降的变化趋势,最大值同步出现在0.9 mmol·L-1Spd处理,分别较对照增加了11.07倍、4.14倍。保护酶活性的变化表明,0.9 mmol·L-1Spd处理,可诱发和激活南瓜幼苗在逆境下的保护性反应,提高植株清除ROS的能力。但随处理强度加大,除叶片CAT活力持续升高外,1.2 mmol·L-1Spd处理导致酶活显著下降,也说明这种保护性反应是有限的,当超过防御能力的阈值时,仍会造成细胞结构和功能的损害。
2.4 外源Spd对渗透胁迫下南瓜幼苗根系ASA-GSH循环抗氧化物质的影响
ASA是存在于植物细胞质和叶绿体的小分子抗氧化剂,既可以通过自身氧化还原状态的可逆变化来清除由呼吸代谢和逆境压力产生的ROS,也可以借助于抗坏血酸-谷胱甘肽循环(ASA-GSH)清除H2O2,来降低氧化胁迫对植物所造成的损伤。由图1可知,渗透胁迫下,根系ASA含量比对照下降46.01%,差异显著;DHA比对照增加了5.76倍,达差异极显著。外源Spd处理后不同程度提高了根系ASA含量,降低了DHA水平。0.9 mmol·L-1Spd处理,ASA含量达渗透胁迫的2.88倍,DHA含量降至胁迫处理的29.34%。ASA的还原状态是抗逆境胁迫的重要前提,0.6、0.9、1.2 mmol·L-1Spd处理,ASA/DHA分别较渗透胁迫下提高了4.68、7.26倍和2.93倍。说明外源Spd处理通过参与南瓜幼苗内ASA-GSH循环,有效提高南瓜幼苗ASA含量,0.9 mmol·L-1Spd处理ASA/DHA达到最大值。
GSH也是胞内过氧化物的重要清除剂。渗透胁迫GSH含量比对照下降了32.40%,氧化型谷胱甘肽(GSSG)则增加了96.31%(P<0.05);0.6、0.9 mmol·L-1Spd处理,GSH含量分别比胁迫下提高了2.25、2.41倍,GSSG则含量降至胁迫的81.46%和69.95%;渗透胁迫处理GSH/GSSG比对照下降72.05%,GSH/GSSG比值随Spd处理浓度加大先升后降,0.9 mmol·L-1Spd达到处理最大值,此后又下降。说明外源Spd在ASA-GSH循环中可以刺激和诱导GSH含量增加,减少GSSG生成,参与了ASA-GSH循环中GSH和GSSG含量的调节。
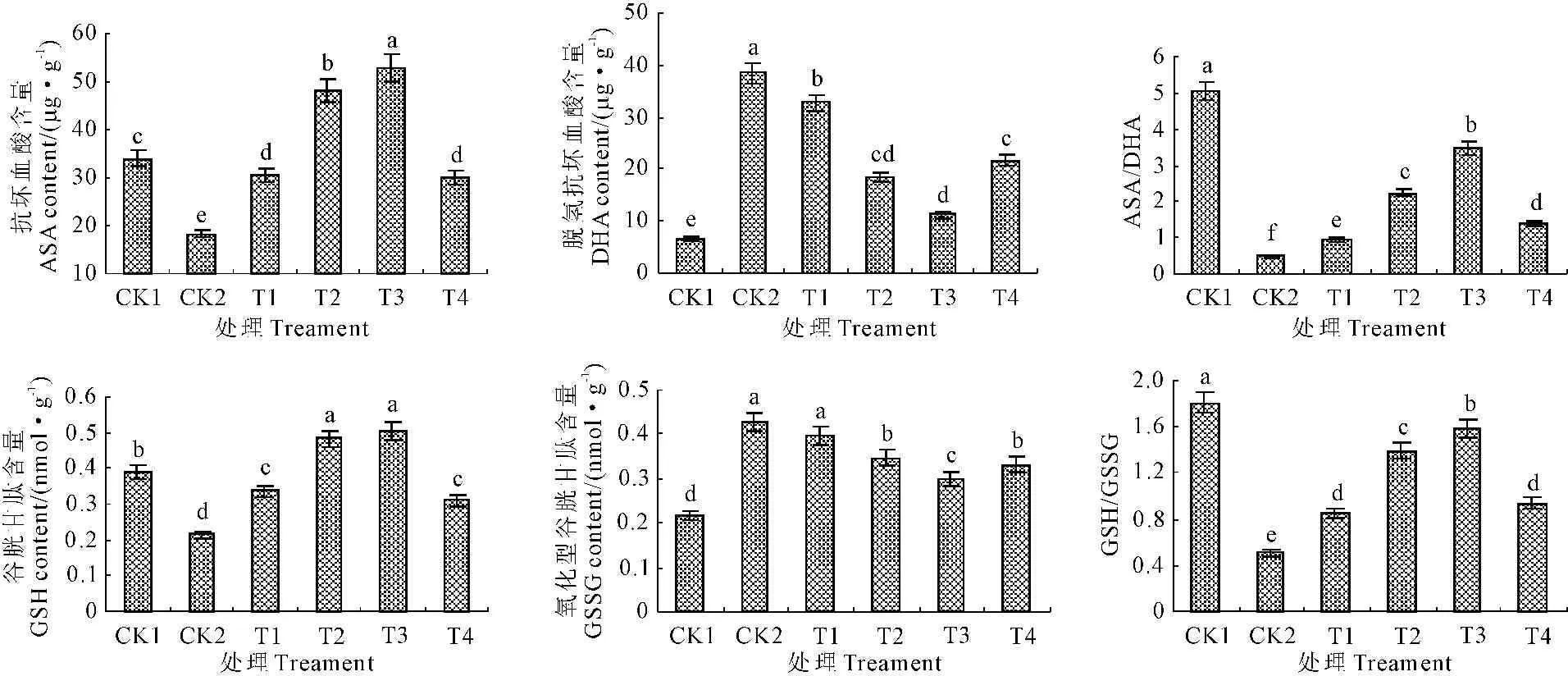
图1 外源Spd对渗透胁迫下南瓜根系ASA、DHA、GSH、GSSG含量及ASA/DHA和GSH/GSSG的影响
Fig.1 Effects of exogenous Spd on ASA,DHA,GSH,GSSG contents and ASA/DHA and GSH/GSSG ratios of pumpkin roots under osmotic stress
2.5 外源Spd对渗透胁迫下南瓜幼苗叶片渗透调节物质含量的影响
南瓜叶片游离氨基酸含量在渗透胁迫下大幅升高,处理7 d时达对照的2.74倍。外源Spd处理后,南瓜叶片的氨基酸含量均显著下降,且随处理浓度加大游离氨基酸的积累呈先降后升的变化趋势。0.9 mmol·L-1Spd处理效果最为显著,叶片游离氨基酸含量降至渗透胁迫处理的54.19%。植物体内的可溶性蛋白多为参与代谢活动的酶类,渗透胁迫逆境,叶片可溶性蛋白含量大幅下降。0.6、0.9 mmol·L-1Spd处理,蛋白质含量分别比渗透胁迫升高了61.47%、48.52%(P<0.01)。由此表明,适宜剂量的Spd处理,可显著抑制南瓜叶片可溶性蛋白含量的下降。推测为以多聚阳离子状态存在的多胺,与胞内某些蛋白质之间因电荷效应抑制了蛋白质的降解或促进了某些蛋白质的合成。
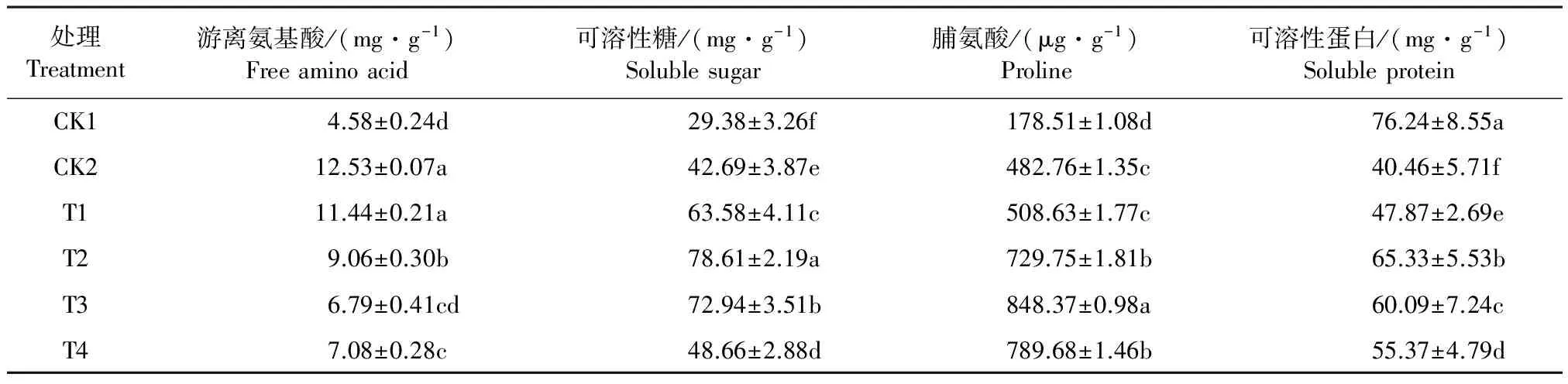
表4 外源Spd对渗透胁迫下南瓜叶片渗透调节物质含量的影响
可溶性糖是重要的渗透调节物质,胁迫导致可溶性糖含量升高。Spd各处理分别比胁迫逆境增加了48.93%、84.14%、70.86%、13.98%,说明在逆境下,0.6、0.9 mmol·L-1Spd处理通过对碳代谢关键酶水平的调节,增加了光合碳同化产物积累,细胞渗透势下降,保持了细胞膨压和各种代谢的正常进行,提高了干旱逆境中南瓜幼苗的渗透保护能力。脯氨酸既是植物体内重要的渗透调节物质,又是抗氧化物质。当植物遭受渗透胁迫时,由于生理缺水,体内脯氨酸大量积累。表4显示,渗透处理使南瓜叶片脯氨酸含量比对照提高了140.18%(P<0.05)。外施Spd后不同程度促进了脯氨酸含量的提高,0.6、0.9、1.2 mmol·L-1Spd处理,脯氨酸含量分别达到对照的4.08、4.75、4.42倍。由于脯氨酸是多集中于细胞质中的不带静电荷无毒的偶极含氮化合物,有极强的水合能力,因此在渗透胁迫环境下有助于细胞持水,通过调控自身水分平衡,缓解了南瓜幼苗遭受的胁迫伤害。0.9 mmol·L-1Spd处理既保持了细胞与环境的渗透平衡,提高了细胞的保水能力,有效调控了南瓜叶片的脯氨酸代谢。
3 讨 论
根系是植物对渗透胁迫环境感应最早和最敏感的器官。本试验中渗透胁迫下,南瓜幼苗的地上、地下部干物重显著降低,根系活力的大幅下降而使幼苗耐性指数升至最高,与同期对照比较,对根系的影响明显大于地上部分。其可能原因为逆境下ROS增加,过氧化伤害导致膜结构受损,光合碳同化产物减少,游离氨基酸总量和可溶性蛋白减少。在形态建成过程中,C/N代谢受阻,尤其是碳架不足,以及渗透调节能耗损失较大等由于渗透胁迫导致的生理干旱的原因而抑制了南瓜生长。外源Spd处理后,不同程度促进了干物质积累,提高了根系活力和耐性指数。0.9 mmol·L-1Spd叶面喷施后,显著缓解了对根系和地上部分的生长抑制。表明外源Spd通过与膜结合,直接调控了膜的流动性,间接调节了膜结合酶的活性[6],显著提高了旱害下南瓜幼苗的持水能力,缓解了水分亏缺造成的发育障碍,促进了细胞扩展和植株生长。这与宋维贤等[21]应用Spd促进了玉米幼苗生长的研究结果一致。刘怀攀等[11]的研究也证明了外源Spd可以通过抑制玉米叶片质膜NADPH氧化酶活性,从而减少了ROS的生成,减轻了渗透胁迫对玉米幼苗的伤害。
ASA是抗氧化系统中高丰度小分子抗氧化剂,能与有毒的H2O2在APX的催化下进行反应,自身首先被氧化成单脱氢抗坏血酸(MDHA),MDHA继续氧化生成脱氢抗坏血酸(DHA),而H2O2在GSH提供的电子和还原力(NADPH)的作用下还原为H2O,从而解除H2O2的毒性。ASA可以由DHA和MDHA在DHA还原酶(DHAR)和MDHA还原酶(MDAR)作用下再生。本试验渗透胁迫使南瓜根系ASA含量下降,其可能原因为:一是胁迫逆境抑制了ASA的合成速度;二是胁迫下植物体内ROS大量生成,ASA作为抗氧化剂参与了自由基的猝灭而自身被氧化,并同时导致DHA含量的升高和ASA/DHA比值的下降。外源Spd缓解了渗透胁迫下南瓜幼苗根系ASA含量的下降,降低了DHA含量,0.9 mmol·L-1浓度的Spd维持了各处理最高的ASA/DHA比值,进一步说明,Spd通过影响渗透胁迫下GSH-ASA代谢循环而调控了细胞内的氧化还原状态,并通过提高ASA再生和合成途径中的酶活性增强了南瓜幼苗的抗氧化能力。GSH是植物细胞内含量丰富的巯基化合物,作为巯基保护剂,可以有效还原S-S键,因此其胞内含量水平与机体的抗氧化能力密切相关。本研究的结论也表明,渗透胁迫降低了GSH含量和GSH/GSSG,0.9 mmol·L-1Spd提高了胁迫环境下南瓜根系的GSH含量,降低了GSSG含量,提高了GSH/GSSG。已有证据表明,GSH/GSSG可作为胞内信号分子,对相关基因的表达、翻译速率、蛋白质巯基化以及酶活进行直接调控[24]。在ASA-GSH循环中,GSSG以NADPH作为还原力和电子供体还原为GSH,推测Spd通过提高该代谢途径的关键酶谷胱甘肽还原酶(GR)活力,维持了GSH的高含量水平和适合的GSH/GSSG,使之处于有利于抵御氧化损伤的胞内氧化还原状态。
植物在发育过程中,不断需要氨基酸来合成自身组织蛋白和功能性含氮有机物,渗透胁迫逆境下,游离氨基酸总量激增,可能是蛋白质对内源蛋白酶的敏感性升高,加速了贮存蛋白的水解所致。Spd处理后,首先由于氧自由基的清除,光合碳同化的改善促进了碳流的运转,大量游离氨基酸参入到蛋白质的合成中;其次适度增加的氨基酸为维持细胞水势起到了一定的渗透调节作用。可溶性糖和脯氨酸都是植物体内公认的渗透调节物质,本研究结果表明,0.6、0.9 mmol·L-1Spd提升了可溶性糖的积累,0.9 mmol·L-1Spd更有效地促进了光合碳代谢向氮代谢的转化,脯氨酸含量的大幅升高,推测外源Spd通过激活谷氨酸途径中脯氨酸合成的限速酶和关键酶活性促进了脯氨酸的积累,同时也提高了分解代谢关键酶ProDH的活性,加速了在南瓜叶片内的转化和利用。李州等[23]对白三叶(Trifoliumrepens)脯氨酸代谢的研究也证实,水分逆境下,Spd提高了脯氨酸合成途径(谷氨酸途径)合成代谢关键酶Δ’-吡咯啉-5-羧酸合成酶(P5CS)和分解代谢关键酶脯氨酸脱氢酶(ProDH)活性,促进了水分胁迫下脯氨酸的代谢。南瓜叶片经Spd(0.6、0.9 mmol·L-1)处理后,可溶性蛋白大幅度增加,其可能性为:一是Spd作为信息分子,在信号转导过程中,诱导了逆境蛋白相关基因的高水平表达,增加了蛋白质的合成;二是在蛋白质翻译后,多胺可与胞内原有的蛋白质发生共价交联,稳定了蛋白质的结构,减缓了蛋白质的降解[5]。
[1] Minocha R,Long S,Thangavl P,et al. Elevation dependent sensitivity of northern hardwoods to Ca addition at Hubbard Brook Experimental Forest,NH,USA[J]. Forest Ecology Management,2010,260(12):2115-2124.
[2] Khomutov A R, Keinanen T A, Grigorenko N A, et al. Methylated analogs of spermine and spermidine as tools to investigate cellular functions of polyamines and enzymes of their metabolism[J]. Molecular Biology,2009,43(2):149-159.
[3] 段辉国,袁 澍,刘文娟,等.多胺与植物逆境胁迫的关系[J] .植物生理学通讯,2005,41(4):531-536.
[4] Gill S S,Tuteja N. Polyamines and abiotic stree tolerance in plants[J].Plant Signal & Behavior,2010,5(1):26-33.
[5] Kasukabe Y, He L X,Nada K, et al. Overexpression of spermidine synthase enhances tolerance to multiple environmental stresses and up-regulates the expression of various stress regulated genes in transgenic Arabidopsis thaliana[J]. Plant and Cell Physiology,2004,45(6):712-722.
[6] 杜红阳,常云霞,刘怀攀.多胺的作用机理研究进展[J].周口师范学院学报,2010,27(5):88-91.
[7] Roychoudhury A, Basu S, Sengupta D N. Amelioration of salinity stress by exogenously applied spermidine or spermine in three varieties of rice differing in their level of salt tolerance[J]. Journal of Plant Physiology,2011,168(4):317-328.
[8] Hu X H, Zhang Y, Shi Y, et al. Effect of exogenous spermidine on polyamine content and metabolism in tomato exposed to salinitye-alkalinity mixed stress[J]. Plant Physiology and Biochemistry,2012,57(8):200-209.
[9] Sharma D K, Dubey A K, Manish S. Effect of paclobutrazol and putrescine on antioxidant enzymes activity and nutrients content in salt tolerant citrus rootstock sour orange under sodium chloride stress[J]. Journal of Plant Nutrition,2013,36(11):1765-1779.
[10] 刘锦春,Johannes H C, Cornelissen. CO2浓度变化下燕麦对干旱胁迫的生理响应[J]. 草业科学,2015,32(7):1116-1123.
[11] 刘怀攀,胡炳义,刘天学,等.亚精胺对渗透胁迫的玉米幼苗叶片NADPH氧化酶和抗氧化酶活性的影响[J].河南农业大学学报,2007,41(4):363-367.
[12] 段辉国,雷 韬,卿东红,等.亚精胺对渗透胁迫小麦幼苗生理活性的影响[J].四川大学学报(自然科学版),2006,43(4):922-926.
[13] 闫 刚,张春梅,邹志荣.外源亚精胺对干旱处理下番茄幼苗碳水化合物代谢及相关酶活性的影响[J].干旱地区农业研究,2012,30(1):143-147.
[14] 张志良,瞿伟菁,李小方.植物生理学实验指导[M].第四版.北京:高等教育出版社,2009:32-33,227-229.
[15] 王爱国,罗广华.植物的超氧自由基与羟胺反应的定量关系[J].植物生理学通讯,1990,26(2):55-57.
[16] 刘 俊,吕 波,徐朗来.植物叶片中过氧化氢测定方法的改进[J].生物化学与生物物理学研究进展,2000,27(5):548-550.
[17] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[18] 张宪政.超氧化物歧化酶活性的测定[M].北京:中国农业出版社,1992.
[19] Nakano Y, Asada K. Hydrogen peroxide is scavenged by ascorbate specific peroxidase in spinach chloroplasts[J]. Plant Cell physiology,1981,22(5):867-880.
[20] 李晓云,王秀峰,吕乐福,等.外源NO对铜胁迫下番茄幼苗根系抗坏血酸-谷胱甘肽循环的影响[J].应用生态学报,2013,24(4):1023-1030.
[21] 宋维贤,杜红阳,刘怀攀,等.亚精胺对渗透胁迫下玉米幼苗生长和有机渗透调节物质的影响[J].西北植物学报,2010,19(7):66-70.
[22] Amri E,Mohammadi M J. Effects of timing of drought stress on pomegranate seedlings(PunicagranatumL. cv ‘Atabaki’) to exogenous spermidine and putrescine polyamines[J]. African Journal of Microbiology Research,2012,6(25):5294-5300.
[23] 李 州,彭 燕.亚精胺对水分胁迫下白三叶脯氨酸代谢、抗氧化酶活性及其基因表达的影响[J].草业学报,2015,24(4):148-156.
[24] 樊怀福,李 娟,郭世荣,等.外源NO对NaCl胁迫下黄瓜幼苗生长和根系谷胱甘肽抗氧化酶系统的影响[J].西北植物学报,2007,27(8):1611-1618.
Effects of extraneous spermidine on antioxidant enzyme activities and other physiological characteristics of pumpkin seedlings under osmotic stress
WU Xu-hong1, FENG Jing-min2
(1.CollegeofLifeSciences,AgricultureandForestry,QiqiharUniversity,Qiqihar,Heilongjiang161006,China;2.QiqihaerHealthInspectionInstitute,Qiqihar,Heilongjiang161006,China)
pumpkin seedling; spermidine; osmotic stress; osmoregulation substance; antioxidant enzyme
1000-7601(2017)04-0255-08
10.7606/j.issn.1000-7601.2017.04.39
2016-05-20
黑龙江教育厅科学技术项目(10551332)
吴旭红(1962—),女,黑龙江齐齐哈尔人,教授,主要研究方向为植物营养学和生物化学。E-mail:wvg25583681129@sina.com。
S642.1
A

