多粘菌素B和E:如何选择Polymyxin B and E: how to choose
·综述·
多粘菌素B和E:如何选择Polymyxin B and E: how to choose
袁 莹(YUAN Ying),杨 颖(YANG Ying)
(上海交通大学医学院附属仁济医院,上海 200127)
(Renji Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200127, China)
多粘菌素; 化学结构; 杀菌机制; 抗菌谱; 药代动力学; 临床应用
革兰阴性菌是临床常见致病菌,但这些年由于各种抗生素的大规模使用,多重耐药革兰阴性菌比例逐年上升,多粘菌素作为革兰阴性菌的最后一道防线,再次引起了广泛的关注。多粘菌素B(polymyxin B)最早于1947年在Bacilluspolymyxa的二次代谢产物中提取得到,1949年在B.polymyxasubsp.colistinus中得到多粘菌素E(polymyxin E)[1]。1959年作为抗菌药物用于临床,由于严重的肾毒性,而逐渐被新晋抗菌药物取代。近期,除了替加环素批准用于治疗多重耐药鲍曼不动杆菌(但该药对铜绿假单胞菌无效)外,就再无其他新研发的针对多重耐药革兰阴性杆菌感染的药物,但随着替加环素的大规模使用,耐药率也呈明显的上升趋势[2]。所以,原来的抗菌药物,如多粘菌素被再次启用,作为治疗泛耐药革兰阴性杆菌感染的最后选择。
PubMed数据表明,从1959—2005年由于多粘菌素使用较少,其药代动力学和药效学资料很少,但过去十年中,该药的静脉使用明显增多,研究数量呈指数式增长,见图1。由于化学结构,抗菌谱和杀菌机制均非常相似,一直以来多粘菌素B和多粘菌素E都被认为是等价的。但有研究通过药理学、效能和给药方式的差异,揭示多粘菌素B和E的不同点,反驳了大家一直以来都认为多粘菌素B和E是等价的观点[3-4]。多粘菌素B非肠道给药形式是其活性药物,而多粘菌素E非肠道给药形式是一个前体药物,代谢途径不相同,最终导致此两种抗生素在临床应用方面的潜力也是不同的。本综述主要从化学结构,抗菌谱,杀菌机制,药代动力学和临床应用方面,总结多粘菌素B和多粘菌素E的相同点和不同点,并认为与多粘菌素E相比,多粘菌素B的临床应用更有优势。
1 多粘菌素的基本化学结构和给药形式
多粘菌素是一组碱性多肽类抗生素的总称,主要有A、B、C、D和 E 5种,其基本结构均为类环状十肽序列,包括一个七肽环,一个三环侧链,三环侧链各带有一个含氨基酸残基端的脂肪酸尾链,残基端的不同氨基酸组成导致其化学结构不全相同,是多粘菌素分型的主要依据。但只有多粘菌素B和E用于临床,多粘菌素B和E仅有一个氨基酸的差异,多粘菌素B的6号位上是苯丙氨酸,E是亮氨酸。见图2。临床上常用多粘菌素B和E均为混合物,多粘菌素B主要部分为B1[脂酰基:(S)-6-methyloctanoyl]和B2(脂酰基:6-methylheptanoyl),而粘菌素 A[脂酰基:(S)-6-methyloctanoyl]和B(脂酰基:6-methylheptanoyl)是多粘菌素E的主成分[3,5-6]。生产厂家不同主要成分的含量有差异,同一个厂家不同批次生产含量也有差异,大概占70%~80%[5,7]。商业上生产的多粘菌素B为硫酸盐制剂(polymyxin B sulfate),1 mg相当于10 000 IU;E主要用的是甲磺酸盐(colistimethate sodium),但也有硫酸盐(colistin sulfate),各国的计量单位不一样,因此换算比较复杂,主要有3种:多粘菌素E基质(colistin base activity,CBA)、多粘菌素E甲磺酸盐(CMS)和国际单位(IU)。30 mg CBA相当于80 mg CMS,相当于多粘菌素E 100万IU[4]。临床用药常有人把CBA和CMS混淆,导致严重不良反应,因此,在2011年美国药品差错报告网站重点警告临床要注意多粘菌素E的计量单位[8]。

图1 PubMed关于多粘菌素的文献报道数量

图2 多粘菌素B和多粘菌素E的化学结构
2 多粘菌素的杀菌机制
多粘菌素B和E的作用机制相同,主要有3种说法。(1)“自发摄取”原理:由于多粘菌素是两性化合物,可以通过与细菌细胞膜的接触,多粘菌素分子中聚阳离子环与革兰阴性菌细胞膜上的脂蛋白游离带负电荷的磷酸基通过电作用结合,导致外膜的通透性增加,细胞内小分子成分尤其是嘌呤、嘧啶等重要物质外漏,而致渗透不平衡,导致细菌膨胀、溶解死亡[9]。(2)“羟基自由基的累积损害”原理:是最新提出的多粘菌素破坏细菌的机制,考虑与氧化应激反应,导致羟基自由基的积累破坏细菌DNA相关[6]。(3)“中和内毒素”作用[10-11]:多粘菌素阳离子环形肽通过电作用与内毒素活性中心的硫酸根离子结合,使内毒素失去活性,从而达到消除内毒素,抑制内毒素的释放及其活力,进一步达到抑制炎症因子释放,减轻炎性反应的效果。可用于脓毒血症的治疗,其机制和释放细胞因子有关,至今还没有确切的说法。最新研究发现,对于脓毒血症,多粘菌素B和E的治疗效果是有差异的,多粘菌素B硫酸盐的效果最好,多粘菌素E硫酸盐次之,CMS最差[1,12]。
3 抗菌谱与药敏折点
多粘菌素B和E都有相同的抗菌谱,作为窄谱抗生素,对大部分革兰阴性菌均敏感,包括鲍曼不动杆菌、铜绿假单胞菌、克雷伯菌属、肠杆菌属、埃希菌属、沙门菌属、志贺菌属、耶尔森鼠疫菌属和柠檬酸杆菌属。最新研究[13-14]表明,多粘菌素在高浓度下具有广谱抗真菌作用,与氟康唑联用,对抗光滑假丝酵母菌和新生隐球菌具有明显的协同作用,甚至可杀灭耐氟康唑的光滑假丝酵母菌和新生隐球菌。
临床常使用的是CMS,为无活性前体药,需在体内水解为粘菌素,而药敏试纸常为多粘菌素E硫酸盐,因此实验室药敏标准不一定能代表临床使用标准。对于多粘菌素的敏感折点,各组织之间存在不同的界定值,到2016年为止,主要见表1。
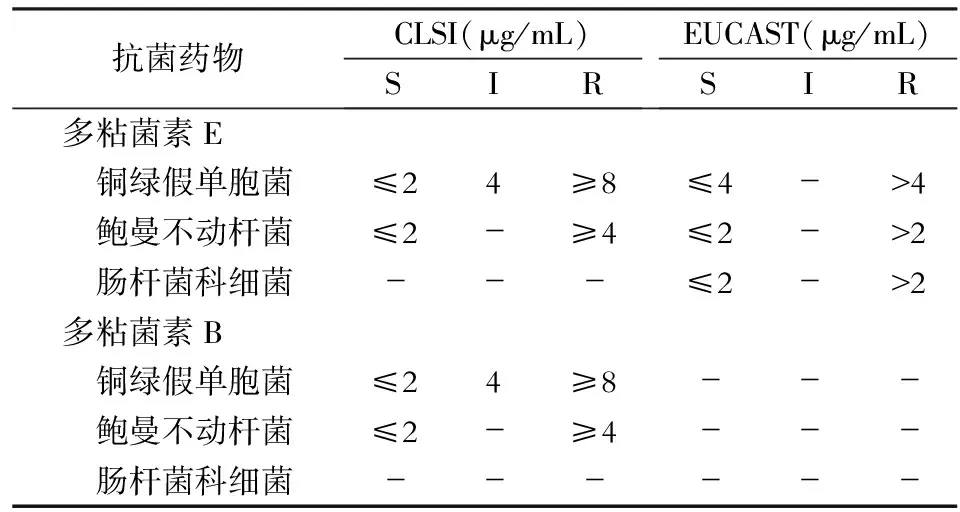
表1 多粘菌素B和多粘菌素E对不同细菌的药敏折点[6]
CLSI:美国临床实验室标准化协会; EUCAST:欧洲临床微生物和感染病学会药敏委员会
4 不同区域多粘菌素的使用情况
到目前为止,并不是所有国家临床上均能使用到注射用多粘菌素,很多国家多粘菌素B和E都没有,如中国(最近有消息称马上上市)、日本和南非,欧洲和澳大利亚只有多粘菌素E,美国、巴西、马来西亚和新加坡两者皆有。但同一个国家B和E的使用分布也不均匀,如在美国多粘菌素B主要在纽约地区使用,而其他地区主要用多粘菌素E。
5 药代动力学特点
CMS作为非活性的前体药物,必须要在体内经水解转化成粘菌素(colistin)才具有抗菌活性,而多粘菌素B的给药形式是活性药物,注射后直接具有抗菌活性,此差异直接影响多粘菌素B和E临床使用情况。多粘菌素E的药代动力学非常复杂,如图3所示,进入体内前体药物(CMS) 大部分会经肾脏排泄,仅少部分经肾脏转化成有效成分粘菌素,在肾脏中该药物的排泄率远高于转化率,因此经常药物还没来得及转化就已经排泄很大部分(t1/2= 2 h),转化率的多少主要取决于患者肾功能的差异。文献表明,CMS转化成有效的粘菌素的比率仅20%左右[15-17],意味着在体内达到一定数量的粘菌素是需要注射4~5倍量的CMS,粘菌素的排泄主要是非肾脏途径。患者粘菌素的血药浓度和肾功能是成反比的,主要是因为CMS主要经肾脏途径排泄,肾功能受损的患者CMS排泄率降低,导致更多的CMS转化成粘菌素,因此粘菌素的血药浓度将升高[16]。CMS、粘菌素均能通过连续性静脉-静脉血液透析滤过或者常规的血液透析快速清除[16],但持续不卧床腹膜透析对CMS或者粘菌素的清除效率非常低[18]。
和多粘菌素E复杂的代谢过程相比,多粘菌素B简单很多,主要是因为多粘菌素B给药形式是活性的药物,在体内可以直接发挥抗菌作用,而不需要类似CMS到粘菌素的转化。见图3。多粘菌素B主要经非肾脏途径排泄,这也使得多粘菌素B在尿中的浓度相对较低[19]。

图3 多粘菌素B和多粘菌素E的代谢途径[20]
6 临床应用情况
多粘菌素E和多粘菌素B的药代动力学特性相差较大,因此在临床使用上也大有不同。综合比较下来,多粘菌素B在临床使用上更有优势。
第一,由于多粘菌素E是前体药物,代谢转化成粘菌素的过程效率低且很缓慢,因此在体内达到药物峰浓度的时间较长,大概需要5~7 h,而且需要的剂量很大[21]。就算在首剂负荷剂量的情况下,达峰时间也变化不大。这样在临床使用上是很不利的,因为对于重症感染的患者,很有可能在尚未达到药物有效浓度,患者就已经死亡[22]。另外,上文中提到患者粘菌素的血药浓度和肾功能是成反比的,肾功能正常或增强的患者(肌酐清除率>80 mL/min)粘菌素血药稳态浓度较低,因此,很有可能达不到有效的血药浓度[16],就算多粘菌素E的给药剂量达到300 mg/d(最大用药剂量)的CBA,在肌酐清除率>80 mL/min患者体内的粘菌素血药稳态浓度也<2 mg/L[16],并且此种情况也不能简单的通过加大给药物剂量解决,因为CMS主要经肾脏途径排泄,加大剂量导致其毒性也增加[23]。而对于肾功能差的患者,常规的维持剂量能达到4~9 mg/L的血药浓度,因此最新研究认为,多粘菌素E在肾功能正常或增强患者的使用上是有很大的局限性的[24]。和多粘菌素E不同的是,多粘菌素B的给药形式是活性药物,不需要经过转化,直接具有抗菌活性,在药物注射完后的1 h左右达到血药峰浓度,不需要通过首剂负荷剂量就可以快速达到理想的血药浓度,对于重症感染患者是很有利的,可以快速控制感染,降低死亡率[16]。
第二,由于多粘菌素B和E的给药形式不一样,药代动力学特性差异大。多粘菌素E的给药剂量较大,而且受肾功能影响很大。患者粘菌素的血药浓度和肾功能是成反比的,当患者的肾功能受损时,CMS的排泄率降低,CMS转化成粘菌素的比例增加,而粘菌素的排泄属于非肾脏途径,因此较低的剂量也能达到理想,也就是说对于肾功能受损的患者,需要减少多粘菌素E的给药剂量[16,20]。而多粘菌素B主要经非肾脏途径排泄,和肌酐清除率没有关系,因此给药剂量也不需要根据患者的肾功能差异而调整剂量,Sandri等[19]研究发现,多粘菌素B应该以患者的体重为用药参数,因多粘菌素B的不以肾脏代谢途径为主,所以肌酐清除率对多粘菌素B的给药剂量影响无显著差异。
第三,CMS代谢转化成粘菌素的效率低,而且粘菌素在体内的半衰期只有4.2~7.4 h,因此很多厂家的说明书是大剂量多次给药,而多粘菌素B不需要经过转化,而且半衰期为11.9~13.6 h,有着小剂量少次给药的特点,在临床使用极为便利[4]。
第四,一直以来,多粘菌素都因为肾毒性和神经毒性的不良反应而在临床限制使用,但最近文献[3]报道,认为肾毒性主要与制剂本身的纯度和给药剂量和间隔有关,肾毒性并没有以往报道的严重。之前一直认为多粘菌素B的肾毒性大于多粘菌素E,但最近研究结果是相反的,Rigatto等[25]通过多中心前瞻性队列研究,总样本量为491例患者,其中接受多粘菌素E治疗的81例,接受多粘菌素B治疗的患者410例,最终肾毒性发生率为16.9%(多粘菌素E:38.3%,多粘菌素B:12.7%);Phe等[26]也得出类似的结果:多粘菌素E(53.3%)的肾毒性大于多粘菌素B(21.1%),在调整可能的干扰因素后,结论也是相同的。可能主要是因为多粘菌素E主要经肾脏转化和排泄,而且多粘菌素E的给药剂量比多粘菌素B大很多。相比于多粘菌素的肾毒性,神经毒性的发生率非常低(0~3%),而且最近很多临床研究都未发现神经毒性[27-28]。
7 总结
随着多重耐药革兰阴性菌比例逐年上升,多粘菌素作为阴性菌的最后一道防线,再次引起了广泛的关注。多粘菌素B和E的化学结构基本相同,仅有一个氨基酸差异。常用的多粘菌素B是硫酸盐,多粘菌素E为甲磺酸盐,它们有着相同的抗菌谱和杀菌机制。全球不同区域两种药物的使用情况是不一样的,但是两种药物之间也存在差异,多粘菌素E的给药形式是前体药物,需要在体内转化成粘菌素后才能发挥作用,代谢途径复杂;而多粘菌素B不需要转化,可以直接在体内发挥作用,代谢途径相对简单,此差异使得两者的药代动力学特性不同,两者的临床使用不一样。总体而言,多粘菌素B更有优势,原因主要为:(1)多粘菌素E在肾功能正常或增强的患者使用后,粘菌素的血药浓度较低,很难达到理想的血药浓度,而且药物转化效率低,达峰时间长,需要首剂负荷剂量;(2)多粘菌素E需要根据患者的肾功能调整剂量,而多粘菌素B不需要;(3)多粘菌素E的给药方式是大剂量多次给药,而多粘菌素B是小剂量少次给药,更加方便;(4)最近研究发现多粘菌素E的肾毒性大于多粘菌素B。
随着耐碳青霉烯鲍曼不动杆菌、铜绿假单胞菌、肺炎克雷伯菌等的比例不断增高,而多粘菌素对上述细菌的敏感性接近100%[2],希望本综述能对多粘菌素在临床使用上提供帮助,也希望我国临床上也能尽快使用多粘菌素。
[1] Falagas ME, Kasiakou SK, Saravolatz LD, et al. Colistin: the revival of polymyxins for the management of multidrug-resistant gram-negative bacterial infections[J]. Clin Infect Dis, 2005, 40(9): 1333-1341.
[2] 华山医院抗生素研究所.2016年上半年CHINET中国细菌耐药性监测报告[EB/OL].(2016-11-17)[2017-01-10].https://wenku.baidu.com/view/f2baf3f7afaad1f34693daef5 ef7ba0d4a736dd3.html.
[3] Kwa A, Kasiakou SK, Tam VH, et al. Polymyxin B: similarities to and differences from colistin (polymyxin E)[J]. Expert Rev Anti Infect Ther, 2007, 5(5): 811-821.
[4] Cai Y, Lee W, Kwa AL. Polymyxin B versus colistin: an update[J]. Expert Rev Anti Infect Ther, 2015, 13(12): 1481-1497.
[5] Orwa JA, Govaeris C, Busson R, et al. Isolation and structural characterization of colistin components[J]. J Antibiot (Tokyo), 2001, 54(7): 595-599.
[6] Yu Z, Qin W, Lin J, et al. Antibacterial mechanisms of polymyxin and bacterial resistance[J]. Biomed Res Int, 2015(2015): 109-120.
[7] Orwa JA, Govaerts C, Busson R, et al. Isolation and structural characterization of polymyxin B components[J]. J Chromatogr A, 2001, 912(2): 369-373.
[8] National Medication Error Reporting Program. Nan alert risk of serious or fatal medication error[EB/OL].(2011-6-29)[2017-1-5].http://www.docin.com/touch/detail.do?id=1774326177.
[9] Lin QY, Tsai YL, Liu MC, et al.Serratiamarcescensarn, a PhoP-regulated locus necessary for polymyxin B resistance[J]. Antimicrob Agents Chemother, 2014, 58(9): 5181-5190.
[10] Moffatt JH, Harper M, Adler B, et al. Insertion sequence ISAba11 is involved in colistin resistance and loss of lipopolysaccharide inAcinetobacterbaumannii[J]. Antimicrob Agents Chemother, 2011, 55(6): 3022-3024.
[11] Nigam A, Kumari A, Jain R, et al. Colistin neurotoxicity: revisited[J]. BMJ Case Rep, 2015, 2015(21): 87-88.
[12] Evans ME, Feola DJ, Rapp RP. Polymyxin B sulfate and colistin: old antibiotics for emerging multiresistant gram-negative bacteria[J]. Ann Pharmacother, 1999, 33(9): 960-967.
[13] Zhai B, Zhou H, Yang L, et al. Polymyxin B, in combination with fluconazole, exerts a potent fungicidal effect[J]. J Antimicrob Chemother, 2010, 65(5): 931-938.
[14] Pankey G, Ashcraft D, Kahn H, et al. Time-kill assay and Etest evaluation for synergy with polymyxin B and fluconazole againstCandidaglabrata[J]. Antimicrob Agents Chemother, 2014, 58(10): 5795-5800.
[15] Li J, Milne RW, Nation RL, et al. Pharmacokinetics of colistin methanesulphonate and colistin in rats following an intravenous dose of colistin methanesulphonate[J]. J Antimicrob Chemother, 2004, 53(5): 837-840.
[16] Garonzik SM, Li J, Thamlikitkul V, et al. Population pharmacokinetics of colistin methanesulfonate and formed colistin in critically ill patients from a multicenter study provide dosing suggestions for various categories of patients[J]. Antimicrob Agents Chemother, 2011, 55(7): 3284-3294.
[17] Couet W, Gregoire N, Gobin P, et al. Pharmacokinetics of colistin and colistimethate sodium after a single 80-mg intravenous dose of CMS in young healthy volunteers[J]. Clin Pharmacol Ther, 2011, 89(6): 875-879.
[18] Koomanachai P, Landersdorfer CB, Chen G, et al. Pharmacokinetics of colistin methanesulfonate and formed colistin in end-stage renal disease patients receiving continuous ambulatory peritoneal dialysis[J]. Antimicrob Agents Chemother, 2014, 58(1): 440-446.
[19] Sandri AM, Landersdorfer CB, Jacob J, et al. Population pharmacokinetics of intravenous polymyxin B in critically ill patients: implications for selection of dosage regimens[J]. Clin Infect Dis, 2013, 57(4): 524-531.
[20] Nation RL, Velkov T, Li J. Colistin and polymyxin B: peas in a pod, or chalk and cheese?[J]. Clin Infect Dis, 2014, 59(1): 88-94.
[21] Mohamed AF, Karaiskos I, Plachouras D, et al. Application of a loading dose of colistin methanesulfonate in critically ill patients: population pharmacokinetics, protein binding, and prediction of bacterial kill[J]. Antimicrob Agents Chemother, 2012, 56(8): 4241-4249.
[22] Luna CM, Aruj P, Niederman MS, et al. Appropriateness and delay to initiate therapy in ventilator-associated pneumonia[J]. Eur Respir J, 2006, 27(1): 158-164.
[23] Hartzell JD, Neff R, Ake J, et al. Nephrotoxicity associated with intravenous colistin (colistimethate sodium) treatment at a tertiary care medical center[J]. Clin Infect Dis, 2009, 48(12): 1724-1728.
[24] Nation RL, Li J, Cars O, et al. Framework for optimisation of the clinical use of colistin and polymyxin B: the Prato polymyxin consensus[J]. Lancet Infect Dis, 2015, 15(2): 225-234.
[25] Rigatto MH, Oliveira MS, Perdigão-Neto LV, et al. Multicenter prospective cohort study of renal failure in patients treated with colistin versus polymyxin B[J]. Antimicrob Agents Chemother, 2016, 60(4): 2443-2449.
[26] Phe K, Lee Y, McDaneld PM, et al. In vitro assessment and multicenter cohort study of comparative nephrotoxicity rates associated with colistimethate versus polymyxin B therapy[J]. Antimicrob Agents Chemother, 2014, 58(5): 2740-2746.
[27] Shahbazi F, Dashti-Khavidaki S. Colistin: efficacy and safety in different populations[J]. Expert Rev Clin Pharmacol, 2015, 8(4): 423-448.
[28] Justo JA, Bosso JA. Adverse reactions associated with systemic polymyxin therapy[J]. Pharmacotherapy, 2015, 35(1): 28-33.
(本文编辑:左双燕)
2017-01-24
袁莹(1981-),女(汉族),江苏省南通市人,药师,主要从事临床药学研究。
杨颖 E-mail:3702337@qq.com
10.3969/j.issn.1671-9638.2017.07.022
R978.1
A
1671-9638(2017)07-0677-06

