白念珠菌CaCSC1基因的敲除和功能研究
杨益 王亚楠 蒋伶活
(江南大学生物工程学院 粮食发酵工艺与技术国家工程实验室,无锡 214122)
·论著·
白念珠菌CaCSC1基因的敲除和功能研究
杨益 王亚楠 蒋伶活
(江南大学生物工程学院 粮食发酵工艺与技术国家工程实验室,无锡 214122)
目的 构建白念珠菌CaCSC1基因的基因缺失株,并初步探究它的功能。方法 设计长引物,通过PCR直接扩增出带有SAT1 flipper的CaCSC1基因敲除盒,转化到野生型白念珠菌菌株CAI4,并通过PCR鉴定出基因型正确的转化子,得到CaCSC1的基因缺失株。最后,通过倍比稀释的方法进行表型筛选。结果 成功得到CaCSC1基因的缺失菌株。基因缺失菌株对酮康唑 (Ketoconazole)敏感,对Zn2+、Mn2+和荧光增白剂 (Calcofluor white)表现出耐受性。结论 CaCsc1蛋白参与对锌离子和锰离子的稳态调控,和细胞膜和细胞壁的完整性也相关。
白念珠菌;CaCSC1基因;基因敲除;离子稳态
[Chin J Mycol,2017,12(3):144-147]
白念珠菌 (Candidaalbicans)是临床上最常见的人体条件致病真菌,存在于正常人体的皮肤黏膜,与其宿主免疫系统维持平衡的状态[1]。当机体免疫力下降时,白念珠菌引发危及生命的系统性真菌感染[2]。在长期的临床治疗中,白念珠菌逐渐对一些抗真菌药物产生耐药性,大大降低了临床治疗的效果[3-4]。因此,研究并揭示白念珠菌的致病与耐药机理,发现白念珠菌新型毒力因子,开发新型抗真菌药物,对白念珠菌感染的治疗具有重要意义。
离子通道对于细胞的生存至关重要,细胞利用离子通道进行营养吸收,同时也利用通道感知环境刺激和进行信号传导[5]。在真核生物中,许多环境刺激都能引起钙离子的跨膜流动。钙离子不仅参与细胞内多种基础代谢反应,而且作为一种多功能的信号载体,调节细胞内各种生命活动[6-7]。拟南芥 (Arabidopsisthaliana)AtCsc1和酿酒酵母 (Saccharomycescerevisiae)ScCsc1都是钙离子通透性高渗刺激激活的阳离子通道 (Calcium-permeable Stress-responsive Cation channel)蛋白[8]。通过序列比对,我们在白念珠菌基因组中找到1个与酿酒酵母ScCsc1和拟南芥AtCsc1同源的蛋白CaCsc1。通过敲除CaCSC1基因,我们对其在白念珠菌细胞中的功能进行了初步探究。
1 材料与方法
1.1 材料
菌种、质粒和引物 本实验所用的菌株和质粒见表1,引物见表2。

表1 菌株和质粒

表2 实验所用引物
培养基 YPD液体和固体培养基 (酵母浸出粉胨葡萄糖培养基):蛋白胨20 g,酵母提取物10 g,葡萄糖20 g,加去离子水定容至1 000 mL,固体加2%琼脂,高压灭菌后4℃保存备用;LB液体和固体培养基 (Luria-Bertani培养基):蛋白胨10 g,酵母提取物5 g,氯化钠10 g,加去离子水定容至1 000 mL,固体加2%琼脂,高压灭菌后4℃保存备用。
试剂 PCR相关试剂全部购自宝生物工程 (大连)有限公司;诺尔丝菌素 (NAT)购自Werner BioAgents公司;醋酸锂、鲑鱼精DNA (SS DNA)和聚乙二醇3350购自Sigma公司;表型筛选药物购自Sigma公司;所有引物均由南京金斯瑞生物科技有限公司合成。
实验仪器与装置 PCR仪 (北京东胜创新生物科技有限公司);核酸电泳仪 (北京六一仪器厂);凝胶成像仪 (美国Bio-Rad公司);酶标仪 (美国Bio-Rad公司);高速冷冻离心机 (日立公司);恒温振荡培养箱 (江苏省太仓市实验设备厂);生物超级洁净工作台 (哈尔滨东联电子科技有限公司)。
1.2 方法
菌株保存和培养 白念珠菌菌株保存在-80℃ YPD液体培养基中 (含有15%的甘油),待用时划线接种到YPD固体培养基上,30℃培养2 d;大肠杆菌菌株保存在-80℃ LA液体培养基中 (含有15%的甘油),待用时划线接种到LA固体培养基上,37℃过夜培养。
CaCSC1基因的敲除 采用诺尔斯菌素 (NAT)的筛选标记敲除CaCSC1基因的2个等位基因。首先设计带有同源臂的长引物,模板为pSFS2质粒[10],通过PCR扩增出NAT敲除盒。用醋酸锂法转染白念珠菌CAI4菌株,涂布于YPD+200 μg/mL NAT平板筛选出转化子,提取其基因组进行PCR验证。接下来将正确的转化子接种于YPD培养基过夜培养,稀释到10-5浓度后取100 μL涂布于YPD+25 μg/mL NAT平板上进行复筛,选择生长较小的单菌落在YPD和YPD+200 μg/mL NAT平板上划线,选择能在YPD平板上生长而不能在YPD+200 μg/mL NAT平板上生长的克隆,提取其基因组进行PCR验证,得到删除了NAT抗性基因的克隆,即完成了CaCSC1基因的1个等位基因的敲除。重复上述步骤,完成CaCSC1基因的第2个等位基因的敲除。
表型筛选实验 配制含药的YPD平板,挑取单菌落接种于3 mL液体YPD培养基中过夜培养 (220 r/min,30℃),用无菌的去离子水调整菌液浓度为5×106cells/mL、5×105cells/mL、5×104cells/mL、5×103cells/mL和5×102cells/mL 5个浓度梯度,每个菌株,每个浓度梯度取2 μL点板。
2 结 果
2.1CaCSC1与ScCSC1编码的蛋白具有相似的序列和结构
用ScCsc1蛋白的氨基酸序列,从白念珠菌基因组数据库 (http://www.candidagenome.org/)里,我们发现了1个基因位点C1_06270W,编码1个913个氨基酸组成的蛋白质。序列比对分析表明它和酿酒酵母ScCsc1蛋白的相似性为61% (见图1A)。用SMART软件 (http://smart.embl-heidelberg.de/)进行结构分析,结果表明这2个蛋白具有相似的结构,在N末端都具有3个跨膜结构域,在C末端都具有8个跨膜结构域 (见图1B)。
2.2CaCSC1基因的敲除及基因型验证结果
以实验室保存的野生型菌株CAI4为出发菌株来敲除CaCSC1基因,对CaCSC1基因的2个等位基因都采用SAT1 flipper[10]的敲除方法,敲除策略见图2A。以pSFS2质粒为模板,用引物CaCSC1-NAT-UP和CaCSC1-NAT-DOWN扩增出4.7 kb的NAT敲除盒 (见图2B)。转化CAI4后获得敲除了1个等位基因的杂合子 (YCA02)和敲除了2个等位基因的纯合子 (YCA04)菌株。
通过PCR对它们进行基因型验证。用引物CaCSC1-ORF-UP和CaCSC1-ORF-DOWN,从野生型和杂合子菌株都扩增出663 bp的片段 (见图2C的泳道2和3);用引物CaCSC1-DF和CaCSC1-DR,从野生型菌株扩增出3 592 bp的片段,从杂合子菌株扩增出896 bp的片段 (见图2C的泳道4和5)。用引物CaCSC1-ORF-UP和CaCSC1-ORF-DOWN,从野生型菌株扩增出663 bp的片段,但是从纯合子菌株不能扩增出条带 (见图2D的泳道6和7)。用引物CaCSC1-DF和CaCSC1-DR,从野生型菌株扩增出3 592 bp的片段,从纯合子菌株扩增出896 bp的片段 (见图2D的泳道8和9)。这些结果表明我们得到的杂合子 (YCA02)和纯合子 (YCA04)菌株都是正确的。
2.3 基因缺失株表型筛选
倍比稀释表型筛选结果表明,相比于野生型菌株CAI4,杂合子 (YCA02)和纯合子 (YCA04)菌株都对15 μg/mL的酮康唑 (Ketoconazole,KCZ)敏感,而对3 mmol/L ZnCl2和15 mmol/L MnCl2都具有耐受性 (见图3)。此外,杂合子对450 μg/mL的荧光白 (Calcofluor white,CFW)具有微弱的耐受性,而纯合子菌株对CFW具有很强的耐受性 (见图3)。然而,杂合子和纯合子菌株对1 mmol/L CdCl2,0.4 mol/L LiCl,0.5 mol/L MgCl2,0.6 mol/L CaCl2,1 mol/L sorbitol (山梨醇)和1.5 mol/L NaCl都没有表型 (结果没有显示)。这些结果表明,CaCsc1蛋白参与对锌离子和锰离子的稳态调控,和细胞膜和细胞壁的完整性也相关。
3 讨 论
目前对于白念珠菌基因功能研究最常用的手段是基因敲除。本实验采用的SAT1 flipper的敲除方法可将白念珠菌中1个基因的2个等位基因进行敲除。该方法通过设计长引物直接通过PCR扩增出敲除盒,不需要通过克隆构建敲除盒质粒,节省了大量的时间。通过该方法得到的基因缺失株,最后是用FRT序列替换掉靶基因,不具有对NAT的抗性,可以用该方法构建2个或多个基因同时缺失的菌株,而且FRT序列只有34 bp,相较于传统的白念珠菌基因敲除方法Ura-Blaster[11-12]遗留下来的1 kb多的hisG序列,减小了由于外源基因片段的插入对菌株造成的未知影响。
表型筛选结果显示csc1/csc1基因缺失株对酮康唑敏感,因此临床耐药的白念珠菌株中CaCSC1基因是否有高表达的现象值得研究。此外,对Zn2+、Mn2+和CFW表现出耐受性,表明CaCSC1基因在白念珠菌里不仅具有调节离子稳态的功能,而且与细胞质膜和细胞壁的完整性有关[13]。前人研究表明酿酒酵母的ScCsc1和拟南芥的AtCSsc1是阳离子通道蛋白,由此我们可以推测CaCsc1蛋白在白念珠菌里也可能是一种阳离子通道。本研究成功构建了CaCSC1基因的缺失菌株,并对它的功能进行了初步的探究,为深入研究它调控白念珠菌细胞离子稳态、致病性和耐药的机理提供了基础。
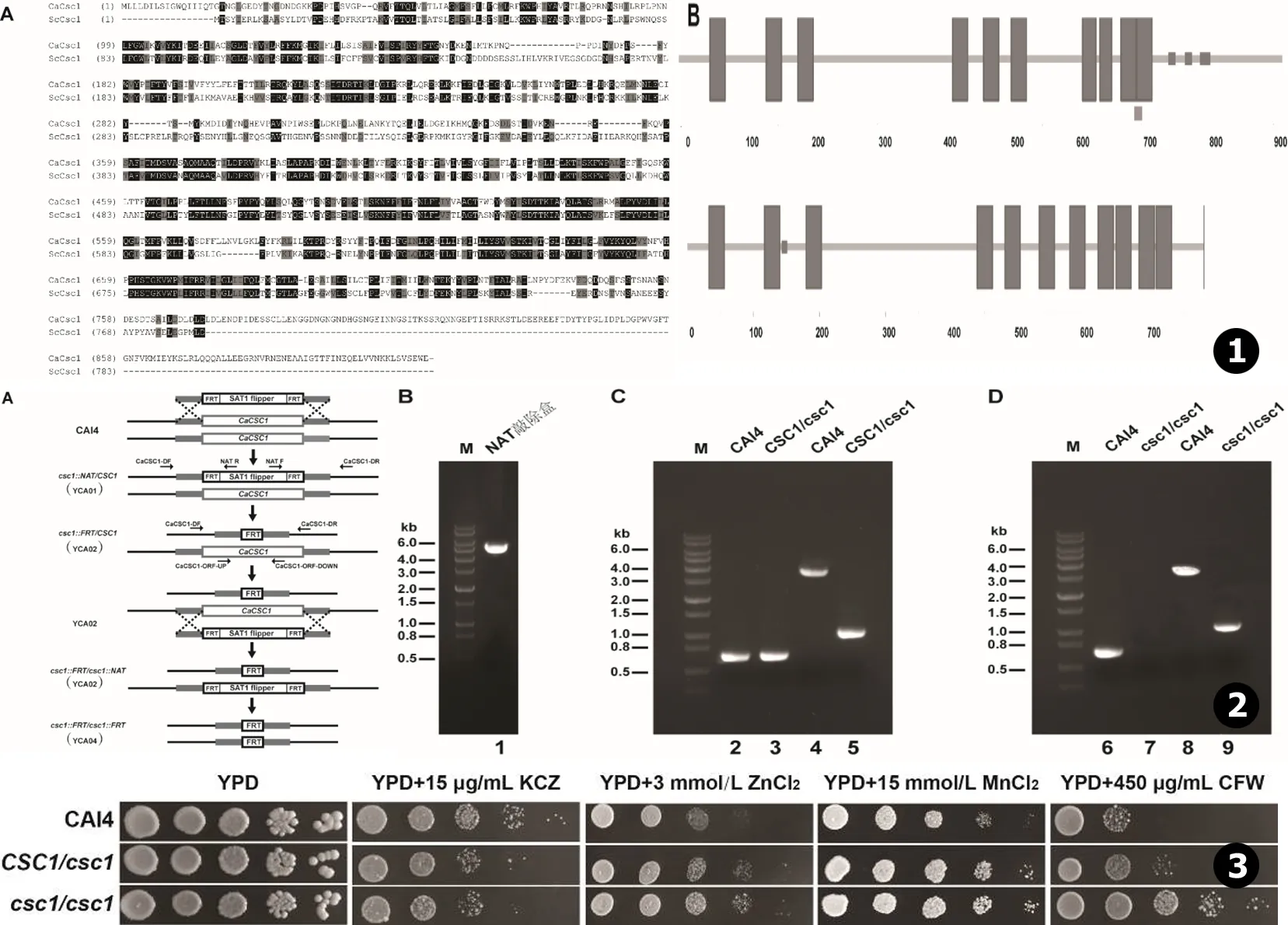
图1 CaCsc1与ScCSC1的序列比对和结构分析 图2CaCSC1双等位基因的敲除原理和基因型PCR验证 图3 白念珠菌杂合子CSC1/csc1 (YCA02)和纯合子csc1/csc1 (YCA04)菌株的表型
Fig.1 Amino acid alignment between CaCsc1 and ScCsc1 (A) and their structural analysis (B) Fig.2 Strategy of knocking-outCaCSC1 two alleles and PCR Confirmation of Genotype Fig.3 Phenotypes of theC.albicansCSC1/csc1 andcsc1/csct1 mutants
[1] Zhu W,Filler SG.Cellular interactions ofCandidaalbicanswith human oral epithelial cells and enterocytes[J].Cell Microbiol,2010,12(2):248-271.
[2] Yu Q,Ding X,Zhang B,et al.The P-type ATPase Spf1 is required for endoplasmic reticulum functions and cell wall integrity inCandidaalbicans[J].Int J Med Microbiol,2013,303(5):257-266.
[3] Calderone RA,Fonzi WA.Virulence factors ofCandidaalbicans[J].Trends Microbiol,2001,9(7):327-335.
[4] Mayer FL,Wilson D,Hube B.Candidaalbicanspathogenicity mechanisms[J].Virulence,2011,4(2):119-128.
[5] Hou C,Tian W,Kleist T,et al.DUF221 proteins are a family of osmosensitive calcium-permeable cation channels conserved across eukaryotes[J].Cell Res,2014,24(5):632-635.
[6] Tan AR,Cai AY,Deheshi S,et al.Elevated intracellular calcium causes distinct mitochondrial remodelling and calcineurin-dependent fission in astrocytes[J].Cell Calcium,2011,49(2):108-114.
[7] Kaufman RJ,Swaroop M,Murtha-Riel P.Depletion of manganese within the secretory pathway inhibits O-linked glycosylation in mammalian cells[J].Biochemistry,1994,33(33):9813-9819.
[8] 侯聪聪.高渗胁迫门控的钙通透阳离子通道的分离、鉴定与初步功能分析[D].北京:首都师范大学,2014.
[9] Fonzi WA,Irwin MY.Isogenic strain construction and gene mapping inCandidaalbicans[J].Genetics,1993,134(3):717-728.
[10] Reuss O,Vik AR,Morschhauser J.The SAT1 flipper,an optimized tool for gene disruption inCandidaalbicans[J].Gene,2004,341(1):119-127.
[11] Dennison PM,Ramsdale M,Manson CL,et al.Gene disruption inCandidaalbicans,using a synthetic,codon-optimised Cre-loxP,system[J].Fungal Genet Biol,2005,42(9):737-748.
[12] Staab JF,Sundstrom P.URA3 as a selectable marker for disruption and virulence assessment ofCandidaalbicansgenes[J].Trends Microbiol,2003,11(2):69-73.
[13] Dichtl K,Samantaray S,Wagener J.Cell wall integrity signalling in human pathogenic fungi[J].Cell Microbiol,2016,18(9):1228-1238.
[本文编辑] 卫凤莲
Disruption and Functions ofCaCSC1 inCandidaalbicans
YANG Yi,WANG Ya-nan,JIANG Ling-huo
(SchoolofBiotechnology,theNationalEngineeringLaboratoryforCerealFermentationTechnology,JiangnanUniversity,Wuxi214122)
Objective To construct deletion mutants forCandidaalbicansCaCSC1 and explore its functions.Methods TheCaCSC1 knockout cassette containing the SAT1 flipper was PCR amplified using a pair of long primers.The cassette DNA was transformed into the wild type CAI4 strain,and genotypes of correct mutant strains were confirmed by PCR.Phenotypes of gene deletion mutants were screened by serial dilution assay.Results Gene deletion mutants ofCaCSC1 were successfully constructed.Deletion mutants ofCaCSC1 were sensitive to ketoconazole and tolerant against Zn2+,Mn2+and Calcofluor white.Conclusions CaCsc1 participates in the regulation of zinc and magnesium homeostasis as well as plasma membrane and cell wall integrity inCandidaalbicans.
Candidaalbicans;CaCSC1;gene knockout;ion homeostasis
国家自然科学基金 (81371784,81571966)
杨益,男 (汉族),硕士研究生在读.E-mail:554640517@qq.com
蒋伶活,E-mail:linghuojiang@jiangnan.edu.cn
R 379.4
A
1673-3827(2017)12-0144-04
2017-01-20

