结直肠癌组织及细胞中人叉头框蛋白C2的水平变化及意义
邹永平,李龙鹤
(海南省人民医院,海口570311)
结直肠癌组织及细胞中人叉头框蛋白C2的水平变化及意义
邹永平,李龙鹤
(海南省人民医院,海口570311)
目的 探讨人叉头框蛋白C2(FOXC2)在结直肠癌组织及细胞中的表达变化及意义。方法 收集结直肠癌组织及癌旁组织标本40例份,使用RT-PCR技术检测癌组织和癌旁组织FOXC2 mRNA表达水平。采用Western blotting法检测结直肠癌细胞系HT29、SW620、SW480、LOVO、HCT116、LS174T、HCT8中FOXC2蛋白的表达。针对FOXC2基因设计4组shRNA干扰目的序列及无任何靶向位点的随机序列,将序列剪切至慢病毒载体上,利用二代慢病毒包装系统包装成慢病毒悬液。将HT29接种至6孔板中,分别标记对照组、shFOXC2 1#组、shFOXC2 2#组、shFOXC2 3#组、shFOXC2 4#组,对照组加入插入随机序列载体的慢病毒悬液,shFOXC2 1#组、shFOXC2 2#组、shFOXC2 3#组、shFOXC2 4#组分别加入插入4组shRNA干扰目的序列的慢病毒悬液,构建稳定knock-down FOXC2的细胞系。检测各组FOXC2蛋白mRNA的表达。收集shFOXC2 1#组、shFOXC2 4#组及对照组(GV248细胞)的细胞,通过MTS比色法检测细胞增殖能力,划痕修复试验检测细胞侵袭能力,同时Western blotting法检测E-钙黏蛋白(E-cadherin)、紧密连接蛋白1(Zo-1)、波形蛋白(Vimentin)的表达。结果 癌旁组织FOXC2 mRNA的表达量低于癌组织(P<0.05)。 HT29细胞系FOXC2蛋白表达量高于其他细胞系(P均<0.05)。与对照组比较,shFOXC2 1#组、shFOXC2 2#组、shFOXC2 4#组FOXC2蛋白表达量低,shFOXC2 1#组、shFOXC2 3#组、shFOXC2 4#组FOXC2 mRNA表达量低(P均<0.05)。与对照组比较,shFOXC2 1#组、shFOXC2 4#组48、72 h细胞增殖活力、侵袭能力降低(P均<0.05);E-cadherin、Zo-1蛋白表达量升高,Vimentin蛋白表达量降低(P均<0.05)。结论 FOXC2在人结直肠癌组织中水平升高,其可促进细胞增殖、侵袭和上皮间充质转化过程的发生。
结直肠癌;人叉头框蛋白C2;细胞增殖;上皮间质转化;细胞侵袭
结直肠癌是最常见的消化道肿瘤,其发病率和病死率在全球呈现出上升趋势,严重威胁人类健康。近年研究报道,人叉头框蛋白C2(FOXC2)可能参与到部分恶性肿瘤的形成和发展,如乳腺癌上皮间充质转化(EMT)、胰腺癌细胞增殖迁移的过程。2015年1~9月,本研究拟探讨FOXC2在结直肠癌细胞中的表达情况,以及其对结直肠癌组织及细胞增殖、侵袭能力及EMT过程的影响。
1 材料与方法
1.1 组织、细胞及试剂仪器 结直肠癌组织40例份,相应癌旁(距癌变边缘15 cm)组织40例份,患者男26例,女14例;年龄32~70(52.3±11.9)岁;体质量39.6~75.1(58.6±13.4)kg;TNM分期:Ⅰ期6例,ⅡA期10例,ⅡB期11例,Ⅲ期13例。取材后置于冻存管中液氮保存。实验所用的人结直肠癌细胞系HT29、SW620、SW480、LOVO、HCT116、LS174T、HCT8均购自中国医学科学院研究中心。一抗:FOXC2抗体(Abcam,ab55004)、E-cadherin抗体(Abcam, ab15148)、Zo-1抗体(Abcam, ab59720)、Vimentin抗体(Abcam, ab92547)、β-actin抗体(santa cruz, sc-4778)。二抗:山羊抗鼠IgG H&L (FITC,ab6785),山羊抗兔IgG H&L (Alexa Fluor®488,ab150077)。RPMI-1640培养基(Hyclone)、DMEM培养基(Hyclone)、Fetal Bovine Serum (Hyclone)、逆转录试剂盒(Maxima®First Strand cDNA Synthesis Kit, Fermentas)、定量PCR试剂盒(iQ SYBR Green Supermix, BioRad)、RNAiso Plus(TAKARA公司,9108)、Lipofectamine (Thermo Fisher Scientific公司,2000CAT)、细胞增殖能力检测试剂盒(MTS, Promega)、BCA Assay Reagent(美国Pierce Chemical公司)、PVDF膜(Millpore公司)。
1.2 组织FOXC2 mRNA的检测 采用RT-PCR法。TRIzol法抽提细胞总RNA。紫外分光光度仪检测RNA浓度,取RNA 5 μg进行逆转录反应,采用Cyber Green荧光实时定量PCR反应体系检测基因表达水平。反应条件:预变性 94 ℃ 4 min,扩增条件 94 ℃ 30 s,60 ℃ 1 min,40 个循环。FOXC2上游引物:5′GATGCATTATCTTTGTCTCCTGATC3′;下游引物:5′GCTGCCCAGTTCTCAGCTCACAGGC3′;扩增引物大小为319 bp。以β-actin为内参基因,其上游引物序列为5′TGGCACCCAGCACAATGAA3′;下游引物序列为5′CTAAGTCATAGTCCGCCTAGAAGCA3′;目的片段大小为186 bp。目的基因表达量以2-ΔΔCt法计算。
1.3 结直肠癌细胞系中FOXC2蛋白的检测 采用Western blotting法检测HT29、SW620、SW480、LOVO、HCT116、LS174T、HCT8细胞中FOXC2蛋白表达,收集对数生长期2×106以上的待检测细胞,IP裂解液冰上裂解1 h,15 000 g、15 min离心后提取上清液,收集蛋白质,BCA 法行蛋白定量分析,配制10%丙烯酰胺胶,上样,80 V稳压跑胶30 min,120 V稳压跑胶1 h,湿转至 PVDF 膜,5 %脱脂奶粉封闭 1 h,一抗 4 ℃孵育过夜,二抗 37 ℃孵育 1.5 h,发光液曝光显影。一抗浓度比为1∶1 000,二抗浓度比为1∶3 000,以β-actin作为内参。ImageLab4.0软件进行灰度扫描,结果以相对灰度值表示。
1.4 慢病毒转染及稳定knock-down FOXC2细胞系的构建 针对FOXC2基因设计4组shRNA干扰目的序列及无任何靶向位点的随机序列,将序列剪切至慢病毒载体上,利用二代慢病毒包装系统包装成慢病毒悬液。将HT29接种至6孔板中,分别标记对照组、shFOXC2 1#组、shFOXC2 2#组、shFOXC2 3#组、shFOXC2 4#组,对照组加入插入随机序列载体的慢病毒悬液,shFOXC2 1#组、shFOXC2 2#组、shFOXC2 3#组、shFOXC2 4#组分别加入插入4组shRNA干扰目的序列的慢病毒悬液,构建稳定knock-down FOXC2的细胞系。具体方法如下:使用Lipofectamine 2000以2.5∶1的体积比将慢病毒shRNA质粒(6 μg/dish)、packing质粒(psPAX2, 4.5 μg/dish)和envelop质粒(pMD2.G; 1.5 μg/dish)一并转入293T细胞,7 h后更换正常培基,培养48 h,过滤收集上清液,并将带有慢病毒的上清液感染HT29细胞,感染3 d后加入Polybrene,使用puromycin筛选稳定细胞系,并进行Western blotting验证。四组shRNA序列为shFOXC2#1:5′GGGAGCGGGAGGGGCGGCCC3′;shFOXC2#2:5′GGTGCGCGGGCGGCGGCGCT3′;shCtrl:5′GCTGTTTTTTGAGATTTCAG3′,shFOXC2#3:5′CCGGAGGCTGCCAGGAGCCC3′;shFOXC2#4:5′TTGCCCGGGGCGCGCCCTCC3′。检测各组FOXC2蛋白及mRNA水平。方法同1.2、1.3。选取有效序列shFOXC2#1、shFOXC2#4进行下一步试验。
1.5 knock-down FOXC2细胞系增殖活力的检测 采用MTS法。收集shFOXC2 1#组、shFOXC2 4#组及对照组(GV248细胞)的对数生长期细胞,以2×103个/孔接种至96孔板中,每孔加入细胞悬液100 μL(设置5个复孔),置于5% CO2、37 ℃培养箱中培养。分别检测0(细胞贴壁后)、24、48、72 h的细胞增殖活力,MTS液与培基以1∶9的比例混合均匀,混匀后于生化培养箱中37 ℃孵育1 h后用多孔板酶标仪在490 nm波长下检测吸光度,相对增殖能力以各时间点OD值与0 h OD值的比值表示。
1.6 knock-down FOXC2细胞系侵袭能力的检测 采用划痕修复试验。收集1.5中三组的对数生长期细胞,将1×106细胞接种至标记笔划线的水平6孔板中,待细胞长满后100 μl移液枪头垂直划线进行划痕,每孔5条。分别在划痕后及24 h两个时间点进行拍照,结果以×200显微镜视野中划痕面积与视野总面积比值表示划痕大小。
1.7 knock-down FOXC2细胞系E-cadherin、Zo-1以及Vimentin蛋白表达的检测 采用Western blotting法。收集1.5中的三组细胞,方法同1.3,结果以相对灰度值表示。

2 结果
2.1 组织FOXC2 mRNA的表达 结直肠癌组织中FOXC2的mRNA水平(0.214±0.007)高于正常癌旁组织(0.070±0.008)(t=13.71,P<0.01)。
2.2 结直肠癌细胞系中FOXC2蛋白的表达 HCT116、SW620、SW480、LOVO、HT29、LS174T、HCT8细胞系中FOXC2蛋白表达量分别为0.062±0.009、0.115±0.016、0.174±0.013、0.208±0.022、0.439±0.030、0.173±0.019、0.027±0.005,HT29细胞系FOXC2蛋白表达量高于其他细胞系(P均<0.05)。
2.3 5组FOXC2蛋白及mRNA表达量比较 对照组、shFOXC2 1#组、shFOXC2 2#组、shFOXC2 3#组、shFOXC2 4#组FOXC2蛋白表达量分别为0.834±0.155、0.151±0.043、0.526±0.077、0.742±0.102、0.179±0.038,FOXC2 mRNA表达量分别为0.307±0.043、0.056±0.020、0.241±0.077、0.206±0.035、0.074±0.012。与对照组比较,shFOXC2 1#组、shFOXC2 2#组、shFOXC2 4#组FOXC2蛋白表达量低,shFOXC2 1#组、shFOXC2 3#组、shFOXC2 4#组FOXC2 mRNA表达量低(P均<0.05)。
2.4 knock-down FOXC2细胞系不同时间增殖活力比较 见表1。
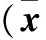
表1 knock-down FOXC2细胞系不同时间增殖活力比较±s)
注:与对照组比较,*P<0.05。
2.5 knock-down FOXC2细胞系侵袭能力变化 对照组划痕面积与总面积比为17.58±3.91,shFOXC2#1及shFOXC2#4组分别为5.83±1.51及6.41±1.28,与对照组相比,knock-down FOXC2细胞系划痕面积与总面积比低(P均<0.05)。
2.6 knock-down FOXC2细胞系E-cadherin、Zo-1和Vimentin蛋白表达比较 对照组、shFOXC2 1#组、shFOXC2 4#组E-cadherin蛋白表达量分别为0.358±0.049、0.740±0.102、0.591±0.084,Zo-1蛋白表达量分别为0.262±0.047、0.405±0.072、0.679±0.114,Vimentin蛋白表达量分别为0.633±0.095、0.294±0.031、0.280±0.064。与对照组比较,shFOXC2#1及shFOXC2#4组E-cadherin、Zo-1蛋白表达量高,Vimentin蛋白表达量低(P均<0.05)。
3 讨论
FOXC2属于人forkhead家族的转录因子,在正常机体中参与脂肪代谢的调节、淋巴与血管的生成以及对胰岛素敏感性的影响。近年研究指出,在多种恶性肿瘤中,多条途径的激活能够促进FOXC2表达,包括TGF-β、TGF-α、WNT、Snai1/FOXC2信号通路,并促进肿瘤的发生发展。Hollier等[1]研究发现,FOXC2在乳腺癌细胞中能促进EMT及干细胞性转化过程,通过使用PDGFR-β小分子抑制剂舒尼替尼下调FOXC2的表达能够降低乳腺癌细胞干细胞性及转移的趋势。Mortazavi等[2]证明非小细胞肺癌中FOXC2通过下调E-cadherin的表达促使细胞丧失极性,细胞间黏附作用减弱。Paranjape等[3]的研究显示,FOXC2在前列腺癌细胞中促进其产生干细胞特性的细胞表型,其也在子宫内膜癌及宫颈癌中高表达,并且与子宫内膜癌和宫颈癌的恶性程度密切相关,FOXC2促进血管生成的作用可能在其中发挥作用。基质金属蛋白酶是降解细胞外基质的主要酶类,在肿瘤的侵袭转移中发挥着重要作用。FOXC2不仅促进EMT的发生,同时与基质金属蛋白酶的表达也有一定的相关性。Nishida等[4]的研究指出在食管癌中,患者FOXC2的表达与基质金属蛋白酶2及基质金属蛋白酶9的表达呈正相关,提示其可能促进食管癌的侵袭转移,并导致不良预后。
本研究结果显示,结直肠癌组织相比癌旁正常组织FOXC2 mRNA表达量升高,提示高表达的FOXC2可能在癌症发生发展的过程中起一定的作用。我们进一步通过慢病毒感染构建稳定shFOXC2的HT29细胞系,MTS的结果显示FOXC2下调后,肿瘤细胞增殖能力低于对照组,提示FOXC2在结直肠癌细胞增殖中起到一定的促进作用。划痕修复试验的结果显示,FOXC2下调后,细胞侵袭迁移能力减弱,表明FOXC2在结直肠癌中发挥促进肿瘤细胞转移的作用。对此,我们进一步对shFOXC2细胞系EMT相关分子进行检测,包括E-cadherin、Zo-1及Vimentin。E-cadherin的减少或缺失是EMT最主要的标志性变化,其不仅是实现细胞间连接黏附的重要分子,还在维持细胞极性方面起着重要作用。许多研究显示,E-cadherin的下调对于上皮细胞癌的发生发展具有重要意义。Zo-1在细胞中起封闭细胞间间隙的作用,其下调可导致细胞间紧密连接中断,促进癌细胞扩散[5],Vimentin是成纤维细胞中等纤维的主要成分,其表达上调提示EMT程度加重。本试验中,HT29细胞下调FOXC2后,E-cadherin、Zo-1蛋白表达上调,Vimentin蛋白表达下调,提示FOXC2对结直肠癌细胞EMT过程有促进作用,综上,认为FOXC2对结直肠癌的发生发展有促进作用。在接下来的研究中,我们将提取细胞质胞核蛋白对FOXC2进行定位,同时通过动物体内实验进一步验证FOXC2的促癌作用,并研究分子间相互作用探究FOXC2的作用机制,确定其可能的靶标分子,为结直肠癌的临床诊治以及诊断提供新的依据。
[1] Hollier BG, Tinnirello AA, Werden SJ, et al. FOXC2 expression links epithelial-mesenchymal transition and stem cell properties in breast cancer[J]. Cancer Res, 2013,73(6):1981-1992.
[2] Mortazavi F, An J, Dubinett S, et al. p120-catenin is transcriptionally downregulated by FOXC2 in non-small cell lung cancer cells[J]. Mol Cancer Res, 2010,8(5):762-774.
[3] Paranjape AN, Soundararajan R, Werden SJ, et al. Inhibition of FOXC2 restores epithelial phenotype and drug sensitivity in prostate cancer cells with stem-cell properties[J]. Oncogene, 2016,35(46):5836-5976.
[4] Nishida N, Mimori K, Yokobori T, et al. FOXC2 is a novel prognostic factor in human esophageal squamous cell carcinoma[J]. Ann Surg Oncol, 2011,18(2):535-542.
[5] Jain K, Basu A. Protein kinase C-ε promotes EMT in breast cancer[J]. Breast Cancer, 2014,8(1):61-67.
10.3969/j.issn.1002-266X.2017.29.010
R735.37
A
1002-266X(2017)29-0033-03
2016-12-13)

