日本小菊组培技术的研究
温福欣
(丹东市林业科学研究院,辽宁丹东118000)
日本小菊组培技术的研究
温福欣
(丹东市林业科学研究院,辽宁丹东118000)
以日本小菊花蕾为外植体,研究了外植体诱导、扩繁、生根、炼苗的最佳培养条件。结果表明,最佳消毒处理为75%酒精30s+0.1% HgCl26min,污染率低至3.8%;初代培养的最佳激素配比为MS+6-BA 1.5mg/L+NAA 0.1mg/L,萌发率达到88.2%,平均株高达2.4cm;增殖培养的最佳激素配比是MS+6-BA 0.5mg/L+IBA 0.05mg/L,平均株高达2.8cm,增殖系数达9。生根培养最佳培养基为1/2MS+IBA 0.15mg/L,生根率达96.0%。
日本小菊;初代培养;增殖培养
日本小菊是菊花[Dendranthemamorifolium(Ramat. ) Tvzel.] 中的一类地被型矮生小菊,植株矮小,花色丰富、花多而密、矮生、花期长,色彩绚丽,开花热烈,也是极好的盆栽观赏花卉。本试验以日本小菊花蕾为外植体进行离体培养试验,目的在于探寻一种快速高效的繁殖新途径。花型多样,色彩繁多,在切花、园林、城市绿化等方面广泛应用,深受人们喜爱。但宿根花卉的繁殖速度较慢,很难满足市场需求,组织培养因具有繁殖率高、生长周期短以及培养条件可以人为控制等特点,能够在短时间内产生大量的试管苗[1-2]。
1 材料与方法
1.1 试验材料
春季取日本小菊尚未完全开放的花蕾。
1.2 消毒方法
将花蕾剪下放在自来水下冲洗30min,置于超净工作台上,采用75%酒精和0.1%HgCl2进行消毒处理,75%酒精处理30s,0.1%HgCl2处理分别为4、6、8、10 min,最后用无菌水冲洗5~7次。
1.3 培养方法
1.3.1 初代培养。花蕾消毒后, 根据花蕾大小将其切割成2半或4半,再接种于培养基上培养,在无菌环境中将其接种于如表2所示的10种培养基中,每个处理3次重复,每个重复接种6瓶,1瓶接种2个,观察腋芽萌发及生长情况。
1.3.2 增殖培养。待茎段腋芽伸长生长至4~5cm后,将其从基部剪下,剪成长约1.5cm左右的1芽1叶1段,分别转接于如表3所示的9种培养基中进行增殖培养,每个处理3次重复,每个重复接种6瓶,每瓶接种4~6个。
1.3.3 生根培养。将高度5cm以上的健壮植株剪取接入如表3所示的3种生根培养基中,每个处理3次重复,每个重复接种6瓶,每瓶接种2个。
1.3.4 炼苗移栽。移栽前,将生根后的试管苗培养瓶移入到大棚内,先适应大棚内光照和温度,并逐渐打开培养瓶盖,使其适应大棚内湿度。3d 左右取出健壮的生根苗,用清水洗净培养基,在温室内移栽到配好的基质中。
1.3.5 培养条件。白天温度25±1℃,夜间温度20±1℃,光周期(光照/黑暗)14h/10h,光强2000~3000 lx。初代培养、增殖培养以MS为基本培养基,添加不同浓度的6-BA、NAA、IBA,蔗糖30 g/L,琼脂7.5g/L,pH值调至6.0,生根培养基为1/2MS培养基,添加不同浓度的IBA和NAA,其它条件不变。
2 结果与分析
2.1 不同灭菌处理对材料的影响
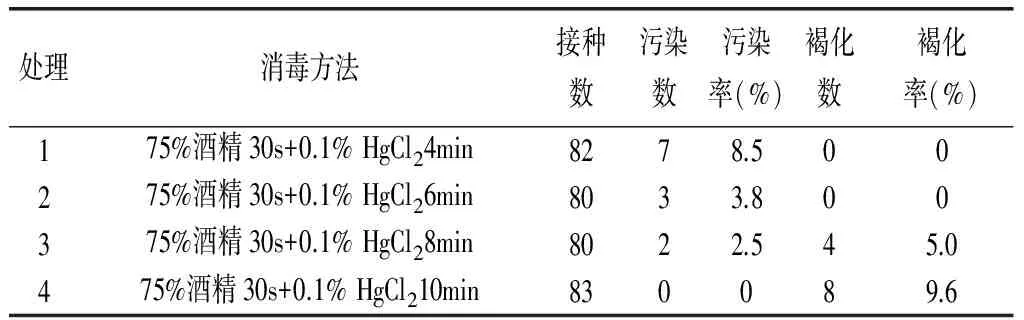
表1 不同处理外植体的灭菌表现
在接种后第7~9d,灭菌不彻底的外植体陆续出现污染现象。从表1可以看出,处理4污染率最小为0,处理3和处理2次之,污染率分别为2.5%和3.8%,但是处理3和处理4由于HgCl2处理时间稍长,出现了褐化现象,另外两个处理无褐化现象,结合以上两项指标发现处理2即75%酒精30s+0.1% HgCl26min污染率3.8%,无褐化现象,为最佳消毒方法。
2.2 外植体的诱导
外植体在芽诱导培养基上培养1周后基部开始膨大,第12d花药部分变大变绿;约15d后花蕾陆续长出绿色小芽。诱导培养30d后观察结果见表2。
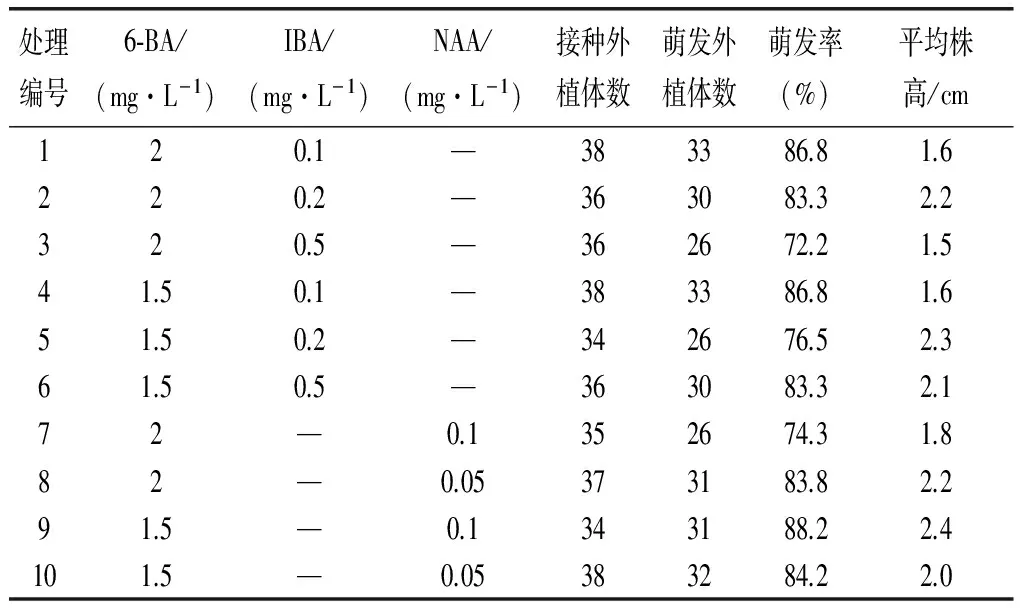
表2 不同激素浓度外植体诱导的影响
从表2可以看出不同浓度的6-BA、NAA和IBA均能诱导花蕾萌发出芽苗,且萌发率在70%以上;6-BA、NAA激素组合较6-BA、IBA激素组合芽萌发较快,萌芽长势较好,且芽苗较高、壮,其中6-BA1.5mg/L,NAA0.1 mg/L的诱导效果最好,萌发率达到88.2%,平均株高达2.4cm,所以最适宜日本小菊花蕾诱导的最适培养基为MS+6-BA 1.5mg/L+NAA0.1mg/L。
2.3 继代增殖
诱导培养30d后瓶内产生大量丛生芽,待芽长至3~4cm剪出接入增殖培养基中,增殖培养1周后,腋芽开始萌发,第30d观察记录生长情况,每个激素组合随机抽取6瓶测量株高,计算增值系数,结果见表3。
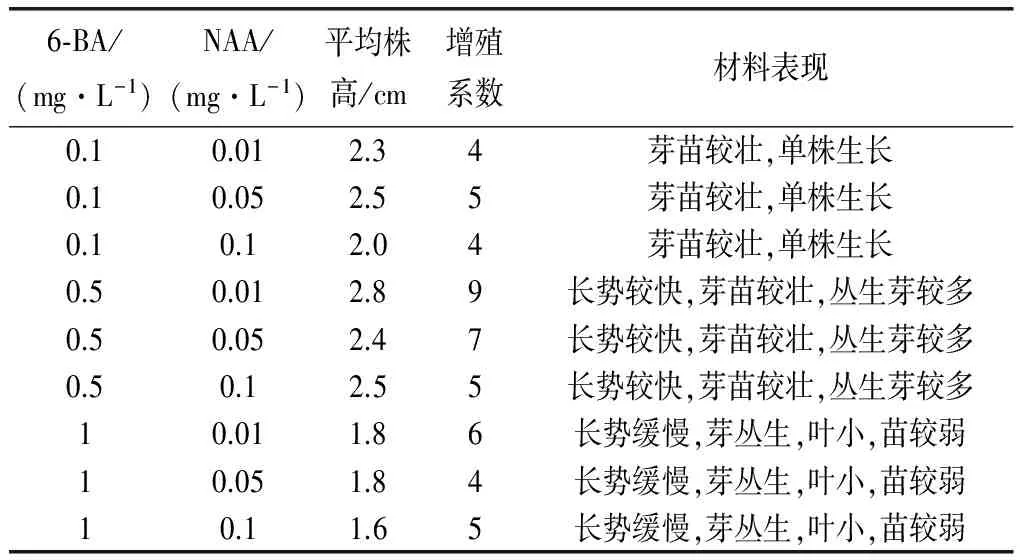
表3 不同激素浓度对芽苗增殖的影响
由表3可以看出, 6-BA浓度低于0.5mg/L时,长势较快,芽苗较壮,单株生长,无从生现象;6-BA浓度高于0.5mg/L时,植株长势缓慢,芽苗较弱,叶小,易丛生;6-BA为0.5mg/L时,长势较快,芽苗较壮,丛生芽较多,增值系数较高,其中6-BA0.5mg/L,NAA0.01 mg/L,平均株高2.8cm,增值系数达9,表现较好。综上所述最适宜日本小菊增殖的培养基是MS+6-BA 0.5 mg/L +NAA0.01 mg/L。
2.4 生根培养
当芽苗长至5cm时,剪出接入生根培养基上,生根培养一周后,芽苗基部陆续出现白色细长的根。20d后,每个处理随机抽取6瓶测量根长、生根条数,统计根系生长情况见表4。
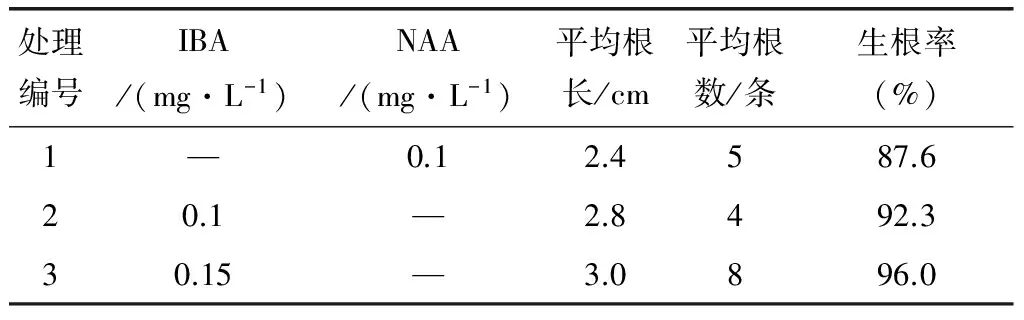
表4 不同处理对苗木根系生长情况的影响
由表4可以看出IBA浓度为0.15mg/L时生根率最高,达96.0%,平均根条数为8条,所以最适日本小菊生根的培养基为1/2MS+IBA 0.15mg/L。
2.5 炼苗
炼苗移栽基质为1∶4的珍珠岩和草炭土,将组培苗移栽至配好的基质中,棚内温度控制在15~28℃,湿度控制在70%以上,定期浇施杀菌剂。15d后观察记录,移栽苗的成活情况,成活率为95%以上,且成活的日本小菊长势良好。
3 结论与讨论
以日本小菊花蕾为外植体,研究了外植体诱导、扩繁、生根、炼苗的最佳条件。结果表明,最佳消毒处理为75%酒精30s+0.1% HgCl26min,污染率低至3.8%;初代培养的最佳激素配比为MS+6-BA 1.5mg/L+NAA 0.1mg/L,萌发率达到88.2%,平均株高达2.4cm;增殖培养的最佳激素配比是MS+6-BA 0.5mg/L+IBA 0.05mg/L,平均株高达2.8cm,增殖系数达9。生根培养最佳培养基为1/2MS+IBA 0.15mg/L,生根率达96.0%。
日本小菊具有抗性强、花色丰富、花量大,花期集中且时间长、株型矮且紧凑、管理粗放、适合露地栽植的特点,非常适于在当前水资源日益紧张的情况下作为城市美化和绿化的优选素材[3-4],本研究为日本小菊快速繁殖以满足市场需求奠定了基础。

图2 芽苗生根培养(立面图)(1/2MS+0.15mg/L IBA)

图3 芽苗生根培养(底面图)(1/2MS+0.15mg/L IBA)
[1]陈龙清. 日本早小菊的组织培养及玻璃苗防治[J].华中农业大学学报,1995,14(3): 272-274.
[2]冯慧. 北京小菊组织培养和再生体研究[J]. 北京农业职业学院学报,2006,20(3): 11-13.
[3]齐向英. 菊花组织培养研究[J]. 江苏农业科学,2009 (5): 63-64.
[4]刘悦明. 日本小菊引种栽培试验及推广应用[J].广东园林,1996 (4): 31-32.
DOI.:10.13268/j.cnki.fbsic.2017.04.016
S682.1+1
:A
温福欣(1989-),女,助理工程师,主要从事林业组培技术研究,E-mail:nmgnydx132@163.com。

