慢性低强度应激抑郁症模型大鼠组织中5-羟色胺和色氨酸羟化酶的表达变化Δ
陈 栘,徐海霞,朱明月,刘 坤,林 波,罗儒献,陈川柏,李孟森#(1.海南医学院分子生物学重点实验室,海口 571199;2.海南省肿瘤发生和干预重点实验室,海口 571199;.海南省安宁医院精神科,海口571199)
慢性低强度应激抑郁症模型大鼠组织中5-羟色胺和色氨酸羟化酶的表达变化Δ
陈 栘1,2*,徐海霞1,2,朱明月1,2,刘 坤1,2,林 波1,2,罗儒献3,陈川柏3,李孟森1,2#(1.海南医学院分子生物学重点实验室,海口 571199;2.海南省肿瘤发生和干预重点实验室,海口 571199;3.海南省安宁医院精神科,海口571199)
目的:为抑郁症治疗药物的开发提供依据和思路。方法:将适应性喂养7 d的大鼠随机分为正常组、抑郁组和治疗组(氢溴酸西酞普兰1 mg/kg),每组8只,抑郁组和治疗组大鼠每天随机给予1次低强度刺激[夹尾刺激(1 min)、频闪照明刺激(120次/ min,12 h)、噪声刺激(4 h)、冰水游泳刺激(1 h)、热水刺激(45℃,1 h)、电击足底(10 Hz,1 mA,每次间隔100 ms,100次)、禁食禁水(24 h)],连续21 d建立应激抑郁症模型。分别于适应性喂养第0、7天和应激第7、14、21天称量各组大鼠体质量,检测旷场实验中大鼠的水平移动频率和垂直活动频率。应激结束后,各组大鼠ig相应药物,连续30 d后检测脑、肝、肾组织中5-羟色胺(5-HT)和色氨酸羟化酶(TPH)的表达。结果:与正常组比较,抑郁组和治疗组大鼠从应激第14天起体质量增加趋势减慢(P<0.05)。抑郁组和治疗组大鼠应激第14、21天的水平移动频率较前一时间点明显降低(P<0.05或P<0.01),应激第21天的垂直活动频率较前一时间点明显降低(P<0.05或P<0.01);给药30 d后,治疗组大鼠水平移动频率和垂直活动频率较前一时间点明显升高(P<0.01)。与抑郁组比较,治疗组大鼠脑、肾组织中的5-HT水平明显增加(P<0.05),脑组织中TPH水平明显增加(P<0.05)。结论:应激大鼠模型抑郁症的发生与大鼠脑组织中TPH表达的降低从而导致5-HT水平降低有关,提示TPH可作为抑郁症治疗的靶点。
抑郁症模型;5-羟色胺;色氨酸羟化酶;大鼠
抑郁症属于情感障碍性疾病,主要特征是持续性的心境低落,并伴有情绪不振、食欲下降、体质量下降、活动频率降低、失眠、疲劳、无望感以及自杀倾向等[1]。据世界卫生组织预计,到2020年抑郁症将成为仅次于冠心病之后的人类第二大疾病。然而,迄今为止抑郁症的发病机制尚未明确,对于抑郁症发病机制和治疗手段的探索是目前医学及生物学领域的研究热点之一。
建立合理可靠的抑郁症动物模型是研究抑郁症发病机制和治疗手段的先决条件。慢性低强度应激(CMS)抑郁症动物模型是Willner P等[1]在1987年建立的,这种模型具有高度的有效性和可靠性,抑郁症状可持续2周以上,且抗抑郁药物对其有治疗作用,因此该模型基本符合抑郁模型的要求。
抑郁症发生的5-羟色胺(5-HT)学说指出,抑郁症是中枢神经系统中5-HT释放量减少,使其在突触间隙的含量降低所致。有研究已证实,抑郁症患者的中枢神经系统中5-HT含量降低[2-3]。5-HT由色氨酸经两步反应合成:(1)色氨酸由色氨酸羟化酶(TPH)催化生成5-羟色氨酸;(2)5-羟色氨酸在5-羟色氨酸脱羧酶的作用下最终生成5-HT。由于TPH在脑中的含量和活性较低,其成为5-HT合成的限速酶[4]。因此,笔者推测中枢神经系统中TPH表达水平和生理活性的降低导致5-HT释放量的下降,继而抑制了5-HT作为情绪性行为调节因子的作用,导致抑郁症的发生。为验证这个假设,本课题建立了CMS抑郁症大鼠模型,采用免疫组织化学法对大鼠脑、肝、肾组织中5-HT和TPH的表达进行了检测,以期为探索抑郁症发病机制及研发抗抑郁药物提供新的思路。
1 材料
1.1 仪器
BL-420E生物机能实验系统(成都泰盟科技有限公司);Shandon Finesse E+石蜡切片机(美国Thermo Scientific公司);IX51荧光倒置显微镜(日本Olympus公司)。
1.2 药品与试剂
氢溴酸西酞普兰口服溶液(上海实业联合集团长城药业有限公司,批号:20130614,规格:10 mL∶20 mg);大鼠源anti-5-HT抗体(货号:ab6336,批号:GR83127-1)、兔源 anti-TPH抗体(货号:ab52954,批号:YI060902CSR)、驴抗大鼠二抗(货号:ab102182,批号:GR140392-3)、山羊抗兔二抗(货号:ab6721,批号:GR113458-1)均购自美国Abcam公司;二甲苯、一水柠檬酸、二水柠檬酸钠、牛血清白蛋白(BSA,上海阿拉丁生化科技股份有限公司,批号:20110711、26219、34208、46769);苏木素(江苏凯基生物技术股份有限公司);3, 3′-二氨基联苯胺(DAB,北京索莱宝科技有限公司,批号:20131106)。
1.3 动物
SPF级SD大鼠24只,♀♂各半,体质量为180~220 g,购自海南医学院实验动物中心(海南省药物安全性评价研究中心),合格证号:SYXK(琼)2012-0012。本实验受海南医学院医学伦理委员会监督及审查。
2 方法
2.1 分组、建模、给药与取样
大鼠按性别分笼常规适应性喂养7 d后,区分性别并随机分为正常组、抑郁组和治疗组,每组8只,♀♂各半。正常组大鼠在整个建模过程中保持正常饲养。抑郁组和治疗组大鼠每天随机给予1次低强度刺激[包括夹尾刺激(1 min)、频闪照明刺激(120次/min,12 h)、噪声刺激(4 h)、冰水游泳刺激(1 h)、热水刺激(45℃,1 h)、电击足底(10 Hz,1 mA,每次间隔100 ms,100次)、禁食禁水(24 h)],连续21 d建立CMS抑郁症模型。建模后,治疗组大鼠每天按1 mg/kg剂量ig氢溴酸西酞普兰口服溶液,正常组和抑郁组大鼠ig等量生理盐水,连续30 d。治疗结束后,各组大鼠麻醉、解剖,分离脑、肝、肾组织,快速放入-80℃超低温冰箱中保存,待用。
2.2 大鼠体质量、水平移动频率和垂直活动频率的检测
观察各组大鼠的饮食情况,分别于适应性喂养的第0、7天,刺激应激第7、14、21天和给药30 d后称量每组大鼠体质量,并进行旷场实验。取每组大鼠各时间点的体质量平均值,比较同组大鼠各时间点间体质量的增加趋势。记录并计算每组大鼠各时间点在旷场实验中的水平移动频率和垂直活动频率的平均值,比较同组大鼠各时间点间运动频率的变化趋势。数据以Excel 2003软件进行分析,正态计量指标以±s表示,两两比较行t检验。P<0.05表示差异有统计学意义。
2.3 大鼠脑、肝、肾组织中5-HT和TPH水平的检测
采用免疫组织化学法检测各组大鼠脑、肝、肾组织中的5-HT和TPH水平。将取样得到的脑、肝、肾组织石蜡包埋,切片(厚度4 μm),烘烤固定到载玻片上。免疫组织化学法检测时,先将载玻片浸入二甲苯5 min×3进行脱蜡,依次浸入100%、95%、70%乙醇中各3 min进行水化,再浸入蒸馏水5 min×2清洗后,浸入3%过氧化氢溶液室温孵育5 min以封闭组织本身的过氧化物歧化酶;流水冲洗5 min,滴加2%BSA室温孵育10 min封闭组织上空白位点,磷酸盐缓冲液(PBS)清洗10 min×3,浸入柠檬酸缓冲液微波加热10 s×6进行抗原修复;流水冲洗5 min后,滴加用PBS稀释的大鼠源anti-5-HT抗体(1∶140稀释)或兔源anti-TPH抗体(1∶200稀释),4℃孵育过夜;PBST缓冲液(PBS+聚山梨酯20)清洗10 min× 3,滴加二抗(1∶1 000稀释)37℃孵育30 min;PBST清洗10 min×3,滴加DAB室温孵育2~10 min对目的蛋白进行染色,浸入苏木素室温孵育3 min复染细胞核;流水冲洗5 min,依次浸入70%、95%、100%乙醇中各5 min,再浸入二甲苯5 min×2,滴加一小滴中性树脂后用盖玻片封片。采用显微镜观察,以Image-Pro Plus 6.0软件对染色的平均积分光密度(IOD)分析。采用Excel 2003软件进行数据处理,数据以±s(柱状图的误差线)表示,组间数值行t检验,P<0.05表示差异有统计学意义。
3 结果
3.1 大鼠体质量、水平移动频率和垂直活动频率变化
应激过程中,抑郁组和治疗组大鼠均出现食欲下降的症状。与正常组比较,抑郁组和治疗组大鼠从应激第14天起体质量增加趋势减慢(P<0.05)。与抑郁组比较,治疗组大鼠给药30 d后体质量明显增加(P<0.05)。
旷场实验中,正常组大鼠不同时间点间水平移动频率和垂直活动频率差异均无统计学意义(P>0.05)。抑郁组和治疗组大鼠应激第14、21天的水平移动频率与前一时间点比较明显降低(P<0.05或P<0.01);应激第21天的垂直活动频率与前一时间点比较明显降低(P<0.05)。给药30 d后,治疗组大鼠水平移动频率和垂直活动频率与前一时间点比较明显升高(P<0.05或P<0.01)。各组大鼠体质量、水平移动频率和垂直活动频率的变化趋势见图1。

图1 各组大鼠体质量、水平移动频率和垂直活动频率的变化趋势(n=8)Fig 1 Change trends of body mass,horizontal activity and vertical activity frequencies of rats in each group(n=8)
3.2 大鼠不同组织中5-HT含量变化
与正常组比较,抑郁组大鼠脑、肾组织中5-HT含量明显降低(P<0.05或P<0.01);与抑郁组比较,治疗组大鼠脑、肾组织中5-HT含量明显增加(P<0.05)。各组大鼠脑组织中5-HT含量较肝、肾组织低。3组大鼠肝组织中5-HT含量变化不明显。各组大鼠不同组织中5-HT含量的免疫组织化学图见图2,测定结果见图3。

图2 各组大鼠不同组织中5-HT水平的免疫组织化学图(×200)Fig 2 Immunohistochemistry diagram of 5-HT levels in different tissues of rats in each group(×200)

图3 各组大鼠不同组织中5-HT水平的测定结果(n=8)Fig 3 Determination results of 5-HT levels in different tissues of rats in each group(n=8)
3.3 大鼠不同组织中TPH水平变化
与正常组比较,抑郁组大鼠脑、肾组织中TPH水平明显降低(P<0.05或P<0.01);与抑郁组比较,治疗组大鼠脑组织中TPH水平明显增加(P<0.05),肾组织中TPH水平继续降低。抑郁组大鼠脑组织中TPH水平降低趋势较肝、肾组织明显。各组大鼠不同组织中TPH水平的免疫组织化学图见图4,测定结果见图5。
4 讨论
抑郁症动物模型的建立是探索抑郁症发生机制和治疗方法的基础,常见的模型建立方法包括药物诱发抑郁模型、应激模型、分离模型等,其中应用较为广泛、模型建立方式较为接近人抑郁症发生的CMS模型就属于应激模型的一种。CMS模型的建立原则及该模型的优势体现在以下两点:(1)在有效范围内尽可能降低应激因子的强度,以模拟人类抑郁症发生的中慢性及应激源低水平性;(2)以人类抑郁的核心症状,即快感缺乏为依据,利用快感测试监控和评价大鼠应激的形成。本课题采用的旷场实验即快感测试的一种,本实验建立的抑郁症模型大鼠呈现快感下降症状。
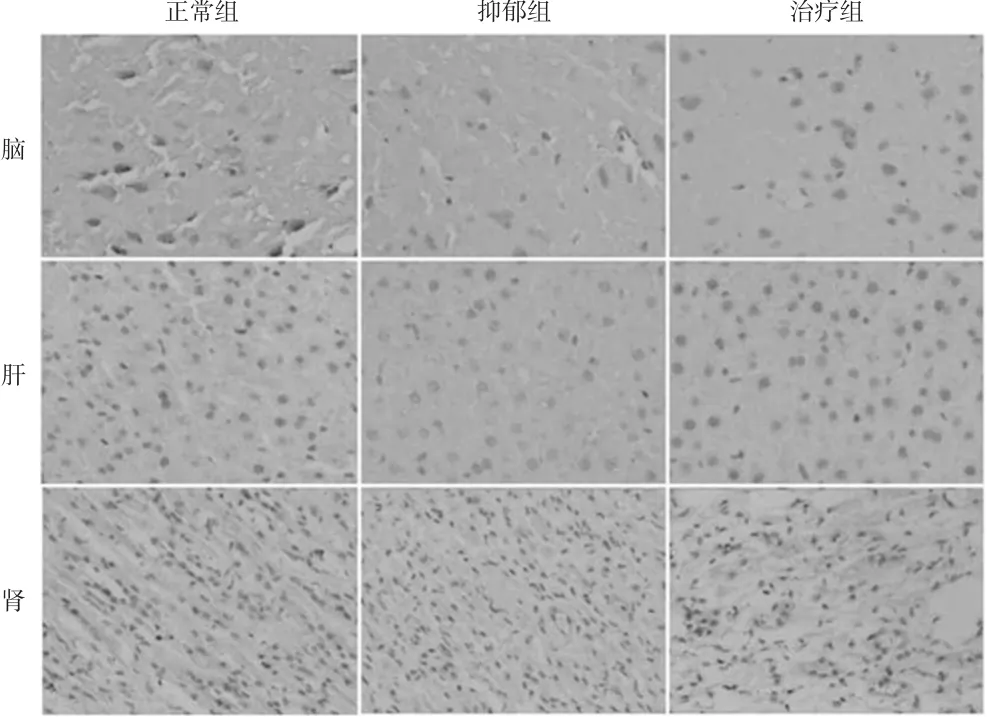
图4 各组大鼠不同组织中TPH水平的免疫组织化学图(×200)Fig 4 Immunohistochemistry diagram of TPH levels in different tissues of rats in each group(×200)

图5 各组大鼠不同组织中TPH水平的测定结果(n=8)Fig 5 Determination results of TPH levels in different tissues of rats in each group(n=8)
近年来,抑郁症发生的神经递质学说取得了很大的进展。目前已发现与抑郁症发生相关的神经递质包括去甲肾上腺素(NE)、多巴胺(DA)和5-HT等。5-HT是一个重要的情绪性行为的调节因子,在脑内参与情感控制、睡眠、进食、体温调节、药物依赖和性行为等多种生理功能的调节[5-6]。因此,选择性抑制5-HT的重吸收也是抗抑郁药物的药理作用之一[7]。由此可见,5-HT与抑郁症有着密切联系,就5-HT及其相关蛋白的研究对探索抑郁症的发病机制和治疗方法具有重要意义。本文选用的抗抑郁药西酞普兰是一种选择性5-HT再摄取抑制剂(SSRIs),与同类药比较,其再摄取抑制作用更强、选择性更高[8]。本实验选用的剂量以药品说明书为依据换算而得。
本研究结果显示,抑郁组大鼠脑组织中5-HT水平较肝、肾组织低,这个结果与抑郁症发生的5-HT学说及国内外相关报道一致[2-3,9-10]。中枢神经系统中5-HT虽然可对情绪性行为起调控作用,但只占体内5-HT总量的一小部分[8]。然而,作为5-HT合成限速酶的TPH在各组织中的分布却不同于5-HT,这也许是因为TPH的两个亚型TPH1和TPH2分别分布于外周和中枢,其催化机制也许存在差异。5-HT与TPH组织分布的差异性有可能与其在肝、肾组织中含量变化趋势不同相关。本研究结果也充分辅证了抑郁症发生的5-HT学说,同时TPH在抑郁症大鼠模型脑组织中表达改变与5-HT含量的改变呈现相同的趋势,证实了抑郁症发生的5-HT学说可能与其合成的限速酶TPH相关。
(致谢:感谢海南医学院分子生物学重点实验室李孟森主任对本课题实验技术的指导和资助;感谢海南医学院2011级本科实习生徐海霞协助本课题的实验操作;感谢海南医学院分子生物学重点实验室的同事在实验技术上的指导和帮助!)
[1] Willner P,Towell A,Sampson D,et al.Reduction of sucrose preference by chronic unpredictable mild stress,and its restoration by a tricyclic antidepressant[J].Psychopharmacology,1987,93(3):358-364.
[2] El Marroun H,White TJ,Fernandez G,et al.Prenatal exposure to selective serotonin reuptake inhibitors and non-verbal cognitive functioning in childhood[J].J Psychopharmacol,2017,31(3):346-355.
[3] Safer DJ.Raising the minimum effective dose of serotonin reuptake inhibitor antidepressants:adverse drug events [J].J Clin Psychopharmacol,2016,36(5):483-491.
[4] Mockus SM,Vrana KE.Advances in the molecular characterization of tryptophan hydroxylase[J].J Mol Neurosci,1998,10(3):163-179.
[5] Lin SH,Lee LT,Yang YK.Serotonin and mental disorders:a concise review on molecular neuroimaging evidence[J].Clin Psychopharmacol Neurosci,2014,12(3):196-202.
[6] Benjamin DS,Jason RN,Marc GC.Brain 5-HT deficiency increases stress vulnerability and impairs antidepressant responses following psychosocial stress[J].PNAS,2015,112(8):2557-2562.
[7] Cui YH,Zheng Y.A meta-analysis on the efficacy and safety of St John’s wort extract in depression therapy in comparison with selective serotonin reuptake inhibitors in adults[J].Neuropsychiatr Dis Treat,2016,doi:10.2147/ NDT.S106752.
[8] Fidalgo S,Ivanov DK,Wood SH.Serotonin:from top to bottom[J].Biogerontology,2013,14(1):21-45.
[9] Kawai M,Rosen CJ.Minireview:a skeleton in serotonin’s closet?[J].Endocrinology,2010,151(9):4103-4108.
[10] 刘文,李焕德.新型抗抑郁药物的临床应用及其作用机制研究进展[J].中国药房,2007,18(1):66-68.
Changes of 5-hydroxytryptamine and Tryptophan Hydroxylase Expressions in Tissues of Depression Model Rats Induced by Chronic Low-intensity Stress
CHEN Yi1,2,XU Haixia1,2,ZHU Mingyue1,2,LIU Kun1,2,LIN Bo1,2,LUO Ruxian3,CHEN Chuanbai3,LI Mengsen1,2
(1.Key Laboratory of Molecular Biology,Hainan Medical University,Haikou 571199,China;2.Hainan Provincial Key Laboratory of Carcinogenesis and Intervention,Haikou 571199,China;3.Dept.of Psychiatry,Hainan Anning Hospital,Haikou 571199,China)
OBJECTIVE:To provide basis and thinking for the development of medicines for treating depression.METHODS:Rats with adaptive feeding for 7 d were randomly divided into normal group,depression group and treatment group(citalopram hydrobromide 1 mg/kg),8 in each group.Rats in depression group and treatment groups randomly
once low-density stimulation in a day[catching tail stimulation(1 min),frequent flashing stimulation(120 times/min,12 h),noise stimulation(4 h),ice water swimming stimulation(1 h),hot water stimulation(45℃,1 h),electric shocking foot(10 Hz,1 mA,each time interval of 100 ms,100 times),no food and no water(24 h)]for 21 d to reduce stress depression model.Body mass of rats in 0,7 d of adaptive feeding and 7,14,21 d of stress were respectively weighed,and horizontal activity and vertical activity frequencies in open field test were detected.After stress,rats were intragastrically administrated related medicines for 30 d,then 5-hydroxytryptamine(5-HT)and tryptophan hydroxylase(TPH)expressions in brain,liver,kidney tissues were determined.RESULTS:Compared with normal group,the increasing trend of body mass in depression group and treatment group slowed down from the 14 d of stress(P<0.05).The horizontal activity frequencies in depression group and treatment group in 14,21 d of stress slowed more obviously than the previous time point(P<0.05 or P<0.01);vertical activity frequencies in 21 d of stress slowed more obviously than the previous time point(P<0.05 or P<0.01).After 30 d of administration,horizontal activity and vertical activity frequencies in treatment group were increased more obviously than the previous time point(P<0.01).Compared with depression group, 5-HT level in brain,kidney tissues was obviously increased(P<0.05)and TPH level was obviously increased in brain tissue(P<0.05).CONCLUSIONS:The occurrence of depression in stress rat models may be associated with the decrease of 5-HT content induced by the decrease of TPH expression inbrain tissue of rats,indicating that TPH can be used as a target for depression treatment.
Depression model;5-hydroxytryptamine;Tryptophan hydroxylase;Rats
R965
A
1001-0408(2017)22-3061-04
2017-03-24
2017-06-02)
(编辑:邹丽娟)
海南省自然科学基金资助项目(No.812162,813198)
*助理研究员,硕士。研究方向:分子肿瘤学。电话:0898-66893780。E-mail:chenyioi@163.com
#通信作者:研究员,博士。研究方向:分子肿瘤学。电话:0898-66895322。E-mail:mengsenli@163.com
DOI10.6039/j.issn.1001-0408.2017.22.10

