微生物几丁质酶的研究进展及应用现状
龚福明,何彩梅,唐小艳,柳陈坚*
(1.德宏职业学院临床医学系,云南芒市678400;2.贺州学院化学与生物工程学院,广西贺州542899;3.昆明理工大学生命科学与技术学院,云南昆明650500)
微生物几丁质酶的研究进展及应用现状
龚福明1,何彩梅2,唐小艳1,柳陈坚3*
(1.德宏职业学院临床医学系,云南芒市678400;2.贺州学院化学与生物工程学院,广西贺州542899;3.昆明理工大学生命科学与技术学院,云南昆明650500)
几丁质酶(chitinase)是一类可催化几丁质水解为N-乙酰氨基葡萄糖寡聚体或单体的糖苷水解酶,广泛存在于微生物(真菌、细菌、放线菌与病毒)及动植物中,因其特殊的生理功能而被广泛应用于生物防治、医学应用、废弃物处理及环境保护等领域。文章综述了微生物几丁质酶的来源与分类、发酵条件、酶学性质及应用领域,以期为几丁质酶的进一步开发应用提供理论指导。
几丁质;微生物几丁质酶;发酵条件;酶学性质;应用
几丁质(chitin)也称为甲壳质,是一种由N-乙酰-D-氨基葡萄糖以β-1,4-糖苷键连接而成的直链高分子生物多聚体,是含量仅次于纤维素的第二大天然多聚物[1]。相关报道表明,几丁质是甲壳类动物、昆虫、真菌及线虫等病原生物体壁结构上的重要组成[2],对机体具有支持与保护作用。几丁质在甲壳类动物外壳中的含量极高(可高达85%),当其与钙盐及蛋白质结合后会变成坚硬的外壳,用酸碱处理甲壳类动物外壳脱去钙盐和蛋白质后,加热即可制备可溶性壳聚糖,因而也被俗称为甲壳素。
几丁质酶(chitinase)EC3.2.1.1 4是BENECKE U[3]在1905年研究几丁质芽孢扦菌(Bacillus chitinovrous)分解几丁质的过程中,首次分离发现的一类可催化几丁质水解并将之彻底水解为N-乙酰氨基葡萄糖寡聚体或单体的糖苷水解酶,分属于18和19两个家族,而微生物几丁质酶大多归属于18家族[4]。随着研究深入与继续,发现几丁质酶除广布于真菌、细菌及放线菌等微生物中外,还大量存在于昆虫、甲壳动物、高等植物甚至病毒中[5]。相关研究表明,几丁质酶是生物体内降解或利用几丁质的关键,一方面几丁质酶能通过水解病原真菌细胞壁,破坏害虫体壁及杀虫增效等机制发挥生物防治作用,另一方面几丁质酶还能通过催化几丁质水解,促进其自然界循环的作用,维持生态系统平衡[4-5]。又因几丁质酶催化几丁质水解后的N-乙酰氨基葡萄糖寡聚体或单体等产物的抗菌,调节机体免疫,抑制肿瘤细胞生长等特性,使几丁质酶被大量用于环境保护、医药、农业、食品加工等领域并表现出巨大的市场潜力[6-7]。
正是基于巨大的市场潜力和应用价值,几丁质酶制备及其研发并日益受人们重视。与其他几丁质酶来源相比,微生物几丁质酶具备生长周期短、易培养、可通过发酵法制备,操作性强,经济效益良好等优势[8],加之近年来微生物几丁质酶的结构特性、产酶条件及基因克隆与表达等研究与日俱增,微生物几丁质酶逐渐成为研究新热点。本文对微生物几丁质酶的来源与分类、发酵条件、酶学性质及应用领域等内容进行综述,以期为微生物几丁质酶的开发应用提供论指导与参考。
1 微生物几丁质酶的来源
继BENECKE U于1905年首次从几丁质芽孢杆菌(Bacillus chitinovrous)中发现并分离微生物几丁质酶后,各国学者陆续发现细菌、放线菌、真菌,甚至病毒等分属46个属近70个种的微生物均能分泌几丁质酶(见表1)[4,9]。此外,海洋微生物也蕴藏着巨大的潜力,诸如珊瑚、嗜冷菌(Moritellamarina)、海洋链霉菌(Streptomycesolivaceus)FXJ7.023、白孢链霉菌(Streptomycesalbosporeus)及蜂房芽孢杆菌(Bacilluspluton)等海洋微生物都表现出极强的几丁质酶分泌能力[10-12]。而芽孢杆菌属(Bacillus sp.)中的苏云金芽孢杆菌(Bacillus thuringiensis)、环状芽孢杆菌(Bacilluscirculans)及枯草芽孢杆菌(Bacillussubtilis)等更是目前研究运用比较多的几丁质酶来源微生物;坚信随着研究深入,大量的微生物几丁质酶将被运用到环境保护、医药、农业及食品加工等领域。

表1 常见几丁质酶来源微生物Table 1 Microorganism s of sources of common chitinase
2 微生物几丁质酶的发酵条件
几丁质酶来源微生物类群很多,涵盖了46个属近70个种,菌种及菌株差异会导致发酵制备几丁质酶的条件各不相同,但大多微生物几丁质酶都是诱导酶,只在几丁质或几丁质衍生物等底物诱导下才合成可分泌到胞外的几丁质酶[13]。此外,微生物发酵分泌几丁质酶时易受碳氮源种类,温度、pH值、金属离子及有机溶剂等因素影响。相关研究证实,微生物法制备几丁质酶的最适温度一般在28~30℃,最适pH值介于5.0~9.0之间,底物浓度一般为1.5%~2.0%,单糖葡萄糖及N-乙酰氨基葡萄糖(N-acetyl-D-glucosamine,NAG)与阿洛氨菌素(allosam idin)等化合物对产酶有阻遏作用,金属离子对几丁质酶活性也有较大影响,但上述影响因素在作用时存在明显菌株差异[13-14]。
国内外相关研究报道证实,不同菌株在发酵条件及抑制因素等方面也存在较大差异。郝之奎等[15]在慢生根瘤菌科芽生杆菌属(Bradyrhizobiaceaeblastobacter)菌株SYBC-H2发酵分泌几丁质酶的研究中证实,几丁质是诱导几丁质酶合成并分泌的关键,玉米浆与几丁质的产酶交互作用较好,能有效提高酶活性(5.70 U/m L),而葡萄糖与几丁质的交互作用不明显,在一定程度上起抑制作用。RISHAD K S等[16]在短小芽孢杆菌(Bacilluspum ilus)MCB-7产几丁质酶条件优化过程中证实,碳氮源种类、温度、pH值、金属离子及有机溶剂等因素均能影响该菌株的酶产量与活性,而几丁质、蛋白胨及发酵液pH值是决定酶产量及活性的关键,经Box-Behnken试验优化后,菌株B.pum ilus MCB-7的酶活达23.19 U/m L,比未优化前(3.36 U/m L)提高近7倍。另外,诱变育种也是提高几丁质酶产量及活性的有效途径,胡基华等[17]通过NaNO2、紫外和复合诱变等方法对粘质沙雷氏菌(Serratiamarcescens)S68进行诱变育种并分离到高活性突变株CM 5,与原始菌株相比其几丁质酶活性提高了4.3倍。相关研究表明[18,26],Na+、K+、Mg2+、Ca2+、Mn2+等金属离子对几丁质酶活性有促进作用,而Hg2+、Ag2+、Cu2+、Fe2+、Zn2+、Co2+及Pb2+等金属离子对酶活却起到抑制作用,但存在菌株差异。Mg2+和Ca2+能有效提升芽孢杆菌属(Bacillus sp.)菌株R2由来几丁质酶活性,而能有效提高气单胞菌属(Aeromonas sp.)由来几丁质酶活性的金属离子则是Mn2+和Mg2+,重金属离子Hg2+、Ag2+及Pb2+等对上述菌株由来几丁质酶活性的抑制作用极强。此外,相关报道表明菌种及菌株差异也会影响几丁质酶活性,SUZUKIS等[19]在用几丁质酶18家族抑制剂阿洛氨菌素对6株链霉菌属(Streptomyces sp.)细菌的产酶抑制研究中发现,大多18家族的微生物几丁质酶会被阿洛氨菌素抑制,但链霉菌属的实验菌株因含chi65基因而未被抑制。
3 微生物几丁质酶的分离纯化
为开发微生物几丁质酶潜在的市场价值,实现标准化及规模化生产,探索快速而有效的制备与分离纯化体系就成了微生物几丁质酶开发运用的关键。目前,微生物几丁质酶常用的分离纯化方法有超滤、离心、盐析、层析凝胶过滤及电泳等方法,为尽量降低酶活损失,提高纯度及回收率,在分离纯化时往往会综合考虑运用上述分离纯化方法。即首先用盐析等方法对粗酶液进行浓缩,然后再用DEAE纤维素层析及葡聚糖凝胶(Sephadex G-100柱)层析等方法纯化粗酶,最后经十二烷基硫酸钠(sodium dodecylsulfate,SDS)-聚丙烯酰胺凝胶电泳(polyacrylamidegelelectrophoresis,PAGE)分离即可得到纯度高且活性较强的几丁质酶。KARTHIK N等[20]首先用60%(NH4)2SO4沉淀法浓缩几丁质酶粗酶液,接着依次用DEAE阴离子交换层析及高分子凝胶渗透层析法纯化粗酶,用SDS-PAGE分离初步纯化的几丁质酶,然后再用上述两种层析法进一步纯化,并最终通过几丁质酶谱法与等电点测定相结合的体系,分离到链霉菌(Streptomyces sp.)由来且具有抗真菌活性的酸性几丁质酶。后续研究表明,该酶分子质量为40 ku,在温度为50℃时,该酶在pH值2~10范围内均表现出活性,pH值2~6的酸性环境中酶活最高(61.3U/mg)且能在室温下长时间维持活性并表现出极强的抗真菌活性[20]。
4 微生物几丁质酶的酶学性质
4.1 微生物几丁质酶的分类
微生物几丁质酶来源广泛,加之粘质沙雷氏菌(Serratia marcescens)QMB1466等产酶菌株能同时产生多种分子质量不同的几丁质酶(21 ku、36 ku、48 ku、52 ku及57 ku)[21],因而微生物几丁质酶种类繁多,但仍能根据其结构特点,作用位点,最适pH值等特性将之分类。(1)根据微生物几丁质酶氨基酸序列的同源性差异,可将微生物来源几丁质酶分为糖苷水解酶18和19家族,而微生物几丁质酶大多属于18家族[22]。(2)按微生物几丁质酶对底物寡糖链酶切方式及终产物差异可分为外切几丁质酶和内切几丁质酶[23];外切几丁质酶能与底物非还原端结合,然后依次切开糖苷键得到单糖;内切几丁质酶则与底物随机结合并切开相应糖苷键,得到几丁寡糖和几丁二糖。(3)根据微生物几丁质酶催化反应最适pH值不同,可将其分为酸性、中性和碱性几丁质酶,但大多微生物几丁质酶是酸性酶[24]。(4)根据微生物几丁质酶分泌性质不同,可将之分为胞外酶与胞内酶,大部分微生物都能产生胞外酶,又因胞外酶较容易提取制备,所以目前研究和应用较多的微生物几丁质酶均属于胞外酶。
4.2 微生物几丁质酶的理化性质
微生物几丁质酶是一大类复杂多样的糖苷水解酶,分子质量介于10~100 ku之间,具有活性且较稳定的pH值介于3~10之间,最适pH值大多介于4~7之间,等电点(isoelectric point,p I)介于3.6~8.6之间,在4~60℃范围内均有活性,而40~50℃是酶活最高的温度区间(见表2),低温较稳定,-20℃冻存两年以上仍能保持较高活性[25-26]。此外,微生物几丁质酶活性还易受金属离子、化学试剂、有机溶剂及培养时间等因素影响。CHEBA BA等[27]发现,芽孢杆菌属(Bacillus sp.)R2来源几丁质酶的分子质量为41.68 ku,最适温度为40℃,pH值7.5,Mg2+、Ca2+及1%SDS等因素能有效提升其活性,而Cu2+、Fe2+、Zn2+、Ag+、Hg2+及化学试剂乙二胺四乙酸(ethylene diamine tetraacetie acid,EDTA),N-乙酰葡萄糖胺和有机溶剂乙醇及丙酮等则能抑制其活性。

表2 部分微生物几丁质酶的酶学性质Table 2 Enzymatic properties of some m icrobial chitinase
4.3 微生物几丁质酶的分子生物学研究
4.3.1 微生物几丁质酶多样性
微生物几丁质酶大多属于诱导酶,为利用环境中几丁质,微生物在长期进化进程中逐渐形成了分解利用环境中不同衍生类型几丁质的酶,因而几丁质酶的类型及编码基因会随菌种及菌株差异而发生变化,甚至同一菌株产生的几丁质酶也存在显著差异。TAKESHIT等[28]在分析耕地土壤微生物几丁质酶基因时发现,土壤类型及其pH值是决定土壤微生物几丁质酶基因类型和种类的关键,根据其预测的几丁质酶氨基酸序列分析结果发现,501个耕地土壤微生物几丁质酶被分为9个类群,与现有已知几丁质酶比较,差异显著,同源性仅介于40%~70%之间。粘质沙雷氏菌(Serratiamarcescens)MB1466的5种几丁质酶由不同基因编码及橄榄绿链霉菌(Streptomyces olivaceoviridis)ATCC 11238可由相同基因编码的前体酶蛋白经不同方式剪切形成同源性小,差异较大的5种几丁质酶则进一步说明微生物几丁质酶的多样性[21,29]。
4.3.2 微生物几丁质酶的基因结构
几丁质酶作用机理与生态学意义是现阶段研究的热点之一,随着分子生物学的迅猛发展,人们开始从微观领域来阐明几丁质酶在各应用领域的分子机理及生态学意义。一般说来微生物几丁质酶从氨基端到羧基端依次含有决定几丁质酶是否分泌到胞外的信号肽(signalpeptide,SP),起真正催化水解作用的几丁质酶催化域(catalytic domain,CHC),与几丁质结合并显著提升催化效率的几丁质结合域(chitin binding domain,CBD)及一个位于C末端可能与分泌相关的插入序列[30]。但产酶微生物种类及菌株差异会导致微生物几丁质酶及其结构域存在一定差异,如埃博拉病毒、丙型肝炎病毒及登革热病毒等病毒不具备完整几丁质酶但含有几丁质结合域并参与致病[4],哈维氏弧菌(Vibrio harveyi)由来几丁质酶则主要包含了N-末端信号肽(SP),由137个氨基酸残基组成,富含β折叠股的几丁质结合域(ChBDVhChiA),428个氨基酸残基折叠成含(α/β)8复杂结构的提姆-桶(TIM-barrel)催化域(catalytic domain,CatD)及由86个氨基酸残基折叠成的较短且可区分几丁质酶不同亚类的(α+β)-折叠插入域(α+β-fold insertion domain)等四个区域(见图1)[31]。FERRANDON S等[32]在研究环状芽孢杆菌(Bacilluscirculans)由来几丁质酶时发现,几丁质结合域中含有高度保守的色氨酸和脯氨酸(Trp687,Pro689,Pro693),其中687位的色氨酸(Trp687)是该结构域的活性中心;位于几丁质酶催化域表面的色氨酸(Trp122,Trp134)是引导几丁质进入催化活性中心裂隙的功能位点,而天冬胺酸和谷氨酸(Asp200,Glu204)是催化域中催化水解几丁质的活性中心;而相关研究表明纤连蛋白III型结构域(FnⅢ)在部分产几丁质酶细菌中可能跟致病性相关[4]。
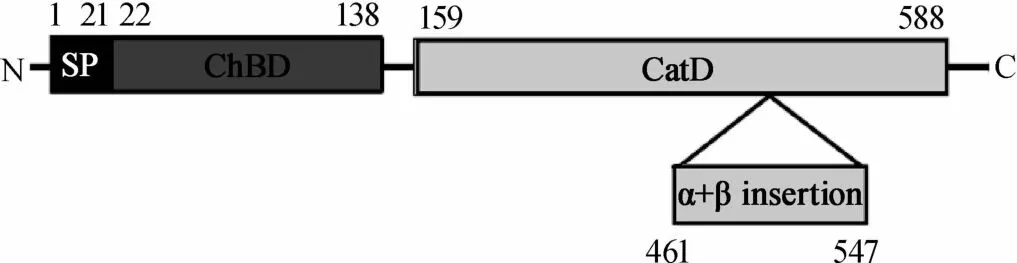
图1 哈维氏弧菌几丁质酶的一级结构Fig.1 Prim ary structure of chitinase from Vibrio harveyi
4.3.3 微生物几丁质酶基因的表达调控
除苏云金芽孢杆菌(Bacillus thuringiensis)等少数种属菌株的几丁质酶表达兼具组成型和诱导型特点外,微生物几丁质酶大多属于诱导酶,当外界环境中存在诱导底物时,几丁质酶合成微生物能经过N-乙酰葡糖胺磷酸转移酶系统(N-acetylglucosamine phosphotransferase system,PTS),三磷酸腺苷(adenosine triphosphate,ATP)结合盒转运子(ATP-binding cassette,ABC)及主要协助转运蛋白超家族(major facilitator superfamily,MFS)类转运蛋白NagP等转运系统将几丁质降解产物几丁寡糖或单体转运到细胞内部,产生特定信号调控几丁质酶相关基因的转录与表达,因而微生物几丁质酶基因的表达调控可从转运系统和基因表达两个层面进行调控[33-34]。
COLSON S等[33]在研究菌株天蓝色链霉菌(Streptomyces coelicolor)几丁质酶基因调控时发现,几丁二糖被ABC转运系统转运时会诱导产生几丁质酶,但ABC转运系统会受到全局性调节因子DasR的阻遏调控;当几丁单糖被PTS转运系统转运时,转运蛋白DasA则能通过与双组份调节系统ChiS/ChiR中的感受器ChiS外部结构域结合,抑制几丁质酶基因表达。糖催化特异性蛋白酶Ⅱ(EⅡ)是大肠杆菌PTS转运系统中的关键,因为不论是转运几丁单糖PTS系统中编码EⅡ的nagE-BACD操纵子,还是转运几丁二糖PTS系统中编码EⅡ的chb-BCARFG操纵子均受调节因子NagC和cAMP受体蛋白-降解物激活蛋白(catabolite activator proteins,CAP)的调控,而chb操纵子还会受到自身基因chb-R产物ChbR的调控,当NagC及ChbR与相应操纵位点结合后可起到阻遏作用,而cAMP/CAP则可增强阻遏作用,进一步抑制PTS系统的转运;此时,一旦受到6-磷酸-N-乙酰氨基葡萄糖的诱导,该阻遏作用就会消除[35]。
5 微生物几丁质酶的应用
随着研究深入,微生物几丁质酶在生产及生活中的应用越来越受关注,加之其来源广,易培养等特性,使微生物几丁质酶被广泛运用在生物防治、环境保护、医药、农业及食品加工等领域[16]。
5.1 微生物几丁质酶的生物防控作用
微生物几丁质酶生物防控作用主要体现在植物真菌及害虫性病害与蚊媒传播人畜共患病的预防等方面。相关研究发现木霉菌由来几丁质酶对根霉等真菌细胞壁有降解作用,植物真菌感染及害虫性病害与蚊媒传播人畜共患病防治时,则因微生物几丁质酶对杀虫剂的增效作用而得到有效控制。KOBAYASHID Y等[36]成功证实嗜麦芽寡养单胞菌(Stenotrophomonasmaltophilia)34S1由来几丁质酶是生物防治真菌感染导致草坪夏季斑枯病的关键。此外,SEODJ等[37]在类芽孢杆菌(Paenibacillusehimensis)MA2012由来几丁质酶体外抗真菌实验中发现,初步纯化的类芽孢杆菌MA2012的几丁质酶对引起经济林果实腐烂,造成严重经济损失的胶孢炭疽菌(Collectotrichum gloeosporioides)的孢子萌发有较强抑制作用,其抑制率可高达87%以上。而苏云金芽孢杆菌以色列亚种(Bacillus thuringiensis subsp. israelensis)IPS78和苏云金芽孢杆菌鲇泽亚种(Bacillus thuringiensis subsp.aizawai)HD133由来几丁质酶则能通过破坏虫体内富含几丁质且起到抵御细菌和病毒入侵屏障-肠围食膜的机制,发挥杀虫增效作用,从而达到防治植物海灰翅夜蛾及小菜蛾害虫,预防及控制埃及伊蚊所致蚊媒传播人畜共患病的目的[38]。
5.2 微生物几丁质酶及分解产物在医学上的应用
微生物几丁质酶与抗真菌药物联用,可预防不同类型真菌感染,而几丁质经几丁质酶降解后的N-乙酰几丁寡糖和壳聚几丁寡糖等产物具备抗肿瘤、抗感染及防治疟疾等多种生理功能[39]。几丁质降解产物几丁六糖和壳六糖在ddY鼠抗肿瘤实验中证实,注射剂量为100mg/(kg·d),连续注射3次后,几丁六糖和壳六糖对S180肉瘤的抑制率可达85%和93%,注射5次后几乎可完全抑制肿瘤生长[40];而几丁六糖则在促进BALB/C鼠PEC(腹膜腔渗出细胞)活性氧生成,增强杀菌作用,发挥抗感染方面表现出巨大潜力[41]。REBECCA C L等[42]通过敲除恶性疟原虫(Plasmodium falcarum)几丁质酶基因(PbCHT1)的研究证实,几丁质酶是恶性疟原虫感染按蚊中肠的关键,针对恶性疟原虫几丁质酶PbCHT1表面抗原决定簇的单克隆抗体1C3能有效抑制疟原虫对按蚊的侵染,从而利于控制疟疾的传播与感染。另外,人体肠道正常菌群也具有分泌几丁质酶,并通过分解几丁质产生N-乙酰几丁寡糖和壳聚几丁寡糖等降解产物的机制,发挥营养及增强机体免疫的功能[43]。
5.3 微生物几丁质酶在几丁质废弃物处理上的应用
在日常生活及工业生产活动过程中会产生蟹壳、虾壳等大量几丁质废弃物,这些废弃物会对水体等自然环境造成严重污染,为提高废弃物利用率,防止水体等环境被污染,产几丁质酶微生物就被大量用于几丁质废弃物处理[39]。相关报道表明,几丁质降解产物N-乙酰几丁寡糖和壳聚几丁寡糖等产物是良好的膳食纤维,有甜味适宜,吸湿性及保湿性强,能有效改善食品风味及品质,提升营养等特性;加之几丁质水解产物氨基糖寡糖素具有调节动植物细胞代谢的特性,使微生物几丁质酶在处理几丁质废弃物,提升食品、化妆品及饲料品质方面有巨大的开发应用前景[2]。而粘质沙雷氏菌(Serratiamarcescens)等几丁质酶产生菌已被广泛用于以蟹壳等几丁质废弃物为原料,分解制备高经济价值单细胞蛋白的食品工业,并表现出巨大的市场潜力[21]。
5.4 微生物几丁质酶在其他方面的应用
随着研究深入,几丁质酶除上述几个应用领域外,几丁质酶在基因工程、真菌性原生质体制备及提升菌株生物技术应用等领域表现出广阔的应用前景。相关研究表明,转入并成功表达微生物相关几丁质酶基因的转基因植物表现出极强的抗真菌感染能力与预防线虫及昆虫性病害的特性[39],几丁质酶在作用于黑曲霉(Aspergillusniger)细胞壁后,能有效从黑曲霉培养液中制备丹宁酸酶(反胶团萃取该酶回收率可高达43%)[44],而去除细胞壁的真菌原生质体则被广泛用于真菌细胞壁合成机理,酶合成分泌机理及生物技术应用方面的探究[45]。
6 结语与展望
综上所述,微生物几丁质酶是一类具有广阔应用前景的新型生物酶,能有效用于生物防治,医学应用,废弃物处理,环境保护及食品加工等领域。现阶段微生物几丁质酶的研究多集中在菌种选育及产酶条件等方面,加之几丁质酶结构及调控机理复杂,自然分离的酶活性不高,热稳定性差等因素,使微生物几丁质酶的应用及市场开发受到严重限制。坚信随着热稳定微生物几丁质酶分子结构、催化机理及其基因水平调控机理研究的深入,微生物几丁质酶将实现标准化的大规模生产,其应用领域将被进一步扩宽,市场发展前景也将越来越广阔。
[1]李美玉,曹洪玉,张庆芳,等.几丁质结合蛋白基因克隆、表达与纯化[J].中国酿造,2015,34(11):41-46.
[2]GOODAY GW.The ecology of chitin decomposition[J].T Brit M ycol Soc,1968,51(2):293-309.
[3]BENECKEU.Bacillus chitinovorous einen chitin zersetzenden Spaltpilz [J].Bot Ztg,1905,63(8):227-242.
[4]PATEL S,GOYAL A.Chitin and chitinase:Role in pathogenicity,allergenicity and health[J].Int JBiol M acrom ol,2017,1864(9):1253-1259. [5]ROSAM D,DISTEFANOG,ZORENA K,etal.Chitinasesand immunity: Ancestralmoleculeswith new functions[J].Immunobiology,2015,221 (3):399-411.
[6]MAJETIN V,KUMAR R.A review of chitin and chitosan applications [J].React Funct Polym,2000,46(1):1-27.
[7]THARANATHANRN,KITTURFS.Chitin-theundisputed biomolecule ofgreatpotential[J].Crit Rev Food Sci Nutr,2003,43(1):61-87.
[8]张新军,范丽卿,岳海梅,等.几丁质酶产生菌发酵条件初步研究[J].中国农学通报,2010,26(24):42-46.
[9]FUNKHOUSER JD,ARONSON N N.Chitinase fam ily GH18:evolutionary insights from the genom ic history of a diverse protein fam ily[J]. BMC Evol Biol,2007,7(1):1-16.
[10]DOUGLASN L,MULLEN K M,TALMAGE SC,etal.Exploring the role of chitinolytic enzymes in the sea fan coral,Gorgonia ventalina[J]. Mar Biol,2007,150(6):1137-1144.
[11]STEFANIDIE,VORGIASC E.Molecular analysis of the gene encoding a new chitinase from themarine psychrophilic bacterium Moritella marina and biochem ical characterization of the recombinantenzyme[J]. Extrem ophiles,2008,12(4):541-552.
[12]YUECW,LIY Y,LÜY H,etal.Isolation,expression and identification ofmultifunctional chitosanase from marine Streptomyces olivaceus FXJ7.023[J].China Biotechnol,2014,34(8):47-53.
[13]张圆.产几丁质酶菌株的筛选与酶学性质研究[D].哈尔滨:东北农业大学,2015.
[14]SONG Y S,SEO DJ,JUWT,et al.Enzymatic properties of chitinaseproducing antagonistic bacterium Paenibacillus chitinolyticus with varioussubstrates[J].M icrobial Pathogenesis,2015,89:195-200.
[15]郝之奎,杨美玲,张自英,等.一株几丁质酶产生菌的筛选及产酶条件优化[J].食品与生物技术学报,2015,34(11):1203-1211.
[16]RISHAD K S,REBELLO S,NATHAN V K,et al.Optim ised productionofchitinase from anovelmangrove isolate,Bacilluspum ilus MCB-7 using responsesurfacemethodology[J].Biocatal Agr Biotechnol,2016, 5:143-149.
[17]胡基华,陈静宇,曹旭,等.高产几丁质酶的粘质沙雷氏菌株的诱变选育[J].东北林业大学学报,2016,44(3):106-109.
[18]AHMADIK JA,YAZDIM T,NAJAFIM F,et al.Optim ization of medium and cultivation conditions for chitinase production by the newly isolated:Aeromonas sp.[J].Biotechnology,2008,7(2):266-272.
[19]SUZUKIS,NAKANISHIE,FURIHATA K,et al.Chitinase inhibitor allosam idin promotes chitinase production of Streptomyces generally [J].Int JBiol M acrom ol,2008,43(1):13-19.
[20]KARTHIK N,BINOD P,PANDEY A.Purification and characterisation of an acidic and antifungal chitinase produced by a Streptomyces sp.[J]. Bioresource Technol,2015,188(6):195-201.
[21]HARPSTERM H,DUNSMUIRP.Nucleotide sequenceof the chitinase B geneof Serratiamarcescens QMB1466[J].Nucleic Acids Res,1989, 17(13):5395-5395.
[22]FÜLÖP L,PONYI T.Classification of glycosyl hydrolases based on structuralhomology[J].JUniv Sci,2015,2(1):1-9.
[23]单立波,贾旭.几丁质酶及其在抗真菌病基因工程中的应用[J].生物工程进展,1998,18(3):37-39.
[24]韩放,李景鹏.植物几丁质酶的研究进展望[J].生物技术,2001,11(5):25-28.
[25]李丽,杨雪松,刘红全.微生物几丁质酶的特性及其应用的研究进展[J].广西民族大学学报:自然科学版,2011,17(1):92-96.
[26]CHEN L,CHEN JP,KUMARA,etal.Effectsof domainsmodification on the catalytic potential of chitinase from Pseudomonas aeruginosa[J]. Int JBiol M acrom ol,2015,78:266-272.
[27]CHEBA BA,ZAGHLOULT I,EL-MASSRYM H,etal.Effectofmetal ions,chemical agents,and organic solvent on Bacillus sp.R2 chitinase activity[J].Proced Technol,2016,22:465-470.
[28]TAKESHIT,SEISHII,CHIAKIN,etal.Molecular diversity of bacterial chitinases in arable soils and the effects of environmental factors on thechitinolytic bacterialcommunity[J].Soil Biol Biochem,2009,41(3): 473-480.
[29]LIH M,PLATTNER H,SCHIMZ K L,et al.Cloning,sequencing and heterologous expression of a new chitinase gene,chi92,from Streptomyces olivaceoviridis ATCC 11238[J].Biotechnol Lett,2000,22(15): 1203-1209.
[30]GABER Y,MEKASHA S,VAAJE-KOLSTAD G,et al.Characterization ofachitinase from the cellulolytic actinomycete Thermobifidafusca [J].BBA-Pro Proteom,2016,1864(9):1253-1259.
[31]SUGINTAW,SIRIMONTREEP,SRITHO N,etal.The chitin-binding domain of a GH-18 chitinase from Vibrio harveyi is crucial for chitinchitinase interactions[J].Intl J Biol M acrom ol,2016,93(PtA):1111-1117.
[32]FERRANDON S,STERZENBACH T,MERSHA F B,et al.A single surface tryptophan in the chitin-binding domain from Bacillus circulans chitinase A1 playsapivotal role in binding chitinand can bemodified to create an elutable affinity tag[J].BBA-Gen Subjects,2003,1621(1): 31-40.
[33]COLSON S,VANWEZELG P,CRAIGM,etal.The chitobiose-binding protein,DasA,actsasa link between chitin utilization andmorphogenesis in Streptomyces coelicolor[J].M icrobiology,2008,154(Pt 2): 373-382.
[34]BOULANGER A,D GUILLAUME,LAUTIER M,et al.Identification and regulation of the N-acetylglueosam ine utilization pathway of the plantpathogenic bacterium Xanthomonas campestris pv.Campestris[J]. J Bacteriol,2010,192(6):1487-1497.
[35]谢池楚,贾海云,陈月华.细菌几丁质酶基因的表达调控[J].遗传,2011,33(10):1029-1038.
[36]KOBAYASHID Y,REEDY R M,BICK J,etal.Characterization of a chitinase gene from Stenotrophomonasmaltophilia strain 34S1 and its involvement in biological control[J].App l Environ M icrobiol,2002, 68(3):1047-1054.
[37]SEOD J,LEE Y S,KIM K Y,etal.Antifungalactivity of chitinaseobtained from Paenibacillus ehimensis MA2012 against conidial of Collectotrichum gloeosporioides in vitro[J].M icrob Pathogenesis,2016, 96:10-14.
[38]LIU M,CAIQ X,LIU H Z,et al.Chitinolytic activities in Bacillus thuringiensis their synergistic effects on larvicidal activity[J].J Appl M icrobiol,2002,93(3):374-379.
[39]SINGH R A,GUPTA R D.Chitinases from bacteria to human:properties,applications,and future perspectives[J].Enzyme Res,2015,2015 (2):1-8.
[40]TAKIGUCHIY Y,SHIMAHARA K.Isolation and identification of a thermophilic bacterium producing N-diacetylchitobiose from chitin[J]. Agr Biol Chem,1989,53(6):1537-1541.
[41]STLEGER R J,JOSHIL,ROBERTSD.Ambient pH is amajor determinantin theexpression of cuticle-degrading enzymesand hydrophobin by Metarhizium anisopliae[J].App l Environ M icrobiol,1998,64(2): 709-713.
[42]REBECCA C L,VINETZ JM.Monoclonal antibody against the Plasmodium falcarum chitinase PfCHT1,recognizesaMalaria transmissionblocking epitope in Plasmodium gallinaceum ookinetesunrelated to the chitianse PgCHT1[J].Infect Immun,2002,70(3):1581-1590.
[43]李丽,杨雪松,刘红全.微生物几丁质酶的特性及其应用的研究进展[J].广西民族大学学报:自然科学版,2011,17(1):92-96.
[44]BARTHOMEUFC,REGERAT F,POURRAT H.Improvement in tannase recovery using enzymatic disruption ofmycelium in combination w ith reversem icellar enzyme extraction[J].Biotechnol Tech,1994,8 (2):137-142.
[45]VANAALTEN D M,KOMANDER D,SYNSTAD B,et al.Structural insights into the catalyticmechanism of a fam ily 18 exo-chitinase[J].P Natl Acad Sci USA,2001,98(16):8979-8984.
Research progressand application statusof microbial chitinase
GONG Fuming1,HECaimei2,TANGXiaoyan1,LIU Chenjian3*
(1.DepartmentofClinicalMedicine,Dehong VocationalCollege,Mangshi678400,China; 2.College ofChem istry and Bioengineering,Hezhou University,Hezhou 542899,China; 3.Faculty ofLife Science and Technology,Kunm ing University ofScience and Technology,Kunm ing 650500,China)
Chitinase isa kind of glucoside hydrolasewhich can catalyze chitin hydrolysis to N-acetylglucosamine oligomersormonomers,and w idely found inmicrobe(fungi,bacteria,actinomycetesand viruses),animalsand plants.Because of its special physiological function,chitinase isw idely used in biological control,medicalapplication,wastemanagement,environmentalprotection and other field.The source and classification,fermentation conditions,enzymology propertiesand applicationsofmicrobial chitinasewere summarized,in order to provide theoreticalguidance for further developmentand application of chitinase.
chitin;m icrobial chitinases;fermentation conditions;enzymatic property;application
Q939.99
0254-5071(2017)08-0020-06
10.11882/j.issn.0254-5071.2017.08.005
2017-04-13
云南省教育厅科学研究基金资助项目(2017ZZX109)
龚福明(1982-),男,讲师,硕士,研究方向为食品微生物与食品安全。
*通讯作者:柳陈坚(1968-),教授,博士,研究方向为应用微生物、食品营养与安全。

