沉默ski基因对大鼠星形胶质细胞活化增殖及Cyclin D1表达的影响①
赵鑫,郭永强,寇江力,丁宁,周开升,南伟,张海鸿
沉默ski基因对大鼠星形胶质细胞活化增殖及Cyclin D1表达的影响①
赵鑫1,2,郭永强1,2,寇江力1,2,丁宁1,2,周开升1,2,南伟1,2,张海鸿1
目的 研究ski基因对大鼠星形胶质细胞增殖的影响及其分子机制。方法 分离3日龄Sprague-Dawley大鼠脑皮质星形胶质细胞,体外培养。合成ski和阴性对照小干扰片段。设置ski-siRNA组、阴性对照组和空白对照组,采用脂质体法将特异性针对ski基因的siRNA和阴性对照siRNA转入ski-siRNA组、阴性对照组星形胶质细胞中。Western blotting分析ski、胶质纤维酸性蛋白(GFAP)和Cyclin D1蛋白表达;CCK8法检测星形胶质细胞增殖活力;流式细胞仪检测细胞周期。结果 ski-siRNA组星形胶质细胞ski蛋白表达明显降低(F=38.611,P<0.01),GFAP(F=7.547,P<0.05)和Cyclin D1蛋白(F=3.901,P<0.05)表达降低;培养12 h后,ski-siRNA组增殖活力明显降低(F>30.507,P<0.01),G1期细胞比例明显增加,S期明显减少(F>48.425,P<0.01)。结论 沉默ski基因可能通过下调Cyclin D1表达,抑制星形胶质细胞增殖。
ski;RNA干扰;增殖;星形胶质细胞;大鼠
ski基因是Stavnezer等[1]于1986年首次在感染病毒Bratislava77的鸡胚细胞中发现的。ski作为细胞内的一个原癌基因,在不同物种间和组织内分布极为广泛,参与并调节机体多种生理和病理过程[2-4]。本课题组已明确ski在正常脊髓组织和星形胶质细胞中表达很低,而在脊髓损伤和活化星形胶质细胞中表达逐渐增高,推测ski可能作为新型信号分子影响星形胶质细胞的增殖特性,进而调节致密胶质瘢痕的生成[5-7]。本研究采用RNA干扰技术,观察ski对大鼠星形胶质细胞增殖及其相关蛋白的影响。
1 材料与方法
1.1 实验动物和主要试剂
3日龄Sprague-Dawley大鼠,购于甘肃省中医药大学动物实验中心。
DMEM/F12培养基、胰蛋白酶:GIBCO公司。胎牛血清(FBS):PAN-BIOTECH GMBH公司。TritionX-100、SDS、小鼠抗大鼠及兔抗大鼠神经胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)多克隆抗体(G3893):SIGMA公司。RIPA裂解液和BCA蛋白定量检测试剂盒:碧云天公司。加兔抗大鼠ski多克隆抗体(H-329,sc-9140)、小鼠抗大鼠Cyclin D1多克隆抗体(A-12,sc-8396):SANTA CRUZ。ski干扰RNA及阴性对照:THERMOFISHER公司合成。Lipofectamine®RNAiMAX Reagent:THERMOFISHER 公司。小鼠抗大鼠β-actin单克隆抗体:PROTEINTECH公司。山羊抗小鼠lgG、FITC标记山羊抗兔lgG、PI、Rnase、山羊封闭血清、PVDF 膜(0.45 μm):SOLARBIO公司。辣根过氧化物酶标记山羊抗兔或抗小鼠lgG:北京中杉金桥公司。CCK8试剂盒:日本同仁化学公司。ECL试剂盒:MILLOPORE公司。
1.2 方法
1.2.1 原代大鼠星形胶质细胞的培养、纯化和鉴定
3日龄Sprague-Dawley乳鼠,提取大脑皮质星形胶质细胞,具体操作步骤参见文献[3,7]。
1.2.2 细胞纯度鉴定
将原代细胞接种到盖玻片上,贴壁后PBS洗涤,多聚甲醛固定30 min,PBS洗涤,TritionX-100通透20 min,PBS洗涤;滴加山羊封闭血清,37℃封闭30 min;吸净封闭液,勿洗,加入小鼠抗大鼠GFAP多克隆抗体(1∶300),玻片置于湿盒中,于4℃冰箱中孵育过夜。PBS洗涤,避光下加山羊抗小鼠lgG(1∶300),37℃温箱中避光孵育90 min,PBS洗涤,避光下附加DAPI,室温孵育20 min,PBS洗涤。各步PBS洗涤均为2遍。甘油封片。荧光显微镜下观察。阴性对照用PBS代替一抗。
在200倍视野下随机选取6个互不重叠的视野,计数GFAP阳性细胞数和总细胞数,阳性细胞数占总细胞数达96%以上的星形胶质细胞集落用于后续实验。
1.2.3 siRNA转染
转染前1 d,取纯化后呈对数生长期的星形胶质细胞,2×105/ml接种于6孔板。用含12%胎牛血清的DMEM/F12完全培养基培养过夜,待细胞汇合度为80%时,行siRNA转染,具体步骤按siRNA转染试剂盒说明书提供的方法。待细胞转染72 h后,倒置光学显微镜下观察细胞形态学变化,提取细胞总蛋白,Western blotting检测沉默效果。
siRNA转染效率的检测:将FITC-control-siRNA(终 浓 度 100 nmol/L)6 μl 与 siRNA Lipofectamine®RNAiMAX Reagent 8 μl混匀后,转染星形胶质细胞;12 h后在荧光显微镜下计数出现绿色荧光的细胞数。转染效率(%)=荧光细胞数/细胞总数×100%。
细胞分为3组:ski-siRNA组采用siRNA Lipofectamine®RNAiMAX Reagent将ski-siRNA转入星形胶质细胞,阴性对照组采用siRNA Lipofectamine®RNAiMAX Reagent将阴性对照-siRNA(negative control-siRNA,NC-siRNA)转入星形胶质细胞,空白对照组仅加入siRNALipofectamine®RNAiMAX Reagent。
ski-siRNA正义链序列为5'-GCC CUG AUU CGA GAC AGC UUC UAC U-3',反义链序列为5'-AGU AGA AGC UGU CUC GAA UCA GGG C-3';NC-siRNA正义链序列为5'-UUG UGG CCU GUU AGC UUC AGA GCG A-3',反义链序列为5'-UCG CUC UGA AGC UAACAG GCCACAA-3'。
1.2.4 Western blotting
收集转染72 h后各组细胞,用预冷PBS清洗细胞2遍,RIPA裂解液提取总蛋白,BCA试剂盒测定总蛋白浓度。10%SDS-PAGE电泳(浓缩胶90 V,分离胶120 V),将电泳分离的蛋白电转至甲醇浸透的PVDF膜上,5%脱脂奶粉室温封闭2 h,TBST(10 mmol/L Tris-HCI、150 mmol/L NaCI、0.5%Tween 20,pH=7.5)洗涤10 min,共3遍。加兔抗大鼠ski多克隆抗体(1∶100)、兔抗大鼠GFAP多克隆抗体(1∶2000)、小鼠抗大鼠Cyclin D1多克隆抗体(1∶500)、小鼠抗大鼠β-actin单克隆抗体(1∶5000),4℃冰箱过夜;TBST洗膜,方法同前;加辣根过氧化物标记的山羊抗兔或抗小鼠lgG(1∶5000),室温2 h;TBST洗膜3次,方法同前;滴加ECL发光液,GE凝胶成像系统测量目的条带的灰度值,计算目的蛋白与内参β-actin蛋白条带的相对灰度。
1.2.5 CCK8检测
收集转染72 h后各组星形胶质细胞,胰蛋白酶消化,调整为1×104/ml单细胞悬液,接种于96孔板内,每孔100 μl,各组均设5个复孔;96孔板周围加PBS液100 μl保持湿度。细胞培养箱(37℃、5%CO2)内培养。分别在细胞贴壁后0 h、6 h、12 h、24 h、48 h,向相应培养板中加入CCK8试剂,再将孔板重新放入培养箱培养,2 h后终止显色,酶联免疫检测仪上测量对应孔中细胞在450 mm波长处的吸光度值(OD)。
1.2.6 流式细胞仪分析
PBS洗涤各组星形胶质细胞,0.25%胰蛋白酶消化,PBS吹打制成细胞悬液。1000 r/min离心5 min,弃上清,预冷PBS洗涤2次;PBS 1 ml重悬,边震荡边滴入预冷的75%乙醇中,4℃冷藏过夜。重复洗涤和离心收集细胞2次,预冷PBS 1 ml重悬,加入EDTA 190 μl和 10 mg/ml RNase 10 μl,室温5 min,加入PI染液,4℃避光反应10 min,目筛过滤到上样管,上机检测细胞周期各阶段细胞数。
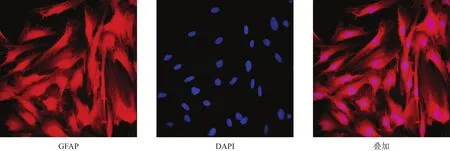
图1 星形胶质细胞纯度鉴定(GFAP免疫荧光染色,200×)
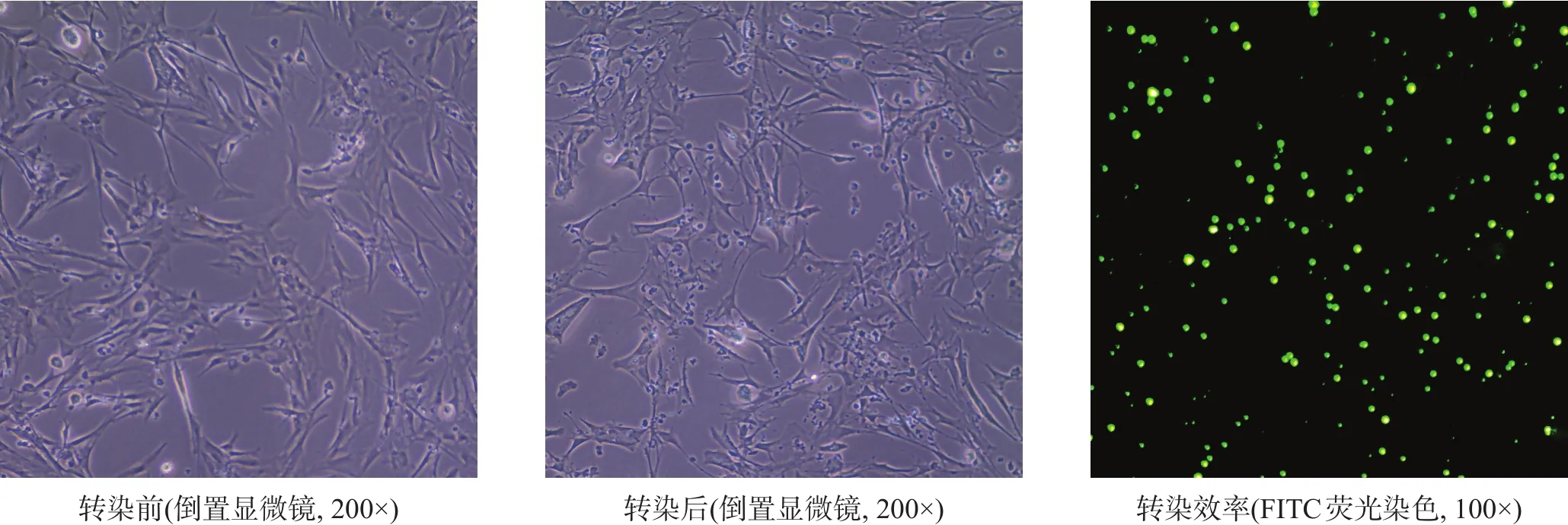
图2 转染前后细胞形态
1.3 统计学分析
采用SPSS 21.0统计软件进行分析。每组数据来自3次独立实验,以(xˉ±s)表示,采用单因素方差分析。显著性水平α=0.05。
2 结果
2.1 纯度鉴定
荧光显微镜下可见星形胶质细胞形态学特征,胞核呈圆形或椭圆形。阳性细胞数占总细胞数96%,符合设计要求。特异性标记抗原GFAP位红色荧光,DAPI标记细胞核为蓝色荧光,均清晰可辨(图1)。
2.2 转染后细胞形态
转染前,星形胶质细胞呈贴壁生长,可见细胞轮廓清晰,突起较多,胞突间交叉连接明显;胞体多数呈星状或不规则状,细胞核清晰,呈圆形或椭圆形,核仁明显可见,细胞胞膜完整;转染ski-siRNA 72 h后,可见星形胶质细胞体积较转染前增大,胞突增粗,但细胞集落减少,未贴壁细胞增多,细胞碎片增多。转染效率(86.71±4.18)%。见图2。
2.3 Western blotting
ski-siRNA组ski相对灰度(0.130±0.065),低于空白对照组(0.767±0.103)、NC-siRNA组(0.667±0.111)(F=38.611,P=0.001),NC-siRNA组与空白对照组之间无显著性差异(P=0.247)(图3)。
ski-siRNA组GFAP相对灰度(0.193±0.044),低于空白对照组(0.449±0.108)、NC-siRNA组(0.393±0.089)(F=7.547,P=0.023)(图3)。
ski-siRNA组Cyclin D1相对灰度(0.088±0.053),低于空白对照组(0.265±0.101)、NC-siRNA组(0.234±0.087)(F=3.901,P=0.023)。NC-siRNA组与空白对照组之间无显著性差异(P=0.666)(图3)。
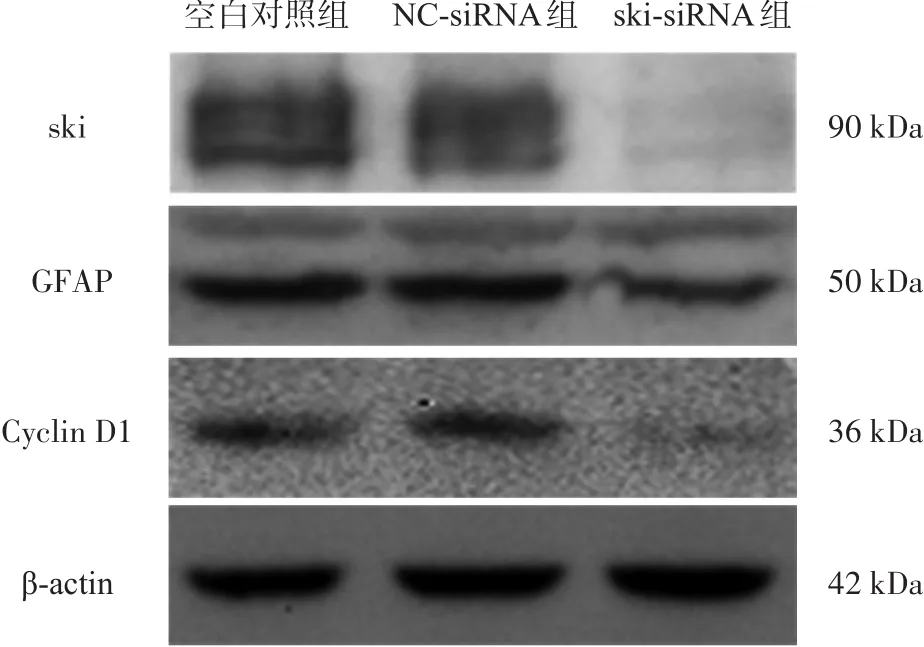
图3 Western blotting条带图
2.4 CCK-8
ski-siRNA组培养12 h后,OD值均明显低于空白对照组和NC-siRNA组(P<0.01)。见表1。
2.5 流式细胞仪分析
ski-siRNA组G1期细胞百分比为(79.62±1.04)%,明显高于空白对照组(71.02±1.53)%、NC-siRNA组(71.69±1.09)%(F=48.425,P=0.002);ski-siRNA组S期细胞百分比为(12.47±0.84)%,明显低于空白对照组(17.20±2.26)%、NC-siRNA组(16.87±1.69)%(F=83.343,P=0.001)。见图4。
3 讨论
ski作为进化保守蛋白,在不同物种中广泛参与并调节多种细胞的增殖及分化等过程[4]。研究表明,ski与多种细胞的增殖、分化、转化及肿瘤发生发展相关[9-11]。目前关于ski分子的调控研究主要集中在胚胎发育、组织创伤修复及对肿瘤细胞发生发展的调节等方面[4]。我们前期实验首次证实,ski在星形胶质细胞生物功能方面起一定作用[6-8]。
星形胶质细胞是中枢神经系统(central nervous system,CNS)中数量最多、分布最广的胶质细胞,对神经递质调节、内环境稳态、血脑屏障的维持起着重要作用[7,12-13]。活化星形胶质细胞增生早期可分泌某些神经元营养因子,对维持和促进神经元生长、发育、分化具有重要作用[14-15];晚期形成胶质瘢痕,可作为物理屏障,妨碍轴突的再生、延长[16-17]。胶质瘢痕的形成是影响CNS损伤后功能恢复的重要因素,而胶质瘢痕的形成与星形胶质细胞增殖特性密不可分。
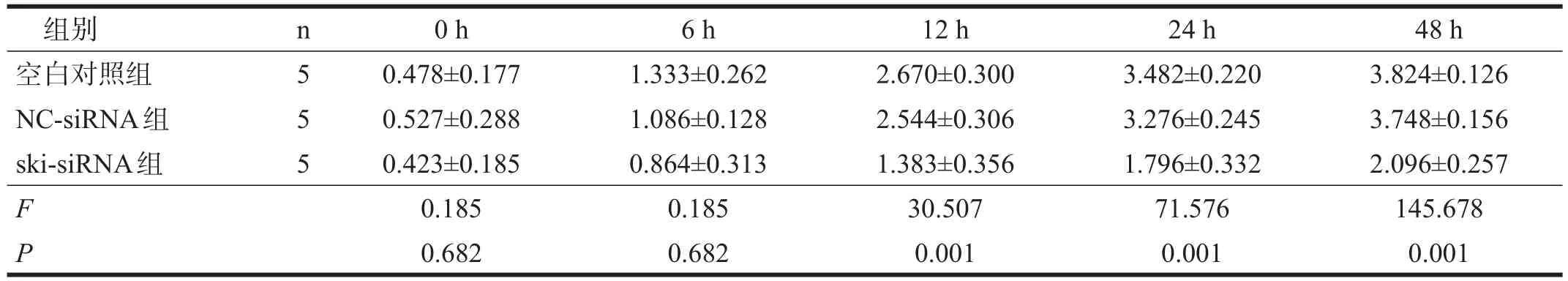
表1 各组星形胶质细胞增殖活力比较(OD)

图4 各组细胞周期G1期和S期百分比(流式细胞仪)
siRNA是一种高效、特异的基因沉默技术,能与目的基因mRNA的同源序列互补结合,使整条mRNA失去翻译成蛋白质的功能[18]。本研究采用siRNA技术,将特异针对ski序列的siRNA转染大鼠星形胶质细胞,Western blotting显示转染后星形胶质细胞ski基因成功沉默。沉默ski基因后,星形胶质细胞增殖能力明显被削弱,证明ski在促进星形胶质细胞增殖方面起重要作用。
此前研究显示,ski与GFAP之间存在一定的关联[6],而GFAP作为星形胶质细胞活化特有标志蛋白,参与星形胶质细胞生物学活性的调节,我们推测ski可能调控星形胶质细胞的生物学活性。本研究显示,ski-siRNA转染后,细胞GFAP表达水平与ski表达水平同时下调。结合CCK8结果,证实ski在星形胶质细胞活化、增殖等方面起重要作用。
细胞分裂中,从G1到S期的过渡是调节细胞周期的主要作用节点[19-20]。G1期细胞处于DNA合成阶段,尚未开始分裂,而S期细胞处于DNA复制合成和分裂阶段[21]。本研究表明,ski-siRNA组较多细胞停留于G1期,而S期细胞比例降低。
有研究指出[22-25],细胞周期G1期进程主要由D型Cyclin-Cdk4细胞周期调节子支配。本研究显示,沉默ski基因后,Cyclin D1表达显著下调。推测ski可能通过促进Cyclin D1的表达,调节星形胶质细胞DNA复制、合成与细胞分裂,进而促进星形胶质细胞增殖。
综上所述,采用ski-siRNA技术可以成功沉默ski基因;沉默ski基因后,星形胶质细胞活化增殖能力明显抑制,此作用可能通过下调Cyclin D1的表达实现。由于ski下游通路机制非常复杂,具体分子机制尚需进一步研究。
[1]Stavnezer E,Barkas AE,Brennan LA,et al.Transforming Sloan-Kettering viruses generated from the cloned v-ski oncogene by in vitro and in vivo recombinations[J].J Virol,1986,57(3):1073-1083.
[2]周开升,朱彦东,张海鸿,等.Ski在神经系统中的作用及机制的研究进展[J].中国康复理论与实践,2016,22(7):797-800.
[3]赵鑫,郭永强,王明,等.脂多糖对大鼠星形胶质细胞Ski蛋白表达的影响[J].中国康复理论与实践,2017,23(5):514-519.
[4]Bonnon C,Atanasoski S.c-Ski in health and disease[J].Cell Tissue Res,2012,347(1):51-64.
[5]周开升,朱彦东,赵鑫,等.Ski在大鼠脊髓损伤后不同时间的表达变化[J].中国康复理论与实践,2016,22(9):1015-1019.
[6]Zhou K,Nan W,Feng D,et al.Spatiotemporal expression of Ski after rat spinal cord injury[J].Neuroreport,2017,28(3):149-157.
[7]赵鑫,寇江力,郭永强.Ski在大鼠活化星型胶质细胞中表达的变化[J].中国病理生理杂志,2017,33(6):968-974.
[8]赵鑫,王兴文,寇江力,等.沉默ski基因对大鼠星形胶质细胞迁移的影响[J].中国康复理论与实践,2017,23(8):905-911.
[9]Atanasoski S,Notterpek L,Lee HY,et al.The protooncogene Ski controls Schwann cell proliferation and myelination[J].Neuron,2004,43(4):499-511.
[10]Ritter M,Kattmann D,Teichler S,et al.Inhibition of retinoic acid receptor signaling by Ski in acute myeloid leukemia[J].Leukemia,2006,20(3):437-443.
[11]Li J,Li P,Zhang Y,et al.c-Ski inhibits the proliferation of vascular smooth muscle cells via suppressing Smad3 signaling but stimulating p38 pathway[J].Cell Signal,2013,25(1):159-167.
[12]van Gijsel-Bonnello M,Baranger K,Benech P,et al.Metabolic changes and inflammation in cultured astrocytes from the 5xFAD mouse model of Alzheimer's disease:Alleviation by pantethine[J].PLoS One,2017,12(4):e0175369.
[13]Liu T,Xue CC,Shi YL,et al.Overexpression of mitofusin 2 inhibits reactive astrogliosis proliferation in vitro[J].Neurosci Lett,2014,579:24-29.
[14]Liu Z,Xin H,Chopp M.Reactive astrocytes promote axonal remodeling and neurological recovery after stroke[J].Neural Regen Res,2014,9(21):1874-1875.
[15]Hol EM,Pekny M.Glial fibrillary acidic protein(GFAP)and the astrocyte intermediate filament system in diseases of the central nervous system[J].Curr Opin Cell Biol,2015,32:121-130.
[16]Pekny M,Wilhelmsson U,Pekna M.The dual role of astrocyte activation and reactive gliosis[J].Neurosci Lett,2014,565:30-38.
[17]Sofroniew MV.Astrogliosis[J].Cold Spring Harb Perspect Biol,2014,7(2):a020420.
[18]Mohr SE,Smith JA,Shamu CE,et al.RNAi screening comes of age:improved techniques and complementary approaches[J].Nat Rev Mol Cell Biol,2014,15(9):591-600.
[19]Kim SJ,Kim JM,Shim SH,et al.Shikonin induces cell cycle arrest in human gastric cancer(AGS)by early growth response 1(Egr1)-mediated p21 gene expression [J].JEthnopharmacol,2014,151(3):1064-1071.
[20]Chen H,Xu X,Wang G,et al.CDK4 is degraded by APC/C in mitosis and reaccumulates in early G1 phase to initiate a new cell cycle in HeLa cells[J].J Biol Chem,2017,292:10131-10141.
[21]Schafer KA.The cell cycle:a review[J].Vet Pathol,1998,35(6):461-478.
[22]Godínez-Palma SK,Rosas-Bringas FR,Rosas-Bringas OG,et al.Two maize Kip-related proteins differentially interact with,inhibit and are phosphorylated by cyclin D-cyclin-dependent kinase complexes[J].J Exp Bot,2017,68(7):1585-1597.
[23]Godínez-Palma SK,García E,Sánchez ML,et al.Complexes of D-type cyclins with CDKs during maize germination[J].J Exp Bot,2013,64(18):5661-5671.
[24]Zhang Q,Sakamoto K,Wagner KU.D-type Cyclins are important downstream effectors of cytokine signaling that regulate the proliferation of normal and neoplastic mammary epithelial cells[J].Mol Cell Endocrinol,2014,382(1):583-592.
[25]de la Cruz JF,Vergara EJ,Cho Y,et al.Glehnia littoralis root extract induces G0/G1 phase cell cycle arrest in the MCF-7 human breast cancer cell line[J].Asian Pac J Cancer Prev,2015,16(18):8113-8117.
Effects of Knocking Down ski on Proliferation ofAstrocytes and Expression of Cyclin D1 in Rats
ZHAO Xin1,2,GUO Yong-qiang1,2,KOU Jiang-li1,2,DING Ning1,2,ZHOU Kai-sheng1,2,NAN Wei1,2,ZHANG Hai-hong1
1.Department of Orthopedics,Second Clinical Medical College of Lanzhou University,Lanzhou,Gansu 730030,China;2.Key Laboratory of Orthopedics of Gansu Province,Lanzhou,Gansu 730030,China
ZHANG Hai-hong.E-mail:zhanghaihong1968@sina.com
Objective To investigate the role of ski in proliferation of astrocytes and the molecular mechanisms in rats.Methods Astrocytes were obtained from cerebral cortex of a three-day old rat and cultured in vitro.siRNA targeted to ski and negative control sequences were prepared.The astrocytes were divided into ski-siRNA group,siRNA negative control group and untreated control group,while the specific siRNA targeting ski negative control sequences were transfected into astrocytes with Lipofectamine®RNAiMAX Reagent.The protein levels of ski,glial fibrillary acidic protein(GFAP)and Cyclin D1 were determined with Western blotting.The proliferation of astrocytes were measured with CCK8 assay.The cell-cycle of astrocytes were analyzed with flow cytometer.Results The protein level of ski(F=38.611,P<0.01),GFAP(F=7.547,P<0.05)and Cyclin D1(F=3.901,P<0.05)reduced in ski-siRNA group,the proliferation of astrocyte was significantly inhibited since twelve hours after culture(F>30.507,P<0.01),and less cells were in S phase and more in G1/G0 phase(F>48.425,P<0.01),compared with the control groups.Conclusion ski knocking down by siRNAsignificantly inhibits the proliferation of astrocytes,which may associate with the down-regulation of Cyclin D1 expression.
ski;small interfering RNA;proliferation;astrocyte;rats
R338.2
A
1006-9771(2017)09-1032-05
2017-05-25
2017-06-22)
10.3969/j.issn.1006-9771.2017.09.009
[本文著录格式] 赵鑫,郭永强,寇江力,等.沉默ski基因对大鼠星形胶质细胞活化增殖及Cyclin D1表达的影响[J].中国康复理论与实践,2017,23(9):1032-1036.
CITED AS:Zhao X,Guo YQ,Kou JL,et al.Effects of knocking down ski on proliferation of astrocytes and expression of Cyclin D1 in rats[J].Zhongguo Kangfu Lilun Yu Shijian,2017,23(9):1032-1036.
1.国家自然科学基金项目(No.30772299);2.兰州大学第二医院科研基金项目(No.sdkyjj-04)。
1.兰州大学第二医院骨科,甘肃兰州市730030;2.甘肃省骨关节疾病研究重点实验室,甘肃兰州市730030。作者简介:赵鑫(1991-),男,汉族,山东潍坊市人,硕士研究生,主要研究方向:脊柱脊髓损伤。通讯作者:张海鸿,主任医师,副教授,硕士研究生导师,主要研究方向:脊柱外科。E-mail:zhanghaihong1968@sina.com。

