生物法合成双乙酰的研究进展
崔真真,毛雨丰,陈 聪,袁倩倩,王智文,陈 涛
(1.天津大学 化工学院教育部系统生物工程重点实验室,天津 300345;2.天津化学化工协同创新中心,天津 300345;3.中国科学院天津工业生物技术研究所中国科学院系统微生物技术重点实验室,天津 300308)
生物法合成双乙酰的研究进展
崔真真1,2,毛雨丰1,2,陈 聪1,2,袁倩倩3,王智文1,2,陈 涛1,2
(1.天津大学 化工学院教育部系统生物工程重点实验室,天津 300345;2.天津化学化工协同创新中心,天津 300345;3.中国科学院天津工业生物技术研究所中国科学院系统微生物技术重点实验室,天津 300308)
随着对双乙酰生物合成途径的深入研究,利用代谢工程的方法定向改良菌株,优化双乙酰的代谢途径,成为提高双乙酰生产水平的新思路。本文总结了双乙酰的生产菌株和相关代谢途径,综述了改造双乙酰生产菌株的代谢工程策略,提出了未来的研究方向。
双乙酰;生物法;代谢工程
双乙酰(diacetyl),又称2,3-丁二酮,广泛存在于天然植物中,如:郁金香、草莓和薰衣草等,同时也存在于酸奶、食醋和啤酒等发酵产品中。双乙酰常作为食品添加剂来提高黄油口味,它同3-羟基-2-丁酮(乙偶姻)一样,在食品安全国家标准/食品添加剂使用标准GB2760—2011中列为允许使用的食品用合成香料;双乙酰还可作为干酪和糖果的增白剂、明胶的硬化剂以及用于合成医药、农药和精细化学品的中间体[1]。
双乙酰的合成方法主要有提取法、化学法和生物法,练敏等[2]对其合成方法进行了比较详尽地综述。提取法制备双乙酰的成本高、效益低,而化学法有污染重、工艺复杂且生产的双乙酰难以达到食品级的安全要求等问题。生物法制备双乙酰具有安全、环保等特点,能够有效减少资源和环境压力,因此,国内外研究者对应用生物法生产双乙酰进行了广泛的研究[3-7]。随着现代生物技术的发展,人们对微生物生理机能和代谢途径有了更加深入的认识,应用生物法生产双乙酰在经济、技术和安全性上都具有可行性。本文中,笔者综述了国内外利用微生物发酵生产双乙酰的研究现状,简述了双乙酰的生产菌株和相关途径,重点介绍利用代谢工程的原理和方法对双乙酰生产菌株的代谢网络进行设计和改造的策略,并对未来的研究方向进行展望。
1 双乙酰的生产菌株及代谢途径
自然界中存在很多能够天然代谢生产双乙酰的微生物,如乳酸菌属(Lactobacilus)、芽孢杆菌属(Bacillus)、肠杆菌属(Enterobacter)以及酵母(yeast)等[8],主要生产菌株及其研究水平如表1所列。生产双乙酰的菌株主要包括乳酸菌[9]、乳酸乳球菌[10-11]、阴沟肠杆菌[12]和乳链球菌[8,13]。乳酸菌等利用柠檬酸生产双乙酰,柠檬酸在转变为丙酮酸的过程中没有还原力的产生,抑制了依赖于还原力的反应的发生,因此可减少副产物的生成[14-16],能大量积累丙酮酸;但只以柠檬酸为底物时,菌体生长慢,产量低。近来,研究人员开始运用代谢工程方法改造微生物以葡萄糖为底物生产双乙酰,如Candida glabrata[5]、Escherichia coli[17]和 Bacillus subtilis[18]等。目前报道的双乙酰产量最高的菌株是B.subtilis,在分批补料发酵中,双乙酰产量可达8.69 g/L,但得率不理想,仅为 26%(以 1 mol葡萄糖计)。Liu等[7]利用 L.lactis代谢工程合成双乙酰,得率高达87%(即最大理论得率的87%)。
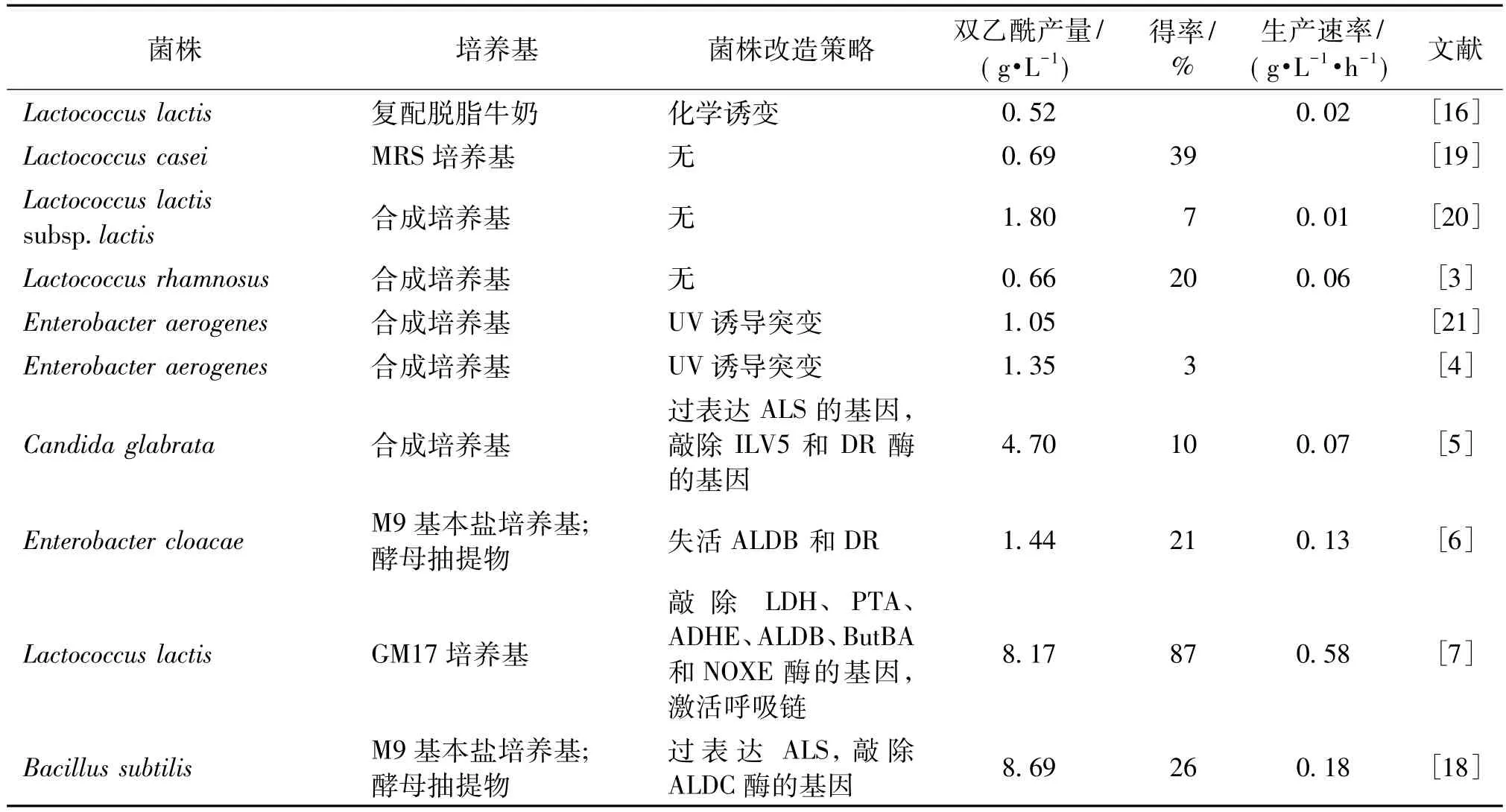
表1 双乙酰的生产菌株及其研究水平Table 1 Strains for diacetyl production and research level
双乙酰合成途径如图1所示。由图1可知:当以柠檬酸为底物时,柠檬酸在柠檬酸裂解酶的作用下裂解为草酰乙酸和乙酸,其中乙酸分泌到胞外,草酰乙酸在草酰乙酸脱羧酶的作用下脱羧形成丙酮酸。丙酮酸再经过脱羧反应生成2-羟乙基-硫胺素焦磷酸(HETPP),然后HETPP与丙酮酸反应形成α-乙酰乳酸。α-乙酰乳酸经过非酶催化脱羧(nonenzymatic decarboxylation,NOD)生成双乙酰,同时此途径中会有乙偶姻和2,3-丁二醇等副产物的产生。以葡萄糖为底物时,葡萄糖经过糖酵解途径生成重要的代谢中间产物丙酮酸,丙酮酸在α-乙酰乳酸合成酶的催化下生成α-乙酰乳酸,然后α-乙酰乳酸在酸性条件下经过非酶氧化脱羧生成双乙酰。在此代谢途径中伴有副产物甲酸、乳酸、乙酸、乙醇、乙偶姻和2,3-丁二醇的产生。其中,由丙酮酸生成α-乙酰乳酸和双乙酰的途径存在争论,以下综述α-乙酰乳酸合成途径和双乙酰合成途径。
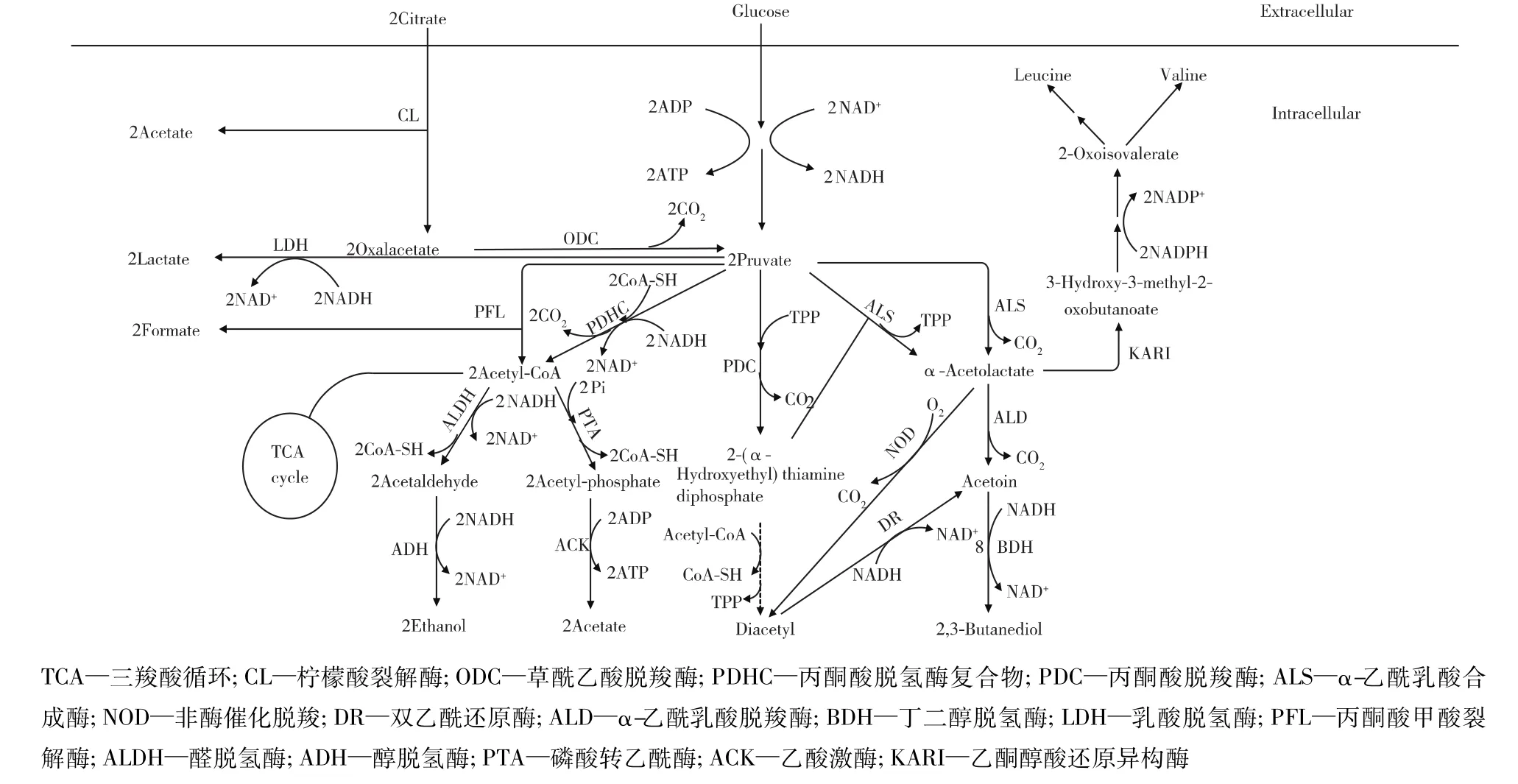
图1 双乙酰的生物合成途径Fig.1 The diacetyl biosynthetic pathway
1.1 α-乙酰乳酸的合成途径
丙酮酸可能通过这两条途径合成α-乙酰乳酸:1)2分子丙酮酸在硫胺素焦磷酸(TPP)和Mg2+的存在下,经α-乙酰乳酸合成酶催化缩合成1分子α-乙酰乳酸,并释放出1分子CO2[22];2)丙酮酸在TPP存在下经丙酮酸脱羧酶催化,生成1分子HETPP(有些研究者又称乙醛-TPP),并释放出 1分子CO2,1分子HETPP和1分子丙酮酸在α-乙酰乳酸合成酶的作用下合成 1分子 α-乙酰乳酸。但BRENDA 数据库(http://brenda-enzymes.org/)中并没有确切的数据支持第2个观点。此外,有研究表明,L.lactis subsp.lactis bv.diacetylactis的 α-乙酰乳酸合成酶并不具有催化HETPP和丙酮酸生成α-乙酰乳酸的活性[23]。因此,α-乙酰乳酸合成酶被认为是合成α-乙酰乳酸的关键酶。
1.2 双乙酰合成途径
现在研究报道的双乙酰合成途径有两条:第一条途径为丙酮酸合成α-乙酰乳酸后,α-乙酰乳酸经过NOD合成双乙酰,这个观点已经被证实[24],且在很多菌中发现存在这条途径[25-27]。第二条途径为丙酮酸生成的HETPP复合体可与乙酰-CoA在双乙酰合成酶的作用下生成双乙酰[13,28],但至今未发现双乙酰合成酶的存在[29]。近年来,越来越多的研究表明,NOD反应是生成双乙酰主要途径[5-7]。
2 生物法合成双乙酰的改造策略
目前,生物法合成双乙酰,主要是以柠檬酸盐或葡萄糖为底物进行微生物发酵。双乙酰的代谢途径如图1所示,由图1可知:增大双乙酰合成途径的代谢通量,阻断双乙酰还原为乙偶姻和2,3-丁二醇的途径,失活双乙酰竞争途径相关基因是构建双乙酰高产菌株的可行策略。同时,通过调节辅因子解决细胞内还原力过剩的问题,并结合发酵条件优化手段可以进一步实现双乙酰的高产。双乙酰是合成乙偶姻和2,3-丁二醇的前体物质,因此,乙偶姻和2,3-丁二醇合成的改造策略与双乙酰生产菌株的改造策略具有相通之处。笔者所在课题组对乙偶姻和2,3-丁二醇合成的改造策略有较为深入的研究[30-32]以及相关综述[33-34],对双乙酰的代谢工程改造具有一定的指导意义。
2.1 增大双乙酰合成途径的代谢通量
2.1.1 增强α-乙酰乳酸合成酶基因的表达
目前,针对丙酮酸到α-乙酰乳酸主要有两种推论(图1),其中由丙酮酸一步脱羧生成α-乙酰乳酸的途径更多地被研究者们采信。通过代谢工程在天然可生产双乙酰菌株中过表达α-乙酰乳酸合成酶编码基因或过表达外源基因,增加双乙酰合成途径的通量,可有效地提高双乙酰的产量。Benson等[14]在 Lactococcus lactis中编码 α-乙酰乳酸合成酶的ilvBN基因,以质粒形式进行多拷贝表达,使其表达量提高了3.6倍,从而在以葡萄糖为底物的发酵中检测到了双乙酰的生成。Swindell等[35]在L.lactis中过表达 α-乙酰乳酸合成酶编码基因ilvBN,乙偶姻产量由 0.85 mmol/L 增加到 3.08 mmol/L,显著提高了乙偶姻的产量,说明丙酮酸到α-乙酰乳酸的代谢通量得到有效加强。Nadal等[36]将L.lactis的α-乙酰乳酸合成酶编码基因ilvBN插入至Lactobacillus casei的乳糖操纵子位点,工程菌株的双乙酰/乙偶姻产量比野生菌提高21倍。Gao等[5]在高产丙酮酸的Candida glabrata中,比较了自身的α-乙酰乳酸合成酶(ILV2)和来自B.subtilis的α-乙酰乳酸合成酶(ALS)的过表达对双乙酰合成的影响,结果发现过表达ALS的菌株具有更高的双乙酰合成能力(0.57 g/L vs 0.23 g/L)。2017 年,Hao等[18]利用高产乙偶姻和 2,3-丁二醇的 Bacillus sp.DL01,通过质粒形式过表达自身的α-乙酰乳酸合成酶编码基因alsS,积累了4.02 g/L的α-乙酰乳酸,双乙酰产量也由1.53 g/L增至1.94 g/L。
截至目前,研究者普遍使用强启动子过表达或者质粒形式过表达的方式提高α-乙酰乳酸合成酶的表达量来实现双乙酰的高产,而涉及转录调控方面的研究尚未见报道。但在很多天然具备2,3-丁二醇/乙偶姻生产能力的菌株中,alsSD操纵子一般受到alsR编码的LysR型转录激活子AlsR的调控[37-38]。例如,在 B.subtilis中,适量的乙酸盐、较低的溶解氧和低pH可以作用于AlsR,从而提高alsSD操纵子的表达水平。该研究思路同样适用于双乙酰菌株的改造,相应研究有待进一步开展。
2.1.2 NOD 途径的优化
双乙酰主要是由α-乙酰乳酸经过NOD反应生成[39-41],优化 NOD途径反应的条件,促进NOD反应的发生,有助于双乙酰的积累。Gollop等[41]利用纯化的α-乙酰乳酸合成酶(ALAS),以丙酮酸为底物,在添加 Mg2+、黄素腺嘌呤二核苷酸(FAD)和TPP的磷酸盐缓冲液中,反应合成α-乙酰乳酸,经过气相检测到双乙酰的生成;同时,作者提出α-乙酰乳酸可经过FeII-O2复合体(FeII-oxygen complex)或处于高度氧化态的金属离子催化生成双乙酰。Mohr等[42]发现,在 pH 6.5 时,28%的 α-乙酰乳酸可转化为双乙酰,但在相同条件下,加入 1.5 mmol/L CuSO4可使α-乙酰乳酸全部转化为双乙酰。Gao等[5]发现,外加 20 mmol/L Fe3+可使双乙酰的产量提高 1倍。Zhang等[6]在 Enterobacter cloacae(ΔbutAΔbudC)培养12 h 后加入 20 mmol/L Fe3+,双乙酰的质量浓度最终达到1.37 g/L。Liu等[7]提出了α-乙酰乳酸生成双乙酰的可能分子机制(图2):α-乙酰乳酸脱羧生成烯醇离子,烯醇离子在金属离子和O2的存在下转变为双乙酰。Liu等[7]对Cu2+、Fe2+和Fe3+对双乙酰生产的影响进行了研究,结果发现,30 mmol/L Fe3+显著提高了转化率,在加入Fe3+4 h后,双乙酰达到最大产量为8.2 g/L,得率达到87%(以 1 mol葡萄糖计)。2017 年,Hao等[18]在最终发酵工程菌株培养12 h后添加20 mmol/L Fe3+,α-乙酰乳酸和双乙酰的产量增加1倍,在最适条件下分批发酵,双乙酰产量达到8.69 g/L。值得注意的是,虽然金属离子的添加促进NOD反应的发生,但在发酵过程中,还要考虑到金属离子对细胞生长、丙酮酸积累和双乙酰生产途径中关键酶的影响。
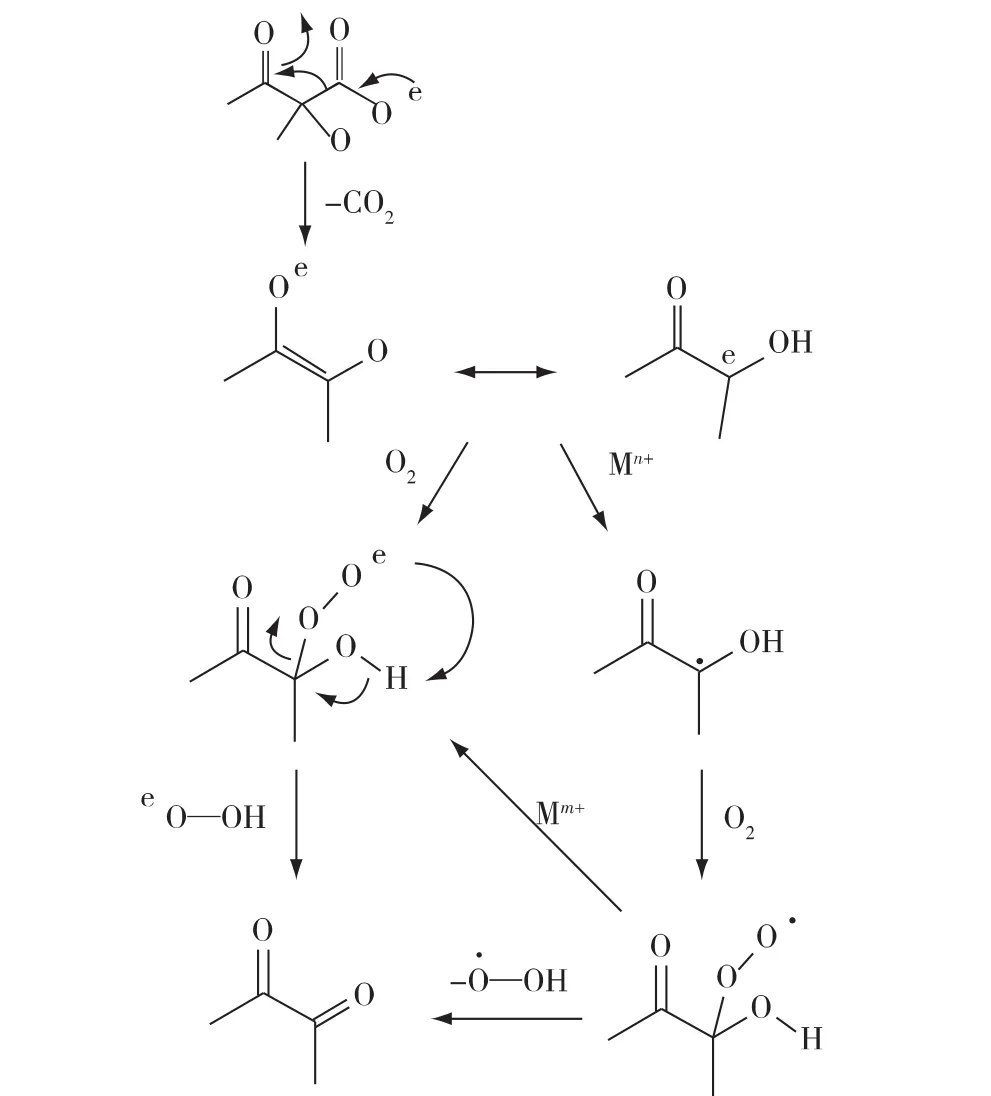
图2 NOD的可能分子机制[7]Fig.2 The proposed mechanism for NOD
2.2 阻断双乙酰还原途径
乙偶姻与2,3-丁二醇是双乙酰生产过程中的主要副产物。乙偶姻可由α-乙酰乳酸在α-乙酰乳酸脱羧酶的作用下经脱羧反应生成,也可由双乙酰在双乙酰还原酶的作用下经还原反应生成。乙偶姻进一步在乙偶姻还原酶(又名2,3-丁二醇脱氢酶)的作用下可被还原为2,3-丁二醇。值得注意的是,通常双乙酰还原酶和乙偶姻还原酶由同一基因编码,因此,失活菌株中的α-乙酰乳酸脱羧酶和双乙酰/乙偶姻还原酶是降低乙偶姻/2,3-丁二醇产量、提高双乙酰产量的有效方法。
Aymes等[43]将菌株 L.lactis subsp.lactis biovar diacetylactis CNRZ483 用 N-甲基-N'-硝基-N-亚硝基胍进行随机突变,选出α-乙酰乳酸脱羧酶失活的突变菌株483MI,其双乙酰产量显著提高。Gasson等[11]失活 α-乙酰乳酸脱羧酶的编码基因 aldB,α-乙酰乳酸和双乙酰的产量分别由0和0.02 mmol/L提高到 0.52 和 0.32 mmol/L。Zhao 等[4]用 UV 线诱变Enterobacter aerogenes 10293,获得 α-乙酰乳酸脱羧酶、乳酸脱氢酶和双乙酰还原酶均高度弱化的突变菌株UV-3,其乙偶姻产量显著降低。Gao等[5]敲除双乙酰还原酶的编码基因,限制双乙酰的下游途径,结果乙偶姻和2,3-丁二醇的产量显著下降,且双乙酰产量提高了30%。2015年,Zhang等[6]将2,3-丁二醇高产菌株E.cloacae中的2个双乙酰还原酶编码基因(gdh和budC)失活,最终双乙酰的产量是出发菌株的7倍。值得注意的是,某些菌株即使失活了α-乙酰乳酸脱羧酶和双乙酰/乙偶姻还原酶,仍有乙偶姻和 2,3-丁二醇的产生[5-7],可能原因是菌株中存在未被发现的乙偶姻还原酶或α-乙酰乳酸脱羧酶。最近,Hao等[18]利用 2,3-丁二醇脱氢酶BDH(即双乙酰还原酶)失活的突变株Bacillus sp.DL01,敲除了 α-乙酰乳酸脱羧酶的编码基因alsD,有效去除乙偶姻的积累,双乙酰的产量从0.24 g/L 提升到 1.53 g/L。
2.3 阻断双乙酰竞争途径
在双乙酰发酵过程中,从丙酮酸出发的旁路副产物主要有甲酸、乙酸、乳酸和乙醇,副产物的产生造成碳源的浪费。通过阻断这些途径,可以提高双乙酰的产量和得率。Boumerdassi等[44]筛选出乳酸脱氢酶活性显著降低的突变株L.lactis subsp.lactis biovar diacetylactis CNRZ 483,以葡萄糖为底物发酵检测到双乙酰的生成,且乳酸浓度由45.7 mmol/L降至2.6 mmol/L。Gasson 等[11]将 L.lactis中的乳酸脱氢酶失活使代谢通量发生了显著的改变,乳酸产量由53 mmol/L降至2.2 mmol/L,乙偶姻浓度由4 mmol/L升至17 mmol/L,说明流向α-乙酰乳酸的代谢通量得以提高。Nadal等[36]失活乳酸脱氢酶基因ldh,以葡萄糖为底物时,双乙酰/乙偶姻产量提高了84 倍。Liu 等[7]将 L.lactis subsp.cremoris MG1363 的乳酸和乙酸生成途径以及双乙酰的下游途径失活,在好氧条件下,无乳酸积累,双乙酰得率达到65%(以1 mol葡萄糖计)。
α-乙酰乳酸参与某些氨基酸的合成,如缬氨酸和亮氨酸等(图1)。过表达乙酰醇酸还原异构酶可抑制 α-乙酰乳酸的生成[45-46]。2014 年,Gao 等[5]敲除α-乙酰乳酸的旁路乙酰醇酸还原异构酶编码基因ilv5,结果发现,双乙酰产量比其上一步工程菌株提高了28%,α-乳酸的积累量提高了37%。但值得注意的是,即使供给足量的氨基酸,敲除ilv5的菌株的比生长速率仍然比出发菌低20%。
2.4 调节辅因子NADH/NAD+的比例
双乙酰生产菌株的构建过程中,副产物乙偶姻、2,3-丁二醇、乳酸和乙酸等途径的阻断会引起胞内的NADH/NAD+比例的大幅提高,造成NAD+再生困难,胞内还原力不平衡,从而影响细胞的生长和代谢。利用各种代谢或辅因子工程手段,调节NADH/NAD+比例,平衡胞内还原力,可使双乙酰高产菌维持正常的生长和代谢水平。
增大NADH氧化酶酶活和呼吸作用的强度是平衡还原力的主要方法。NADH氧化酶编码基因的过表达,使 NADH氧化酶的表达量提高,胞内NADH/NAD+的比例下降,依赖于NADH的副反应,如乳酸的代谢通量下降。呼吸作用的加强不仅可以平衡还原力,还可增加生物量。Lopez等[15]将Streptococcus mutans的NADH氧化酶编码基因nox-2整合到L.lactis上,使得NADH氧化酶的表达量为出发菌株的150倍,明显降低了好氧条件下的NADH/NAD+的比例,最后成功地将胞内丙酮酸几乎全部转化为乙偶姻或双乙酰。Hugenholtz等[47]在α-乙酰乳酸脱羧酶失活的 L.lactis中过表达NADH氧化酶,结果发现80%的丙酮酸重新被导流至α-乙酰乳酸。Guo等[48]为了平衡好氧条件下乳酸和双乙酰的生产,建立了一个L.lactis水合NADH氧化酶基因的启动子文库。在该文库中,筛选出NADH氧化酶活性高的工程菌进行发酵,结果显示:随着NADH/NAD+比例的降低,乳酸的产量由21.15 mmol/L 降至 9.94 mmol/L,而双乙酰产量由 1.07mmol/L 升 至 4.16 mmol/L。Liu 等[7]在 L.lactis subsp.cremoris MG1363中发现,当供给 O2并表达NADH氧化酶时,α-乙酰乳酸、双乙酰和乙偶姻的总得率为65%(以1 mol葡萄糖计);当停止供给O2时,无双乙酰积累;失活NADH氧化酶,双乙酰得率降至5%。有研究表明,NADH氧化酶的活性严重受到双乙酰的抑制[7,47],这极大地限制了利用 NADH氧化酶提高双乙酰产量的应用。考虑到这一点,Liu等[7]利用提高细胞色素氧化酶酶活的方法来调节NADH/NAD+的比例,有效地将α-乙酰乳酸、双乙酰和乙偶姻的总得率提高至90%(以1 mol葡萄糖计)。
2.5 发酵条件的优化
菌株的发酵条件如培养基、温度、pH和通氧量等对发酵高产双乙酰至关重要。Gupta等[12]对E.cloacae生产双乙酰和乙偶姻进行发酵条件优化,主要考察不同质量浓度(10、15、20和50 g/L)的不同糖类(蔗糖、糖浆和葡萄糖)、接种量(体积分数0.2%、0.5%、1.0%、2.0%和 5.0%)、培养温度(20、25、30、35 和 40 ℃)及 pH(5、6、7、8 和 9),结果发现:在含20 g/L的蔗糖、pH为7的培养基中,接种量1%,28℃诱导,培养48 h后,双乙酰和乙偶姻的产量最高。2003年,Jyoti等[3]研究 Lactobacillus rhamnosus在不同碳源培养基中生产双乙酰的情况,结果发现:以葡萄糖和柠檬酸同时为碳源的复合培养基中,其菌株生长和双乙酰得率均高于单独以二者之一为唯一碳源时的结果。2009年,Zhao等[4]利用中心复合设计-响应面分析对培养基进行了优化,得到了最佳的培养基(g/L):葡萄糖100、蛋白胨5、酵母抽提物 5、(NH4)2SO40.1、柠檬酸 1、MnSO42和MgSO42。一些添加物也能使双乙酰的产量得到提高。Chuang等[8]对细菌和酵母的双乙酰合成途径进行研究,发现在Saccharomyces cerevisiae 299中,缬氨酸和亚砷酸盐会抑制双乙酰的合成,但泛酸会促进双乙酰的合成。Monnet等[16]在好氧条件下,添加过氧化氢酶、血红蛋白和酵母抽提物,使原来不能积累 α-乙酰乳酸的 L.lactis subsp.lactis biovar diacetylactis CNRZ 483突变株,大量积累了α-乙酰乳酸。Gao 等[5]在培养基中添加 0.08 mg/L VB1和2 mg/L烟酸,有效抑制了乙醇的生成,并使丙酮酸积累量增加,双乙酰的产量达到4.7 g/L,比对照提高了约4倍。
很多研究表明,溶氧水平对双乙酰的产量有很大的影响,一方面原因是O2为NOD反应的电子供体,另一方面是因为溶氧水平会影响菌体的呼吸作用以及胞内NADH氧化酶的酶活,从而影响菌体生长以及还原力的平衡。1993年,Bassit等[49]研究了初始氧浓度(0、21%、50%和 100%)对 L.lactis subsp.lactis biovar diacetylactis生产双乙酰的影响,结果发现:随着溶氧水平的提高,双乙酰的浓度从0.01 mmol/L逐渐提高到18 mmol/L,且酶活数据显示,高溶氧水平下的α-乙酰乳酸合成酶和NADH氧化酶的酶活也相对较高。1997年,Lopez de Felipe等[50]对L.lactis在好氧条件下以葡萄糖为底物时,不同溶氧水平和pH下NADH氧化酶的活性变化进行研究,发现高溶氧水平和偏酸条件有利于双乙酰的积累。
双乙酰的生产与细胞生长密切相关,通过优化培养基配方和发酵条件有助于双乙酰生产能力的提高,目前发现,较高的氧饱和度和较低的pH对双乙酰的生产有利。此外,双乙酰对细胞中某些酶酶活的影响和细胞生长的影响值得研究者的关注。
3 展望
近几年,生物法制备双乙酰的研究取得了较大的突破,但是双乙酰的产量仍然较低。为了进一步满足双乙酰生产的安全性和环保性,克服双乙酰生产的若干瓶颈,笔者认为应该继续利用微生物发酵法进行双乙酰的生产。今后的研究过程可以在以下几个方面展开:1)菌种的选择。理性选择潜在高产菌株,如选择遗传背景清晰、公认安全的高产乙偶姻的菌株作为宿主菌,进行代谢工程和合成生物学改造,得到高产双乙酰的菌株。2)双乙酰的耐受性。双乙酰不仅影响菌体内部分酶的酶活,还会对菌体生长有一定的毒性。通过物理、化学方法或者进化工程手段筛选耐受性较强的突变株。3)代谢途径相关基因的表达调控。利用启动子文库等方式调控影响菌体生长的基因,如氨基酸合成支路的乙酰醇酸还原异构酶的表达基因,平衡菌株生长与双乙酰生产。4)两阶段生产。由于NOD途径的最优条件可能与细胞生长和重要前体物丙酮酸以及α-乙酰乳酸的积累相冲突,同时考虑到双乙酰对于细胞生长和有关途径酶的不利影响,可以将发酵过程分为两个阶段,第一阶段大量积累α-乙酰乳酸,第二阶段通过化学方法使α-乙酰乳酸最大限度地转化为双乙酰。
参考文献:
[1] 胡文效,姜兴涛,魏彦锋,等.发酵法生产2,3-丁二酮[C]//中国香料香精化妆品工业协会.中国香料香精学术研讨会,2004.
[2] 练敏,纪晓俊,黄和,等.香料2,3-丁二酮的合成现状及展望[J].现代化工,2008,28(8):29-32.
[3] JYOTI B D,SURESH A K,VENKATESH K V.Diacetyl production and growth of Lactobacillus rhamnosus on multiple substrates[J].World J Microbiol Biotechnol,2003,19(5):509-514.
[4] ZHAO L,BAO Y,WANG J,et al.Optimization and mechanism of diacetyl accumulation by Enterobacter aerogenes mutant UV-3[J].World J Microbiol Biotechnol,2009,25(1):57-64.
[5] GAO X,XU N,LI S,et al.Metabolic engineering of Candida glabrata for diacetyl production[J].PLoS ONE,2014,9(3):e89854.
[6] ZHANG L,ZHANG Y,LIU Q,et al.Production of diacetyl by metabolically engineered Enterobacter cloacae[J].Sci Rep,2015,5:9033.
[7] LIU J,CHAN S H,BROCK-NANNESTAD T,et al.Combining metabolic engineering and biocompatible chemistry for high-yield production of homo-diacetyl and homo-(S,S)-2,3-butanediol[J].Metab Eng,2016,36:57-67.
[8] CHUANG L F,COLLINS E.Biosynthesis of diacetyl in bacteria and yeast[J].J Bacteriol,1968,95(6):2083-2089.
[9] CHRISTENSEN M D,PEDERSON C S.Factors affecting diacetyl production by lactic acid bacteria[J].Appl Microbiol,1958,6(5):319-322.
[10] HUGENHOLTZ J,STARRENBURG M J C.Diacetyl production by differentstrainsofLactococcuslactissubsp.lactisvar.diacetylactis and Leuconostoc spp[J].Appl Microbiol Biotechnol,1992,38(1):17-22.
[11] GASSON M,BENSON K,SWINDELLS,etal.Metabolic engineering of the Lactococcus lactis diacetyl pathway[J].Lait,1996,76(1/2):33-40.
[12] GUPTA K G,YADAV N K,DHAWAN S.Laboratory-scale production of acetoin plus diacetyl by Enterobacter cloacae ATCC 27613[J].Biotechnol Bioeng,1978,20(12):1895-1901.
[13] SPECKMAN R,COLLINS E.Diacetyl biosynthesis in Streptococcus diacetilactis and Leuconostoc citrovorum[J].J Bacteriol,1968,95(1):174-180.
[14] BENSON K H,GODON J J,RENAULT P,et al.Effect of ilvBN-encoded α-acetolactate synthase expression on diacetyl production in Lactococcus lactis[J].Appl Microbiol Biotechnol,1996,45(1):107-111.
[15] LOPEZ DE FELIPE F,KLEEREBEZEM M,DE VOS WM,et al.Cofactor engineering:a novel approach to metabolic engineering in Lactococcus lactis by controlled expression of NADH oxidase[J].J Bacteriol,1998,180(15):3804-3808.
[16] MONNET C,AYMES F,CORRIEU G.Diacetyl and α-acetolactate overproduction by Lactococcus lactis subsp.lactis biovar diacetylactismutants that are deficient in α-acetolactate decarboxylase and have a low lactate dehydrogenase activity[J].Appl Environ Microbiol,2000,66(12):5518-5520.
[17] 赵宏峰,边英男,黄伟达.利用重组大肠杆菌生产双乙酰[J].生物技术通报,2011(1):165-169.
[18] HAO W,JI F,WANG J,et al.Metabolic engineering of Bacillus sp.for diacetyl production[J].Process Biochem,2017,58:69-77.
[19] KANEKO T,WATANABE Y,SUZUKI H.Differences between Lactobacilluscasei subsp.casei2206 and citrate-positive Lactococcus lactis subsp.lactis 3022 in the characteristics of diacetyl production[J].Appl Environ Microbiol,1991,57(10):3040-3042.
[20] ISHII N,MATSUMURAM,KATAOKA H,etal.Diacetyl fermentation coupled with pervaporation using oleyl alcohol supported liquid membrane[J].Bioprocess Eng,1995,13(3):119-123.
[21] 赵玲,王静云,包永明,等.丁二酮高产菌株的选育及发酵动力学分析[J].生物技术,2007,17(5):59-64.
[22] JUNI E.Mechanisms of formation of acetoin by bacteria[J].J Biol Chem,1952,195(2):715-726.
[23] SNOEP J L, JOOST TEIXEIRA DE MATTOS M,STARRENBURG M,etal.Isolation,characterization,and physiological role of the pyruvate dehydrogenase complex and alpha-acetolactate synthase of Lactococcus lactis subsp.lactis bv.diacetylactis[J].J Bacteriol,1992,174(14):4838-4841.
[24] DE MAN J C.The formation of diacetyl and acetoin from αacetolactic acid[J].Recl Trav Chim Pays-Bas,1959,78(7):480-486.
[25] HOLTZCLAW W D,CHAPMAN L F.Degradative acetolactate synthase of Bacillus subtilis:purification and properties[J].J Bacteriol,1975,121(3):917-922.
[26] MALTHE-SØRENSSEN D,STØRMER F C.ThepH 6 acetolactate-forming enzyme from Serratia marcescens[J].Eur J Biochem,1970,14(1):127-132.
[27] STORMER F C.2,3-Butanediol biosynthetic system in Aerobacter aerogenes[J].Methods Enzymol,1975,41:518-533.
[28] KANEKO T,TAKAHASHI M,SUZUKI H.Acetoin fermentation by citrate-positive Lactococcus lactis subsp.lactis 3022 grown aerobically in the presence of hemin or Cu2+[J].Appl Environ Microbiol,1990,56(9):2644-2649.
[29] 杨丽杰,王俊沪.乳酸乳球菌中双乙酰代谢支路的调控[J].中国乳品工业,2004,32(5):24-29.
[30] FU J,HUO G,FENG L,et al.Metabolic engineering of Bacillus subtilis for chiral pure meso-2,3-butanediol production[J].Biotechnol Biofuels,2016,9(1):90-103.
[31] WANG M,FU J,ZHANG X,et al.Metabolic engineering of Bacillus subtilis for enhanced production of acetoin[J].Biotechnol Lett,2012,34(10):1877-1885.
[32] CHEN T,LIU W X,FU J,et al.Engineering Bacillus subtilis for acetoin production from glucose and xylose mixtures[J].JBiotechnol,2013,168(4):499-505.
[33] FU J,WANG M,LIU W X,et al.Latest advances of microbial production of 2,3-butanediol[J].Prog Chem,2012,24(11):2268-2276.
[34] 刘晓霏,付晶,霍广鑫,等.生物法制备平台化合物乙偶姻的最新研究进展[J].中国生物工程杂志,2015,35(10):91-99.
[35] SWINDELL S R,BENSON K H,GRIFFIN H G,et al.Genetic manipulation ofthe pathway for diacetylmetabolism in Lactococcus lactis[J].Appl Environ Microbiol,1996,62(7):2641-2643.
[36] NADAL I,RICO J,PÉREZ-MARTÁNEZ G,et al.Diacetyl and acetoin production from whey permeate using engineered Lactobacillus casei[J].J Ind Microbiol Biotechnol,2009,36(9):1233-1237.
[37] RENNA M C,NAJIMUDIN N,WINIK L R,et al.Regulation of the Bacillus subtilis alsS,alsD,and alsR genes involved in postexponential-phase production of acetoin[J].J Bacteriol,1993,175(12):3863-3875.
[38] FRÄDRICH C,MARCH A FIEGE K,et al.The transcription factor AlsR binds and regulates the promoter of the alsSD operon responsible for acetoin formation in Bacillus subtilis[J].J Bacteriol,2012,194(5):1100-1112.
[39] MONNET C,SCHMITT P,DIVIES C.Development and use of a screening procedure for production of α-acetolactate by Lactococcus lactis subsp.lactis biovar diacetylactis strains[J].Appl Environ Microbiol,1997,63(2):793-795.
[40] TEUSINK B,SMID E J.Modelling strategies for the industrial exploitation of lactic acid bacteria[J].Nat Rev Microbiol,2006,4(1):46-56.
[41] GOLLOP N,BARAK Z E,CHIPMAN D M.A method for simultaneous determination of the two possible products of acetohydroxy acid synthase[J].Anal Biochem,1987,160(2):323-331.
[42] MOHR B,AYMES F,REA M C,et al.A new method for the determination of 2-acetolactate in dairy products[J].Int Dairy J,1997,7(11):701-706.
[43] AYMES F,MONNET C,CORRIEU G.Effect of α-acetolactate decarboxylase inactivation on α-acetolactate and diacetyl production by Lactococcus lactis subsp.lactis biovar diacetylactis[J].J Biosci Bioeng,1999,87(1):87-92.
[44] BOUMERDASSI H,MONNET C,DESMAZEAUD M,et al.Isolation and properties of Lactococcus lactis subsp.lactis biovar diacetylactis CNRZ 483 mutants producing diacetyl and acetoin from glucose[J].ApplEnviron Microbiol,1997,63(6):2293-2299.
[45] MITHIEUX S M,WEISS A S.Tandem integration of multiple ILV5 copies and elevated transcription in polyploid yeast[J].Yeast,1995,11(4):311-316.
[46] OMURA F.Targeting of mitochondrial Saccharomyces cerevisiae Ilv5p to the cytosol and its effect on vicinal diketone formation in brewing[J].Appl Microbiol Biotechnol,2008,78(3):503-513.
[47] HUGENHOLTZ J,KLEEREBEZEM M,STARRENBURG M,et al.Lactococcus lactis as a cell factory for high-level diacetyl production[J].ApplEnviron Microbiol,2000,66(9):4112-4114.
[48] GUO T,KONG J,ZHANG L,et al.Fine tuning of the lactate and diacetyl production through promoter engineering in Lactococcus lactis[J].PLoS ONE,2012,7(4):e36296.
[49] BASSIT N,BOQUIEN C Y,PICQUE D,et al.Effect of initial oxygen concentration on diacetyl and acetoin production by Lactococcus lactis subsp.lactis biovar diacetylactis[J].Appl Environ Microbiol,1993,59(6):1893-1897.
[50] LOPEZ DE FELIPE F,STARRENBURG M J,HUGENHOLTZ J.The role of NADH-oxidation in acetoin and diacetyl production from glucose in Lactococcus lactis subsp.lactis MG1363[J].FEMS Microbiol Lett,1997,156(1):15-19.
(责任编辑 荀志金)
Recent advances for microbial production of diacetyl
CUI Zhenzhen1,2,MAO Yufeng1,2,CHEN Cong1,2,YUAN Qianqian3,WANG Zhiwen1,2,CHEN Tao1,2
(1.Key Laboratory of Systems Bioengineering of the Ministry of Education,School of Chemical Engineering and Technology,Tianjin University,Tianjin 300345,China;2.Collaborative Innovation Center of Chemical Science and Engineering,Tianjin 300345,China;3.Key Laboratory of Systems Microbial Biotechnology,Tianjin Institute of Industrial Biotechnology,Chinese Academy of Sciences,Tianjin 300308,China)
With the knowledge of the biosynthetic pathway of diacetyl production,many novel strategies arise for the production of diacetyl.Most strategies focus on metabolic engineering of diacetyl production and optimization of its metabolic pathways.The strains and pathway of microbial production for diacetyl production are summarized,and the metabolic engineering strategies to improve diacetyl production are reviewed.Future directions in the research of diacetyl production are presented in light of current knowledge of biosynthesis of this molecule.
diacetyl;microbial production;metabolic engineering
TQ224.24
A
1672-3678(2017)05-0057-08
10.3969/j.issn.1672-3678.2017.05.007

