我院药物临床试验实施中方案偏离的回顾性研究
刘金华,刘敏,刘雨村,段均,鲁毅
(1.重庆医科大学附属第一医院呼吸科,重庆400016;2.四川大学华西口腔医院正畸科,成都 610041)
我院药物临床试验实施中方案偏离的回顾性研究
刘金华1*,刘敏2#,刘雨村1,段均1,鲁毅1
(1.重庆医科大学附属第一医院呼吸科,重庆400016;2.四川大学华西口腔医院正畸科,成都 610041)
目的:研究药物临床试验实施中方案偏离的影响要素,为提高药物临床试验的质量提供参考。方法:对重庆医科大学附属第一医院2010-2016年开展的药物临床试验项目进行质量核查,对各年度方案偏离进行回顾性研究并归类分析,探讨方案偏离的类别、例数,并比较国际与国内试验项目以及是否有专职研究护士参与试验管理后方案偏离的差异,并提出改进措施。结果:我院2010-2016年开展药物临床试验27项涉及949例病案,方案偏离发生176例,占比18.55%;7年间方案偏离发生比例逐年降低。发生的方案偏离类别主要为观察/评价记录不全(30.11%)、检查漏项/“超窗”(28.41%)、不良事件及合并用药不当(14.20%)和药物管理存在疏漏(11.93%);有专职研究护士参与的项目方案偏离发生比例低于没有专职研究护士参与的项目(11.11%vs.28.67%,P<0.01);国际多中心项目方案偏离发生比例低于国内项目(6.60%vs.28.84%,P<0.01)。结论:建议应有针对性地加强药物临床试验中的薄弱环节,如临床试验机构应建立临床试验数据留存制度,电子数据及时异地备份等。此外,临床试验机构应尽量配备各专业专职研究护士,学习和借鉴国际多中心临床试验项目试验设计严谨科学、操作流程标准化及数据处理真实等做法,以切实减少方案偏离的发生,提高药物临床试验的质量。
药物临床试验;方案偏离;例数;类别;专职研究护士;国际多中心临床试验
ABSTRACTOBJECTIVE:To study the influencing factors of protocol deviation in drug clinical trial implementation,and provide reference for improving the quality of drug clinical trial.METHODS:Quality verification was conducted for the drug clinical trial projects in the First Affiliated Hospital of Chongqing Medical University during 2010-2016,and protocol deviations in each year were retrospectively studied,classified and analyzed.Category,frequency,international and domestic pilot projects and the differences of protocol deviation after full-time research nurse participating in trail management were explored,and the measures were put forward.RESULTS:27 drug clinical trials were implemented in our hospital during 2010-2016,including 949 cases,176 cases with protocol deviation,accounting for 18.55%.Deviation protocol in drug clinical trial was decreased year by year for 7 years.The categories were mainly incompleteness of observation/records(30.11%),checking omission/“broaden the window”(28.41%),adverse drug events and improper combined medication(14.20%)and omission in drug management(11.93%).The proportion of protocol deviation with full-time research nurse participated was lower than the projects without full-time research nurse(11.11%vs.28.67%,P<0.01),and proportion of deviation protocol in international multi-center project was lower than the domestic projects(6.60%vs.28.84%,P<0.01).CONCLUSIONS:It is suggested to pointedly strengthen the weak links of drug clinical trial.For example,clinical trial institutions should establish the clinical trial data retention system,electronic data should be timely backed up in a different places,etc.Besides,clinical trial institutions should equip professional full-time research nurses as much as possible,learn the rigorous scientific experimental design,standard operational procedures and the authenticity of data processing from the international multi-center clinical trial projects to effectively reduce the incidence of deviation protocol and improve the quality of drug clinical trials.
KEYWORDSDrug clinical trial;Protocol deviation;Frequency;Category;Full-time research nurse;International multi-center clinical trial
药物临床试验必须遵循《药物临床试验质量管理规范》(GCP)原则、依从伦理委员会批准的试验方案,任何有意或无意偏离或违反GCP和试验方案的行为叫做方案偏离(Protocol deviation)或方案违背(Protocol violation)[1]。近年药物研发全球化对我国药物临床试验质量也提出了更高的标准和要求[2]。在临床试验方案设计及组织实施过程中应尽可能地考虑各种有可能影响试验的因素,并制订标准操作规程,建立质量控制和质量保证体系,尽量避免及减少方案偏离的发生。但在试验执行过程中,方案偏离往往不可避免。当临床试验出现大量方案偏离时,试验参与各方的利益会受到影响,试验的质量可能下降,甚至影响整个临床试验的结论,从而导致临床试验的失败[3]。本研究对重庆医科大学附属第一医院(以下简称我院)近年来开展的药物临床试验项目进行质量核查,对各年度方案偏离进行回顾性研究并归类分析,探讨方案偏离的类别、例数,比较国际与国内试验项目以及是否有专职研究护士参与试验管理后方案偏离的差异,为以后开展的药物临床试验项目提供参考与借鉴,以更好地提高药物临床试验的质量。
1 资料与方法
1.1 资料收集与统计
国家食品药品监督管理总局(CFDA)117号文件要求对已开展的药物临床试验项目进行全面自查。我院根据总局关于发布药物临床试验数据现场核查要点的公告(2015年第228号)所附《药物临床试验数据现场核查要点》,对我院2010-2016年开展的药物临床试验项目展开质量核查,对存在的方案偏离进行回顾性研究并归类分析。比较7年中药物临床试验方案偏离的总体发生率及类别;比较专职研究护士参与药物临床试验对方案偏离的影响;比较国际多中心药物临床试验与国内药物临床试验发生方案偏离的差异,分析其影响要素。
1.2 统计学方法
采用SPSS 13.0统计软件对所得数据进行分析。数据以频次和率(%)表示,采用卡方检验。P<0.05表示差异有统计学意义。
2 结果
2.1 各年度方案偏离情况统计
对医院近年来药物临床试验项目进行质量检查,共检查药物临床试验27项、病案949例,其中方案偏离176例,占比18.55%;随着时间的推移,方案偏离数量呈逐年下降趋势。检查中2010-2016年方案偏离数量统计见表1;方案偏离的类别及发生数量统计见表2(表中,“超窗”指访视日期未在方案规定的时间段)。
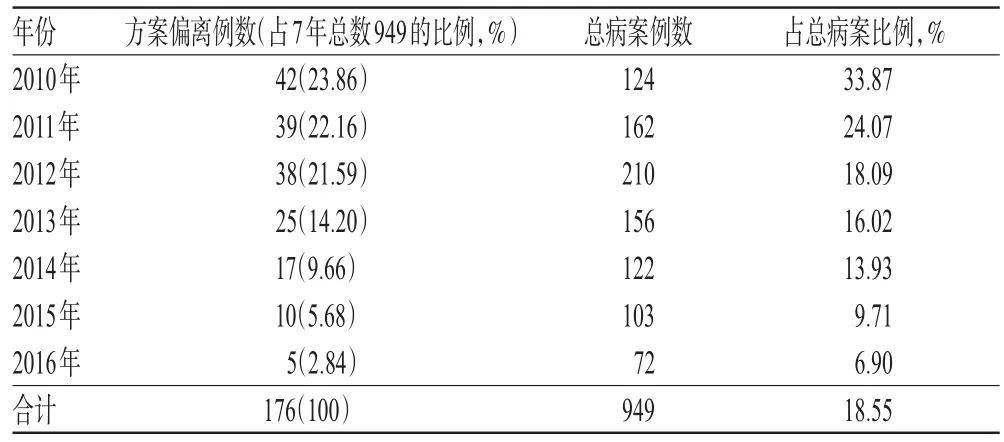
表1 2010-2016年方案偏离数量统计Tab 1 Statistics of protocol deviation number in 2010-2016
2.2 有无专职研究护士参与的试验方案偏离比较
有无专职研究护士参与的药物临床试验发生方案偏离的类别与数量比较见表3。
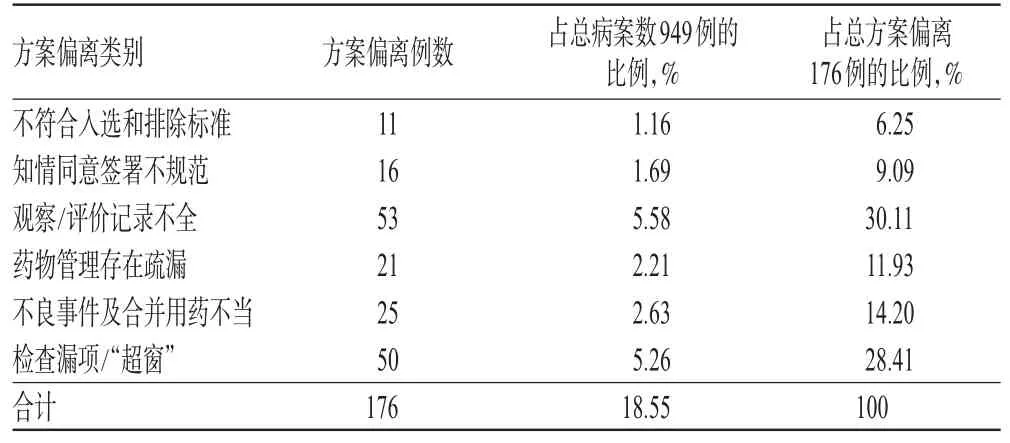
表2 方案偏离的类别及发生数量Tab 2 Category and number of cases of protocol deviation

表3 有无专职研究护士参与的临床试验发生方案偏离的类别与数量比较Tab 3 Comparison of the category and frequency of protocol deviation with or without full-time research nurse participated
由表3可知,有专职护士参与的药物临床试验核查297例,没有专职护士参与的药物临床试验核查286例,前者发生方案偏离的比例显著低于后者,差异有统计学意义(P<0.01)。
2.3 国际与国内临床试验方案偏离比较
将资料完整的106例国际多中心试验与104例国内多中心试验比较(其余病例因资料不完整未纳入统计),发生方案偏离的类别与数量比较结果见表4。
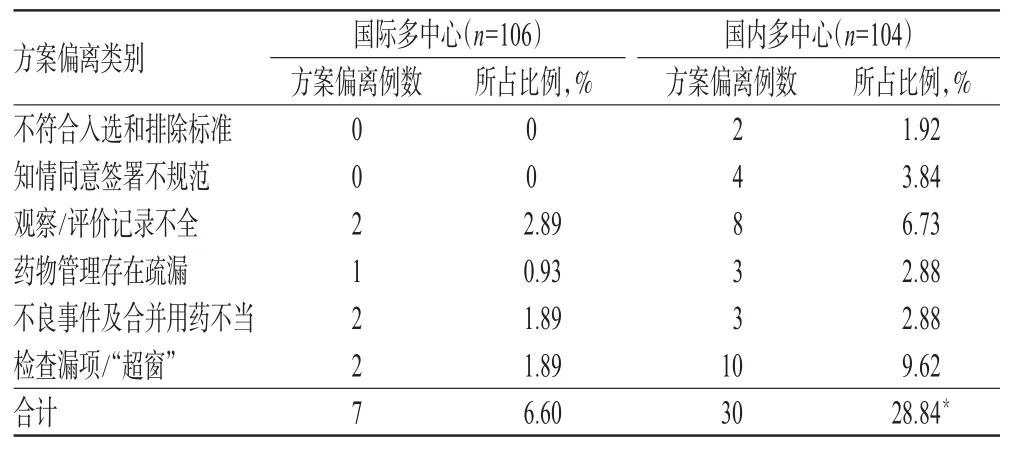
表4 国际与国内临床试验发生方案偏离类别与数量比较Tab 4 Comparisons of the category and frequency of protocol deviation in international and domestic clinical trial
结果,国际多中心试验发生方案偏离的比例显著低于国内多中心试验,差异有统计学意义(P<0.01)。
3 分析与讨论
3.1 药物临床试验质量检查中各年度方案偏离分析
由表1可知,2010-2016年药物临床试验出现方案偏离由42例下降至5例,呈现逐年下降的趋势。分析原因,是缘于我院近年来经过学习、借鉴及摸索,制定并实施了三级培训制度和三级质控管理制度。三级培训制度即定期外派专业人员参加国家级GCP培训、定期在院内及专业科室(即取得GCP资质的科室)进行GCP培训、在每一项药物临床试验项目开展前及实施过程中对参加试验的研究者再次进行GCP及方案培训。三级培训贯穿于整个临床试验过程中。三级质控管理制度是指在临床试验实施过程中,建立的以主要研究者为主的一级质控、以专业科室组长为主的二级质控及医院机构质量控制的三级质控管理制度。通过逐步建立对药物临床试验全过程的监管制度,并以GCP和标准操作规程(SOP)为准则,我院逐步形成了较完善的质量控制体系。经过各级培训及质量管理,药物临床试验质量逐年提高,发生方案偏离的例数逐年降低。但由表2可知,观察/评价记录不全、检查漏项/“超窗”、药物管理存在疏漏仍为我院的薄弱环节,这些问题也是全国药物临床试验普遍存在的问题[4-6]。加强三级培训制度和三级质控管理制度,定期进行三级质量检查,可以减少上述偏离的发生。一般医院机构的三级质控模式如下:当专业组承接某项临床研究后,专业组会就该项目成立一个项目组;该项目组的主要研究者指定项目组中的一名人员来承担一级质控,该名人员可以是研究护士也可以是医师,但必须熟悉方案和试验要点,督促项目组成员严格按照方案实施,项目结束时该人员的一级质控任务解除;二级质控是由专业组组长负责设置的一名相对固定的人员,负责专业所承担项目的质控,能指导一级质控人员开展工作,一般由专业组秘书担任;三级质控则由机构办公室专职质控员承担[7]。
3.2 方案偏离的种类分布及例数分析
3.2.1 观察/评价记录不全 在本次核查中此类问题发生53例,占总方案偏离例数的30.11%。其中,实验室数据无法溯源36例,主要以心电图及X光片较为突出,表现为虽然有报告结果,但部分结果无法在心电图机及X光机上溯源;病例报告表(CRF)的数据与化验单的数据或日期不一致7例;部分化验单缺失5例;实际完成例数与临床总结报告不符2例;患者日记卡有3次不良事件记录,而在研究病历中没有体现等。按GCP要求,记录与报告内容必须完整、真实、准确、规范、可追溯。本次检查中常见因搬迁、数据系统更新等各种原因,导致实验室检查数据无法溯源等问题。这提示临床机构应建立临床试验数据留存相关制度,做到电子数据及时异地备份。
3.2.2 检查漏项/“超窗”在本次核查中此类问题发生50例,占方案偏离总例数的28.41%,以访视或实验室检查“超窗”为主,共发现31例,这可能与方案中未考虑访视时间窗及受试者与研究者重视程度不够有关。在以往的一些调查中显示,受试者与研究者多认为访视及检查超几天没关系,因此受试者在访视时间到期时不及时回访,研究者也未给予充分的强调与重视。实验室检查漏项13例,其中以女性妊娠及较早完成的试验项目中心电图漏查较常见,与研究者认为这两项检查出现异常的可能性较小、可做可不做的主观判断有关;实验室检查结果超过正常值范围未进行判断及复查4例;未按方案中规定的项目进行操作2例。在试验过程中,如果研究者经验认为某些指标结果与方案规定的参数标准相差不大而不查或漏查,结果可能造成试验方案偏离;而任何偏离试验方案的做法都被认为是未遵照方案的[8]。
3.2.3 药物管理存在疏漏,不良事件及合并药物的记录、使用不规范 在本次核查中,此类问题分别占11.93%、14.20%。在药物管理发生偏离的21例中,试验用药的发放、回收、销毁记录不完整12例;药物发放、回收登记表的数量与原始病历或病例报告表上的发放、回收数量不一致5例;处方药物批号与临床试验用药物批号不符3例;未按药物编号依入组时间顺序发放药物1例。GCP对试验用药的发放、回收与管理均有严格的规定,严禁试验用药用于非临床试验的患者,对每一片、每一剂药物的去向都需有清晰的记录,避免本应回收的试验用药遗失在外,这要求研究者对该项目的试验用药精准到片剂、喷剂数量的精确记录。本研究发现,每次受试者回访时,从受试者处回收剩余药物及各种装置有较多不可控因素、清点记数已用的和需回收剩余药片的操作烦琐,造成了研究者记录不完整、不一致。
在不良事件与合并药物不当中,使用合并药物记录不全较多,共计18例;不良事件记录与受试者日记卡记录不符2例;严重不良事件(SAE)超规定上报时间窗3例;SAE无跟踪及总结报告2例。由于少数研究者对GCP和药物管理的相关法规知识掌握不够,对合并药物往往只记录一些自认为治疗疾病的主要药物,而忽略了某些辅助药物,从而导致方案偏离发生。
此外,知情同意书签署不规范在本次核查中占8.37%,因申办者设计知情同意书存在缺陷,多存在信息留取不全,如身份证号及电话号码缺失等;住院受试者的部分检查日期在签署知情同意的日期之前而未进行说明。根据CFDA颁布的《药物临床试验伦理审查工作指导原则》中相关要求,知情同意书作为保护受试者权益非常重要的文书之一,一旦出现方案偏离,伦理委员会应要求申办者和/或研究者就事件的原因、影响及处理措施予以说明[9]。违背入选方案在本次核查中发生较少,仅占6.25%,多为年龄及入组时化验值轻度超标而被误纳入。
3.3 专职研究护士的参与对方案偏离发生的影响
由表3可知,有专职研究护士参与的药物临床试验方案偏离发生比例低于无专职研究护士参与者(P<0.01)。专职研究护士可以协助主要研究者及合作研究者完成临床试验中大量琐碎但又非常重要的工作,保证试验顺利且高质量地完成。参考临床试验的专职研究护士对试验进程和质量标准有较强的把控能力,能够及时发现和解决问题,减少方案偏离的发生。专职研究护士在临床试验中肩负以下重要职责。
3.3.1 GCP相关法规职责 ①保障所有资料均需通过伦理委员会审核:与受试者有关的资料均需递交伦理委员会审核,经伦理委员会同意并出具伦理批件后才能正式开始临床试验,以充分保护受试者的权益。而工作较忙的主要研究者及合作研究者很易忽视这一点,检查中亦有发现早年完成的试验项目入选受试者的时间在伦理批件的时间之前的情况发生。②协助做好知情同意工作:按照GCP要求,专职研究护士应协助研究医师完成受试者知情同意书的签署以保障受试者的权益,在试验前向受试者耐心讲解药物临床试验有关知识,把深奥的医学语言转化为生活中的常用易懂的语言,用举例子、打比方的方法讲解,使受试者易于理解,达到事半功倍的效果[10]。尤其对老年受试者,让其更加充分地知情与理解需要花费大量的时间,这对临床医疗工作繁忙的主要研究者及合作研究者是较难做到的,需要专职研究护士肩负起相关责任。
3.3.2 观察与应急处理的职责 ①药物不良事件及SAE的观察:药物临床试验不仅要评价试验药物的临床疗效,同时还要评价其安全性。专职研究护士在临床试验过程中应密切观察受试者的病情变化及不良反应发生情况,及时发现、记录和报告,对院外受试者进行电话随访,嘱其及时详细地将症状记录于日记卡上;协助主要研究者或合作研究者及时对受试者出现的不良反应给予合理解释,消除受试者的恐慌心理,告知受试者试验期间严禁使用其他同类药物并不得随意更改药物的使用方法;同时,关注受试者合并疾病及用药史,向受试者提供药物信息咨询服务[11]。②注意给药时间及剂量的准确性:不按规定间隔时间及剂量给药会导致血药浓度产生很大波动,过高可发生毒性反应,过低则无效[12]。专职研究护士应严格注意给药时间及剂型的准确性,如发现SAE应及时联系主要研究者或合作研究者作出停药或对症处理;同时详细记录病情及治疗情况,协助合作研究者在24 h内将不良反应事件上报伦理委员会、申办方及CFDA。
3.3.3 沟通与协调的职责 ①防止受试者失访:专职研究护士熟悉试验方案,可协助研究医师严格筛查入选和排除标准,减少方案偏离的发生;此外,做好病例的筛选工作也是防止受试者失访的关键[13]。根据受试者的年龄、住址等基本信息,对其依从性进行初步评估,尽量选择依从性佳的受试者纳入研究,与受试者交换联系方式,定期进行随访,增进双方关系,减少失访的概率。②在住院治疗期间对受试者进行关怀:专职研究护士有更多的时间与受试者进行交流与沟通,使其感受到温暖和关怀。社会支持虽然不能改善受试者的生理症状,但能明显改善受试者的心理状况,如Penedo FJ等[14]研究显示,社会支持能减轻疾病的症状和发展,或改变受试者的行为,提高受试者的依从性。与院外受试者保持联系,确保受试者能够按照计划来院随访,这提高了受试者的依从性,同时可减少“超窗”的发生概率。③协调研究各方时间:主要研究者或合作研究者往往兼任大量临床工作,工作档期满,易遗忘受试者的访视时间。专职研究护士可及时协调研究医师和受试者的时间,确保在访视时间窗内安排受试者进行就诊及检查,及时完成原始病历的记录与填写。
3.3.4 其他职责 专职研究护士还负责收集检验报告,及时粘贴于原始病历上,避免遗失,减少方案偏离的发生;定期接受机构办公室的质量控制检查及本专业自查,接待申办方或国内合同研究组织(CRO)派遣的监察人员的监察,及时发现和弥补问题,避免同一方案偏离重复发生;对其他协助研究护士进行培训,提高各方对GCP及试验方案的依从性,减少方案偏离发生。
3.4 国际与国内多中心临床试验方案偏离发生情况比较
由表4结果可知,国际多中心项目方案偏离发生比例低于国内项目(P<0.01),分析原因可能如下。
(1)严谨、科学的试验方案设计,规范、合理的试验操作是国际多中心项目方案偏离发生率低的前提与保障。国内项目往往因方案设计不严谨或存在缺陷、试验组织实施可操作性不强,使得研究者对方案理解产生分歧,导致试验记录不完善,甚至遗漏某些项目的记录及检查。在临床试验实施过程中,也常发生申办方、项目监查员发现方案缺陷或按他们自己对方案的解读,让研究者在试验实施中作出调整,给研究者造成诸多困惑、无所适从,最后造成方案偏离的情况。
(2)完善的SOP及高素质的监查员是国际多中心项目高质量的重要保证。而国内监查员业务水平良莠不齐,大多未经过严格的GCP培训或缺少严谨的GCP素养,以及对方案的解读与理解不准确、不充分,对试验中的方案偏离不能及时地发现和弥补,对引起方案偏离发生的行为不能及时纠正,从而影响临床试验的质量。
(3)试验数据处理的真实性和合理性,也是国内项目需要学习与完善的地方。国际多中心项目,对整个团队的要求更严谨,对试验组织实施有较强的把控与调节能力;此外,国际多中心项目试验过程中经费充分,宁可进度慢一些或增加开展试验项目的中心,也要追求试验数据的有效真实。这些都为减少方案偏离的发生提供了保障。
4 结语
必须承认,方案偏离在临床试验中是难以避免的。但如果同一方案偏离反复出现,就是对GCP的漠视,也可能潜在影响受试者的安全和权益,还可能破坏研究数据的质量和研究的重现性。笔者通过对我院药物临床试验进行回顾性研究后发现,我院方案偏离的例数逐年减少,而配备了专职研究护士的项目及国际多中心项目方案偏离的发生率更低。笔者建议各中心开展药物临床试验时,应尽可能配备专职研究护士,学习和借鉴国际多中心临床试验项目的试验设计科学严谨、操作流程标准化及数据处理真实的做法,进一步提升国内多中心项目团队的整体实力;研究者需严格遵循GCP原则及研究方案,以更好地保障药物临床试验的质量,减少方案偏离的发生。
[1] 范大超.浅析临床试验中的偏离或违反方案问题[J].中国处方药,2010(10):70-71.
[2] 李见明,孙振球,高荣,等.我国药物临床试验的现状与发展方向[J].中国临床药理学杂志,2013,29(6):473-476.
[3] 吉萍.中国药物临床试验的质量管理[J].中国新药杂志,2013,22(1):13-16.
[4] 沈玉红,高卫,黄建英,等.药物临床试验中存在的主要问题[J].中国医院药学杂志,2012,32(24):2011-2013.
[5] 沈玉红,张正付,李正奇.我国药物临床试验实施问题及对策[J].实用药物与临床,2013,16(2):173-175.
[6] 汶柯,白楠,梁蓓蓓,等.药物临床试验记录文件中常见问题及规范实施办法探讨[J].中国药物应用与监测,2013,10(1):51-54.
[7] 刘琳娜,关波,李诗草,等.我院药物临床试验机构质量控制的操作程序分析[J].中国药房,2014,25(21):1934-1936.
[8]李海燕,吉萍.《药物临床试验质量管理规范》(GCP)在临床研究中的价值及我国研究者的依从情况[J].北京大学学报(医学版),2010,42(6):637-640.
[9] 国家食品药品监督管理局.药物临床试验伦理审查工作指导原则[S].2010-11-02.
[10] 闫广庆,任家顺,陈洪,等.医务人员人文素养在医患沟通中的应用探讨[J].重庆医学,2010,39(14):1927-1928.
[11] Scialdone L.Overview of supportive care in patients receiving chemotherapy:antiemetics,pain management,anemia,and neutropenia[J].J Pharm Pract,2012,25(2):209-221.
[12] 王瑾,柴栋,王昆.医院药物临床试验质量保证体系的建设[J].中国药物应用与监测,2007,4(4):1-3.
[13] 杨春梅,黎艳艳,杨泉.药物临床试验中研究护士依从性的影响因素及对策[J].护理学报,2009,16(15):25-27.
[14] Penedo FJ,Traeger L,Benedict C,et al.Perceived social support asapredictor of disease-specific quality of life in head-and-neck cancer patients[J].J Support Oncol,2012,10(3):119-123.
Retrospective Study on the Protocol Deviation in Drug Clinical Trial Implementation of Our Hospital
LIU Jinhua1,LIU Min2,LIU Yucun1,DUAN Jun1,LU Yi1
(1.Dept.of Respiratory,the First Affiliated Hospital of Chongqing Medical University,Chongqing 400016,China;2.Dept.of Orthodontics,West China Hospital of Stomatology,Sichuan University,Chengdu 610041,China)
R95
A
1001-0408(2017)25-3474-05
2017-03-13
2017-06-29)
(编辑:刘明伟)
DOI10.6039/j.issn.1001-0408.2017.25.06
重庆医科大学附属第一医院护理科研基金项目(No.HLJJ2014-08)
*主管护师。研究方向:新药临床试验及呼吸系统慢病管理。电话:023-89012833。E-mail:Cqmu_liujinhua@126.com
#通信作者:主管护师。研究方向:口腔正畸。电话:028-85503477。E-mail:736919585@qq.com

