喷淋塔氨法脱硫正四价硫氧化数学模型研究
贾 勇,陈宜华,丁希楼,殷李国,钟 秦
喷淋塔氨法脱硫正四价硫氧化数学模型研究
贾 勇1*,陈宜华1,丁希楼1,殷李国1,钟 秦2
(1.安徽工业大学能源与环境学院,安徽马鞍山 243032;2.南京理工大学化工学院,江苏南京 210094)
针对目前氨法烟气脱硫正四价硫S(IV)氧化系统的设计和运行主要依赖于经验,容易造成系统运行不稳定、投资及运行成本高等不足,本文结合S(IV)氧化动力学研究,建立喷淋塔氨法脱硫S(IV)氧化系统的数学模型.该模型能够计算不同浆液pH值、总硫浓度、空气量和停留时间等条件下S(IV)的氧化率.利用该模型对喷淋塔氨法脱硫实验系统中S(IV)的氧化过程进行了模拟,并将计算结果与实验值进行了对比.结果表明,模型计算值和实验值能够较好的吻合,二者之间的误差小于±20%.该模型对喷淋塔氨法脱硫S(IV)氧化系统的优化设计和运行具有较强的理论指导价值.
氨法脱硫;正四价硫;氧化;数学模型
燃煤产生的SO2是造成酸雨和雾霾等环境问题的主要因素之一,在全球范围内受到了普遍关注[1-2].为了满足日益严格的排放标准,燃煤烟气经脱硫处理后方能排入大气.氨法脱硫技术在高效脱除SO2的同时,能够实现硫资源的回收,且无废水和废渣的排放,在我国具有良好的应用前景[3-6].氨法脱硫过程中SO2与NH3·H2O反应生成的S(IV) ((NH4)2SO3和NH4HSO3)热稳定性较差,工程中往往将其氧化成稳定的S(VI)((NH4)2SO4)副产品[7-8].因此,将氨法脱硫吸收生成的S(IV)高效、低能耗地氧化成S(VI)是提高该技术运行稳定性和经济性的关键.
近年来,国内外学者对亚硫酸铵的氧化展开了一系列的研究[7,9-12].然而,研究者在实验过程中普遍采用酸(硫酸或盐酸)和氨水来调节溶液的pH值,但没有考虑引入的酸根离子增强了溶液的离子强度,进而降低了氧气溶解度系数的影响.同时,研究者在实验中控制的pH值与氨法脱硫工程存在一定的差别,如:Gǔrkan等[10]控制pH值为7.0~8.0,Zhou等[11]控制pH值为5.0~8.0,Zhao等[12]控制pH值为5.0~10.0.另外,以往有关氨法脱硫亚硫酸铵氧化的研究中没有对S(IV)中占多数的的氧化进行区分.针对上述不足,作者前期对S(IV)的氧化动力学进行了系统研究,并得出了S(IV)氧化速率方程,能够反映出不同浓度、浓度、pH值、温度和空气量等工艺参数对氨法脱硫S(IV)氧化速率的影响[7].在氨法脱硫工程中,往往在喷淋吸收塔的底部设置氧化槽,利用鼓入的空气将S(IV)氧化成S(VI).氧化槽中S(IV)的氧化率与浆液pH值、S(IV)浓度、空气量和停留时间等因素工艺条件有关.目前,氨法脱硫工程中S(IV)氧化系统的设计和运行主要依赖于经验,缺乏理论模型的指导,系统的稳定性和经济性不易达到最优组合.
本文结合氨法脱硫S(IV)氧化工艺的特点,基于作者前期研究得到的S(IV)氧化动力学方程,对氨法脱硫S(IV)氧化系统的数学模型进行了实验研究.
1 实验
1.1 实验流程
建立如图1所示的喷淋塔氨法脱硫实验系统,由有机玻璃和不锈钢材质组成.喷淋塔直径为0.3m,吸收区有效高度为2m,喷淋塔底部设有氧化槽(0.6m×0.6m×0.6m).SO2钢瓶气(浓度99.99%)经减压阀、稳压阀和转子流量计控制流量,与风机提供的空气在混合罐内充分混合后,形成模拟烟气.模拟烟气从喷淋塔吸收区的底部进入,折转向上与喷淋而下的液滴逆流接触进行脱硫反应,脱硫后的烟气经除雾器除去夹带的液滴后排入环境大气.吸收SO2后的浆液落入喷淋塔底部的持液槽,浆液中的S(IV)被鼓入的空气氧化成为S(VI).为了维持浆液的吸收能力,质量浓度为17%~20%的氨水从循环泵前的管路加入到浆液中,氨水的加入量根据监测浆液的pH值进行控制.浆液中总硫的摩尔增加速率可根据烟气量、SO2浓度和脱硫效率进行确定.为了保持液槽内浆液浓度的稳定,由持液槽底部的放空阀将部分浆液排出,浆液的排出量根据浆液中总硫的摩尔增加率和浆液浓度确定.
实验过程中浆液的浓度累积需要较长时间,为了模拟氨法脱硫工程中的运行条件,同时考虑实验操作的可行性,实验开始前向喷淋塔底部持液槽内加入固体硫酸铵,配置具有一定浓度的浆液.实验系统稳定运行1h后开始测量.
1.2 测量方法
采用德国MRU公司的Vario Plus型烟气分析仪测量喷淋塔进出口烟气中的SO2浓度;采用HANNA公司的HI198128型pH计测量浆液的pH值;采用碘量滴定法(HJ/T60-2000)测量浆液中S(IV)浓度[13],浆液中和的浓度根据S(IV)浓度和浆液pH值,由和的分布系数计算得出[8].浆液中S(IV)的氧化率可由进行计算.
2 模型
2.1 模型假设
持液槽内S(IV)氧化过程中涉及复杂的物理化学过程,较难用数学模型完全按照实际情况进行模拟,因而做出如下假设:(1)持液槽内浆液完全混合,且各离子浓度分布均匀;(2)持液槽浆液中的化学平衡和离子平衡在瞬间完成;(3)持液槽内S(IV)氧化过程中浆液的pH值稳定不变;(4)持液槽内气泡直径及其分布均匀,且浆液温度分布均匀.
2.2 模型
持液槽物理模型示意如图2所示.
稳态条件下,流入和流出持液槽内的浆液流量平衡可表述为:
式中:in为进入氧化槽的浆液流量,L/min;out为氧化槽排出浆液流量,L/min;re为氧化槽循环浆液流量,L/min.为了保持持液槽内浆液浓度的恒定,将持液槽内的部分浆液排出(工程中对排出浆液进行硫酸铵结晶处理),浆液的排出量可按式(2)进行计算:
(2)
式中,为时间,min;为持液槽体积,L;i为持液槽进、出口浆液中离子摩尔流率之差,其表达式为:
(4)
式(3)中,react为离子的生成速率,单位mol/ min,可按式(5)进行计算:
因此,持液槽内S(IV)和S(VI)的浓度变化速率可分别按式(6)和(7)进行计算:
(7)
(9)
式中:0为氧气在水中的溶解度系数, mol/ (m3·Pa);I为离子强度;为比例系数,它是电解质正、负离子对被溶解的气体所引起的数值,可按下式进行计算:
(11)
式(8)中:为气-液接触比表面积,m2/m3;0为常数;为气体平衡常数,J/(mol·K);为温度,K.式(8)中,氧气的液相传质系数L可按式(12)进行计算[17-18]:
式中:为重力加速度,m/s2;L为浆液密度,kg/m3;为浆液表面张力,N/m;氧气在液相的扩散系数(m2/s)及气泡的平均直径vs(m)可分别按式(13)和(14)进行计算:
(13)
式中:为系数;B为溶剂摩尔质量,g/mol;L为浆液粘度,Pa·s;A为氧气的摩尔体积,cm3/mol.
式中:R为持液槽直径,m;OG为持液槽内氧化空气的表观气速,m/mol.
式(8)中:气液接触面积可按式(15)进行计算[14]:
式中:持液槽浆液中的气含率G可按式(16)进行计算:
(16)
2.3 计算方法
基于上述假设,持液槽可近似看作连续流全混鼓泡反应器,持液槽排出浆液和持液槽内浆液的组成完全一致.稳态条件下,持液槽中的离子浓度恒定不变,且持液槽内生成速率()与SO2吸收速率()的摩尔比等于浆液中S (VI)浓度()与总硫浓度()的摩尔比.当持液槽溶液中的总硫浓度和其它参数一定的条件下,S (IV)的氧化率也是一定值.输入浆液pH值、、、停留时间、浆液表面张力和空气量等参数,利用模型计算(IV),考察浆液pH值、空气量、浆液浓度和停留时间等因素对S(IV)氧化率的影响.计算过程中考察某一因素对S(IV)氧化率影响时,其他因素设为定值,调节和的值,直至和的绝对误差小于0.001,此时和的比即为该条件下持液槽中S (IV)的氧化率.模型计算流程如图3所示:
模型参数如表1和表2所示:
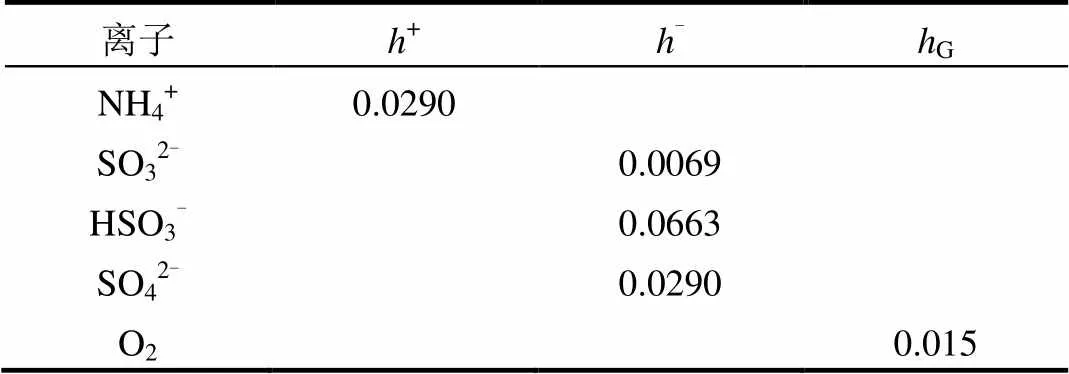
表2 模型参数(h+, h-和hG)[16]
3 结果与讨论
3.1 pH值的影响
浆液pH值对S(IV)氧化率模型计算值的影响如图4所示.从图4中可以看出,S(IV)的氧化率随着pH值的增加而降低,当浆液pH值从5.0增加到6.0时,浆液中S(IV)的氧化率从81.9%下降至60.3%.氨法脱硫浆液中, S(IV)含有的 SO2(aq)、和的分布系数可分别表示为[8]:
(18)
(19)
氨法脱硫工程中浆液的pH值一般控制为5.0~6.0,在此pH值范围内浆液中几乎无游离的SO2,S(IV)主要以和的形式存在.由分布系数可知,和的浓度比是pH值的单值函数,浆液中的浓度随pH值的降低而升高.较更容易被氧化,因而S(IV)的氧化率随着pH值的升高而下降.研究者们在S(IV)氧化动力学研究中也曾指出,降低浆液的pH值有利于提高S(IV)的氧化速率.然而,S(IV)氧化过程中pH值的控制需综合考虑S(IV)氧化率和脱硫效率.
Z3.2 空气量的影响
空气量是氨法脱硫S(IV)氧化过程中的一个重要控制参数.工程中为了确保浆液中S(IV)氧化完全,往往向持液槽中鼓入过量的空气,一般实际空气量为理论空气量的2倍.利用上述模型计算不同pH值条件下空气量对S(IV)的氧化率的影响,结果如图5所示.
图5中的数据表明,相同pH值条件下S(IV)的氧化率随着实际空气量与理论空气量的摩尔比增大而升高,且保持浆液较低的pH值有利于S(IV)氧化.另外,从图中还可以看出,实际空气量与理论空气量的摩尔比从1增加至2时,S(IV)氧化率增加速度较快,此后继续增加空气量S(IV)的氧化率增加缓慢.分析原因可能在于,当实际空气量与理论空气量的摩尔比从1增加至2时,液相中气泡数量和气液接触面积增加迅速,有利于空气中的O2扩散进入液相并参与氧化反应;当实际空气量与理论空气量的摩尔比在2以上继续增加时,气泡之间的聚合现象加剧,持液槽中氧化空气的表观气速增加,且气泡在液相的停留时间变短,不利于O2从气相扩散进入液相.
3.3 浆液浓度的影响
文献中氧化动力学研究表明,浆液中总硫浓度s(,和)对S(IV)的氧化速率具有较大的影响.利用上述模型计算了不同pH值条件下S(IV)氧化率随s的变化情况,结果如图6所示.从图6中可以看出,S(IV)的氧化率随着浆液中s的增大而降低,当pH值为5.0,s从1.6mol/L增加到2.4mol/L的过程中,S(IV)的氧化率从91.8%下降至73.6%;而当pH值为6,s在1.6~2.4mol/L的范围内,S(IV)的氧化率最大为70.9%.结合式(13)~(16)可以推测原因,一方面S(IV)的氧化速率(IV)随着浓度的增加而降低,另一方面浆液中的离子强度随着s的增加而增大,进而降低了O2的溶解度系数,不利于S(IV)的氧化.
3.4 停留时间的影响
浆液在持液槽内的停留时间是氨法脱硫S(IV)氧化系统设计和运行的重要参数.图7显示了不同pH值条件下持液槽浆液停留时间对S(IV)氧化率计算值的影响.从图7中可以看出,相同pH值条件下,S(IV)的氧化率随着停留时间的增加而增大.当pH为5.0,停留时间从4min增加至12min时,S(IV)的氧化率从58.5%增加至95%,当停留时间继续增加至16min以上时,浆液中的S(IV)几乎完全被氧化.另外,图7中的数据同时还表明,当停留时间在12min以下增加时,S(IV)的氧化率增加迅速,此后S(IV)的氧化率随停留时间增加缓慢.原因可能在于,由于S(IV)氧化速率的限制,S(IV)的氧化需要一定的时间,浆液在持液槽内的停留时间越长,S(IV)的氧化率越高;另外,随着氧化反应的进行,浆液中浓度逐渐升高,S(IV)的氧化速率随着停留时间的增加而减缓.
3.5 模型验证
为了验证模型的合理性,在如图1所示的喷淋塔氨法脱硫系统中进行S(IV)氧化实验,并与模型计算值进行对比.实验过程中,控制实际空气量与理论空气量的摩尔比为1.0~1.2,持液槽内浆液pH值为5.08~5.3,浆液中总硫浓度s为1.49~ 1.70mol/L.实验值与实验条件下模型计算值的对比如图8所示.
从图8中可以看出,实验值和模型计算值能够较好的吻合,二者之间的误差小于±20%.另外,图8中的数据同时还表明,S(IV)的模型计算值较实验值偏大,原因可能在于液相中气泡之间存在凝并现象,导致气泡的直径和分布不均匀.
4 结论
4.1 在前期S(IV)氧化动力学研究的基础上,结合氨法脱硫S(IV)氧化工艺的特点建立了喷淋塔氨法脱硫S(IV)氧化系统的数学模型.
4.2 利用该模型能够计算不同浆液pH值、总硫浓度、氧化空气量和停留时间等操作条件下S(IV)的氧化率,对喷淋塔氨法脱硫S(IV)氧化系统的设计和运行具有较大的理论指导价值.
4.3 实验值与实验条件下S(IV)氧化率的计算值对比结果表明,模型计算值能够较好的符合实验值,二者之间的误差小于±20%.
[1] 张 军,张涌新,郑成航,等.复合脱硫添加剂在湿法烟气脱硫系统中的工程应用[J]. 中国环境科学, 2014,34(9):2186-2191.
[2] 白敏菂,毛首蕾,朱玉鹏,等.O2+、O3同时脱硫脱硝实验[J]. 中国环境科学, 2014,34(2):324-330.
[3] 周理明,史永永,李海洋,等.氨法烟气脱硫过程的工艺优化 [J]. 化学工程, 2014,42(4):7-12.
[4] 黄荣廷,潘丹萍,盛 溢,等.氨法烟气脱硫过程中气溶胶颗粒生成特性 [J]. 化工学报, 2015,66(11):4366-4372.
[5] Borio D C. Process for the absorption of sulfur oxides and the production of ammonium sulfate: US, 6531104B1 [P]. 2003- 11-03.
[6] Gao X, Ding H L, Du Z, et al. Gas-liquid absorption reaction between (NH4)2SO3solution and SO2for ammonia-based wet flue gas desulfurization [J]. Applied Energy, 2010,87(8):2647- 2651.
[7] Wang L D, Zhao Y. Kinetics of sulfite oxidation in wet desulfurization with catalyst of organic acid [J]. Chemical Engineering Journal, 2008,136(2/3):221-226.
[8] Jia Y, Zhong Q, Fan X Y, et al.Kinetics of oxidation of total sulfite in the ammonia-based wet flue gas desulfurization process [J]. Chemical Engineering Journal, 2010,164(1):132-138.
[9] Long X L, Li W, Xiao W D, et al. Novel homogeneous catalyst system for the oxidation of concentrated ammonium sulfite [J]. Journal of Hazardous Materials, 2006,129(1-3):260-265.
[10] Gŭrkan T, Nufal A, Eroğlu I. Kinetics of the heterogeneous oxidation of ammonium sulfite [J]. Chemical Engineering Science, 1992,47(13/14):3801-3808.
[11] Zhou J H, Li W, Xiao W D. Kinetics of heterogeneous oxidation of concentrated ammonium sulfite [J]. Chemical Engineering Science, 2000,55(23):5637-5641.
[12] Zhao B, Li Y, Tong H L, et al. Study on the reaction rate of sulfite oxidation with cobalt ion catalyst [J]. Chemical Engineering Journal, 2005,60(3):863-868.
[13] HJ/T60-2000 水质硫化物的测定-碘量法 [S].
[14] Ueyama K, Hatanka J. Salt effect on solubility of nonelectrolyte gases and liquids [J]. Chemical Engineering Science, 1982,37(5): 790-792.
[15] Thomas D, Colle S, Vanderschuren J. Kinetics of SO2absorption into fairly concentrated sulphuric acid solution containing hydrogen peroxide [J]. Chemical Engineering Science, 2003, 42(6):487-494.
[16] 朱炳辰.化学反应工程 [M]. 北京:化学工业出版社, 2007:187- 210.
[17] Aktia K, Yoshida F. Bubble size interfacial area and liquid-phase mass transfer coefficient in bubble columns [J]. Industrial & Engineering Chemical Processing and Design, 1974,13(1):84-91.
[18] 伍 钦,钟 理,邹华生,等.传质与分离工程 [M]. 广州:华南理工大学出版社, 2005:100-102.
Investigation of mathematical model of oxidation of total sulfite of ammonia-based desulphurization in a spray scrubber.
JIA Yong1*, CHEN Yi-hua1, DING Xi-lou1, YIN Li-guo1, ZHONG Qin2
(1.School of Energy and Environment, Ahhui University of Technology, Maanshan 243032, China;2.School of Chemical Engineering, Nanjing University of Science and Technology, Nanjing 210094, China).
In order to solve the disadvantage of the design and operation of total sulfite oxidation system of ammonia-based desulphurization process relied on experience, resulting in fluctuation of service, high cost of investment and high operation cost, a mathematical model of total sulfite oxidation system was developed based on investigation of kinetics of oxidation of total sulfite. The model can predict the oxidation ratio of total sulfite at different parameters such as pH of solution, total sulfur concentration, air flow and residence time. The model was used to simulate the oxidation of total sulfite of a lab-scale ammonia-based desulphurization system and the predicted oxidation ratio of total sulfite was compared with the measured values. The results showed that the predicted oxidation ratio of total sulfite agreed well with the experimental values and the difference between the two was below ±20%. The mathematical model would assist us in the design and operation of the total sulfite oxidation system of ammonia-based desulphurization process.
ammonia-based desulphurization;total sulfite;oxidation;mathematical model
X511
A
1000-6923(2017)04-1291-07
2016-08-01
国家自然科学基金资助项目(51308002);国家重大研发计划项目(2016yfc0801605)
贾 勇(1981-),湖南常德人,副教授,博士,主要从事烟气脱硫脱硝研究.发表论文20余篇.
* 责任作者, 副教授, jiayong2000@163.com
, 2017,37(4):1291~1297

