建泽泻鲨烯合酶原核表达、功能验证及其免疫检测研究
刘青芝+谷巍+吴启南+巢建国+桑晓华+刘琪+王小浩

[摘要] 泽泻鲨烯合酶 (AoSS) 催化法呢基焦磷酸[(farnesyl diphosphate, FPP)]合成鲨烯,是碳源流向原萜烷型三萜生物合成的关键调节酶。为深入研究AoSS基因的功能及表达,课题组将前期克隆获得的建泽泻鲨烯合酶基因(accession No. JX866770) 的开放阅读框(ORF)构建到原核表达载体 pCzn1上,并在大肠杆菌BL21(Roseta)中进行诱导表达,诱导表达出的融合蛋白主要以包涵体的形式存在,经纯化获得高纯度的目的蛋白;以此目的蛋白进行体外酶促反应验证其功能,其结果显示该目的蛋白具有催化法呢基焦磷酸生成鲨烯的活性;为进一步研究其表达规律,在此基础上,利用该蛋白免疫新西兰兔制备多克隆抗体并纯化,ELISA检测抗体效价大于1∶51 200,Western blotting 检测表明其具有较好的特异性;用制备得到的抗体免疫检测建泽泻AoSS在不同组织中的表达情况,结果显示建泽泻块茎中AoSS表达最高,其次为叶,根中表达甚微。原核表达载体的成功构建、基因功能的进一步验证及快速免疫检测方法的建立,为进一步开展AoSS基因功能及其调控的研究奠定基础,为泽泻资源性成分原萜烷型三萜的合成生物学应用提供科学依据。
[关键词] 建泽泻; 鲨烯合酶; 原核表达; 功能验证; 免疫检测
[Abstract] Squalene synthase of Alisma orientale catalyzes farnesyl diphosphate (FPP) to form squalene, which is the key regulatory enzyme of the carbon source flow to protostane triterpenes biosynthesis. For further research on the function and expression of AoSS gene, the open reading frame (ORF) of squalene synthase gene (accession no. JX866770) from A. orientale was subcloned into a prokaryotic expression vector pCzn1 and induced the expression of AoSS gene in Escherichia coli BL21(Roseta). The fusion protein was mainly in the form of inclusion bodies and purified to obtain high purity protein. By verifying its functionality through vitro enzymatic reaction, the results showed that the catalytic protein had the catalytic activity of FPP into squalene. In order to research the expression of AoSS in A. orientale, the purified protein was used to immunized rabbits to prepare polyclonal antibody which was then purified, the titer of the antibody was greater than 1∶51 200 by ELISA detection, and displayed good specificity by Western blotting. The prepared antibody was used for immunoassay of AoSS in different organs of A. orientale, and the results showed that the AoSS expression level was the highest in tubers, followed by leaves, and lowest in root. Successful construction of prokaryotic expression vector, validation of gene functions and establishment of rapid immunoassay lay the foundation for further researches on the function and regulation of AoSS gene, and also provide scientific basis on the application of the protostane triterpenes of A. orientale in the field of synthetic biology.
[Key words] Alisma orientale; squalene synthase; prokaryotic expression; functional identification; immunoassay
澤泻Alismatis Rhizoma为泽泻科植物东方泽泻Alisma orientale的干燥块茎,具有利水、渗湿、泄热之功效,道地产区为福建[1-2]。泽泻的主要药效成分为原萜烷型(protostane)四环三萜类[2-3],其结构独特,C-10位和C-14位上有β-CH3,C-8上有α-CH3,C-20为S构型,该类成分具有抗高血脂、降血压、抗HIV1、抗癌等显著活性[4-7]。近期的研究表明,原萜烷型三萜能促进肝再生和防止ANIT诱导的肝毒性和胆汁淤积[5-8],但该类成分在植物体中含量低,分布窄,仅存在于泽泻属等少数植物类群中[9-11],限制了其进一步开发利用。生物工程是提高活性成分含量的有效途径之一,而活性物质的生物合成效率与其合成途径中的关键酶密切相关。endprint
植物体内三萜类化合物的生物合成主要通过甲羟戊酸(mevalonic acid pathway,MVA) 途径[12],鲨烯合酶(squalene synthase,SS) 能够催化2分子的法呢基焦磷酸(farnesyl diphosphate,FPP) 生成1分子的鲨烯,是碳源流向三萜类化合物合成路径的关键调节酶[13-14]。目前,SS基因从雷公藤Tripterygium wilfordii[13]、甘草Glycyrrhiza uralensis[14]、人参Panax ginseng[15]、睡茄Withania somnifera[16]、厚朴Magnolia officinalis[17]等药用植物中已克隆获得。研究发现,通过诱导睡茄鲨烯合酶的表达,能够提高植物甾醇的含量[18];而通过抑制人参鲨烯合酶的表达,可使三萜皂苷的生成量降低[19]。鲨烯合酶作为三萜类成分生物合成途径的关键酶,在合成途径中发挥重要的作用,而有关建泽泻三萜类成分生物合成鲨烯合酶的研究除本课题组前期工作外未见报道[20]。
课题组前期已克隆获得建泽泻鲨烯合酶基因全长AoSS(accession No. JX866770)[20],其功能以及在植物体内的表达有待进一步验证与研究。目的蛋白的获取是研究其功能的前提,而制备高效价的抗体是研究蛋白基因表达的重要工具。本研究通过原核表达获得目的蛋白,利用体外酶促反应验证其功能,并运用获得的纯化蛋白免疫新西兰兔制备多克隆抗体,建立快速免疫检测方法,分析AoSS在建泽泻中不同组织的表达,为研究AoSS的功能及参与的蛋白翻译调控机制提供了基础资料,同时也为该类资源性成分生物合成途径的阐明提供科学依据。
1 材料
1.1 样品 实验用材料采自福建建瓯,经南京中医药大学药学院谷巍教授鉴定为泽泻科植物东方泽泻A. orientale。取建泽泻的叶、块茎、根分装于冻存管中,在液氮中保存备用。原核表达载体pCzn1购自南京钟鼎生物技术有限公司,转化菌株Escherichia coli DH5α、表達宿主细胞BL21(Roseta)由本实验室保存。
1.2 试剂 DNA胶纯化试剂盒、质粒小提试剂盒购自Axygen公司;T4 DNA连接酶、限制性内切酶、羊抗兔IgG (HRP标记) 购自南京钟鼎生物技术有限公司;苯甲基磺酰氟(PMSF)、异丙基硫代β-D-半乳糖苷(IPTG)、氨苄青霉素(Amp)、蛋白酶抑制剂(bacteria protease inhibitor cocktail)、FPP购自Sigma公司;Ni2+IDA亲和色谱胶购自Novagen公司;0.22 μm无菌滤器和透析袋购自Millipore公司,其他试剂均为分析纯;引物合成及测序由上海生工生物工程股份有限公司完成。
1.3 仪器 台式高速冷冻离心机 (Beckman)、Biologic LP层析系统(Bio-Rad)、小型垂直电泳槽Mini-PROTEAN Tetra System (Bio-Rad)、凝胶成像系统(Bio-Rad)、PTC-200基因扩增仪(MJ Research)、Nano-Drop 2000核酸/蛋白定量仪(Thermo)、气质联用仪Agilent7890B-7000C(DB-5MS,0.25 μm×0.25 mm×30 m,Agilent)。
2 方法
2.1 原核表达载体pCzn1-SS的构建 根据提交到NCBI上的建泽泻AoSS基因全长cDNA序列 (accession No. JX866770),找出其完整的ORF序列设计并合成引物,上游引物5′-ATGGAGCTCGACCCGCACC-3′(下划线为SacI酶切位点),下游引物5′-TAATCTAGATAGGTAATCTC-3′(下划线为XbaI酶切位点)。进行PCR扩增,PCR反应体系(50 μL):10×PCR缓冲液5.0 μL,25 mmol·L-1 MgCl2 4.0 μL,10 mmol·L-1dNTP 4.0 μL,10 nmol·L-1上下游引物各1.0 μL,cDNA模板5.0 μL,5 U rTaq DNA聚合酶0.5 μL,ddH2O 29.5 μL。PCR反应程序:94 ℃预变性5 min,94 ℃ 30 s,54 ℃ 30 s,72 ℃延伸 1 min,30个循环,再72 ℃延伸7 min。PCR产物经琼脂糖电泳检测后,切胶回收PCR目的片段,用SacI和XbaI进行双酶切后,连接到表达载体pCzn1上,然后转入大肠杆菌DH5α,酶切和测序鉴定阳性克隆。
2.2 AoSS基因的原核表达 将测序正确的重组质粒pCzn1-SS转入表达菌BL21(Roseta)中,筛选出阳性克隆,挑取阳性克隆接入含有50 mg·L-1 Amp的LB培养基中,37 ℃过夜振荡培养,按1∶100将过夜菌转接至100 ml 含50 mg·L-1 Amp的LB培养液中,37 ℃振荡培养至A600为0.6~0.8时,取出 1 mL留作诱导前的对照,向剩余的培养物中加入IPTG至终浓度为 0.5 mmol·L-1,11 ℃ 220 r·min-1诱导12 h,离心收集菌体。分别取诱导前菌液,诱导后菌液,诱导后菌液的上清及沉淀作为样品,进行 10% SDS-PAGE 电泳分析。
2.3 重组蛋白的纯化与复性 将诱导表达的培养菌液低温离心10 min,菌体沉淀重悬与20 mL裂解缓冲液(20 mmol·L-1Tris-HCl,含1 mmol·L-1 PMSF、bacteria protease inhibitor cocktail,pH 8.0)超声破碎20 min,破碎液12 000 r·min-1 4 ℃离心 20 min,收集沉淀,使用包涵体洗涤液(20 mmol·L-1Tris,1 mmol·L-1 EDTA,2 mol·L-1尿素,1 mol·L-1NaCl,1% Triton X-100,pH 8.0)洗涤包涵体3次,用包涵体溶解液(20 mmol·L-1Tris,5 mmol·L-1 DTT,8 mol·L-1尿素 pH 8.0) 按一定比例溶解包涵体,4 ℃放置过夜后,15 000 r·min-1离心15 min,将包涵体溶解液滴加到20 mmol·L-1 Tris,pH 8.0 缓冲液逐步成倍梯度稀释,缓慢搅拌,至尿素浓度达到0.5 mol·L-1时,将蛋白溶液装入透析袋,于4 ℃ 在20 mmol·L-1 PBS,pH 7.4中透析过夜;进行10% SDS-PAGE 分析。endprint
2.4 原核表达蛋白体外酶促反应 酶促反应体系[21]:总体系为200 μL,5 mmol·L-1 FPP,50 mmol·L-1 MgCl2,25 μmol·L-1巯基乙醇,25 μmol·L-1 NADPH,0.8 g·L-1AoSS蛋白纯化产物,pH 7.2 磷酸缓冲液补足,上覆400 μL正己烷,在35 ℃反应2 h,充分涡悬振荡后1万 r·min-1离心,取携带空载体菌液提取的蛋白代替AoSS蛋白,其他组分不变,作为对照组,采用气质联用仪(GC-MS)对催化产物进行检测。GC-MS条件:电离方式EI,电子能量70 eV,载气为氦气,进样口温度260 ℃,120 ℃ 3 min,以15 ℃·min-1升至180 ℃,再以25 ℃·min-1升至260 ℃,保持25 min。
2.5 多克隆抗体制备及纯化 将纯化蛋白免疫新西兰白兔(2~2.5 kg),皮下免疫400 μg/次,2~3周免疫1次,免疫4次。采血检测,通过间接ELISA方法确定抗血清针对蛋白的效价,待效价大于1∶5万 进行最终采血制备抗血清,并准备纯化。将蛋白与琼脂糖介质偶联制备成抗原亲和纯化色谱柱,将所得抗血清与PBS等量混合后缓慢上样,待抗原抗体结合后用甘氨酸洗脱缓冲液洗脱,得到所需纯化抗体,立即在PBS中进行4 ℃透析过夜,隔日进行浓度、纯度及效价测定。
2.6 多克隆抗体浓度、纯度及效价测定 采用BCA蛋白浓度测定试剂盒对所得抗体进行浓度测定;通过SDS-PAGE电泳,考马斯亮蓝染色观察纯化抗体的纯度;采用间接ELISA检测抗体效价:用包被液(0.05 mol·L-1碳酸盐缓冲液,pH 9.6)将AoSS稀释至5 mg·L-1,每孔加入100 μL,置于4 ℃中包被过夜。次日每孔加入100 μL 5%的脱脂奶粉,37 ℃孵育1 h,PBST(pH 7.4)洗涤3次;加100 μL倍比稀释的兔抗血清,以阴性血清作为对照,37 ℃孵育1 h,同上洗涤3次。加100 μL HRP标记的羊抗兔IgG,37 ℃孵育1 h,同上洗涤3次。加底物 TMB室温显色20 min,终止反应后,于450 nm处读取吸光度(A)。
2.7 Western blotting 测定抗体特异性 将纯化的AoSS蛋白和未经诱导的重组菌表达的蛋白经SDS-PAGE后转膜,以纯化的多克隆抗体作为一抗,HRP标记的羊抗兔IgG作为二抗,进行蛋白Western blotting分析,洗膜增强化学发光法(enhanced chemiluminescence,ECL)进行显影。
2.8 多克隆抗体在建泽泻组织中的免疫检测 分别取建泽泻的块茎、叶及根各200 mg,剪碎加入适量裂解液(使用前加PMSF),匀浆器匀浆,充分裂解,以制备的多克隆抗体为一抗,β-actin 蛋白作为内参照,取上清进行Western blotting,Image J软件进行灰度定量分析。
3 结果与分析
3.1 原核表达载体的构建及鉴定 利用PCR的方法,将建泽泻鲨烯合酶基因(accession No. JX866770)的ORF插入到原核表达载体pCzn1的SacI和XbaI酶切位点之间,获得了N端携带有HIS6表达标签的重组表达载体pCzn1-SS (图1A),提取质粒,酶切验证,获得了1条1 500 bp大小的DNA 片段和1条约5 000 bp的载体片段(图1B),与预期大小一致;测序结果显示,重组表达载体pCzn1-SS插入的序列与本课题组克隆的泽泻AoSS基因的ORF序列完全一致,此结果表明,获得了正确的重组原核表达载体pCzn1-SS。
3.2 重组蛋白的诱导表达 将构建好的重组质粒pCzn1-SS转化表达菌BL21(Roseta)中,经过0.5 mmol·L-1IPTG诱导,将IPTG 诱导后的菌体超声破碎,离心后分别取上清和沉淀进行SDS-PAGE蛋白电泳分析,在46 kDa处出现1条预期大小的特异性条带,与预测的蛋白分子量相吻合,表明已表达出融合蛋白AoSS,且蛋白存在于沉淀中,为包涵体蛋白(图2A)。
3.3 重组蛋白的纯化及复性 超声破碎表达菌后离心收集包涵体,用包涵体洗涤液洗涤除去杂质,然后采用8 mol·L-1尿素使包涵体变性溶解,逐步成倍梯度稀释尿素浓度使其蛋白复性,SDS-PAGE检测获得单一目的条带,结果表明获得纯度较高的鲨烯合酶重组蛋白(图2B)。
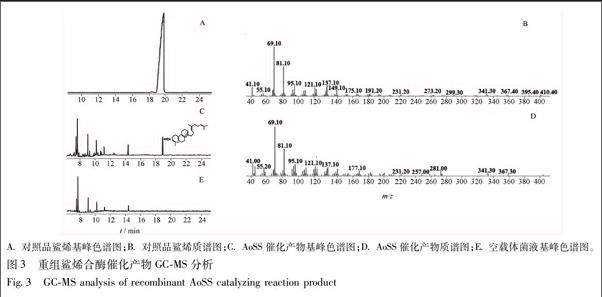
3.4 蛋白酶促反应产物分析 取纯化的鲨烯合酶重组蛋白进行体外酶促反应,催化产物经正己烷萃取后用GC-MS分析,结果显示催化的产物单一,样品的保留时间(RT)在18.901存在特征峰,而对照中并未检测到相应的特征峰,根据GC-MS联用仪所得质谱信息与文献中的标准谱图对照分析[17,21],由此确定该催化产物为鲨烯(图3)。此结果表明,经RACE方法克隆的全长cDNA编码的建泽泻鲨烯合酶具有催化FPP生成鲨烯的活性。
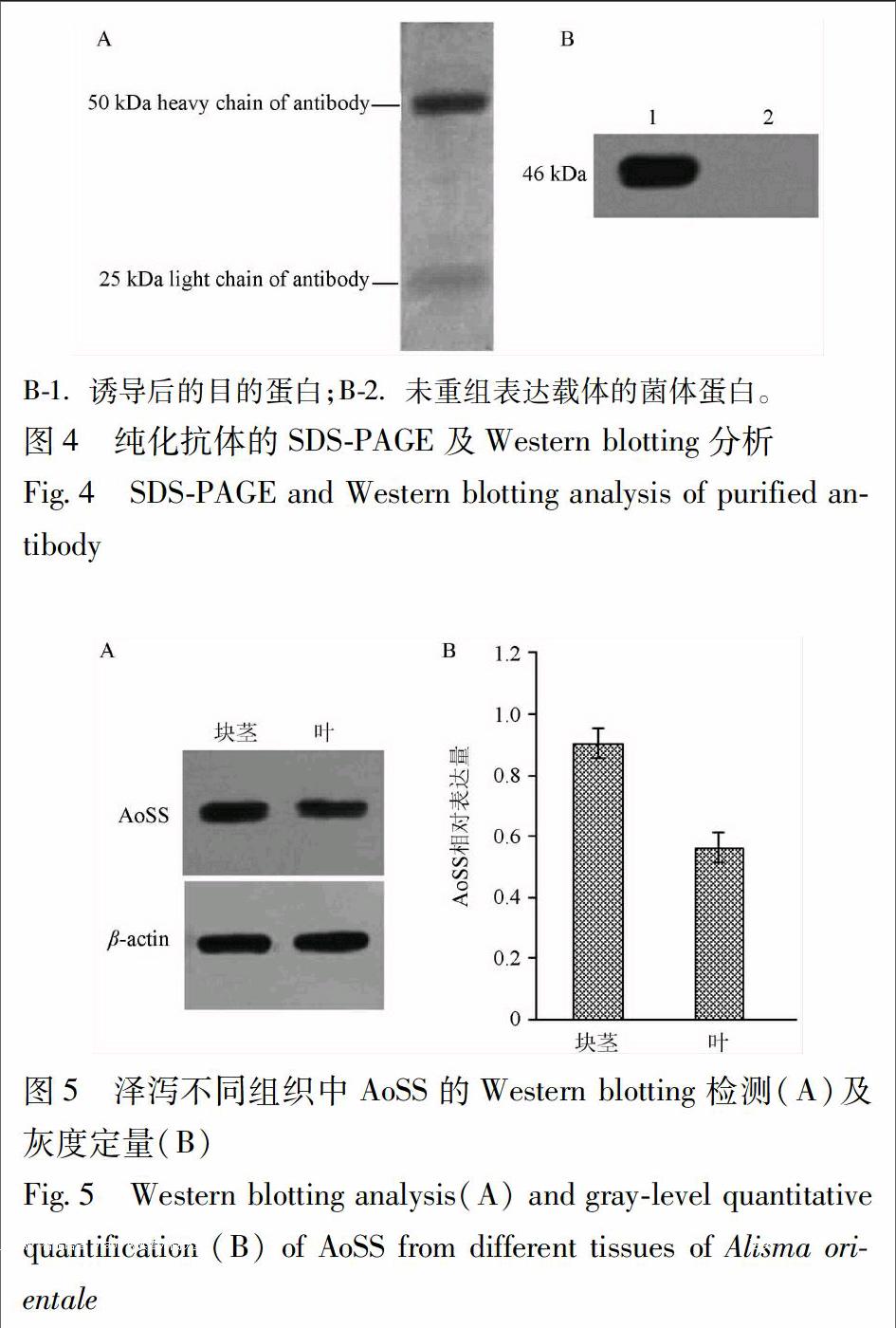
3.5 多克隆抗体浓度、纯度及效价测定 利用纯化的蛋白免疫新西兰兔,制备AoSS多克隆抗体并纯化,测得抗体浓度为0.22 g·L-1,其纯度在 95%以上(图4A)。以纯化的融合蛋白为包被抗原,抗血清以500~512 000倍数稀释,按酶标仪检测的A450大于阴性对照A450的2.1倍时,则判为阳性,其结果显示抗体效价在1∶512 000以上。
3.6 Western blotting 测定抗体特异性 采用Western blotting对纯化的多克隆抗体进行特异性检测,检测结果显示制备的抗体可特异识别目标抗原,而未经诱导的重组菌表达的蛋白未见信号(图4B),表明制备的AoSS多克隆抗体特异性好。
3.7 建泽泻组织中AoSS蛋白的免疫检测 采用制备的抗体对建泽泻不同组织中的AoSS蛋白进行检测。AoSS在块茎和叶中均有表达(图5A),而根中表达甚微。块茎、叶通过Western blotting 检测和ImageJ软件灰度定量分析,建澤泻块茎中AoSS蛋白表达量高于叶(图5B)。endprint
4 討论
鲨烯合酶为三萜生物合成途径中的关键酶,竞争利用 FPP 合成三萜,其含量和活性决定了下游产物的含量,SS基因的过量表达可促进三萜类化合物合成[17,22]。本研究在前期克隆获得AoSS全长的基础上,开展建泽泻鲨烯合酶原核表达、功能验证及其免疫检测研究,为进一步开展AoSS基因功能及其调控机制研究奠定基础。
构建原核表达载体,将目的蛋白在大肠杆菌内高效表达。但由于原核生物缺乏蛋白质翻译后加工修饰的过程,使蛋白无法折叠或形成正确的二硫键,常以包涵体的形式存在于细胞中[23]。包涵体因立体结构存在错误,没有生物活性,包涵体的复性是获取有活性蛋白的关键步骤,包涵体的复性条件对其构象和活性有着重要的影响[24]。因此,本研究将充分洗涤的包涵体溶解于8 mol·L-1的尿素,逐步成倍梯度稀释降低尿素浓度,有助于减少蛋白复性过程中产生的沉淀,确保包涵体能够形成正确的二硫键,进行特定空间结构的折叠,最终获得可溶性且具有生物活性的AoSS蛋白。AoSS目的蛋白的获得为其功能鉴定提供底物,同时也为多克隆抗体的制备提供材料基础。
体外表达蛋白催化活性分析是基因功能研究的重要手段[25],本研究对得到的蛋白,采用体外酶促反应验证其功能,GC-MS结果显示该蛋白具有催化FPP生成鲨烯的活性。本研究首次证明了建泽泻鲨烯合酶基因的功能,为揭示泽泻三萜形成的分子机制奠定了理论基础,为全面解析三萜生物合成的机制提供依据。
从翻译水平探讨泽泻原萜烷型三萜类化合物与AoSS表达的关系,免疫学技术是研究蛋白质表达水平的有效方法,因其快速、简便、特异性高、不依赖酶活性、易于标记等特点,得到较为广泛的应用[26]。本研究利用纯化的AoSS蛋白免疫新西兰兔,制备获得多克隆抗体,ELISA及Western blotting 结果显示其抗体具有较高的效价及良好的特异性,建立快速免疫检测方法,对建泽泻不同组织中的AoSS蛋白表达进行分析,结果显示其在块茎中表达量最高,其次是叶,根中表达甚微。泽泻块茎不仅是原萜烷型三萜成分形成的主要器官,也是贮藏器官[11],较高的表达量可能与原萜烷型三萜合成部位有关,推测泽泻原萜烷型三萜生物合成的主要器官为块茎。本研究为泽泻原萜烷型三萜生物合成途径阐明及其调控机制研究奠定基础,为该类资源性成分的合成生物学应用提供科学依据。
[参考文献]
[1] Miyazawa M, Yoshinaga S, Kashima Y, et al. Chemical composition and characteristic odor compounds in essential oil from Alismatis Rhizoma(tubers of Alisma orientale)[J]. J Oleo Sci, 2016, 65(1): 91.
[2] Mai Z P, Zhou K, Ge G B, et al. Protostane triterpenoids from the rhizome of Alisma orientale exhibit inhibitory effects on human carboxylesterase 2[J]. J Nat Prod, 2015, 78(10): 2372.
[3] Kim K H, Kwun M J, Choi J Y, et al. Therapeutic effect of the tuber of Alisma orientale on lipopolysaccharide-induced acute lung injury[J]. Evid Based Compl Alt, 2013, 2013:863892.
[4] Zhang S, Sodroski J. Efficient human immunodeficiency virus (hiv-1) infection of cells lacking PDZD8[J]. Virology, 2015, 481: 73.
[5] Tian T, Chen H, Zhao Y Y. Traditional uses, phytochemistry, pharmacology, toxicology and quality control of Alisma orientale(Sam.) Juzep: a review[J]. J Ethnopharmacol, 2014, 158: 373.
[6] Meng Q, Chen X, Wang C, et al. Protective effects of alisol B 23-Acetate via farnesoid X receptor-mediated regulation of transporters and enzymes in estrogen-induced cholestatic liver injury in mice[J]. Pharm Res, 2015, 32(11): 3688.
[7] Meng Q, Chen X, Wang C, et al. Protective effects of alisol B 23-acetate from edible botanical Rhizoma Alismatis against carbon tetrachloride-induced hepatotoxicity in mice[J]. Food Funct, 2015, 6(4): 1241.endprint
[8] Meng Q, Chen X, Wang C, et al. Alisol B 23-acetate protects against ANIT-induced hepatotoxity and cholestasis, due to FXR-mediated regulation of transporters and enzymes involved in bile acid homeostasis[J]. Toxicol Appl Pharm, 2015, 283(3): 178.
[9] Mi J, Wu C, Li C, et al. Two new triterpenoids from Ampelopsis japonica (Thunb.)Makino[J]. Nat Prod Res, 2014, 28(1): 52.
[10] Lakhal H, Kabouche A, Magid A A, et al. Triterpenoids from Salvia argentea var. aurasiaca (Pomel) Batt. & Trab. and their chemotaxonomic significance[J]. Phytochemistry, 2014, 102: 145.
[11] 谷巍, 吴启南, 巢建国, 等. 建泽泻法呢基焦磷酸合酶分子克隆, 分布表达及生物信息学研究[J]. 药学学报, 2011, 46(5): 605.
[12] Gu W, Geng C, Xue W, et al. Characterization and function of the 3-hydroxy-3-methylglutaryl-CoA reductase gene in Alisma orientale (Sam.) Juz. and its relationship with protostane triterpene production[J]. Plant Physiol Bioch, 2015, 97: 378.
[13] 刘雨佳,苏平,王秀娟,等. 雷公藤鲨烯合酶基因全长cDNA克隆及诱导表达分析[J]. 药学学报,2016,51(4):657.
[14] 荣齐仙,刘春生,黄璐琦,等.甘草鲨烯合酶基因及cDNA的克隆与序列分析[J]. 中国中药杂志,2011,36(11):1416.
[15] Kim T D, Han J Y, Huh G H, et al. Expression and functional characterization of three squalene synthase genes associated with saponin biosynthesis in Panax ginseng [J]. Plant Cell Physiol, 2011, 52(1): 125.
[16] Gupta N, Sharma P, Kumar R J S, et al. Functional characterization and differential expression studies of squalene synthase from Withania somnifera[J]. Mol Biol Rep, 2012, 39(9): 8803.
[17] Zha L, Liu S, Su P, et al. Cloning, prokaryotic expression and functional analysis of squalene synthase (SQS) in Magnolia officinalis[J]. Protein Expr Purif, 2016, 120: 28.
[18] Patel N, Patel P, Kendurkar S V, et al. Overexpression of squalene synthase in Withania somnifera leads to enhanced withanolide biosynthesis[J]. Plant Cell Tiss Org, 2015, 122(2): 409.
[19] Han J Y, In J G, Kwon Y S, et al. Regulation of ginsenoside and phytosterol biosynthesis by RNA interferences of squalene epoxidase gene in Panax ginseng[J]. Phytochemistry, 2010, 71(1): 36.
[20] 申修源,谷巍,周娟娟,等.建泽泻鲨烯合酶基因克隆及其生物信息学分析[J]. 中草药,2013(5):604.
[21] 李振秋,王花红,王红,等.中药青蒿鲨烯合酶的大肠杆菌表达, 纯化与功能鉴定[J]. 应用与环境生物学报,2007(3):309.
[22] Singh A K, Dwivedi V, Rai A, et al. Virus-induced gene silencing of Withania somnifera squalene synthase negatively regulates sterol and defence-related genes resulting in reduced withanolides and biotic stress tolerance [J]. Plant Biotechnol J, 2015, 13(9): 1287.
[23] Qin M, Wang W, Thirumalai D. Protein folding guides disulfide bond formation[J]. Proc Natl Acad Sci USA, 2015, 112(36): 11241.
[24] Papaneophytou C P, Kontopidis G. Statistical approaches to maximize recombinant protein expression in Escherichia coli: a general review[J]. Protein Expr Purif, 2014, 94: 22.
[25] 徐洁森, 魏建和, 陶韵文, 等. 北柴胡糖基转移酶基因 BcUGT8 的克隆, 序列分析及其原核表达载体构建[J]. 中草药, 2013, 44(17): 2453.
[26] Ermolli M, Prospero A, Balla B, et al. Development of an innovative immunoassay for CP4EPSPS and Cry1AB genetically modified protein detection and quantification[J]. Food Addit Contam, 2006, 23(9): 876.
[責任编辑 吕冬梅]endprint

