左旋多巴的生产工艺及相关物质研究概况
* .广西中医药大学科学实验中心,广西 南宁 50;.广西中药质量标准研究重点实验室,广西 南宁 500;.广西邦尔药业有限公司,广西 百色 5500
左旋多巴的生产工艺及相关物质研究概况
赵小超1李学坚1*卢文杰2黄艳2苏彩珍3
1.广西中医药大学科学实验中心,广西 南宁 530222;2.广西中药质量标准研究重点实验室,广西 南宁 530022;3.广西邦尔药业有限公司,广西 百色 531500
从左旋多巴的生产工艺以及相关物质研究等方面的研究概况展开综述,对生产工艺可能产生的相关物质、相关物质的药理作用以及相关物质对左旋多巴的药理作用影响等方面进行总结,为相关物质的深入研究提供文献参考依据。
左旋多巴;相关物质;生产工艺;药理作用
左旋多巴(L-dopa),1911年由FunkC首先合成,1913年Guggenheim从植物蚕豆中提取获得,1967年临床研究发现其具有抗帕金森综合征作用,延续至今,已经有100多年的研究史。目前,依然是抗帕金森综合征的主要药物之一。左旋多巴是神经递质多巴胺的直接前体,可以通过脱羧酶的作用转化为多巴胺,补充脑内多巴胺不足,从而起到抗帕金森综合征的作用[1-5]。左旋多巴的研究史比较丰厚,然而,其原料药中相关物质的研究却相当欠缺,尤其是国内。因此,本文将主要对左旋多巴的生产工艺以及相关物质等近十年研究概况进行综述,为更好地展开相关物质的研究提供参考。
1 生产工艺
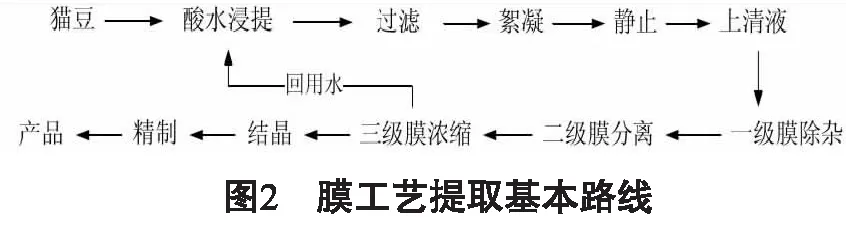
1.1 天然左旋多巴的生产 猫豆中左旋多巴含量高达5.22 %~9.44 %,广西是国际上以猫豆为原植物药材提取天然左旋多巴的主要生产基地[6-9]。左旋多巴主要的提取方法有溶剂提取法、离子交换色谱法、超声强化提取法、膜分离技术法、活性炭吸附法等[10-19]。其中,左旋多巴传统的溶剂提取法对比超声强化提取法,得率明显比较低,相差约58%[12];离子交换色谱法是国内生产企业应用比较广泛的提取方法,通过企业的实践学习以及文献的查阅,总结绘制其基本工艺流程如图1[11,13]。根据生产企业生产经验,猫豆在酸水浸提的时候不宜打粉过细,压扁即可,否则会给生产带来不便。此工艺的需要多次调解pH,比较繁琐且化学试剂用量大,中间还大量使用氨水洗脱,危险增大,同时给废水处理带来困难,得率较传统方法大大提高,但仍需要进一步优化改进。罗栋源等[15]对左旋多巴的膜工艺提取技术进行研究,并与传统方法比较,发现收率提高27.98%,同时膜工艺提取技术还具有能耗低、污染少、不使用有毒试剂等优点,符合新时代清洁生产工艺的要求,有待深入研究,以实现工业化大生产。膜工艺提取技术基本路线如图2[15]。

1.2 非天然左旋多巴的生产工艺
1.2.1 化学合成合成工艺 经过了106年的研究发展,越来越简便高效且收率高,整体工艺原料也走向经济化。近几年左旋多巴的化学合成研究比较少,主要有铜催化羟基化反应以及以藜芦醛和海因为底物经过一系列的反应合成左旋多巴[20-21]。其中铜催化羟基化反应合成路线见图3。

化学合成主要优点是合成目标准确可得、收率大、纯度高、副产物等相关物质种类较少且大都可预测;主要缺点有成本高、生产工艺相对复杂、反应条件要求苛刻、中间体和副产物与目标化合物难以分开等。
1.2.2 微生物酶转化 微生物酶转化合成中常用的酶有2种,已报到的有3种,分别为酪氨酸酚解酶、羟化酶和在左旋多巴合成中使用相对较少的转氨酶[22-24]。马强强等[23]以L-酪氨酸为底物,通过LmbB2目的基因的表达构建载体转化大肠杆菌,最终合成左旋多巴,此工艺比较复杂且添加底物和抗坏血酸,成本提高,可控性难度加大。Krishnaveni等[25-27]均以酪氨酸为底物,分别通过真菌转化、填充床酶法以及对填充床酶法改进的方法(电气自动合成法)合成左旋多巴,其中以Mina的电气自动合成法产率最高,为95.9%。其主要路线见图4。

微生物酶转化合成法工艺简洁,产率高,但效率相对较低,且产物与左旋多巴难以分离,环境要求苛刻,成本高,需要进一步深入研究以更好的适应工业化生产。
1.2.3 新兴代谢工程合成 代谢工程合成左旋多巴是代谢工程在左旋多巴生产领域一种新的应用,具有很大的发展前景。Munoz A J等[28]通过改造大肠杆菌代谢通路合成左旋多巴。Asli Giray Kurt等[29]利用透明颤菌血红蛋白( vhb )对异源生物的作用在两种细菌枸橼酸杆菌属和欧文氏菌中生产左旋多巴,结果发现所构建的重组基因( vgb+)的细胞质的左旋多巴含量( c为112mg/L和e 为97mg/L )明显高于各自宿主( 30.4mg/L和33.8mg/L)。代谢工程合成左旋多巴的方法是一种新兴的生物合成方法,它本身固有的科技前沿性已经显出巨大的优越性,各方面研究尚不成熟,有很大发展前景,值得深入研究探讨。
2 相关物质研究
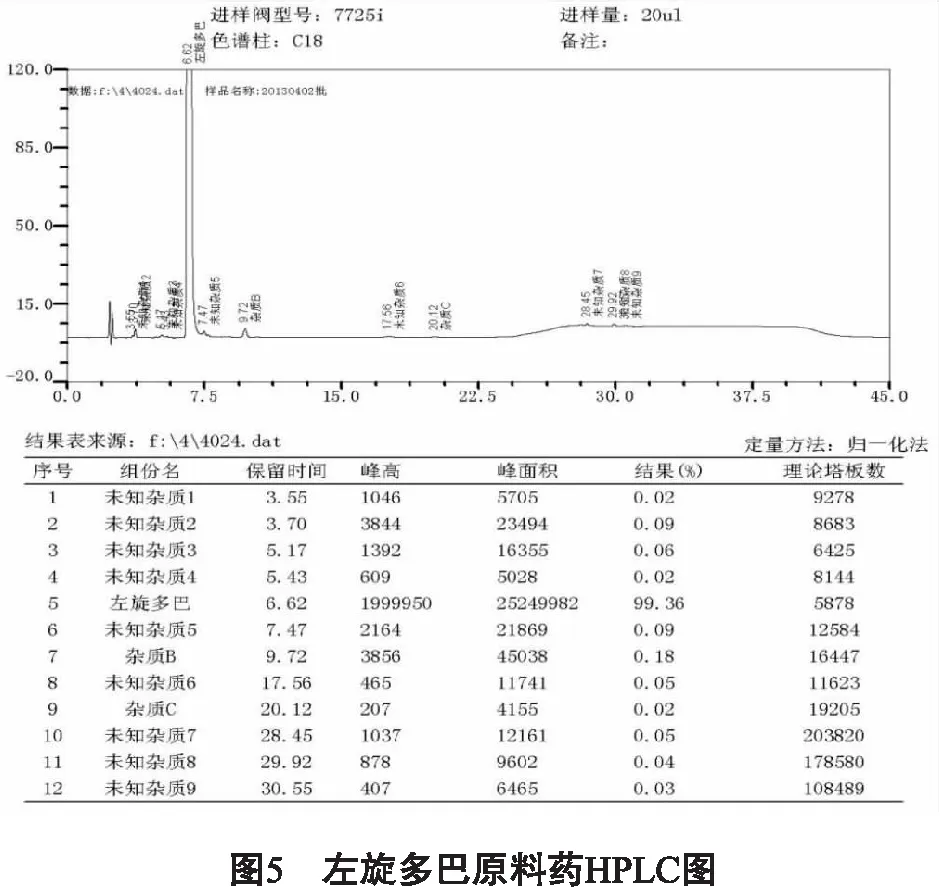
2.1 提取分离 欧洲药典和英国药典[30-31]注明已知的有4个杂质,且一致,分别为杂质A:(2S)-2-氨基-3-(2,4,5-三羟苯基)丙酸;杂质B:3-甲氧基-L-酪氨酸;杂质C:3-甲氧基-DL-酪氨酸;杂质D:右旋多巴。以植物药材(猫豆)提取获得的左旋多巴原料药中只检测到杂质B和C,按照药典方法对广西邦尔药业有限公司提供的左旋多巴样品进行含量测定,结果如图3,尚有多种检测到的未知杂质有待分离提取研究。黄增琼等[32-35]分别用717型阴离子交换树脂和732型阳离子交换树脂分离提取猫豆胍,并做比较,确定732型阳离子交换树脂更加适合工业化生产中去除原料药中的猫豆胍。研究人员还通过柱层析分离得到另一种相关物质单体暂记为L-DAⅡ。近几年天然左旋多巴原料药中相关物质的分离提取仅有以上两种化合物。图3显示还有多种未知杂质尚未得到分离研究,因此左旋多巴原料药中相关物质的提取分离具有重大意义。
2.2 含量测定 由于生产科技水平的不断提升以及国内、国际质量标准的日益完善,对各种原料药的质量要求也逐渐提高,含量测定的要求也越来越严格。目前含量测定的方法有很多,比较流行且操作简单、专属性强、准确性高、重复性好的方法是高效液相色谱法。左旋多巴原料药中的相关物质的含量测定方法[36-42]有许多,色谱柱选择基本都是C18柱,检测条件各有不同,结果分离度、精密度、稳定性、重复性均良好,即除药典收录的含测方法以外依然存在良好的方法有的测定方法。所以,相关物质含量测定方法的依然有待深入研究探讨,优化药典方法,为我国的质量标准进一步提高完善提供依据,更好的与国际化接轨。
2.3 药理作用研究 黄增琼[43]通过小鼠实验从四个方面对猫豆胍进行药理研究。结果表明:小剂量LDA对小鼠自主活动有明显影响;大剂量具有一定的延缓硝酸士的宁致惊厥发作的作用;大、中剂量具有镇静催眠作用;大剂量可延长戊巴比妥钠睡眠时间。进一步对猫豆胍以及猫豆非左旋多巴组分做药理研究,发现具有镇静催眠、抗震颤麻痹和抗惊厥的作用[44-45]。黄增琼等[46]通过对急性足趾肿胀模型小鼠致炎后分别给予猫豆胍不同剂量治疗,结果低、中剂量对肿胀有抑制作用;又通过热板致小鼠疼痛反应、醋酸所致小鼠扭体反应,发现中、高剂量具有一定的阵痛作用。邓霖芳等[47]对左旋多巴5个衍生物(猫豆中含有3个)进行多巴脱羧酶的抑制活性研究,发现其中4个衍生物(猫豆中的3个都包含)均有剂量依赖性的抑制作用。Christopher A. Lieu等[48]发现藜豆属简单水提物对帕金森综合征的治疗比左旋多巴单用具有更好的效果。另有实验证明,预防性服用猫豆浸提液具有一定的抗马来亚眼镜蛇毒作用[49]、等量的右旋多巴与左旋多巴在多巴胺生成量上没有很大差异且能更缓慢地释放多巴胺[50-51]。
3 小结与展望
3.1 生产工艺对相关物质种类的影响 生产工艺对相关物质的种类有很大影响。相关物质的来源较广泛,不同的原药材、使用的每1种试剂、中间体以及副产物等等都是相关物质的主要来源,即来源具有复杂性。欧洲药典注明的4个杂质在广西邦尔药业有限公司的产品中只检测出B和C,如图3所示,尚有其它未知成分的存在;在化学合成工艺中均有出现,尤其是右旋多巴,因为化学合成的方法容易产生手性相关物质[52]。不同的生产工艺都有不同的理论技术支撑,采用不同方法、应用各种试剂、不同的中间处理环节,因此相关物质的种类各有所异。某公司在生产过程中通过控制温度可以降低甚至除去某相关物质,从而提高产品纯度。不难看出,生产工艺对相关物质种类的影响巨大。
3.2 相关物质对产品质量和药理作用的影响 相关物质其实就是原料药中的杂质,对产品质量和药理作用都有严重的影响。某药业公司向欧美市场销售左旋多巴原料药时就曾因为杂质B含量过高而不符合质量标准,造成巨大损失,相关物质直接影响产品质量。相关物质通常也具有一定的药理、毒理作用,可能会影响有效成分的药理作用,甚至隐藏巨大的安全隐患,影响患者健康与生命安全,也或许相关物质具有一定的协同作用,增强疗效。总之,相关物质对产品质量和药理作用的影响不可忽视,扩展相关物质研究,提高产品质量才能更好地发挥疗效。
3.3 研究相关物质的意义 左旋多巴原料药中相关物质的研究意义重大,初步总结为4个方面:①为优化生产工艺、提高左旋多巴原料药质量提供依据,有利于左旋多巴原料药的出口从而产生巨大的经济效益。②为修订《中国药典》中左旋多巴原料药的质量标准提供科学依据。③为研究相关物质的药理作用、以及相关物质对左旋多巴的主要药效是否有影响,提供基础。④左旋多巴原料药的相关物质研究目前已经确证的(欧洲药典收录的除外)只有2个化合物,尚有多种未知化合物存在,相关物质研究的深入将具有远大意义,并可为今后研究提供参考。
[1]Ray H, Georges F. A genomic approach to nutritional, pharmacological and genetic issues of faba bean (Vicia faba): prospects for genetic modifications[J]. GM Crops, 2010, 1(2): 99-106.
[2]Poewe W, Antonini A, Zijlmans J, et al. Levodopa in the treatment of Parkinson’s disease: An old drug still going strong[J]. Clinical Interventions in Ageing, 2010(5):229-238.
[3]孙绍武. 普拉克索联合左旋多巴对晚期帕金森病患者临床症状及负性情绪的影响[J]. 中国实用神经疾病杂志,2017,20(4):118-120.
[4]Rascol O, Perez-Lloret S, Ferreira JJ. New teratments for levodopa-induced motor complications[J]. J Movement Disord Soc, 2015, 30(11):1451-1460.
[5]McKenzie J A, Lindsay J Spielman L J, Pointer C B, et al. Neuroinflammation as a Common Mechanism Associated with the Modifiable Risk Factors for Alzheimer's and Parkinson’s Diseases[J]. Current Aging Science,2017,10(4):1.
[6]张凤银,陈禅友. 藜豆的研究进展[J]. 江汉大学学报,2012,40(6):87-89.
[7]邱卓,蒋伟哲,巫玲玲,等. 猫豆营养成分的初步研究[J]. 广西中医学院学报,2011,14(4):48-51.
[8]巫世红. 猫豆的鉴别研究[J]. 中药材,2009,32(5):693-396.
[9]巫世红,蒋伟哲,吕力,等.猫豆药材的质量标准研究[J]. 中药材,2009,32(3):333-336.
[10]卢艳花.中药有效成分的分离纯化方法[M]. 北京:化学工业出版社,2008.
[11]罗栋源. 从猫豆中提取左旋多巴的清洁生产工艺研究[D].武汉:湖北工业大学,2011.
[12]宋江峰,李大婧,刘春泉.发芽蚕豆左旋多巴超声强化提取及其动力学过程[J].农业工程学报,2012,28(19): 248 - 253.
[13]蒋伟哲. 猫豆产业链支撑技术研究[D].南京:广西医科大学,2008.
[14]蒋宇,余从田,吴正钧. 猫豆与左旋多巴的检测及生产工艺研究进展[J]. 食品工业,2014,35(4):145-149.
[15]罗栋源,魏璇,龚琴,等.膜工艺提取猫豆左旋多巴的研究[J]. 化学与生物工程,2011,28(1):26-32.
[16]冯淑萍. 正交试验优选猫豆提取工艺[J]. 中国药业,2016,25(15):49-51.
[17]Misra L, Wagner H. Extraction of bioactive principles from Mucuna pruriens seeds[J]. Indian Journal of Biochemistry and Biology, 2007, 44(1): 56-60.
[18]汪桂芳,李传润,曹政,等.从猫豆中提取左旋多巴的膜分离工艺探索[J].安徽化工,2014,40(1):17-20.
[19]徐晓俞,李爱萍,吴凌云,等. 蚕豆花左旋多巴提取工艺优化[J].中国农学通报,2014,30(34):56-60.
[20]翟宁,周后元,张福利,等.铜催化羟基化反应合成左旋多巴[J]. 中国医药工业杂志,2015,46(10):1055-1057.
[21]翟宁,周后元,张福利. 左旋多巴的合成[J]. 中国医药工业杂志,2015,46(5):439-441.
[22]Krishnaveni R, Rathod V, Thakur M S, et al. Transfor-mation of L-Tyrosine to L-DOPA by a novel fungus, Acremonium rutilum, under submerged fermentation[J]. Current Microbiology,2009,58(2) : 122-128.
[23]马强强,赵广荣. LmbB2催化酪氨酸合成左旋多巴的工艺研究[J]. 化学工业与工程,2014,31(4):75-79.
[24]马强强,赵广荣. 左旋多巴合成研究进展[J]. 化工进展,2013,32(6): 1367-1371.
[25]Krishnaveni R, Rathod V, Thakur M S, et al. Transformation of L-tyrosine to L-dopa by a novel fungus, Acremonium rutilum under submerged fermentation[J]. Current Microbiology, 2009, 58(2): 122-128.
[26]Ates S, Cortenlioglu E, Bayraktar E, et al. Production of L-DOPA using Cu-alginate gel immobilized tyrosinase in a batch and packed bed reactor[J]. Enzyme and Microbial Technology, 2007, 40(4):683-687.
[27]Mina K, Parkb D H, Yoo Y J. Electroenzymatic synthesis of L-DOPA[J]. Journal of Biotechnology, 2010, 146(1):40-44.
[28]Munoz A J, Chavez G H, Anda R, et al. Metabolic engineering of Escherichia coli for improving L-3,4 - dihydroxyphenylalanine (L-DOPA) synthesis from glucose[J]. Journal of Industrial Microbiology and Biotechnology, 2011, 38(11):1845-1852.
[29]Kurt A G, Aytan E, Ozer U, et al. Production of L-DOPA and dopamine in recombinant bacteria bearing the Vitreoscilla hemoglobin gene[J]. Biotechnology Journal, 2009, 4(7): 1077-1088.
[30] European Directorate for Quality Medicines. European Pharmacopeia 8.0[S]. 2013: 2608.
[31] British Pharmacopoeia Commission. British Pharmacopeia[S]. 2013:1296.
[32]黄增琼,蒋伟哲,黄兴振,等.717型阴离子交换树脂分离猫豆中的猫豆胍[J].药物研究,2009,18(12):23-24.
[33]黄增琼,蒋伟哲,黄兴振,等.732型阳离子交换树脂分离猫豆中的猫豆胍[J].时珍国医国药,2009,20(9):2115-2116.
[34]黄增琼,蒋伟哲,许小林,等.猫豆中猫豆胍的制备方法研究[J].中草药,2010,41(6): 904-906.
[35]巫玲玲.猫豆化学成分研究[D].南宁:广西医科大学,2011.
[36]邓霖芳,谭蓓蓓,窦冕,等. HPLC同时测定猫豆中左旋多巴及其衍生物含量[J]. 中国现代应用药学,2016,33(7):845-848.
[37]黄增琼,蒋伟哲,黄敏,等. RP- HPLC法测定猫豆中猫豆胍的含量[J]. 中国药房,2010,21(11):1000-1001.
[38]谭蓓蓓,俞樱露,李楠,等.亲水作用色谱法测定猫豆中左旋多巴及其衍生物的含量[J]. 苏州大学学报,2012,32(5):593-596.
[39]黄兴振,蒋伟哲,黄敏,等.高效液相色谱法测定猫豆中酪氨酸含量[J]. 中国药业,2009,18(20):23-24.
[40]蒋宇等. 精制左旋多巴中L-多巴含量及主要杂质成分的HPLC检测[J]. 工业微生物,2015,45(4):58-64.
[41]陆兴毅. HPLC法分析左旋多巴及其有关物质[J]. 中国药师,2010,13(5):681-683.
[42]付莉娜,郑金琪,郑国钢,等. HPLC法测定左旋多巴的有关物质[J]. 药物分析杂志,2014,34(3):475-479.
[43]黄增琼.猫豆中未知成分的分离和药理活性研究[D].南宁:广西医科大学,2008.
[44]黄增琼,蒋伟哲,黄兴振,等.猫豆胍镇静催眠和抗震颤麻痹作用研究[J]. 中草药,2009,40(2):276-278.
[45]黄增琼,许小林,赖术,等.猫豆非左旋多巴组分镇静催眠作用研究[J]. 右江民族医学院学报,2009,31(1):1-3.
[46]黄增琼,蒋伟哲,巫玲玲,等. 猫豆胍抗炎镇痛作用的研究[J]. 时珍国医国药,2011,22(9):2089-2090.
[47]邓霖芳,谭蓓,郝丽莉,等.左旋多巴衍生物对多巴脱羧酶活性的抑制作用研究[J]. 中国药学杂志,2016,51(14):1186-1190.
[48]Lieu C A , Kunselman A , RManyam B V,et al. A water extract of Mucuna pruriens provides long-term amelioration of parkinsonism with reduced risk for dyskinesias [J]. Parkinsonism Relat D, 2010, 16(7):458-465.
[49]Sim SM,FungSY,TanNH,et al. Effect of pretreatment with Mucuna pruriens seed extract on the pharmacological effects of Naja naja sputatrix( Malayan cobra) venom in rats[J]. Acta Pharmacologica Sinica,2006,27(s1) : 326-329.
[50]Karoum F. Composition and method of using D-dopa to treat Parkinson's disease: US, 20060241183[P]. 2006-10-26.
[51]Wu M, Zhou XJ, Konno R, et al. D-Dopa is unidirectionally converted to L-dopa by D-amino acid oxidase, followed by dopa transaminase [J]. Clin Exp Pharmacol Physiol, 2006, 33(11):1042-1046.
[52]岳悦,骆雪芳,钟文英,等.化学药物杂质研究进展[J]. 药学进展,2015,39(7):533-539.
ResearchReviewofProductionTechnologyandRelatedSubstancesofL-dopa
ZHAO Xiaochao1LI Xuejian1*LU Wenjie2HUANG Yan2SU Caizhen3
1.Guangxi University of Chinese Medicine Scientific Research Center,Nanning 530222,China ;2.Guangxi Key Laboratory of Traditional Chinese Medicine Quality Standards,Nanning 530222,China ;3.Guangxi Banger Pharmaceutical co. ltd.,Baise 531500,China
The research progress on production technology of L-dopa and research of related substances were reviewed.The related substances produced from production technology, pharmacological actions of related substances and influence of related substances on the pharmacological actions of L-dopa were summed up, and in order to provide references for the in-depth study of related substance.
L-dopa; Related Dopa Substances; Production Technology; Pharmacological Action
R914.1
A
1007-8517(2017)17-0044-05
2017-06-29 编辑:梁志庆)
广西中药质量标准研究重点实验室开放课题基金项目( GXGZZK201102);广西高校重点实验室基金( 2016年)。
赵小超(1988-),男,汉族,硕士研究生在读,研究方向为中药新产品。E-mail:515532094@qq.com
李学坚(1965-),男,壮族,博士研究生,硕士生研究生导师,高级工程师。E-mail:1211856948@qq.com

